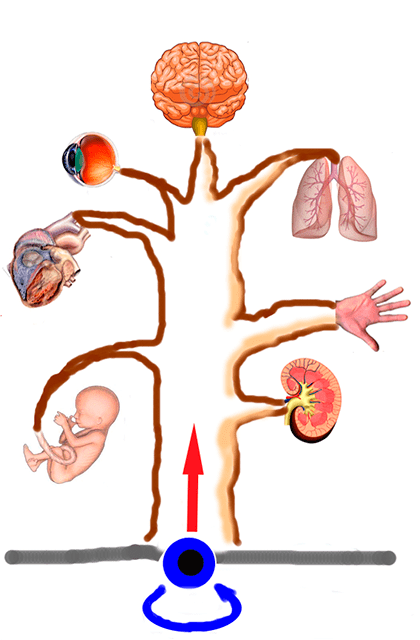
Ствол и ветки: стволовые клетки
02 ноября 2011
Ствол и ветки: стволовые клетки
- 10809
- 2
- 13
«Чудо-дерево»
Статья на конкурс «био/мол/текст»: В статье дан обзор современных представлений о стволовых клетках (СК) животных. Разобрана роль стволовых клеток различных групп животных в бесполом размножении и регенерации. Описаны разные типы стволовых клеток млекопитающих и источники их получения для культивирования. Обсуждается концепция ниши стволовых клеток. Кратко охарактеризовано современное состояние, проблемы и перспективы применения СК в медицинской практике.
Конкурс «био/мол/текст»-2011
 Эта работа заняла первое место в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2011.
Эта работа заняла первое место в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2011.
Одна из главных проблем биологии развития — механизмы дифференцировки клеток. Как и почему клетки, появившиеся в результате деления зиготы, становятся разными? Почему одни из них превращаются в нервные, другие — в мышечные, а третьи — в безъядерные эритроциты? Еще недавно эта тема интересовала в основном ученых и обсуждалась на страницах научных журналов и монографий. Но сейчас достижения в этой области «вдруг» стали интересовать всех — дело дошло до практического применения.
В этой статье пойдет речь о стволовых клетках (СК). Их изучение тесно связано и с проблемами дифференцировки, и с практическим использованием достижений эмбриологии.
Были когда-то и мы стволовыми...
Словосочетание «стволовые клетки» у всех на слуху. Но что за ним стоит? Оказывается, даже среди ученых в этом нет полного согласия [1]. Поэтому начнем с определения. Стволовые клетки должны обладать тремя главными признаками:
- во-первых, СК не до конца дифференцированы. Это позволяет их потомкам развиваться в нескольких разных направлениях;
- во-вторых, эти клетки могут неограниченно делиться и давать любое число поколений потомков (по крайней мере, в течение жизни данного организма);
- в-третьих, эти клетки образуют самоподдерживающуюся популяцию. Это означает, что при делении некоторые их потомки остаются стволовыми, а другие дифференцируются (рис. 1).
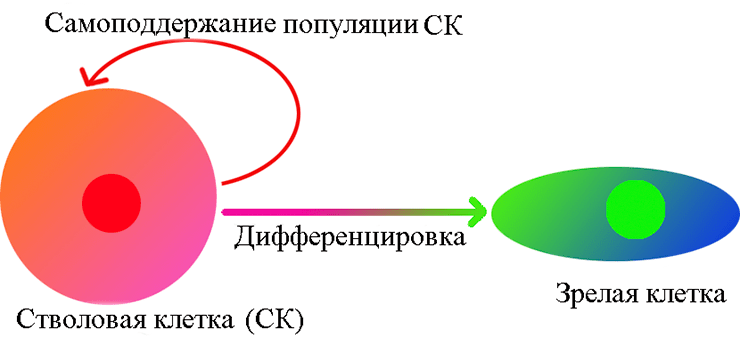
Рисунок 1. Унипотентная стволовая клетка. Самообновляющаяся популяция таких клеток дает зрелые клетки только одного типа.
СК сильно различаются по своей способности давать разные типы клеток-потомков. На одном конце спектра находятся клетки, способные дать целый организм — тотипотентные клетки . На другом конце находятся унипотентные СК, которые могут дифференцироваться только в клетки одного типа (например, СК эпидермиса кожи).
В конце статьи есть Словарик.
Чаще же всего СК плюрипотентны (могут давать клетки разных зародышевых листков, но не целый организм) или мультипотентны (могут давать несколько типов клеток, часто входящих в состав одного органа или ткани). На самом деле границы между этими типами СК очень размыты — всё зависит от условий дифференцировки.
СК разделяют также на генеративные (клетки зародышевого пути, способные превращаться в гаметы) и соматические, дающие остальные клетки тела. Генеративные СК есть у всех групп животных. Соматические СК некоторые животные во взрослом состоянии утрачивают. Это, например, виды с постоянством клеточного состава — многие нематоды, коловратки, мезозои. Когда клеток у взрослого организма строго определенное число, каждая имеет свой «номер», выполняет свою функцию и занимает строго определенное положение — стволовым клеткам нет места. Но у большинства животных в тех или иных тканях есть соматические СК.
Клетки и губки
У губок давно были известны СК — это археоциты. Новые молекулярно-генетические исследования подтвердили, что у этих тотипотентных клеток есть особые клеточные маркеры — белки, присутствующие только в них. Эти СК составляют внутренние ткани личинок, из них состоят геммулы — стадии бесполого размножения пресноводных губок. Затем археоциты дифференцируются в трех направлениях: дают покровные, скелетные или сократимые клетки губки. Из археоцитов образуются и половые клетки. Необычная черта губок — способность полностью дифференцированных воротничково-жгутиковых клеток утрачивать дифференцировку и превращаться в археоциты. Оказывается, грань между стволовыми и дифференцированными клетками преодолима (и, как мы увидим, не только у губок).
Бессмертная гидра
Пресноводная гидра больше 250 лет верой и правдой служит науке — и уже этим заслужила бессмертие. Это замечательная модель для изучения СК. Промежуточные клетки гидры (i-клетки) — типичные плюрипотентные СК. Часто считают, что из i-клеток гидры могут возникать все типы клеток. Но на самом деле это не так. Из i-клеток образуются половые клетки, железистые клетки, нервные и стрекательные клетки. Кожно-мускульные клетки эктодермы и энтодермы — самостоятельные клеточные линии. В средней части тела гидры кожно-мускульные клетки имеют свойства СК и постоянно делятся. Постепенно эти клетки сдвигаются к подошве, ротовому конусу и щупальцам. По ходу дела они дифференцируются: например, клетки эктодермы на щупальцах превращаются в клетки стрекательных батарей, а на подошве — в клетки, выделяющие слизь. Затем эти клетки гибнут. Но сама гидра, чьё тело состоит чуть ли не целиком из СК, по-видимому, может в благоприятных условиях жить вечно.
Геном гидры сейчас расшифрован. Разработан способ получения генетически модифицированных гидр. Можно получать химерных гидр, у которых генетически различаются i-клетки и кожно-мускульные клетки. Наконец, можно получить «безнервных гидр», химическим путем лишив их i-клеток. У таких гидр кожно-мускульные клетки продолжают делиться. Они могут расти и почковаться, если им насильно запихивать пищу в рот (сами они не могут ни ловить добычу, так как лишены стрекательных клеток, ни глотать её — для этого нужны нервные клетки).
Со времен Трамбле гидра — один из главных модельных объектов для изучения регенерации. Уже довольно давно из гидры выделены пептиды, усиливающие регенерацию «головы» и подошвы. Интересно, что у «безнервных» гидр регенерация не нарушена, хотя в норме эти пептиды образуются в нервных клетках. Если же нервных клеток нет, необходимые для регенерации гены активируются в кожно-мускульных клетках.
Все это делает гидру прекрасным объектом и для изучения дифференцировки клеток. А многие гены, задействованные в развитии и дифференцировке у гидры, не так уж сильно отличаются от человеческих.
Все яйца в одной корзине
Другой популярный объект для изучения регенерации — планарии. Яйца они, правда, откладывают обычно в нескольких «корзинах»-коконах. А вот СК у них — только один тип. Эти плюрипотентные СК — необласты — расположены в рыхлой мезодермальной ткани планарий, паренхиме. Делясь, необласты могут дифференцироваться в любые типы клеток, в том числе в клетки покровов и нервной системы (эктодермы). Только необласты отвечают у планарий за регенерацию. После дифференцировки их потомки перестают делиться. Необласты служат также для бесполого размножения и могут превращаться в половые клетки.
Ну как же без дрозофилы...
Хорошо изучены и СК насекомых. Большинство типов этих клеток есть у зародышей или личинок и отсутствуют у имаго (взрослой особи). Типичные для насекомых с полным превращением СК — это клетки имагинальных дисков. Из этих небольших групп клеток личинки развивается большинство органов имаго. Интересная особенность этих клеток — их способность к трансдетерминации. На довольно ранней стадии в имагинальном диске уже есть «разметка» будущего органа: например, известно, какие из клеток крылового диска станут клетками передней половины крыла, а какие — задней. Внешне эти клетки еще не различаются, но их судьба предопределена (детерминирована). Однако при удалении части диска судьба клеток меняется так, что может восстанавливаться нормальная структура крыла.
У большинства взрослых насекомых не так уж много СК. Удивительно, что у многих видов с неполным превращением они сохраняются в особом отделе головного мозга — грибовидных телах. Эти центры мозга насекомых отвечают за многие формы научения. Нейробласты грибовидных тел (СК мозга) у взрослых сверчков постоянно образуют новые интернейроны. Их число увеличивается при усиленной стимуляции органов зрения и обоняния (например, у самцов — при драках с соперниками). У большинства насекомых с полным превращением СК грибовидных тел гибнут на стадии куколки, и пластичность поведения имаго связана с ростом аксонов и образованием новых синапсов.
Из ядущего вышло едомое
Сравнительно новый модельный объект для изучения СК — оболочники. У этих ближайших родственников позвоночных высока способность к регенерации, а многие из них размножаются бесполым путем и образуют колонии. Только у сидячих оболочников — асцидий — насчитывается чуть ли не десяток разных способов деления и почкования!
На асцидиях часто изучают способность различать «свое и чужое» — основу иммунитета. В последние годы чаще всего используют для таких исследований мелкую, широко распространенную колониальную асцидию Botryllus schlosseri.
Особи колонии (зоóиды) окружены прозрачной оболочкой — туникой — и имеют общую кровеносную систему (рис. 2). В норме колония живет 1–5 лет, а каждый зооид — всего неделю. За это время он успевает сформировать почку — зачаток нового зооида. После этого старый зооид распадается, и его клетки гибнут путем апоптоза; затем клетки растущей почки фагоцитируют остатки зооида, и почка его заменяет.
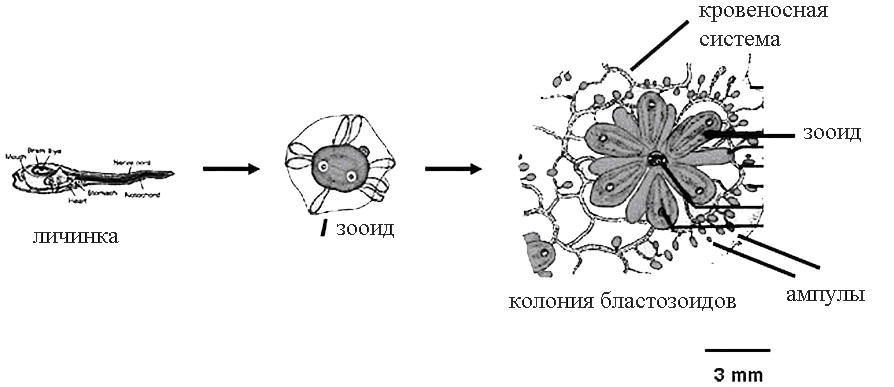
Рисунок 2. Образование колоний у Botryllus schlosseri (вид сверху). После оседания личинки исходная особь (оозооид) начинает почковаться и образует розетки генетически идентичных зооидов. Колония может включать от одной такой розетки до сотни.
Но при удалении всех зооидов происходит сосудистое почкование. В небольших слепых выростах кровеносных сосудов — ампулах — скапливаются лимфоцитоподобные клетки крови. Это — тотипотентные СК асцидии. Из них образуются похожие на бластулы шарики, а затем почки. Одним из первых обособляется в такой почке сердце, затем формируются остальные органы, и новый зооид начинает почковаться обычным способом.
Если две колонии асцидий соприкасаются при росте, они могут либо сливаться, либо разделяться после отторжения и гибели тканей. Результат зависит от одного гена — Fu/HC (fusibility/histocompatibility — ген слияния/гистосовместимости). Этот ген похож на гены, отвечающие за отторжение чужеродных тканей у позвоночных (а возможно, и гомологичен им). Если у двух колоний совпадает хотя бы один аллель этого гена из пары, то они срастаются. Первыми вступают в контакт ампулы, и происходит объединение кровеносной системы колоний.
Самые удивительные события происходят после слияния. У одного из «партнеров» начинается массовая гибель клеток, и все его зооиды полностью разрушаются. Бóльшую часть погибших клеток фагоцитируют клетки крови. Но оказалось, что у «победителя» довольно часто все клетки зародышевого пути имеют генотип «съеденного» партнера! Это означает, что тотипотентные СК «съеденной» особи сохраняются и заселяют «победителя». Иногда и соматические ткани «победителя» целиком или частично заменяются клетками «побежденного». Вот уж действительно — «из ядущего вышло едомое»! Исход «конкуренции» соматических и половых клеток зависит от генотипов сросшихся колоний. Роль этого явления в эволюции и экологии асцидий интенсивно изучается.
И пришивают голову и хвост туда, где нужно...
Для позвоночных бесполое размножение нехарактерно (если не считать полиэмбрионии), но способность к регенерации у них достаточно хорошо развита. Рекордсмены в этом плане — хвостатые амфибии. У саламандр — даже взрослых — регенерируют хвост, глаза, ноги, челюсти, участки миокарда и спинного мозга и другие органы.
Классический объект для изучения регенерации — конечности саламандр и тритонов. После ампутации конечности рана быстро затягивается эпидермисом, а под ним формируется «шапочка» из недифференцированных клеток — бластема.
Откуда берутся эти клетки? Этот вопрос был источником споров в течение десятилетий. И сейчас тут не все еще ясно. Известно, что многие клетки в районе ампутации гибнут, а оставшиеся дедифференцируются. Например, многоядерные клетки скелетных мышц распадаются на одноядерные клетки, а потомки этих одноядерных клеток, возможно, могут превращаться в фибробласты — клетки соединительной ткани. Но насколько они плюрипотентны? В костном мозге, мышцах и соединительной ткани есть и недифференцированные, стволовые клетки. Но насколько важен их вклад в регенерацию?
Сейчас доказано, что большинство клеток бластемы «помнит» свою клеточную линию и в основном дает клетки этой линии при регенерации. Но есть и клетки, которые становятся мультипотентными — это, прежде всего, фибробласты кожи. Большинство клеток бластемы — их потомки, и они точно превращаются в ходе регенерации не только в новые фибробласты, но и в клетки хряща.
Для регенерации, как правило, необходима нервная ткань. Шванновские клетки, окружающие аксоны нервов, подходящих к бластеме, выделяют белок, стимулирующий деление клеток бластемы.
Но в подходящих условиях можно заставить развиваться и бластему, отделенную от конечности. И даже изолированная бластема все равно отращивает только ту часть ноги, которая была отрезана! Значит, клетки бластемы запоминают не только клеточную линию, к которой принадлежат. Они еще и помнят, из какой части ноги происходят и в каком порядке нужно делиться, чтобы недостающая часть была не культей, а нормальной ногой.
Жалкая кучка глупых недифференцированных клеток обладает такой мудростью, что способна сотворить ногу с правильным расположением пальцев, костей и мышц! Как это удается клеткам — тема для отдельной статьи.
«А есть ли СК в СССР?» Стволовые клетки млекопитающих: немного истории
Стволовые клетки крови у взрослых птиц и млекопитающих (включая человека) описал выдающийся российский (с 1922 года — американский) гистолог Александр Александрович Максимов (рис. 3а). В своих работах 1902–1909 гг. он выдвинул и развил идею о существовании общей СК — предшественнике форменных элементов крови. В статье 1909 г. он же впервые использовал термин «стволовая клетка» (к столетнему юбилею публикации эта статья, опубликованная на немецком, была переведена на русский язык [3]). Одним из первых в этих исследованиях Максимов стал использовать культивирование клеток вне организма.
Следующим крупнейшим достижением в этой области стало открытие мезенхимальных мультипотентных СК (МСК). Их открыл советский ученый Александр Яковлевич Фриденштейн (рис. 3б) и его сотрудники [4].
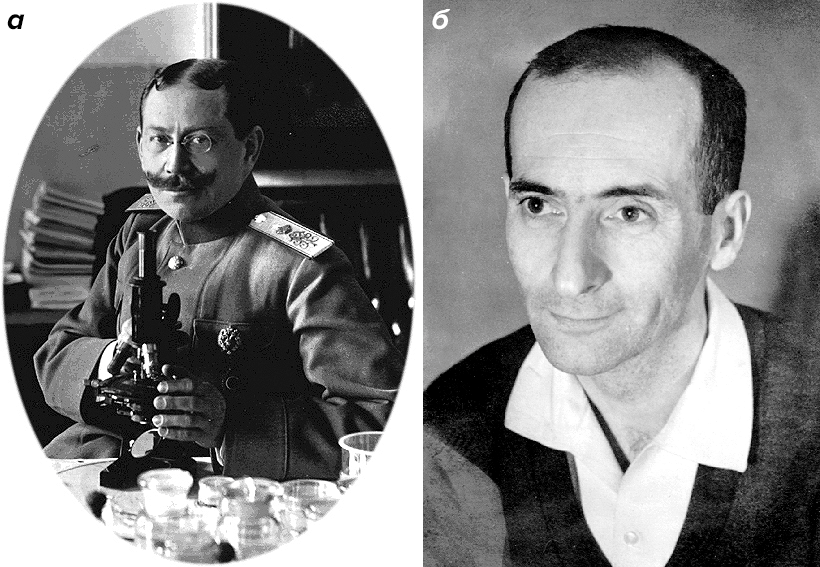
Рисунок 3. Выдающиеся ученые, работавшие со стволовыми клетками. а — Александр Александрович Максимов (1874–1928). б — Александр Яковлевич Фриденштейн (1924–1997).
Оказалось, что в красном костном мозге есть не только кроветворные СК, но и СК ретикулярной (мезенхимальной) ткани — МСК. Как в культуре, так и в организме человека единственная такая СК может давать клетки костной, хрящевой, фиброзной и жировой тканей.
В 1981 г. Мартин Эванс и Мэтью Кауфман и, независимо от них, Гейл Мартин получили культуру эмбриональных стволовых клеток (ЭСК) мыши, а в 1998 г Джеймс Томсон создал первую культивируемую линию ЭСК человека. Оказалось, что эти клетки при определенных условиях культивирования длительное время сохраняют плюрипотентность. С этого момента начался настоящий бум изучения СК: ведь их культивируемые линии позволяют изучать условия и механизмы дифференцировки. Сейчас слова «стволовые клетки» присутствуют в названии примерно двух десятков международных научных журналов.
В 2007 г. сэр Мартин Эванс, Марио Капекки и Оливер Смитис получили Нобелевскую премию по физиологии и медицине «за открытие принципов введения специфических генных модификаций в организм мышей посредством эмбриональных стволовых клеток». Этот метод позволил получать «нокаутных мышей», произведших настоящий бум в молекулярно-биологических исследованиях [5], [6].
Да их там тысячи!..
Наиболее «детские» СК — эмбриональные СК (ЭСК). Их у млекопитающих обычно получают из внутренней клеточной массы бластоцисты — раннего зародыша (рис. 4). Можно получить их и из одного бластомера четырехклеточного или восьмиклеточного зародыша. Эти клетки тотипотентны [7].
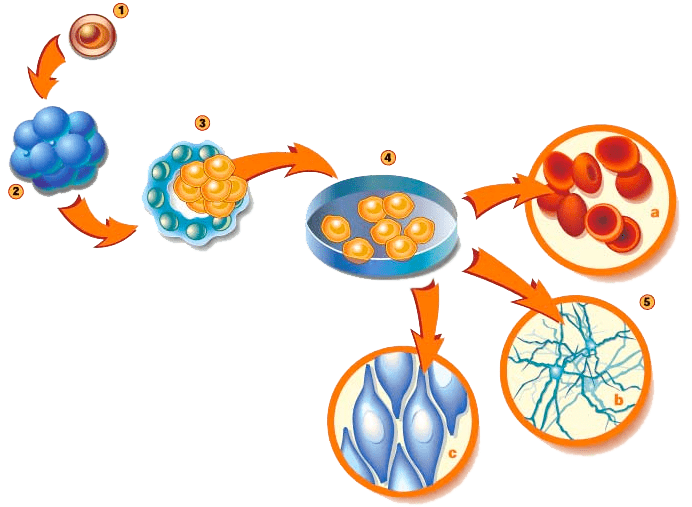
Рисунок 4. Один из способов получения ЭСК млекопитающих. (4) — выделение и культивирование клеток внутренней клеточной массы из раннего зародыша, бластоцисты (3). В подходящих условиях ЭСК дифференцируются в клетки разных тканей (5).
Разнообразные СК содержатся в органах плода и внезародышевых оболочках, в амниотической жидкости. Плюрипотентные СК с генотипом ребенка можно получить из крови плаценты и пуповинного канатика после его рождения. Среди этих клеток есть очень разные (в том числе СК крови), но некоторые точно плюрипотентны — их потомки могут превращаться и в нейроны, и в клетки печени, и в клетки эндотелия сосудов. Таким же или даже бóльшим потенциалом обладают МСК соединительной ткани пуповинного канатика — вартонова студня. Эти клетки очень перспективны для использования в медицинских целях: их сравнительно много, они хорошо растут и быстро размножаются в культуре, долгое время не теряя своих свойств.
По-видимому, плюрипотентны и стволовые клетки из зачатка третьего моляра («зуба мудрости»). Зубы — очень сложные органы, в их состав входит множество тканей. А «зуб мудрости» у детей 5–6 лет еще не начинает дифференцироваться. Часто приходится его удалять в ортопедических (или правильнее — ортодонтических?) целях, и он может оказаться прекрасным источником стволовых клеток для тех, кто не запас пуповинную кровь.
Мультипотентные МСК, видимо, присутствуют в большинстве тканей. К настоящему моменту они обнаружены в эндометрии матки, менструальной крови [8], грудном молоке, в жировой и мышечной ткани и т.д. Возможно, многие из них остаются и плюрипотентными. Доказано, что МСК из костного мозга и жировой ткани могут в культуре в присутствии определенных ростовых факторов превращаться в работающие нейроны.
Уже не вызывает изумления, что мультипотентные СК есть в мозге взрослых млекопитающих. СК гиппокампа, а также некоторых других участков переднего мозга могут превращаться во взрослом мозге в работающие нейроны и клетки глии. Вероятно, СК есть и в мозжечке.
Но оказывается, способные превращаться в нейроны СК есть и в крови взрослых людей! Циркулируют в крови и СК эндотелия сосудов, и другие типы СК. Возможно, там присутствуют и плюрипотентные СК, способные давать вообще практически все ткани. На их роль претендуют недавно обнаруженные «очень маленькие стволовые клетки, похожие на эмбриональные» (VSELsc, very small embryonic-like stem cells). Эти клетки (они и правда очень маленькие, диаметром около 5 мкм) присутствуют в крови в ничтожной концентрации. Их первооткрыватели предполагают, что эти «детские» СК запасаются в разных тканях зародыша и сидят там, не делясь. (Надо сказать, что сами СК вообще делятся редко. Обычно быстро делятся их потомки, уже вставшие на путь диффренцировки — «транзиторные амплифицирующиеся клетки».) Их покоящееся состояние обеспечивается геномным импринтингом [9], но оно обратимо. Возможно, именно эти клетки превращаются во взрослом организме в тканеспецифичные СК. Исчерпание запаса «очень маленьких клеток» может быть связано со старением.
В целом мы явно недооценивали свои «взрослые» СК. Их способность к дифференцировке оказалась ненамного меньше, чем у эмбриональных.
Впасть в детство — но хорошо бы, не навсегда
Почему стволовые клетки — стволовые? И почему некоторые их потомки перестают быть СК и дифференцируются?
Видимо, есть два основных механизма дифференцировки — асимметричное деление и разное микроокружение потомков (рис. 5). Например, нейробласты в ЦНС дрозофилы делятся асимметрично — одна клетка остается СК, а другая превращается в нейрон, и они различаются по размерам (первый механизм). СК эпидермиса человека остаются таковыми, только если сохраняют контакт с межклеточным веществом базальной пластинки (второй механизм).
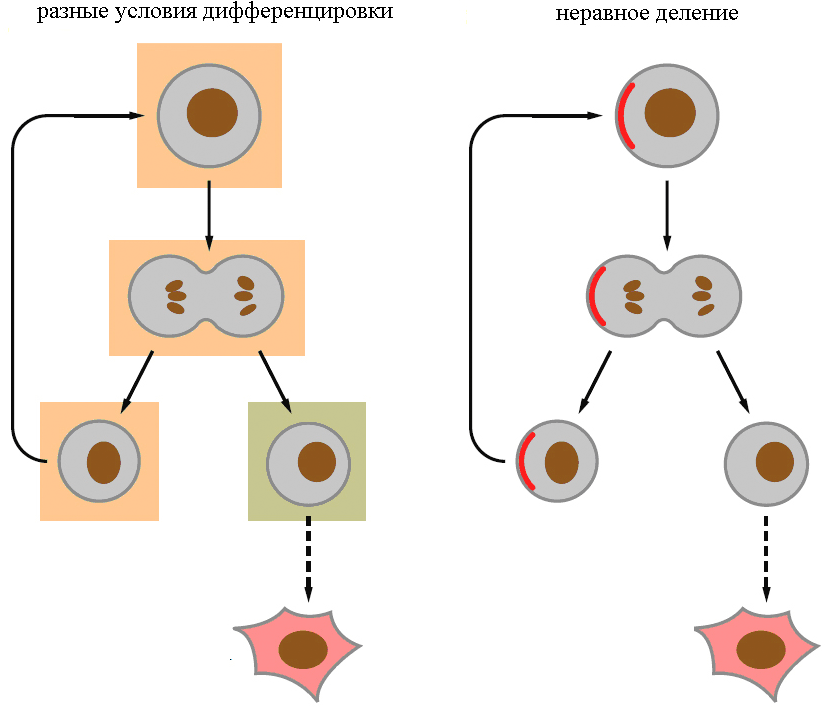
Рисунок 5. Основные механизмы дифференцировки СК. а — Дифференцировка зависит от микроокружения. б — Дифференцировка зависит от асимметричного деления.
В обоих случаях дифференцировка связана с изменением состава белков. Значит, в потомках СК выключаются одни гены и включаются другие. Сейчас для многих линий СК эти белки и гены удалось идентифицировать. И это чрезвычайно важно. Поверхностные белки-маркеры позволяют выявить СК. А на гены можно попробовать повлиять, чтобы вызвать дифференцировку в нужном направлении.
А нельзя ли обратить ее вспять? Оказалось, что можно! Достаточно включить в зрелой клетке (даже не стволовой, а обычной — например, в фибробласте) всего несколько генов — и она вновь станет вести себя, как стволовая. Такие индуцированные плюрипотентные СК (ИПСК) были впервые получены в 2006–2007 гг. А в 2008 г. журнал Science признал получение ИПСК одним из важнейших открытий года [11].
Включить для превращения клетки в ИПСК нужно всего 3–4 гена [12]. Их белковые продукты — факторы транскрипции. Они воздействуют на ДНК и меняют в клетке экспрессию сотен других генов. Например, активируется работа теломеразы — фермента, достраивающего концы хромосом и обеспечивающего способность клетки неограниченно долго делиться. А многие «взрослые» гены, активные в дифференцированных клетках, замолкают.
Сначала эти 4 «гена-хозяина» ЭСК встраивали в геном с помощью ретровирусов. Но такая операция в некоторых случаях может превратить клетку в раковую. Затем удалось уменьшить их число, исключив наиболее опасный — протоонкоген c-Myc. Наконец, оказалось, что можно обойтись вектором на основе аденовируса; он не встраивает гены в хромосомы клетки, а только доставляет их внутрь. Достаточно, что образуются нужные белки — и потомки этой клетки, геном которых не изменен, «запоминают» свое состояние и остаются плюрипотентными. Возможно, скоро научатся получать ИПСК вообще без генетических манипуляций — только с помощью воздействия комбинаций ростовых факторов и других веществ.
В 2009 году было доказано, что ИПСК могут давать полноценный организм, в том числе и клетки зародышевого пути. Так что ИПСК оказались тотипотентными: ИПСК, полученные из фибробластов кожи мышей, дали здоровых взрослых мышей, способных нормально размножаться.
Кстати, при этом впервые были получены по-настоящему клонированные животные. Ведь при стандартной процедуре клонирования (методом пересадки ядер) митохондриальная ДНК передается потомству от яйцеклетки-реципиента, так что клон — не точная генетическая копия донора.
Но получить ИПСК — это полдела. Хотелось бы еще заставить их дифференцироваться в нужном направлении — в культуре, а в перспективе в организме больного. И это тоже постепенно учатся делать. Недавно, например, из ЭСК удалось получить в культуре нейроны, вырабатывающие дофамин. Гибель таких нейронов в мозге вызывает болезнь Паркинсона.
Ниши и клетки
В культуре ЭСК и ИПСК могут долгое время делиться, оставаясь недифференцированными — нужно только создать подходящие условия. А что будет, если ввести ЭСК человека в организм бестимусной мыши с ослабленным иммунитетом? Как правило, они дают тератомы — опухоли, содержащие клетки всех трех зародышевых листков. Это стандартный тест на проверку плюрипотентности СК. Попав в непривычное окружение, ЭСК «не понимают», как им себя вести. В результате они обычно дают беспорядочно расположенные ткани, а иногда — целые органы, но там, где не надо...
Нередко хлопоты доставляют и наши собственные СК. Видимо, они более склонны к злокачественному перерождению, чем остальные. Генеративные СК могут развиваться в тератомы. СК мозга часто дают начало глиобластомам и другим опухолям ЦНС.
Все эти факты говорят о том, что СК, как толпу буйных детей, нужно постоянно держать под контролем — организм должен ограничивать деление СК и направлять в нужное русло их дифференцировку. И огромную роль в этом играет микроокружение СК — их «ниши».
Этот заимствованный в экологии термин в применении к СК означает клетки и межклеточное вещество определенной ткани, которые окружают СК, контролируют их деление и дифференцировку. Расшифровка сигналов, получаемых СК от компонентов «ниши», позволит нам управлять стволовыми клетками. Например, можно коммитировать ЭСК или МСК — направлять их дифференцировку в сторону определенного сорта клеток.
Как нейтрофилы спешат к месту воспаления, так и СК могут выходить из своих ниш (мобилизация) и спешить к месту повреждения, где надеются оказаться полезными (хоуминг). К примеру, при инсульте в поврежденном участке мозга образуются сигнальные вещества, «зовущие на помощь» СК мозга, СК крови и МСК из костного мозга. Все эти клетки находят поврежденный участок, в котором идет воспаление, и пытаются его залечить: выделяют противовоспалительные вещества, стимулируют рост новых кровеносных сосудов, сливаются с выжившими нейронами и заменяют их ядра, дифференцируются в новые нейроны и клетки глии. Если нейральные СК (или другие СК, коммитированные к развитию в нейроны) ввести в желудочек мозга или даже просто в вену, они найдут пораженную инсультом область. У подопытных животных это уменьшает последствия инсульта.
Вот уже десяток лет обсуждается вопрос о существовании особых СК злокачественных опухолей и особых ниш злокачественных СК. Многие факты говорят о том, что СК опухолей существуют. Возможно, именно они отвечают за образование метастазов. И возможно, что они возникают из обычных СК, если ниша за ними «не уследила». Более того — ниша может превращать «обычные» злокачественные клетки в злокачественные СК, позволяя им отрываться от опухоли и проникать в кровеносные сосуды. Само образование метастазов можно рассматривать как аналог мобилизации и хоуминга обычных СК.
Существуют и данные о том, что первичная опухоль готовит ниши для своих будущих метастазов. Она выделяет вещества, вызывающие мобилизацию кроветворных СК; те выходят из костного мозга и проникают в определенные ткани, меняя их свойства и подготавливая к заселению опухолевыми СК. Если эти данные подтвердятся, они укажут множество новых путей для терапии онкологических заболеваний (рис. 6).

Рисунок 6. Гипотеза о наличии раковых стволовых клеток пока окончательно не доказана, но их существование весьма вероятно. а — Прежние представления о том, что любая клетка опухоли способна дать метастазы, могут оказаться неверными. б — Гипотеза раковых СК постулирует, что лишь эти клетки могут стать родоначальницами метастазов. В таком случае для эффективной терапии необходимо выявить их особенности и направленно уничтожить.
И всё — равно, и всё — едино
В одной из статей высказывалась идея, что существует два принципиально разных типа СК, имеющих различное эволюционное происхождение. Одни служат у беспозвоночных для бесполого размножения, а другие — для создания разнообразия клеток. В это можно поверить, вспомнив клеточные линии гидры. Но в целом эта гипотеза вряд ли оправдана: всё, что мы знаем о происхождении и эволюции животных, убеждает в изначальной способности их клеток к взаимным превращениям [14].
Еще недавно нам казалось, что между разными тканями и тем более зародышевыми листками высших животных существуют четкие границы. Но сейчас от этих представлений приходится отказаться. Даже в теле взрослого человека эти границы постоянно нарушаются. СК одних тканей могут менять свою судьбу и входить в состав совсем других тканей и органов.
Так что в этом отношении мы не так сильно отличаемся от губок. Образно говоря, сто миллиардов воротничковых жгутиконосцев, из которых состоит наше тело, до сих пор не утратили способность превращаться в амеб и обратно.
Использование СК: надежды и опасения
Часто обсуждают возникающие при использовании ЭСК человека морально-этические проблемы (рис. 7). Следует ли считать эмбрион, лишенный нервной системы, человеком со всеми его правами? Это — вопрос спорный, его можно обсуждать. Но в данном случае копья, похоже, ломаются зря.

Рисунок 7. «Я помер, дожидаясь, пока исследователи эмбриональных стволовых клеток найдут способ лечения. А ты?» — «А я был использованным для этих исследований эмбрионом...».
Для получения ЭСК нет необходимости убивать эмбрионов [7]. Извлечение одного бластомера восьмиклеточного зародыша человека — рутинная процедура при экстракорпоральном оплодотворении (ЭКО [15]); она необходима для диагностики генетических заболеваний. С помощью той же процедуры можно получать ЭСК. При ЭКО остаются также неиспользованные для имплантации зародыши. Поэтому опасения, что для получения ЭСК будут специально создаваться «плантации человеческих эмбрионов», беспочвенны — в этом нет необходимости. А, кроме того, видимо, и ИПСК ничем не хуже ЭСК. Так что главные для биологов и врачей проблемы — научно-медицинские.
Работа Эванса, Капекки и Смитиса недаром была отмечена Нобелевской премией. На данный момент это — главное для науки и практики достижение исследований СК. «Нокаут» (полное отключение транскрипции) определенных генов — мощнейший инструмент научных исследований [6]. Дополненный генной инженерией, он позволяет получать мышей и крыс с отсутствующим или видоизмененным белком в любой ткани и органе. Благодаря этому можно изучать функции генов и белков, создавать «мышиные модели» множества болезней человека.
Одно из важных направлений использования СК человека — испытание безопасности лекарств на культурах этих клеток. Правда, полностью от опытов на животных отказаться все равно не удастся. Например, на культуре клеток нельзя выявить тератогенный (вызывающий уродства в ходе развития) эффект лекарств.
Отмечу сразу, что в официальной медицине ЭСК пока не используются. С 2010 года в США и Европе проходят первые этапы нескольких серий клинических испытаний коммитированных ЭСК. Клетки, способные превращаться в олигодендроциты (аналоги шванновских клеток в ЦНС), пробуют использовать для лечения больных с травмами спинного мозга. Главные проблемы у таких больных — разрушение миелиновых оболочек аксонов и образование рубцовой ткани. Опыты на крысах показали, что ЭСК могут образовывать новые миелиновые оболочки и выделяют факторы, препятствующие воспалению и образованию рубца. Крысы с травмой шейного отдела спинного мозга после введения ЭСК начинали ходить. В другом испытании попробуют лечить введением ЭСК одну из наследственных форм макулярной дегенерации сетчатки, приводящей к слепоте. Опыты на животных с этим заболеванием позволили вернуть им зрение.
Главная цель этой фазы испытаний — проверка безопасности метода. Параллельно совершенствуются способы сортировки ЭСК, позволяющие отделить недифференцированные туморогенные (способные давать опухоль) клетки от клеток, «вставших на путь истинный» — дифференцирующихся в нужном направлении.
Использование в медицине ИПСК — тоже дело будущего. Пока проводят опыты на животных; для практического применения есть масса барьеров. Например, наиболее безопасные методы перепрограммирования дают очень низкий выход ИПСК, а для терапии их нужно много.
Зато «взрослые» унипотентные или мультипотентные СК (в том числе СК пуповинной крови) используют в медицине успешно, причем все более широко. Уже более 40 лет применяют пересадку костного мозга для лечения лейкозов, а сейчас — и ряда аутоиммунных и наследственных болезней. В последнем случае клетки пациента генетически модифицируют в культуре или применяют клетки подходящего донора (рис. 8).
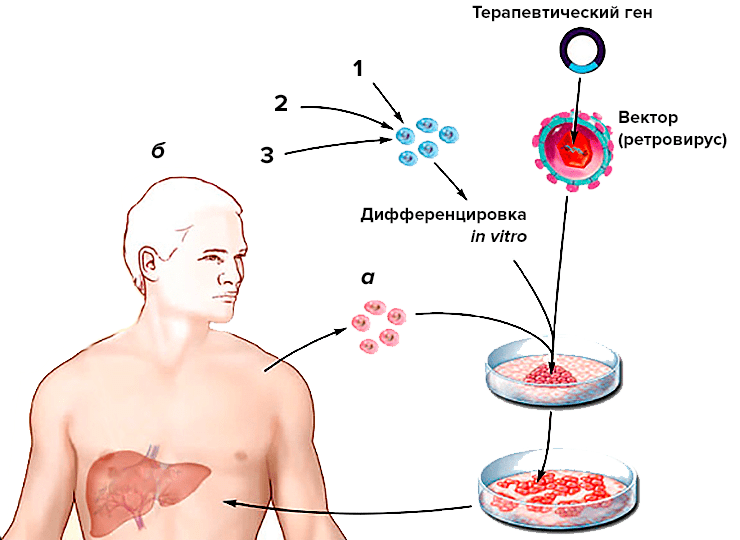
Рисунок 8. Возможности использования СК в терапии наследственных болезней. а — «Взрослые» СК (например, СК красного костного мозга) забирают у больного, доставляют в них терапевтический ген в культуре, а после селекции и размножения трансформированных клеток возвращают их в организм пациента. б — В перспективе для терапии можно будет использовать и ЭСК, даже если больной не имеет запаса таких клеток. Для этого можно генетически модифицировать чужие ЭСК, чтобы они не вызывали иммунного ответа (1); подобрать ЭСК подходящего донора с теми же генами, отвечающими за совместимость тканей (2); наконец, можно получить клонированный зародыш методом пересадки ядра в яйцеклетку донора и получить из него линию ЭСК пациента.
Вот уже 20 лет сложную операцию по пересадке костного мозга часто удается заменить введением СК пуповинной крови. Их не только проще получить — эти клетки по многим своим свойствам лучше подходят для терапии. Они способны дольше делиться и реже заражены вирусами; кроме того, в них еще не успели накопиться соматические мутации. Иметь такие собственные клетки «про запас» явно не вредно. Поэтому создание банков замороженной пуповинной крови — важное направление в здравоохранении.
К этим старым успехам добавились новые. Например, в 1998 г были начаты опыты по использованию СК эпителия роговицы глаза для лечения тяжелых ожогов роговицы (рис. 9). СК располагаются на периферии роговицы; их собирали из неповрежденных участков того же или второго, менее пострадавшего глаза, размножали в культуре и подсаживали обратно пациенту. У многих больных прозрачность роговицы полностью восстановилась, и этот результат сохранялся в течение 10 лет.
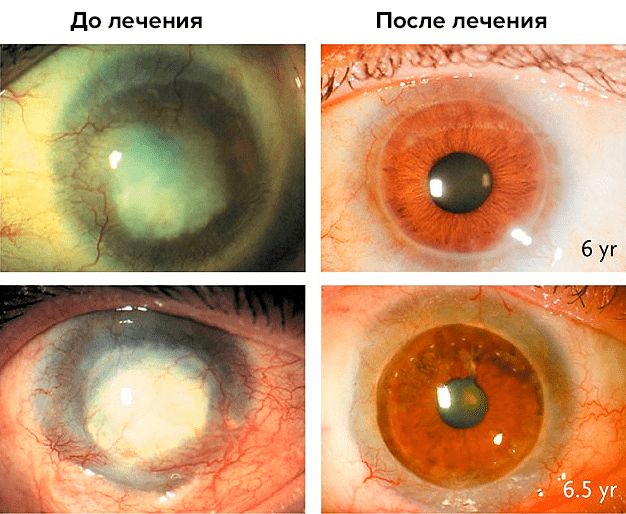
Рисунок 9. Результаты лечения повреждений роговицы лимбальными стволовыми клетками пациента
СК из разнообразных источников пробуют использовать для восстановления функции желудочков после инфаркта миокарда. В некоторых случаях СК превращаются в клетки сердечной мышцы и улучшают сократительную способность сердца.
От клеток — к органам
Впечатляющие успехи достигнуты с применением тканевых СК в выращивании органов (видео 1). Из многих органов можно удалить все клетки, и останется каркас из межклеточного вещества, повторяющий форму органа. Можно и изготовить такой каркас из биодеградируемого материала. Если затем заселить его клетками, которые взяты из соответствующей ткани больного, то в подходящих условиях эти клетки размножаются и строят новый, функционирующий орган [17]. С помощью такой технологии удалось вырастить кровеносные сосуды, трахею и мочевой пузырь. Первые больные с мочевым пузырем «из пробирки» прожили уже более пяти лет.
Еще одна многообещающая технология — печатание органов на струйном принтере. Специальный 3D-принтер заряжают смесью клеток и особого студня («межклеточного вещества»). С помощью компьютерной программы принтер послойно «печатает точки» из групп клеток, восстанавливая трехмерную структуру органа. Кажется, до такого не додумались даже писатели-фантасты!
Видео 1. Когда слушаешь лекцию пионера регенеративной медицины Энтони Атала о производстве искусственных органов — кажется, что это фантастический рассказ. И в самом деле, фантастике уже трудно угнаться за реальными достижениями науки...
Автор благодарит Е.А. Мусаткину за помощь в подготовке этой статьи. Первоначально работа была опубликована в журнале «Биология в школе» [18].
Литература
- Корочкин Л.И. (2005). Что такое стволовые клетки. «Природа». 6, 3–11;
- Diana J. Laird, Anthony W. De Tomaso. (2005). Predatory Stem Cells in the Non-Zebrafish Chordate,Botryllus schlosseri. Zebrafish. 1, 357-361;
- Максимов А.А. (2009). Лимфоцит как общая стволовая клетка различных элементов крови в эмбриональном развитии и постфетальной жизни млекопитающих. «Клеточная терапия и трансплантация». 1;
- Чайлахян Р.К., Лациник Н.В., Герасимов Ю.В., Куролесова А.И., Горская Ю.Ф. (2006). Памяти Ученого и Учителя Александра Яковлевича Фриденштейна посвящается. «Клеточная трансплантология и тканевая инженерия». 4, 9–12;
- Элементы: «Нобелевская премия по физиологии и медицине — 2007»;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Щадящие стволовые клетки;
- Эндометрий как альтернативный источник стволовых клеток;
- Глаголев С.М. (2011). Биология развития — «невезучая» наука. «Биология в школе». 6, 3–15;
- Alberts B. et al. Molecular biology of the cell (5th edition). 2008. — 1421 p.;
- Элементы: «Год перепрограммированных клеток»;
- Была клетка простая, стала стволовая;
- Ryan J. Ward, Peter B. Dirks. (2007). Cancer Stem Cells: At the Headwaters of Tumor Development. Annu. Rev. Pathol. Mech. Dis.. 2, 175-189;
- Kirill V. Mikhailov, Anastasiya V. Konstantinova, Mikhail A. Nikitin, Peter V. Troshin, Leonid Yu. Rusin, et. al.. (2009). The origin of Metazoa: a transition from temporal to spatial cell differentiation. BioEssays. 31, 758-768;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- Paolo Rama, Stanislav Matuska, Giorgio Paganoni, Alessandra Spinelli, Michele De Luca, Graziella Pellegrini. (2010). Limbal Stem-Cell Therapy and Long-Term Corneal Regeneration. N Engl J Med. 363, 147-155;
- Тканевая инженерия — окно в современную медицину;
- Глаголев С.М. (2011). Стволовые клетки. «Биология в школе». 7, 3–13.