«Резервный» механизм восстановления печени
25 октября 2017
«Резервный» механизм восстановления печени
- 23379
- 0
- 5
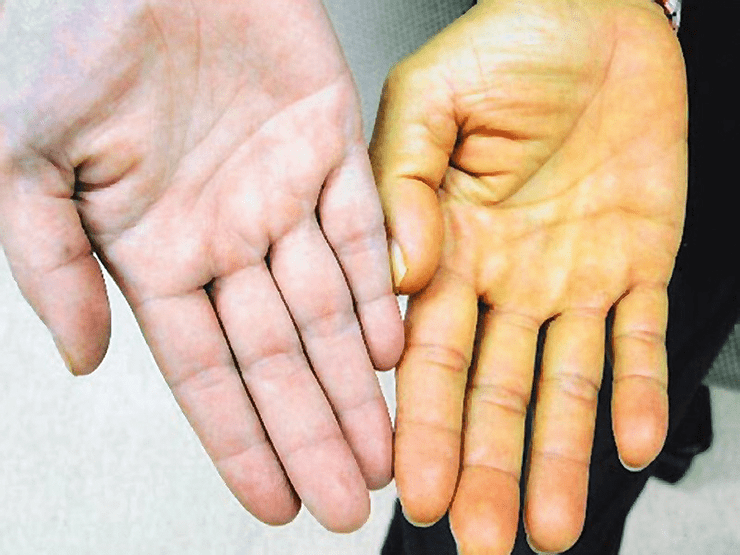
Слева — ладонь здорового человека; справа — ладонь человека, больного желтухой.
сайт gepatolog.com
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Быстрая утомляемость, потеря аппетита, тошнота, пожелтение кожных покровов и даже частые головные боли — все эти симптомы могут быть косвенными свидетельствами патологий печени. Несмотря на высокую способность клеток печени к восстановлению, в некоторых тяжелых случаях они просто не справляются с болезнью. Новое исследование команды ученых из Центра регенеративной медицины в Эдинбурге, Массачусетского технологического института и Сколковского института науки и технологий показывает, как с помощью блокирования основного пути восстановления клеток печени удалось открыть резервных «ремонтников».
Конкурс «био/мол/текст»-2017
 Эта работа заняла первое место в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Эта работа заняла первое место в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Открытие, предсказанное мифами: регенерация у рептилий
Способность организмов к регенерации, то есть восстановлению структуры и функций органов, является одной из важных загадок медицины, которую человек давно пытается разгадать. Наблюдения за животным миром позволили сформулировать следующую закономерность: чем проще устроено животное, тем легче ему восстановить утраченные органы. И если дождевой червь способен «достроить» половину собственного тела, а ящерица — отрастить новый хвост, то у человека способности к регенерации представлены в более узком диапазоне [1], [2].
Сказочных существ, способных отрастить себе новую голову или хвост, довольно много. Но и Лернейская гидра (рис. 1), и горгона Медуза, и даже Змей Горыныч имеют вполне реального «родственника» — тритона. Этот представитель хвостатых амфибий считается одним из древнейших видов фауны на Земле. Тритоны успешно восстанавливают не только хвост и лапы, но даже поврежденные сердце и спинной мозг. Однако амфибии — далеко не единственные существа, которым доступна функция «саморемонта». Например, рыбок данио рерио используют не только в аквариумистике, но и для изучения регенерации тканей сердца. А первым животным, благодаря которому появился термин «регенерация», стал речной рак. Изучением восстановления утраченных ног у раков занимался французский ученый Рене Реомюр, предложивший новый термин еще в 1712 году.

Рисунок 1. «Сражение Геракла с Лернейской гидрой» Антонио дель Поллайоло (1475 г.).
Неудивительно, что ученым хочется понять, почему ящерица, например, может восстановить утерянный хвост, а человек отрастить новую руку не может. Изучение структуры и состава тканей сразу после потери ящерицей хвоста позволило обнаружить модель регенерации у рептилий. В период заживления базальные клетки эпидермиса активно делятся, постепенно «закрывая» собой рану. Дополнительная агрегация делящихся клеток на дистальном конце позвоночника способствует разрастанию бластемы — скоплению неспециализированных клеток. В этот момент запускаются процессы образования новых кровеносных сосудов, а следом — и новых периферических аксонов. Наиболее поздно в дело вступают новообразования костной ткани и мышц. Однако точный механизм регенерации хвоста у ящериц не изучен до конца. Недавнее исследование Университета штата Аризона и Института геномных исследований позволило обнаружить молекулы микро-РНК, способствующие регенерации мышц, хрящей и позвоночника [3]. Возможно, эта работа позволит разработать методы лечения, основанные на управлении экспрессией генов с помощью микро-РНК.
Открытие, сделанное случайно: регенерация у мышей
Но как обстоят дела с возможностями регенерации на уровне целых органов у более высокоорганизованных, чем ящерицы, организмов? Еще недавно ученые были уверены, что млекопитающие не способны восстанавливать утраченные органы. Но это убеждение пошатнуло открытие, сделанное в лаборатории иммунолога Эллен Хебер-Кац из исследовательского центра в Филадельфии. Там проводили различные эксперименты на особых «пациентах» — генетически модифицированных мышах линии Murphy Roth Large (MRL). Такие особи отличались от обычных тем, что у них не работали Т-клетки иммунной системы. Однажды доктор Хебер-Кац дала своему лаборанту несложное задание: пометить выбранных для очередного эксперимента мышей, сделав у них небольшие двухмиллиметровые отверстия в ушах. Через несколько недель выяснилось, что дырочек в ушах подопытных нет. Структура кровеносных сосудов, хрящей, тканей выглядела неповрежденной. Однако лаборант заверил доктора, что задача по «мечению» мышей была своевременно выполнена. После повторения эксперимента с ушной раковиной эффект был таким же: уже через четыре недели на «проколотых» участках ушей образовалась бластема (рис. 2) [4]. Следующим «опытным» объектом стал хвост — и вновь удалось продемонстрировать частичную регенерацию тканей. Однако восстановительные способности MRL мышей не безграничны: например, вырастить новую лапку такая мышь, увы, не смогла. Причина заключается в различном расположении и количестве кровеносных сосудов в органах и тканях животного. Без прижигания мышь просто погибнет от большой потери крови — задолго до запуска регенерационных процессов. А прижигание на месте ампутированной конечности исключает появление бластемы.
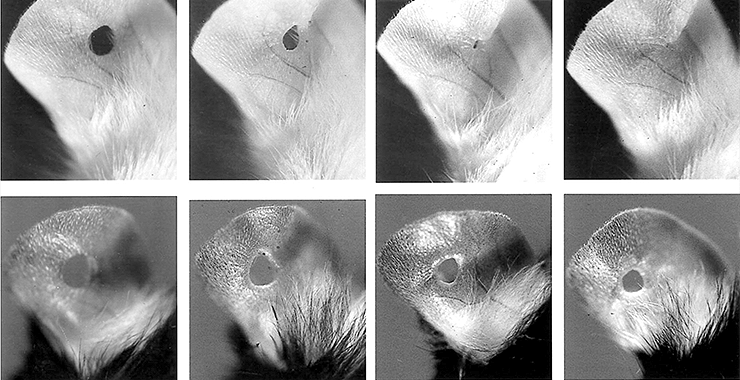
Рисунок 2. Этапы восстановления ткани уха у обычной лабораторной мыши (снизу) и трансформированной линии MRL (сверху).
В результате серии наблюдений за трансгенными мышами удалось показать, что секрет их успеха — в определенном белке. Так, у мышей линии MRL заблокирована экспрессия гена, кодирующего белок р21 (ингибитор циклинзависимой киназы 1А), который регулирует процесс нормального деления клеток. Подавление активности этого гена у нормальных мышей показывает аналогичную способность к регенерации повреждений [5]. Но проводить подобные манипуляции следует с большой аккуратностью: «отключение» гена р21 может привести к нарушению нормального размножения клеток, что способно привести к катастрофическому делению всех клеток тела.
Повседневная реальность: возможности регенерации у человека
А как обстоят дела с регенерацией у людей? Даже без «выключения» гена, кодирующего белок р21, организм человека может восстанавливать некоторые органы. Например, кожу, чья регенерирующая способность привычна для нас так же, как и воздух. Самый большой по площади орган нашего тела постоянно обновляет собственную структуру за счет омертвения и отторжения клеток эпидермиса с последующей заменой их новыми клетками. Сходным образом происходит процесс восстановления других эпителиальных тканей — например, слизистых оболочек дыхательных путей, а также желудка и кишечника. На втором месте в иерархии регенерирующих способностей находится костная ткань. Известно, что переломы довольно успешно заживляются в течение определенного периода неподвижности.
А среди внутренних органов заслуженным лидером по регенерации является печень. Легенда о титане Прометее, у которого всего за одну ночь выклеванная печень вырастала вновь (рис. 3), имеет в себе рациональное зерно.

Рисунок 3. «Прикованный Прометей». Скульптура Никола-Себастьяна Адама, 1762 г. (Лувр).
Действительно, печень обладает уникальным свойством восстанавливаться до своего первоначального объема, даже если разрушено более 70% печеночной ткани. Подобный процесс происходит за счет работы клеток печени — гепатоцитов. Эти клетки играют ключевую роль в модификации и выводе из организма токсичных веществ. В здоровом органе, не тронутом патологическими процессами, эти клетки обычно находятся в состоянии покоя. Но при необходимости восстановления целостности органа, например, после частичной резекции (удаления части органа), почти все гепатоциты активируются и приступают к делению. Причем делятся они 1–2 раза, а затем снова возвращаются в покоящееся состояние. Это свойство лежит в основе лечения некоторых заболеваний, например, цирроза печени или гепатита, когда пациенту пересаживают часть здоровой печени от донора. Однако такие манипуляции могут привести к ряду проблем со здоровьем, в том числе расширению вен пищевода и желудка, почечной недостаточности и желтухе. Более того, появление в печени пациента быстро делящихся клеток донора может привести к возникновению ракового заболевания. Справиться же своими силами при прогрессирующей болезни гепатоциты уже не могут, ведь к делению способны лишь здоровые клетки, которых в организме больного остается все меньше и меньше.
Получается, что, несмотря на мощный регенеративный потенциал, восстановительные способности печени имеют предел. В случаях, когда патологический процесс заходит слишком далеко, эффект от работы гепатоцитов оказывается недостаточным. Например, когда здоровая печень поражается в результате токсических или вирусных воздействий, что провоцирует разрастание соединительной ткани (фиброз). Существуют ли другие способы восстановления структуры этого жизненно важного органа без участия гепатоцитов? На этот вопрос позволяет ответить совместное исследование команды ученых из Эдинбургского университета, Массачусетского технологического института и Сколковского института науки и технологий [6].
Перспективная реальность: ускоренная регенерация печени
Для изучения процессов регенерации печени использовали трансгенных мышей линии tdTomato (tdTom). Эта линия модифицирована красными флуоресцентными белками, что позволяет визуализировать клетки печени [7]. Однако поиск других «спасательных» клеток осложняет то, что гепатоциты в пораженном организме продолжают работать. Для идентификации «не-гепатоцитов» исследователи использовали технологию нокдауна генов у мышей. Эффект нокдауна заключается в том, что позволяет временно снижать активность конкретных генов, не внося изменения в структуру хромосом и последовательность ДНК. Для «выключения» генов, ответственных за деление и миграцию гепатоцитов, создали особые липидные наночастицы с короткими интерферирующими РНК (siRNA) [8], [9]. С их помощью удалось заблокировать экспрессию необходимых генов.
Снижение пролиферации гепатоцитов за счет «выключения» интересующих ученых генов проводили на двух моделях. В первом случае временно блокировали ген ITGB1, который кодирует β1-интегрин. Вторая модель — одновременное блокирование β1-интегрина и стимуляция избыточной экспрессии белка р21. Обе модели обладали сходным эффектом, однако их механизмы отличались: β1-интегрин вызывает некроз гепатоцитов, а избыточная экспрессия р21 подавляет их пролиферацию.
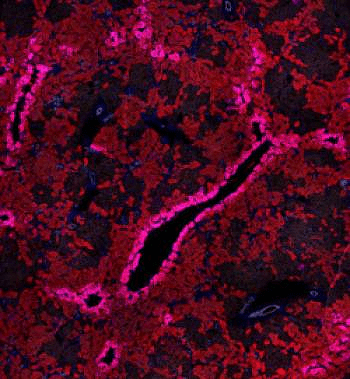
Рисунок 4. Регенерация печени с помощью клеток желчных протоков (выделены белым цветом).
Подобная «блокада» основных функциональных клеток печени привела к необычному эффекту: при выключении главного механизма регенерации запускался резервный способ с участием клеток желчных протоков. Так, потеря β1-интегрина и повышение уровня белка р21 привели к значительному увеличению численности гепатоцитов, полученных из холангиоцитов. Эти эпителиальные клетки внутрипеченочных желчных протоков составляют всего 2–3% от общей популяции, однако дальнейшие наблюдения показали, что именно они способны «перепрограммироваться» и превращаться в гепатоциты, тем самым восстанавливая печень (рис. 4). Более того, холангиоциты показали лучшую, чем гепатоциты, способность к делению. Ранее обнаружили, что они близки к овальным клеткам печени — своеобразным «стволовым» агентам данного органа [10].
Для того чтобы отследить регенеративные способности холангиоцитов, использовали три независимых пути:
- Моделирование холестатической болезни печени.
- Моделирование метаболического неалкогольного стеатогепатита (воспалительного процесса, связанного с чрезмерным накоплением триглицеридов в печени).
- Моделирование фиброза печени (разрастания соединительной ткани в печени при повреждении гепатоцитов).
Для изучения регенерации печени за счет не-гепатоцитов по всем трем путям визуализировали отдельные участки печени. Оказалось, что за счет холангиоцитов восстанавливается примерно 20–30% гепатоцитов, причем малые пролиферативные гепатоциты идентифицировали уже с 7 дня, а к 14 дню регенерации их количество значительно увеличивалось (рис. 4–6).
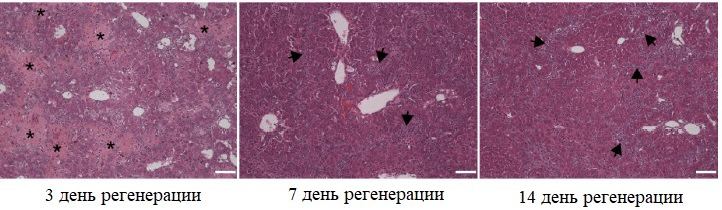
Рисунок 5. Динамика восстановления печеночной ткани с помощью холангиоцитов (на примере модели холестатической болезни печени). Звездочками показаны некротические области; стрелками обозначены области с клеточным инфильтратом.
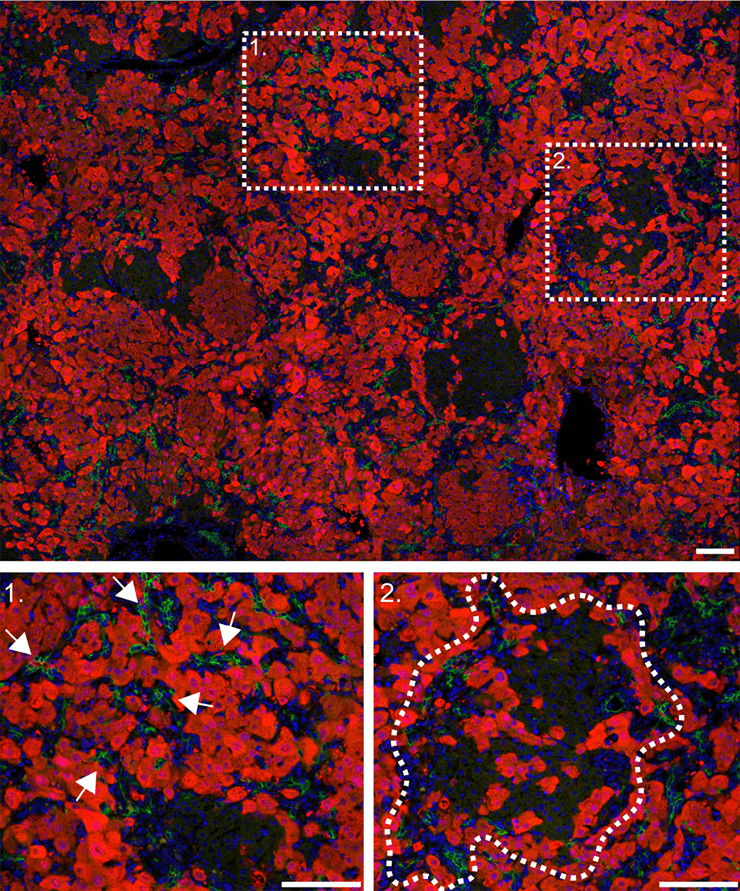
Рисунок 6. Клетки печени мыши, трансформированной по гену ITGB1 (14 день регенерации). Визуализация с помощью красных флуоресцентных белков. 1 — стрелками показаны инвазивные клетки; 2 — пунктиром обведена область регенеративного узла.
Получается, что в печени существует резервный механизм регенерации: трансформация клеток желчных протоков в функциональные гепатоциты при блокировании β1-интегрина. Возможно, в организме существуют и другие гены-мишени, «выключение» которых стабилизирует процессы, связанные с развитием фиброза и дальнейшего цирроза печени. Ученым еще предстоит раскрыть механизмы сигналов, побуждающих желчные клетки запускать процессы «перепрограммирования». Однако результаты исследования уже сегодня открывают новое направление клеточной регенеративной медицины: разработку препаратов, стимулирующих холангиоциты. Возможно, в будущем медицина избавится от необходимости проводить сложные и дорогостоящие операции по пересадке печени. Взамен этого распространится более доступная технология: «включение» сигналов о необходимости регенерации, когда с помощью наиболее активных холангиоцитов будут запускаться процессы активного деления клеток печени.
Литература
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Куликова Н. (2016). Минога помогла узнать, как у человека появился мозг. Сайт ИБХ РАН;
- Elizabeth D. Hutchins, Walter L. Eckalbar, Justin M. Wolter, Marco Mangone, Kenro Kusumi. (2016). Differential expression of conserved and novel microRNAs during tail regeneration in the lizard Anolis carolinensis. BMC Genomics. 17;
- Ellen Heber-Katz. (1999). The regenerating mouse ear. Seminars in Cell & Developmental Biology. 10, 415-419;
- K. Bedelbaeva, A. Snyder, D. Gourevitch, L. Clark, X.-M. Zhang, et. al.. (2010). Lack of p21 expression links cell cycle control and appendage regeneration in mice. Proceedings of the National Academy of Sciences. 107, 5845-5850;
- Alexander Raven, Wei-Yu Lu, Tak Yung Man, Sofia Ferreira-Gonzalez, Eoghan O’Duibhir, et. al.. (2017). Cholangiocytes act as facultative liver stem cells during impaired hepatocyte regeneration. Nature. 547, 350-354;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Roman L. Bogorad, Hao Yin, Anja Zeigerer, Hidenori Nonaka, Vera M. Ruda, et. al.. (2014). Nanoparticle-formulated siRNA targeting integrins inhibits hepatocellular carcinoma progression in mice. Nat Comms. 5;
- Обо всех РНК на свете, больших и малых;
- Киясов А.П., Гумерова А.А., Титова М.А (2006). Овальные клетки — предполагаемые стволовые клетки печени или гепатобласты? Гены и клетки. 2, 55–58.