Руку, ногу и сердце: редкий АТТR-амилоидоз
28 февраля 2022
Руку, ногу и сердце: редкий АТТR-амилоидоз
- 3819
- 0
- 4
Самый характерный симптом ATTR-амилоидоза — накопление в сердце тяжей амилоида, ведущее к кардиомиопатии.
Рисунок в оригинальном разрешении.
-
Авторы
-
Редакторы
-
Рецензенты
-
Иллюстратор
Диагностика орфанных заболеваний — дело непростое, но после верного диагноза необходимо и подходящее лечение. Продолжая Спецпроект об орфанных заболеваниях, мы поговорим о болезнях, для которых диагностика все еще проблематична, но зато терапия уже появилась. Начнем с транстиретинового семейного амилоидоза, способного запросто сбить врачей с толку своими симптомами. Как его распознать и чем лечить? Читайте статью!
Орфанные заболевания
Орфанные заболевания словно окутаны туманом неопределенности. Сегодня даже нет их четкого определения — в общем виде это просто очень редкие болезни. Для большинства нет точных и своевременных методов диагностики, а значит, нет и точной статистики их распространения. Скорее всего, людей с орфанными заболеваниями сильно больше, чем официально диагностировано. Но даже по самым скромным подсчетам, в сумме во всем мире от всех редких заболеваний страдает около 300 миллионов человек — 5% населения. А значит, каждый двадцатый (!) человек на планете попадает в эту группу.
Пациенты с орфанными заболеваниями страдают в одиночестве и смятении. Они чувствуют себя изгоями «стандартной» медицины. Мечты о том, что их заболевание «усыновит» какая-нибудь компания, и лекарство, наконец, будет разработано — то, что не дает им впасть в отчаяние.
Этим спецпроектом мы хотим помочь и остальным орфанным заболеваниям, завязав разговор о них, и надеемся, что его подхватят с интересом.
Ни для кого не секрет, что к концу карьеры здоровье профессиональных спортсменов находится не в лучшем состоянии. Их тела, хоть и походят на превосходно настроенные машины, испытывают пиковые нагрузки и работают на износ. Поэтому неудивительно, что спортсменов-профессионалов доктора проверяют часто и буквально с ног до головы. И пусть проблемы с сердцем нередки для возрастных легионеров большого спорта, Нейту Арчибальду — одному из 50 величайших игроков в истории НБА — пришлось неприятно удивиться. Его проблема с сердцем была особой — и неизлечимой.
По сравнению с большинством людей, страдающих от амилоидоза сердца (ATTR-амилоидоза), Нейту довольно сильно повезло: финансируемая НБА программа скрининга спортсменов помогла обнаружить проблемы с сердцем еще до серьезного проявления симптомов. А доступ к хорошим специалистам-кардиологам позволил заподозрить проблему и провести все нужные тесты для постановки верного диагноза. Но чаще для пациентов с редкими заболеваниями (к коим относится и ATTR-амилоидоз) лечение начинается с «диагностической одиссеи» длиной много лет, без гарантии успеха и адекватного подбора терапии.
Иначе редкие заболевания называют орфанными. Об общей для них беде — малой информированности и оснащенности врачей-диагностов, неспецифичности симптомов и об алгоритмах постановки диагноза — мы уже писали в первой статье Спецпроекта по орфанным заболеваниям: «Редко, но метко: орфанные заболевания как вызов современной медицине» [1].
Даже внутри группы амилоидозов есть свои трудности диагностики. Ведь их причина — это отложение плотных тяжей белков в разных органах, а значит симптомы будут зависеть от того, какой орган поражен. В этой статье мы хотим посмотреть на возможности и сложности в диагностике только одного из заболеваний группы — ATTR-амилоидоза, — коих тоже хватает: ведь эта болезнь не только успешно мимикрирует под другие серьезные патологии, но и дает разные симптомы в зависимости от типа заболевания. Этот амилоидоз может начаться вполне безобидно — с туннельного синдрома, знакомого многим офисным работникам. Может проявиться невропатией конечностей, что не редкость для диабетиков и людей с анемией. А в каких-то случаях первым симптомом и вовсе станет помутнение сетчатки.
Арчибальду повезло и после постановки диагноза, ведь была возможность назначить ему своевременную (и весьма радикальную) терапию — пересадку сердца. Благодаря этому (и лекарственной поддержке), Нейт, получив диагноз уже в 2014 году, все еще жив, что, увы, статистически редко даже с получением лечения. В этой статье мы также рассмотрим современные возможности для лечения этой патологии. Ведь не так давно появилось несколько новых методов терапии, которые могут если и не излечить, то хотя бы замедлить развитие болезни и улучшить качество жизни пациентов.
Но первым делом хотелось бы понять — чем так особенны амилоидозы? Как протекают эти заболевания? И какое место в их группе занимает редкий ATTR-амилоидоз? Читайте статью!
Амилоидозы — какими они бывают?
«Сердце становится очень твердым и жестким. Мышца сердца перестает быть податливой, она больше не может прокачивать через себя достаточно крови», — так доктор объяснял Нейту Арчибальду, что происходит с его сердцем. Так же наблюдали амилоид врачи уже более 300 лет назад, пускай еще не понимая его природы. На аутопсии отмечались то «большая селезенка, наполненная белыми камнями», то «жироподобные уплотнения печени». Пока же пациенты были живы, понять, в чем их недуг, было очень сложно — у них были самые разнообразные симптомы. Одно можно было сказать точно: пускай симптомы и не вписывались в картины известных на тот момент болезней и не вели к пониманию заболевания, но зачастую были очень тяжелыми.
Это и интриговало ученых старого времени — они пытались исследовать инфильтраты в органах больных и понять, в чем истинная причина этих заболеваний. Справедливости ради, понимание их белковой природы заняло достаточно долгое время: первоначальное описание амилоидных поражений не сопровождалось химическими исследованиями. Первый раз природу амилоида попробовал установить Антуан Порталь в 17 веке: он предположил, что эти соединения имеют жировую природу, а в 19 веке добавилась идея об их углеводном происхождении (спойлер: обе теории были неверны).
Случайным образом последняя гипотеза и породила термин «амилоид» (от латинского amylum — крахмал). Знаменитый ученый и врач Рудольф Вирхов обнаружил, что специфические отложения в нервной системе у некоторых больных при обработке йодом окрашивались в синий цвет, совсем как крахмал! И исключительно по этому сродству к краске неизвестная субстанция была названа амилоидом. Этот термин так и прижился, хотя он вовсе не отражает истинную (белковую) природу этих молекул. Окраска йодом происходила не по причине полимеризации йода при его связывании с амилоидными фибриллами. Так окрашивались богатые углеводами другие молекулы (в основном гликозаминогликаны), которые выделялись вместе с амилоидными фибриллами, коих всего-то около 5% от состава инфильтрата.
По мере накопления знаний ученые поняли, что это за молекулы, почему и как они образуются и как влияют на качество и продолжительность жизни. С развитием молекулярных методов была установлена их структура — упорядоченный жесткий β-складчатый каркас, который и формирует фибриллы.

Рисунок 1. Главные места накопления амилоидных фибрилл для разных заболеваний и типов белковых мономеров.
иллюстрация Валерии Кузык по [4]
Ввиду схожести механизма (отложение нерастворимых фибрилл амилоида во внеклеточном пространстве) было решено сгруппировать эти редкие заболевания, назвав их амилоидозами. Они имеют самые различные проявления в зависимости от локализации, количества и типа белковых отложений [2]. Название заболевания может носить имя ученого, впервые его описавшего (так вышло, например, с болезнями Альцгеймера, Крейтцфельда—Якоба, Паркинсона и другими). Но есть и система их более четкого наименования: первая буква «А» (означает амилоидоз как механизм патогенеза), а далее идут буквы, обозначающие белок, вызывающий болезнь. Так, наиболее известный амилоидный белок — β-амилоид, вызывающий болезнь Альцгеймера, поражающую нервную систему. Встречаются как спорадические (то есть возникшие случайно), так и семейные случаи с несколькими пораженными в семье. Но белки могут быть и другими — например, АА-амилоидоз вызывает неправильная агрегация одного из белков острой фазы — сывороточного амилоида А; а AL-амилоидоз — агрегация фрагментов легких цепей иммуноглобулинов. Следуя схожей логике, интересующий нас ATTR-амилоидоз вызывает транстиретин (TTR).
Помимо самых известных представителей, сейчас описано порядка 30 видов амилоидных белков [3]. Большинство из них (34 вида) неприонные (то есть неинфекционные) амилоиды, но есть также несколько видов прионных (инфекционных) белков.
Кроме того, амилоидоз может быть первичным как самостоятельно возникшее заболевание (например, наследственные формы) и вторичным, возникающим на фоне уже существующего хронического (в основном воспалительного) заболевания [2]. А также возможно разделение по степени поражения — локализованный (затрагивающий один орган) или системный амилоидозы. Последние, как правило, возникают вторично на фоне основного заболевания и поражают нескольких органов или даже весь организм (рис. 1) [4]. Для AA-амилоидоза таковым является ревматоидный артрит, а для AL-амилоидоза — миелома, но могут быть и другие лимфопролиферативные заболевания.
Сердечный недруг: в чем особенности ATTR-амилоидоза?
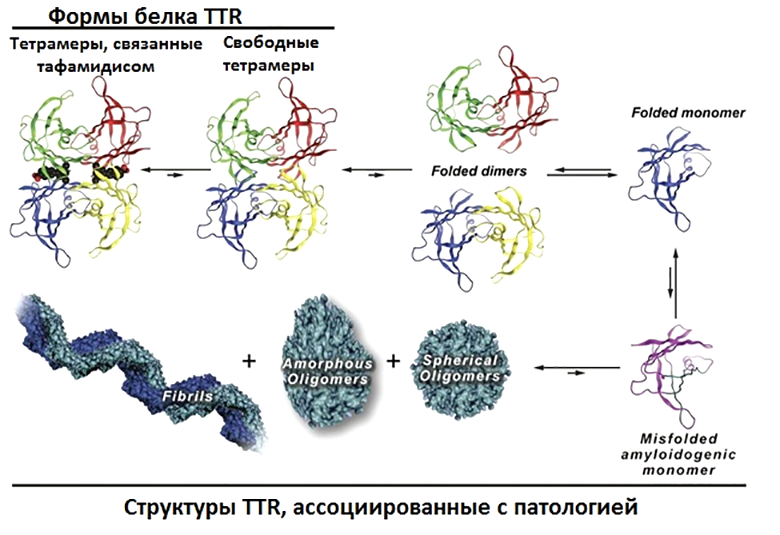
Отдельное значимое место среди всего разнообразия амилоидозов занимает уже упомянутый выше ATTR — амилоидоз, вызываемый агрегацией транстиретина. Это один из известных и изученных амилоидогенных белков, вызывающих заболевания в молодом возрасте с поражением сердца. Его название получилось очень говорящим: белок осуществляет транспорт гормонов щитовидной железы («транс-»), в частности тироксина («-ти-»), и комплекса ретинол-связывающего белка и ретинола («-ретин»). У человека он синтезируется в печени, сосудистой оболочке головного мозга, пигментном эпителии сетчатки. Из мест синтеза он выделяется в кровь, цереброспинальную жидкость и глаза. В клетках транстиретин производится в виде мономерного белка, который далее в норме образует димеры, а затем и функциональные тетрамеры, содержащие два сайта связывания тироксина. Эта сложная структура в физиологических условиях может диссоциировать обратно до мономеров и, напротив, агрегировать с образованием фибрилл (рис. 2 и видео 1).
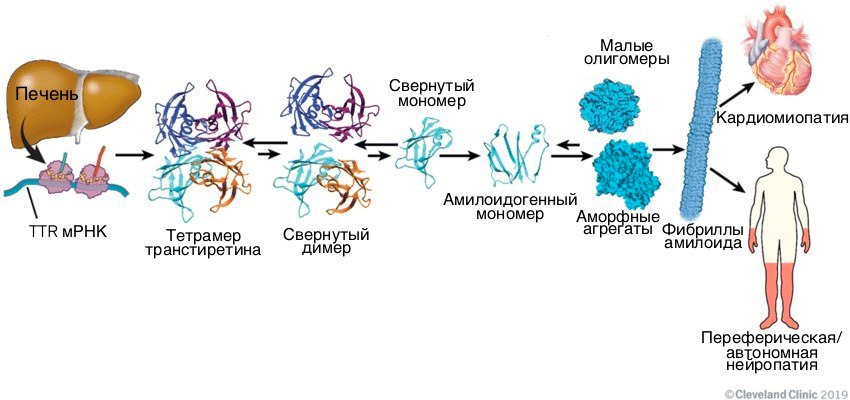
Рисунок 2. Молекулярный путь развития ATTR-амилоидоза. При возникновении некоторых мутаций фолдинг синтезируемого в печени транстиретина может проходить неправильно. Такой белок становится амилоидогенным, и его мономеры полимеризуются, образуя токсичные амилоидные тяжи.
Видео 1. 3D визуализация механизма патогенеза ATTR-амилоидоза.
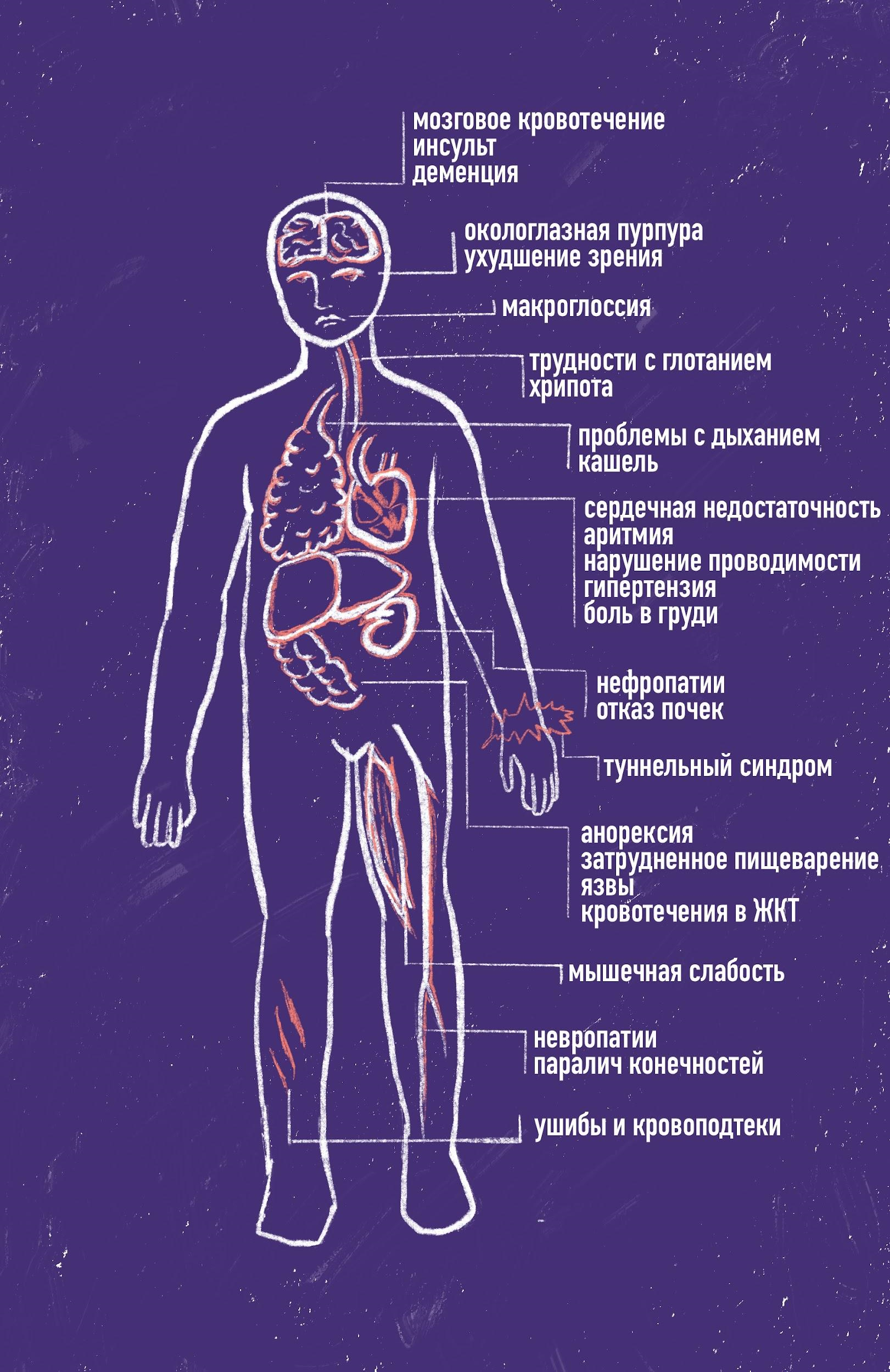
Рисунок 3. Симптомы ATTR-амилоидоза в разных органах и системах органов.
иллюстрация Валерии Кузык по [4]
В норме это происходит достаточно медленно, но если в белке появятся мутации, меняющие его структуру и стабильность, скорость диссоциации и агрегации может увеличиться. Существует гипотеза, что одним из пусковых механизмов формирования амилоидных фибрилл является частичное расщепление С-конца мономерного транстиретина ферментом трипсином. В таком случае могут образоваться нерастворимые фибриллы, которые будут откладываться в органах-мишенях, причем поражен может быть едва ли не любой орган. Но в случае ATTR чаще всего страдают нервная, сердечно-сосудистая (а именно сердце с развитием сердечной недостаточности) и мочевыделительная системы, а также ЖКТ (печень и непосредственно кишечный тракт) (рис. 3).
Понять, с чем имеем дело
На сегодняшний день выделяют два главных подвида ATTR-амилоидоза: дикого типа (он же старческий) и наследственный. Каждый из них представляет значимую проблему для современной медицины, но сильно отличается в патогенезе и диагностике.
Амилоидоз дикого типа (ATTRwt), также называемый старческим системным амилоидозом, в отличие от наследственного, возникает по причине спонтанных мутаций в гене TTR, произошедших из-за возрастных изменений. ATTRwt поражает в основном мужчин старше 60 лет. Как правило, эти пациенты обращаются к докторам с весьма неспецифичными симптомами, частыми для пожилого возраста, что весьма осложняет работу врачам. В основном их беспокоят одышка, слабость, боли за грудиной, проблемы с почками. За последнее время алгоритмы диагностики поменялись, благодаря чему можно не только поставить более точный диагноз, но и более полно оценить распространенность заболевания. Интересно, что при уточнении самочувствия и истории заболевания у пациентов выясняется, что до кардиологических симптомов большинство из них беспокоили боли в спине и онемения конечностей (частые клинические проявления амилоидоза). Без должного лечения болезнь быстро прогрессирует: органы, пораженные амилоидом, перестают нормально функционировать; могут начинаться проблемы с подвижностью, чувствительностью, вплоть до параличей; и самое фатальное — сердце теряет эластичность и не может больше эффективно снабжать органы кровью. Это ведет к отказу многих органов, в том числе и самого сердца. К сожалению, медианная выживаемость пациентов с ATTRwt после появления симптомов составляет чуть больше шести лет [5].
Другой вид — наследственный амилоидоз (ATTRv) с аутосомно-доминантным типом наследования — вызывается врожденными мутациями в гене транстиретина (TTR). На сегодняшний день описано около 200 таких мутаций, и, как правило, для каждой характерна определенная клиническая картина. Ранее заболевание считалось эндемичным для Португалии, Бразилии, Швеции и Японии [6], однако при более тщательной диагностике выяснилось, что распространено оно во всем мире. Его расчетная частота — 1,1:100 000, но предполагается, что реально она заметно выше [7]. Как правило, заболевание проявляется не сразу (на 3–5 десятилетии жизни); чаще всего первым симптомом являются боли и онемения в кисти, то есть туннельный синдром, проявляющийся за несколько лет до дебюта кардиологической или неврологической симптоматики. По клиническим проявлениям выделяют три формы ATTRv:
- Семейная амилоидная полинейропатия — FAP (наиболее частый фенотип). Описано как раннее, так и более позднее начало заболевания.
- Раннее начало FAP характеризуется снижением болевой и температурной чувствительности и поражением автономной нервной системы (в виде ортостатической гипотензии, нейрогенного мочевого пузыря, эректильной дисфункции и нарушенной перистальтики кишечника).
- При позднем дебюте, наоборот, отсутствует семейная история заболевания, и легкие проявления в виде снижения всех видов чувствительности и нетяжелого поражения функций вегетативной нервной системы [6]. Пациентам также регулярно рекомендуют проверять сердце, так как оно часто поражается у больных этой формой, а прогрессия до тяжелой сердечной недостаточности происходит довольно быстро.
- Семейная амилоидная кардиомиопатия — FAC (наиболее тяжелая и жизнеугрожающая форма), проявляющаяся в виде сердечной недостаточности, аритмий и блокад проводимости. Иногда пациентам требуется хирургическое лечение аритмий и блокад (имплантации кардиостимулятора и/или кардиовертера-дефибриллятора) [5], [6]. FAC является одной из наиболее частых причин застойной сердечной недостаточности, и тут уже именно причина заболевания и тактика его лечения являются определяющими для прогноза жизни пациента.
- Семейный лептоменингеальный амилоидоз (самая редкая форма) [6].
Однако стоит отметить, что при любой форме довольно часто могут поражаться и другие органы, а сама форма называется по ведущему симптому. Например, описаны поражения ЖКТ с нарушением перистальтики, почек с развитием почечной недостаточности и глаз с развитием широкого спектра симптомов — от сухости глаз до глаукомы.
Амилоидоз ли? Проблемы диагностики
Увы, любая форма АТТR-амилоидоза имеет достаточно неспецифичные симптомы. Поэтому диагностика тут — серьезная проблема, с которой сталкиваются врачи при лечении пациентов с прогрессирующей сердечной недостаточностью. Часто правильный диагноз ставится уже только на поздних стадиях болезни, когда лечить, по большому счету, уже поздно. Так, например, исследование более 100 пациентов с ATTR-кардиомиопатей в США показало, что 17% больных побывали у пяти разных врачей, прежде чем получили правильный диагноз [8]. Более половины пациентов с наследственным ATTR и 39% с ненаследственной формой получили изначально неправильный диагноз, и около ¾ из них получали неправильное лечение, которое могло только ухудшить болезнь.
Почему так происходит? Амилоидоз — заболевание редкое, а потому врачи начинают задумываться об амилоидозе сердца в последнюю очередь, когда более «привычные» диагнозы уже поставлены, лечение назначено, но оно не помогает, и заболевание лишь прогрессирует. Увы, с орфанными заболеваниями такое происходит часто из-за того, что про них мало говорят, мало пишут, а значит, найти надежную информацию порой не удается. Вообще, дифференциальная диагностика как таковая часто становится краеугольным камнем в работе врача. Без главы, посвященной ей, не обходится ни один сборник клинических рекомендаций. Жалобы пациента зачастую могут указывать на целый ряд различных заболеваний, и постановка точного диагноза напоминает работу сыщика, постепенно исключающего подозреваемых из списка причастных к преступлению. Иногда ситуация настолько сложна, что клиницистам приходится метафорически сменить белый халат на плащ героя нуарного детектива начала XX века и путем дедукции искать истинную причину путем анализа похожих случаев среди массы возможных вариантов.
Для орфанных заболеваний проблема диагностики стоит особенно остро. Основной метод дифференциальной диагностики — анализ эпидемиологии — здесь оказывается неэффективным: специалисты прикидывают вероятность заболевания, начиная с самых распространенных. К сожалению, древний методологический принцип Бритвы Оккама здесь скорее вредит, так как в структуре общей заболеваемости орфанные болезни занимают далеко не лидирующие позиции. Ведь, как гласит девиз международной организации Orphanet, «орфанные заболевания редки, но людей, страдающих ими, много». А это значит, что при переборе диагнозов доктор, последний раз имевший дело с редкими заболеваниями за вузовской партой, придет к ним в последнюю очередь, и драгоценное время будет упущено. Время, которого больным редкими болезнями так часто не хватает.
Конечно, не у всех пациентов с сердечной недостаточностью теперь нужно пытаться найти амилоидоз — заболевание все же редкое. Однако помнить о нем и знать, на что обращать внимание, — необходимо. Для того, чтобы врачам было проще заподозрить ATTR, эксперты выбрали так называемые «красные флажки» — признаки, не укладывающиеся в картину «привычного» пациента. Вовремя заметить их — значит укоротить путь пациента до получения правильного лечения [9].
Рассмотрим самые важные из этих диагностических признаков поподробнее!
Электрокардиография (ЭКГ)
ЭКГ — метод регистрации электрических потенциалов при работе сердца [10]. На грудную клетку и конечности закрепляют набор электродов, и прибор записывает разницу потенциалов между ними. Обычно на ЭКГ можно выделить пять зубцов: P, Q, R, S, T, отражающих проведение электрического импульса и возбуждение/расслабление определенных отделов сердца. В норме в каждом отведении зубцы и соединяющие их сегменты имеют определенную длительность, направление и амплитуду (или вольтаж). Изменения этих параметров могут говорить о появлении патологии. Например, с помощью ЭКГ можно обнаружить изменение источника сердечного ритма, регулярности и частоты сердечных сокращений. ЭКГ может выявить нарушение проводимости из-за повреждения определенного участка проводящей системы сердца или предположить изменения толщины стенок или перегородок.
При нормальной толщине сердечной стенки в левом желудочке высота зубцов Q, R и S на ЭКГ может колебаться в определенном диапазоне значений, свойственном здоровому человеку. Логика такая: чем больше масса сердца, тем выше у человека на ЭКГ пики зубцов QRS (большой орган испускает больше электрических импульсов, чем маленький). Именно так это работает при отсутствии тяжелых патологий, однако накопление амилоидов вносит в эту логику свой патологический парадокс: белок TTR действительно приводит к увеличению массы органа, но зубцы QRS в это время уменьшаются, а не растут, так как амилоиды не имеют никакого функционала в сердечной деятельности. Именно этот феномен должен натолкнуть толкового кардиолога на мысль об амилоидозе еще до назначения других более навороченных исследований. Помимо этого, ATTR-амилоидоз может повлиять и на электропроводимость миокарда. Образующиеся при болезни в сердце фибриллы гораздо хуже проводят электрический ток, чем окружающая их здоровая ткань, что в конечном итоге приводит к блокаде передачи импульса из предсердий в желудочки (AВ-блокаде). В итоге нарушается ритм работы сердца, и возможна полная остановка сердечной деятельности.
Эхокардиография (ЭХО-КГ)
По сути, ЭХО-КГ — это УЗИ сердца. Суть метода — использование ультразвуковых (высокочастотных) волн, которые с помощью специального прибора распространяются в тканях, меняя частоту, период и амплитуду колебаний в зависимости от ткани, через которую проходят. Измененные волны возвращаются к датчику и преобразуются в электрический сигнал, позволяющий восстановить полную картину.
ЭХО-КГ может показать классические признаки заболеваний миокарда, сопровождаемых отложениями разных веществ (рис. 5), такие как утолщение стенки левого желудочка, маленький размер полости левого желудочка, двустороннее увеличение предсердий, утолщение клапанов, повышенное систолическое давление в правом желудочке и увеличение межпредсердной перегородки [13]. При прицельной диагностике ATTR нужно оценивать и более специфические параметры, такие как изменение продольной деформации миокарда. В слове «деформация» здесь нет ничего плохого. Наше сердце качает кровь, и происходит это за счет сокращения отдельных мышечных волокон, длина которых уменьшается при сокращении и увеличивается при расслаблении. Деформация миокарда — это показатель изменения размера объекта по отношению к его исходной величине. При уменьшении длины объекта (при сокращении) значение будет иметь отрицательную размерность, при увеличении (расслаблении) — положительную.
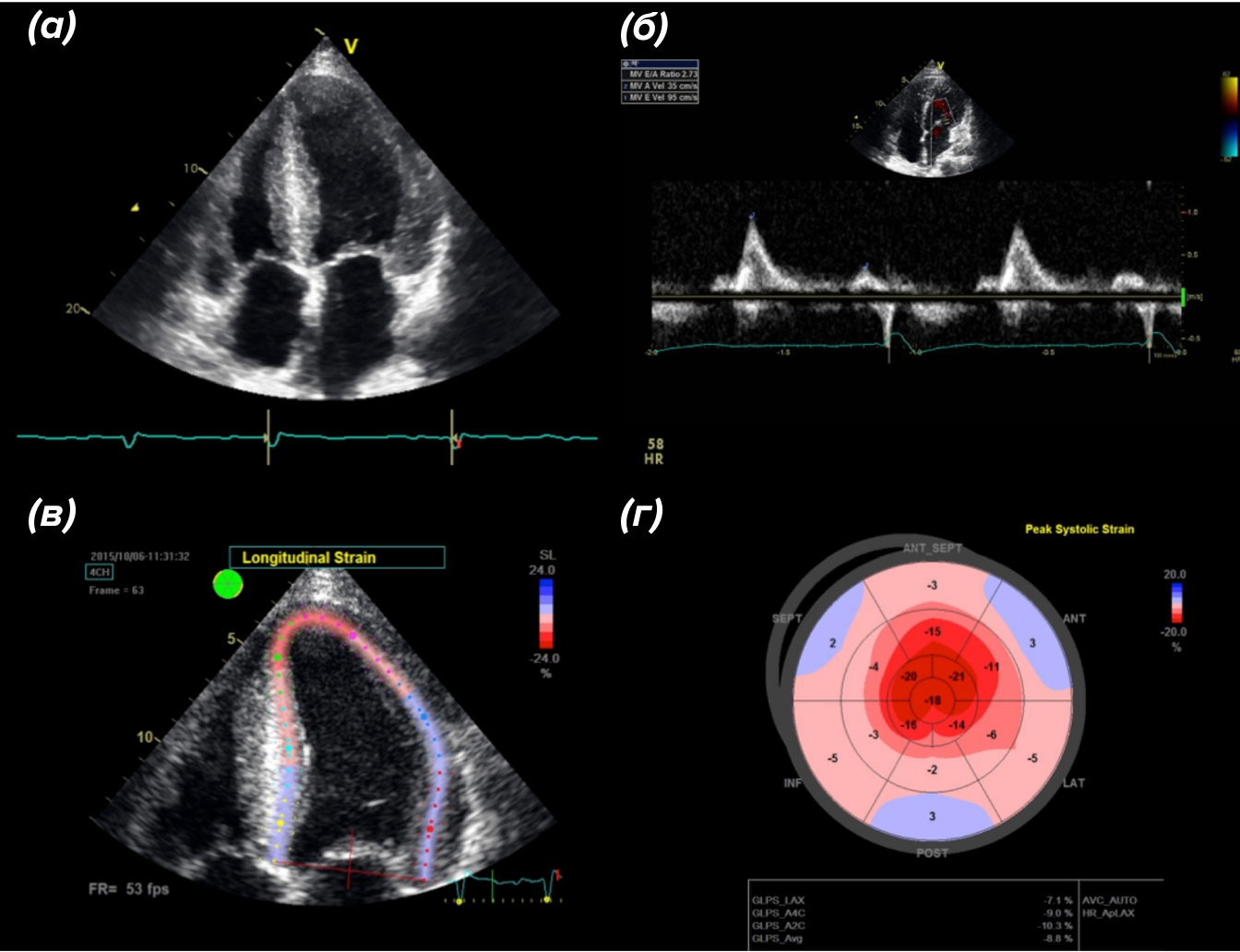
Рисунок 5. Изменения в сердце при ATTR-амилоидозе, диагностируемые на ЭХО-КГ. (а), (б) — увеличенная перегородка и стенка левого желудочка, (в) — увеличение значения продольной деформации (норма: −15,9..−22,1%), (г) — увеличение значения продольной деформации, вид на желудочек изнутри.
МРТ с контрастированием
МРТ — еще один метод, который может поставить дополнительную галочку в пользу диагноза ATTR-кардиомиопатии (рис. 6) [14]. МРТ сердца с гадолиниевым контрастом помогает отличить гипертрофическую кардиомиопатию с признаками амилоидной инфильтрации миокарда и без них. То есть амилоидные фибриллы в миокарде (они и являются инфильтратом) сделают так, что гадолиниевый контраст будет излишне накапливаться, и на МРТ будет наблюдаться усиление сигнала гадолиния.
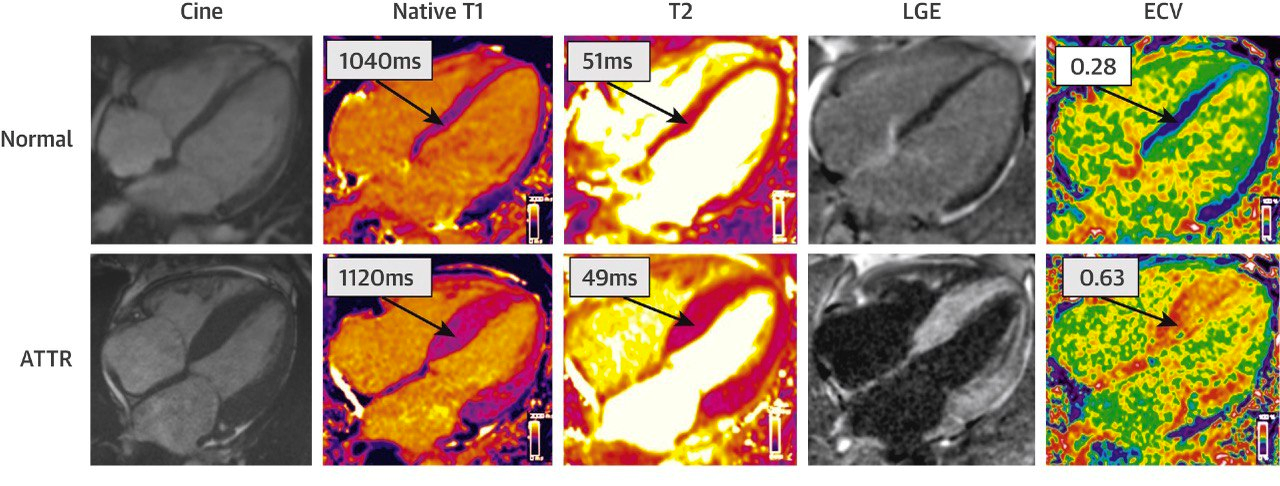
Рисунок 6. МРТ нормального и пораженного амилоидом сердца (гадолиниевый контраст).
Внесердечные проявления ATTR
Внесердечные проявления — это последняя зацепка, которая должна натолкнуть врача на мысль об амилоидозе. Двусторонняя сенсомоторная полинейропатия, начинающаяся в нижних конечностях, нарушения вегетативной нервной системы, проявляющиеся в виде ортостатической гипотензии, диареи/запора и эректильной дисфункции, а также поражения глаз (например, глаукомы) могут сопровождать наследственный ATTR-амилоидоз.
Туннельный синдром является самым частым спутником ненаследственной ATTR-кардиомиопатии за пределами сердца и может стать одним из самых ранних индикаторов появления болезни.
Если врач отметил хотя бы несколько красных флажков (см. врезку выше) — значит, амилоидоз сердца следует искать более прицельно. На этом этапе диагностики нужно уже не просто заподозрить амилоидоз сердца, но и быть почти уверенным в этом диагнозе.
Биопсия миокарда
Достаточно долгое время ATTR-кардиомиопатию финально диагностировали по биопсии миокарда с гистохимической окраской конго красным. Это почти идеальный способ диагностики амилоидоза: его специфичность и чувствительность близки к 100%. Но, увы, конго красный не покажет, с каким типом амилоида мы имеем дело: положительное окрашивание будет как при AL-, так и при ATTR-типах, а дифференцировка необходима для назначения терапии и оценки прогнозов.
Чтобы определить тип амилоида, необходимо провести иммуногистохимическое исследование или масс-спектрометрию, но их сложно сделать в России. Поэтому постановка диагноза ATTR обычно происходит «от обратного». У пациента не должно быть признаков AL-амилоидоза — а именно, легких цепей иммуноглобулинов в моче.
Получается, что обойти сложности с типированием амилоида достаточно просто, но вот второй минус — необходимость биопсии миокарда — так просто не проскочить. Впрочем, это не так уж и страшно, как может показаться: биопсию проводят вовсе не на открытом сердце, а с помощью специальных проводников, которые попадают в сердце через сосуд. Но, разумеется, прежде чем применять любой инвазивный метод, нужно тщательно все взвесить.
Получается, для окончательной диагностики ATTR-кардиомиопатии биопсия миокарда неизбежна? К счастью, уже нет. Существует современный неинвазивный метод диагностики ATTR-кардиомиопатии с достаточно высокой специфичностью и чувствительностью, в случае если диагноз AL-амилоидоза исключен.
Сцинтиграфия миокарда
Сцинтиграфия помогает визуализировать амилоидные инфильтраты по сигналу вводимых пациенту радиоактивных препаратов, способные включаться в искомые амилоиды (испускаемые ими гамма-лучи регистрируются специальной камерой, восстанавливающей картину). Например, в случае амилоидных фибрилл, имеет смысл вводить в организм радиоактивно меченые мономеры амилоидных фибрилл. Но увы, далеко не все существующие радиоактивные метки применимы для диагностики ATTR. Например, 123I-меченный сывороточный амилоид-Р (SAP) с высокой чувствительностью выявлял инфильтраты при системном амилоидозе селезенки, печени, почек, костного мозга, но совершенно не накапливался в миокарде при ATTR-кардиомиопатии [15].
Тем не менее, диагносты предлагают другие, порой весьма неожиданные, соединения для визуализации амилоидных отложений в сердце. Случайно было замечено, что соединения технеция-99m, используемые для сцинтиграфии скелета, способны накапливаться и в амилоидах сердца. Но раз это неспецифический анализ — насколько точна такая диагностика? Врачи полагают, что в сочетании с другими характерными симптомами точность достаточно высока, а безопасность теста выше, чем при проведении биопсии [16].
Генетическая диагностика
Для подтверждения диагноза наследственного амилоидоза (ATTRv), а также для уточнения варианта мутации возможно проведение генетического тестирования; в зависимости от варианта, клиническая картина и стратегии лечения будут отличаться. Так, например, самый распространенный амилоидоз первого типа будет начинаться с потери чувствительности нижних конечностей, а затем распространится по всему телу. Другой же вариант заболевания сильнее воздействует на черепные нервы и проявляется в первую очередь нарушениями зрения и снижением тургора кожи.
Мутации можно искать прицельно — проверяя самые частые варианты, — либо же сканировать (секвенировать) ген TTR на наличие вообще любых изменений. Всего на сегодня описано около 200 мутаций; практически все это миссенс-варианты, приводящие к дестабилизации тетрамера. Последний вариант более трудоемок и дорог, но и более информативен. С другой стороны, сам ген TTR довольно небольшой (всего 4 экзона, в сумме около 600 нуклеотидов), а значит, полная его проверка будет гораздо дешевле, чем для многих других генетических заболеваний. Хочется надеяться, что она станет проводиться чаще.
Подводя итог, постановка диагноза ATTR-кардиомиопатии — это сложно и очень долго. Не зная в целом о патологии амилоидоза сердца, врач не сможет сопоставить все признаки в одну картину и направить пациента на дополнительные, более сложные, но более чувствительные и специфичные исследования. Поэтому первое, чему бы хотелось посвятить этот текст, — повысить осведомленность врачей об амилоидозе сердца. Второе — дать им информацию, что же делать, если подозреваешь ATTR-кардиомиопатию. Красные флажки ATTR, перечисленные в начале этого раздела, — это настоящий призыв к действию, чтобы как можно скорее поставить окончательный диагноз и перейти к лечению, вариантов которого становится больше с каждым годом.
Как лечить АТТR-амилоидоз?
Начнем с грустного. Спустя 15 месяцев с момента постановки диагноза умирает в среднем около 77% пациентов с диким и 22% с наследственным типом транстиретинового амилоидоза, а медианная выживаемость составляет 25,6 месяца для wtATTR по сравнению с 43 месяцами для hATTR. Несмотря на такую большую разницу, различий в клинических характеристиках, биомаркерах или других диагностических параметрах между этими пациентами почти нет. К сожалению, качество жизни таких больных тоже резко ухудшается: им становится все труднее выполнять простые повседневные действия, даже обычная прогулка может стать непосильной. Это хорошо видно по тесту с шестиминутной ходьбой (ТШХ), в котором испытуемому предлагается пройти за это время максимальное расстояние. У пациентов с диагностированной ATTR-кардиомиопатией этот показатель снижается в среднем на 25 метров каждые полгода [17].
Неверно поставленный диагноз и длительное неадекватное лечение являются основной причиной плохих прогнозов выживаемости. Стандартные препараты для лечения сердечной недостаточности направлены в первую очередь на снижение давления, что совершенно неэффективно для пациентов с сердечным амилоидозом и часто приводит к клиническому ухудшению состояния здоровья и потере драгоценного времени [9].
Однако есть и хорошие новости: при правильной постановке диагноза специфическая терапия сердечного амилоидоза уже существует, и достаточно давно. До недавнего времени она была в основном сосредоточена на двух направлениях:
- Подавление синтеза новых копий TTR (пересадка печени, секретирующей нормальный транстиретин, «выключатели» гена ТТR);
- Обезвреживание уже существующих амилоидных фибрилл (например, с использованием моноклональных антител) [18]. Однако уже появившиеся амилоиды нередко обладают способностью к дальнейшему росту из своих же зачатков. Это сильно снижало эффективность подобной терапии.
Пересадка сердца — это довольно очевидный вариант лечения ATTR-амилоидоза, ведь мы просто заменяем больной орган на здоровый. Так поступили и в случае Нейта Арчибальда, который получил новое, хорошо работающее сердце. Конечно, «просто» — понятие весьма относительное, ведь пул доноров весьма невелик, а операция не гарантирует, что в новом органе амилоиды не образуются вновь. К тому же, операция всегда связана с риском для возрастных пациентов, преобладающих среди больных ATTR-кардиомиопатией [19].
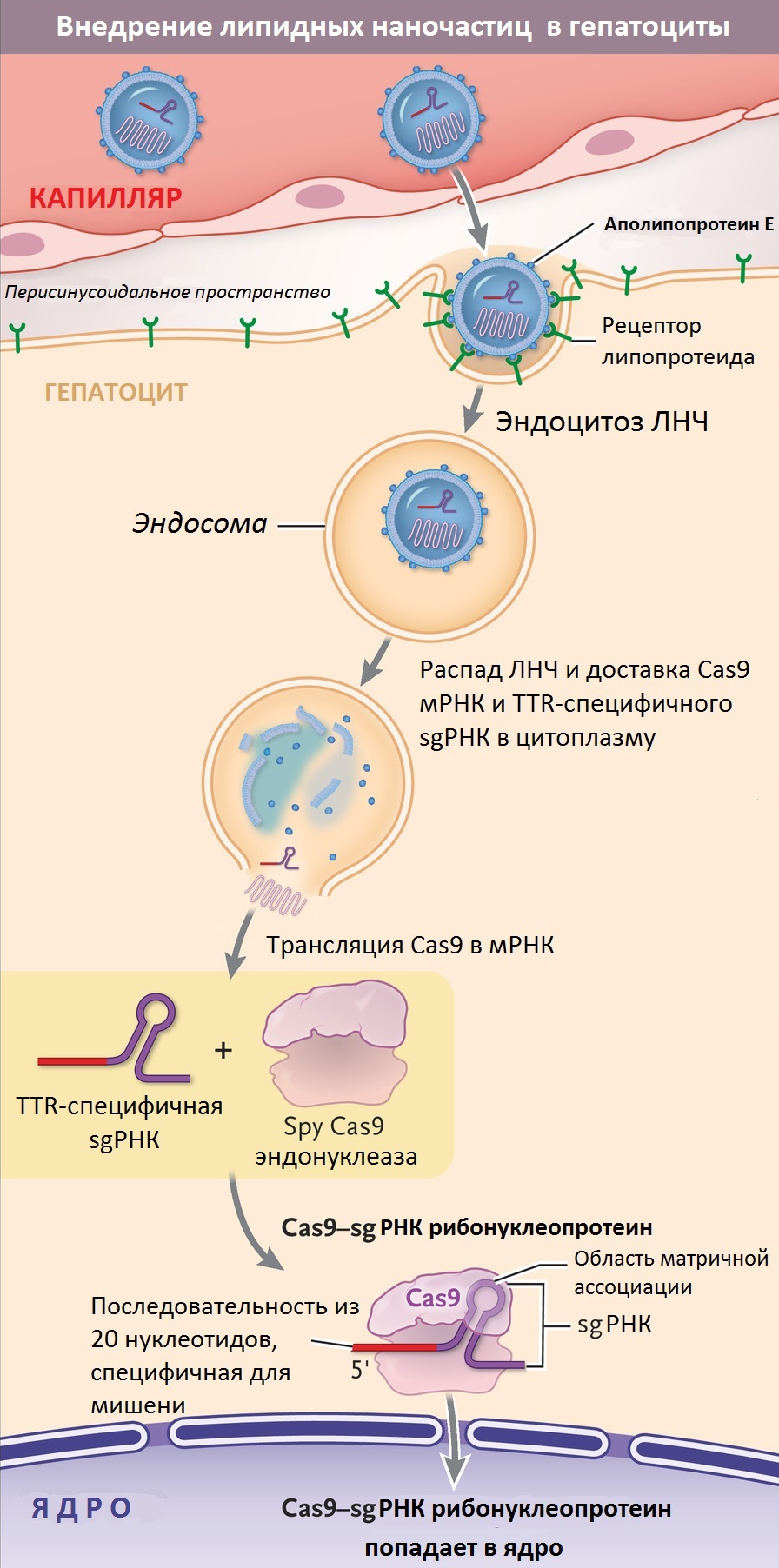
К счастью, в последнее время наука обзавелась несколькими принципиально новыми подходами к лечению амилоидоза сердца. Первый из одобренных FDA препаратов — патисиран (ALN-TTR02, Onpattro) — препарат 2-го поколения, состоящий из липидных наночастиц для доставки миРНК. Связываясь с консервативной последовательностью на 3’-конце мРНК TTR, мРНК влияет на экспрессию ТТR дикого и мутантного типов. К сожалению, сейчас препарат получил одобрение надзорных органов лишь для лечения амилоидогенной полинейропатии. Однако работа не стоит на месте — результаты выглядят вполне обнадеживающе и для ATTR-кардиомиопатии. Клинические исследования I фазы показали результаты однократного внутривенного введения ALN-TTR02: через 7 дней уровень ТТR в крови уменьшился в среднем на 82,3–86,8 %. Побочные реакции на инъекции препарата были выражены слабо и хорошо переносились пациентами. Молекулярному механизму действия патисирана на «Биомолекуле» посвящена отдельная статья [20].
Другой подход основан на стабилизации тетрамеров транстиретина, в норме образующихся из мономеров внутри гепатоцитов с последующей секрецией в кровоток. Большинство мутаций нарушает правильное формирование тетрамера, запуская процесс в сторону губительной полимеризации мономеров до стадии амилоидных фибрилл. И тут ATTR-амилоидоз — не исключение.
Починить то, что сломано
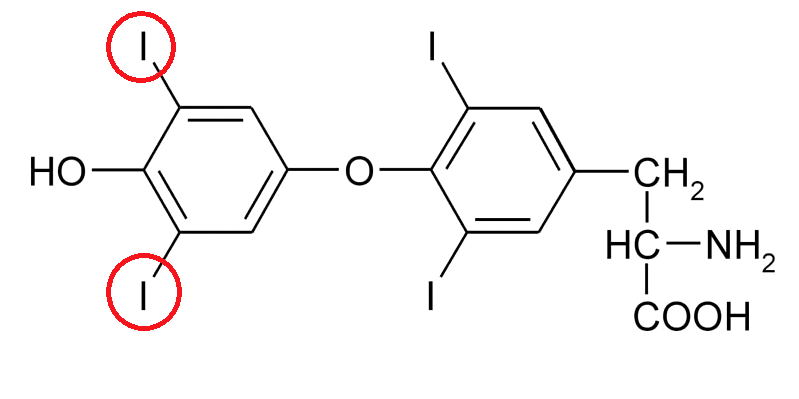
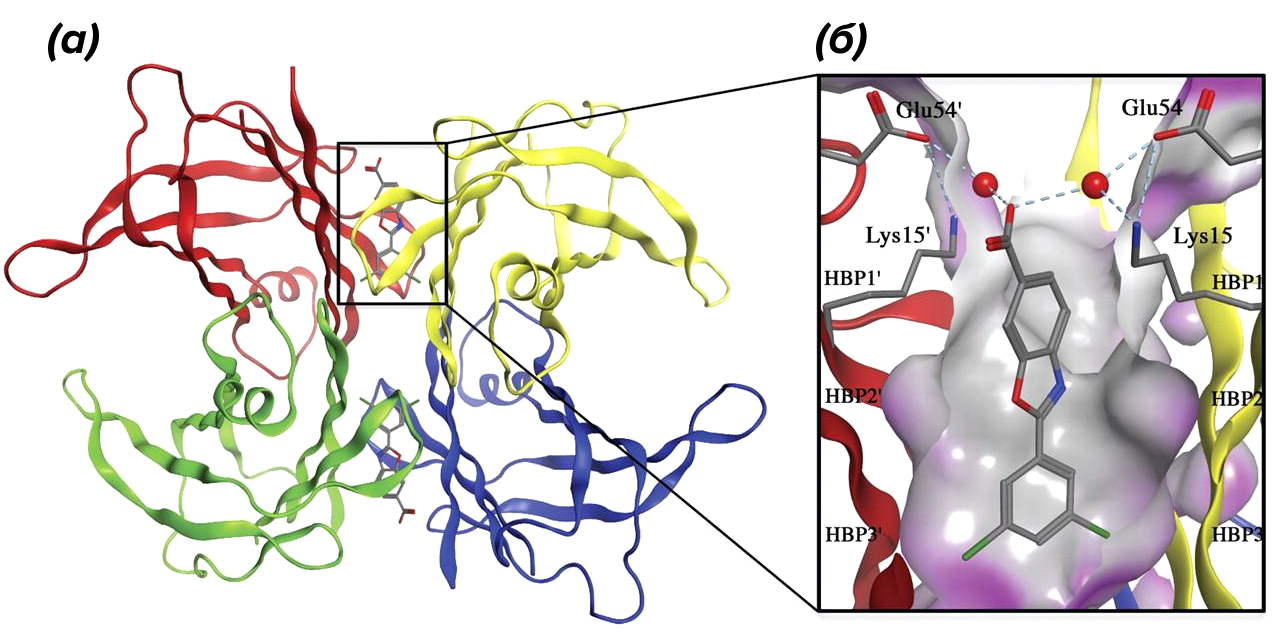
Второй подход к терапии основан на приеме Тафамидиса (рис. 7А) — производного бензоксазола, напоминающего по своему строению гормон тироксин (природный лиганд транстиретина). Он стабилизирует четвертичную структуру транстиретина, тем самым снижая количество свободного мономера, и, как следствие, существенно замедляет амилоидогенез [21].
Сама по себе химическая формула тафамидиса не является научным открытием последних лет: вещество было синтезировано Джеффри В. Келли (Исследовательский институт Скриппса, США) еще в 2003 году. Впоследствии доктор Келли основал биотехнологическую компанию FoldRx Pharmaceuticals и наладил промышленный синтез тафамидиса. Дела с подготовкой испытаний клинической эффективности тафамидиса шли не очень активно до тех пор, пока FoldRx не была приобретена транснациональным гигантом Pfizer в 2010 году. Именно они инициировали клинические испытания тафамидиса для лечения ATTR-кардиомиопатии у пожилых пациентов [22], [23].
Обширное длительное клиническое исследование подтвердило эффективность тафамидиса в лечении транстиретиновой кардиомиопатии. Во всей выборке пациентов лечение тафамидисом на треть снизило риски смерти от любых причин и госпитализаций из-за сердечно-сосудистых проблем. Эффективность препарата не зависела от типа ATTR-амилоидоза — была сопоставима для пациентов с диким и наследственным типами. Больные были случайно распределены по трем группам в соотношении 2:1:2 и получали тафамидис в дозах 80 или 20 миллиграмм в сутки или плацебо. У большей части пациентов, получавших тафамидис, молекулы транстиретина стабилизировались, причем результат был лучше с высокой дозой лекарства. Прием плацебо сопровождался более высокой долей смертей — 40,7% больных из плацебо-группы скончались за время проведения исследования. Среди больных из экспериментальной группы показатель смертности составил 27%.
Обе дозы тафамидиса в целом хорошо переносились и показали уровень безопасности, сравнимый с плацебо. К сожалению, у всех испытуемых по окончанию эксперимента снижались показатели физической силы и выносливости, оцененные по уже известной нам методике ТШХ. Однако в группах, принимающих тафамидис, снижение шло значительно медленнее [24]. Результаты таких исследований позволили пересмотреть клинические рекомендации по лечению ATTR-кардиомиопатии. В конце 2017 года препарат появился на российском рынке, однако пациенты, которым тафамидис будет показан, к сожалению, не смогут избежать общих для терапии большинства орфанных заболеваний трудностей. По предварительным оценкам, годичный курс лечения тафамидисом обойдется одному пациенту не менее чем в 120 тысяч долларов. Про пути государственного решения подобных проблем, связанных с неподъемной для подавляющего большинства стоимостью, «Биомолекула» уже писала в первой статье этого спецпроекта [1].
Иммунитет бактерий выходит на борьбу с амилоидозом
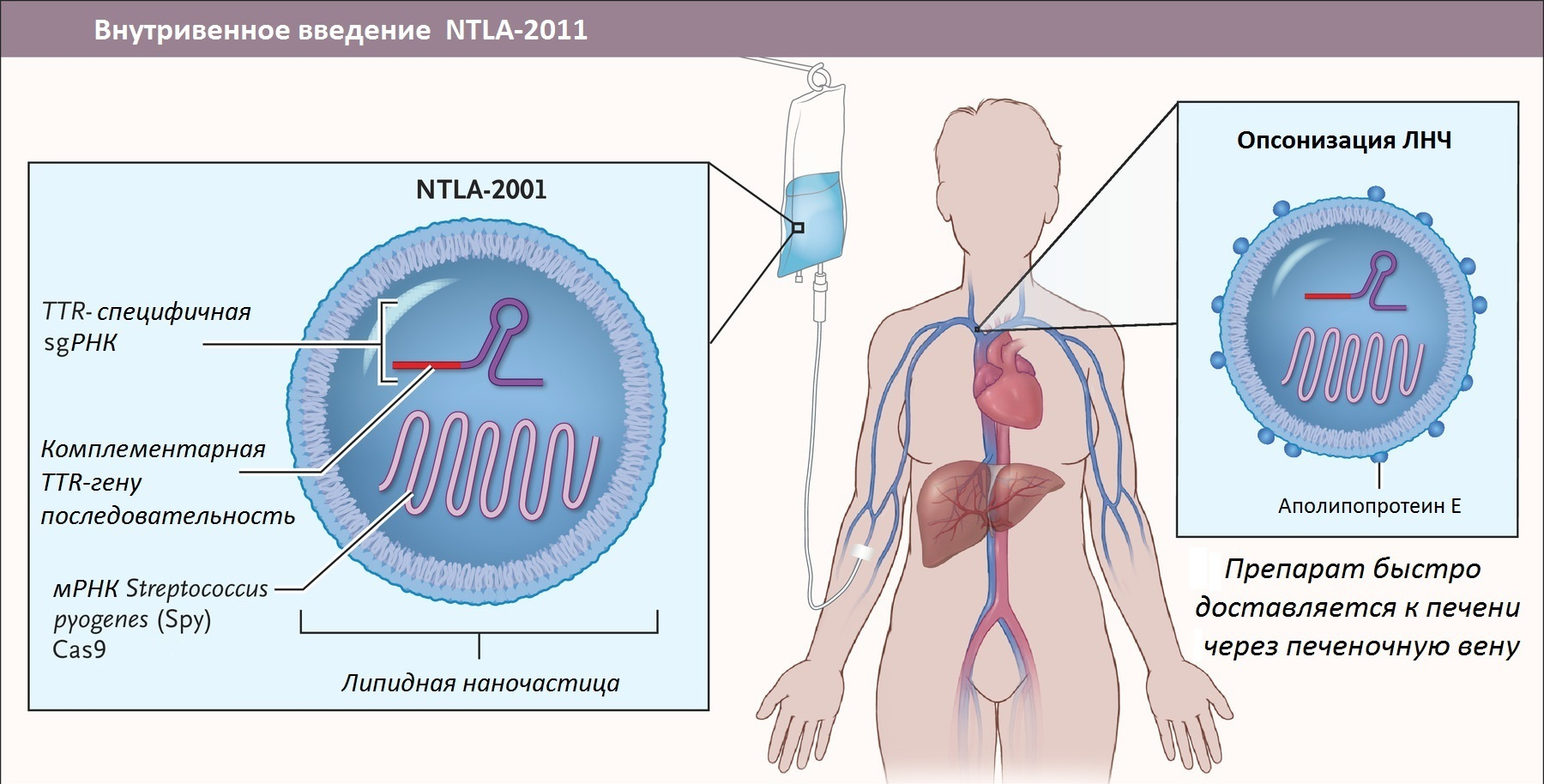
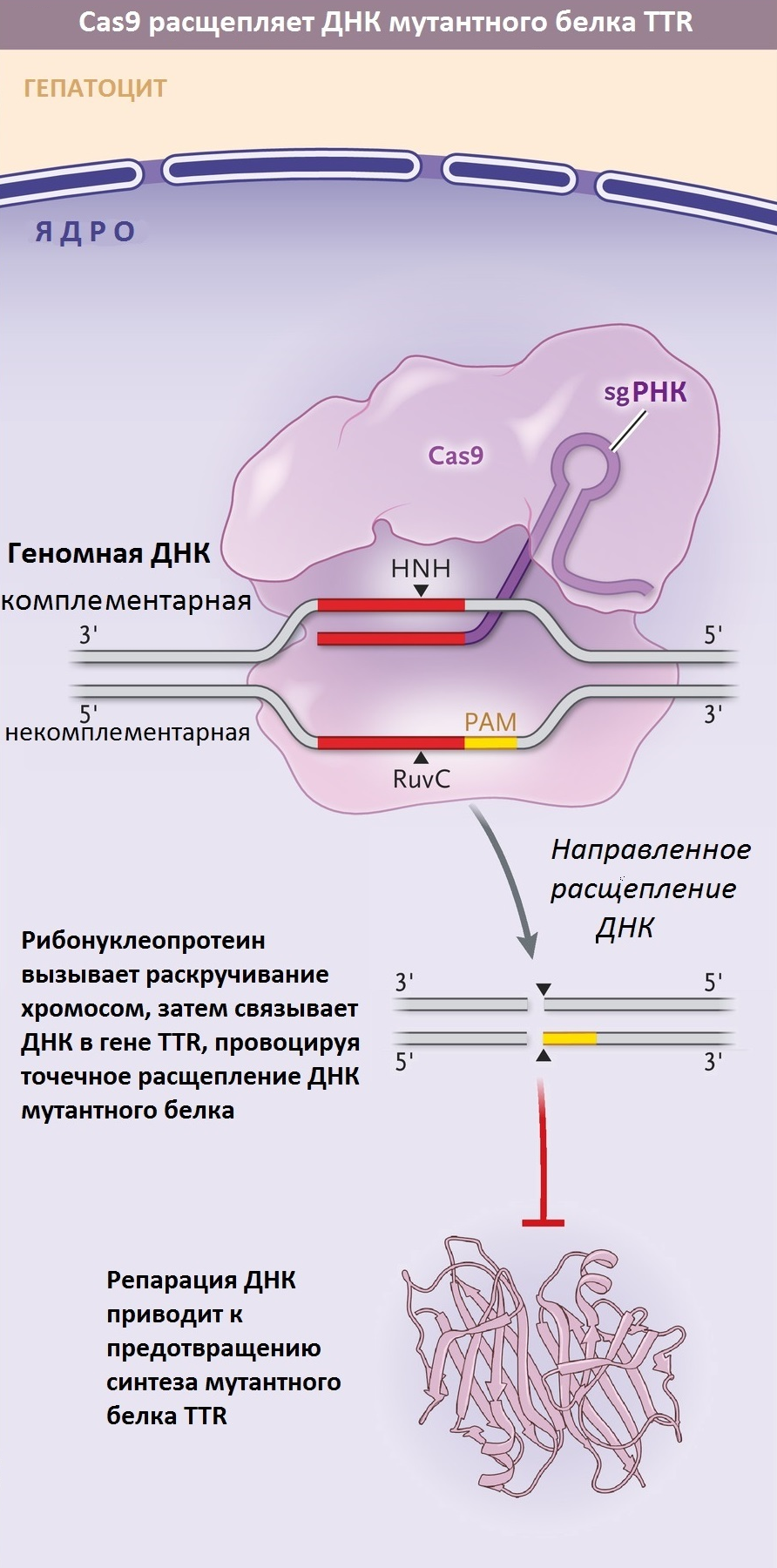
Третий (инновационный!) подход к лечению ATTR-амилоидоза был разработан с использованием технологии редактирования генома CRISPR/Cas9. Система адаптивного иммунитета бактерий уже достаточно давно активно используется в совершенно различных сферах биологии [25], а на «Биомолекуле» статьям о ней посвящен целый раздел.
Летом 2021 года на страницах New England Journal of Medicine появились обнадеживающие новости о первых клинически достоверных результатах лечения путем редактирования участков генома, ответственных за производство мутантного TTR внутри организма пациентов. Для лечения амилоидоза препарат, получивший название NTLA-2001, вводили пациентам внутривенно. Результаты, полученные в процессе 1 фазы клинических испытаний подобного метода терапии, показали, что у всех шести больных амилоидозом, принявших участие в эксперименте, отмечалось снижение уровня TTR в сыворотке крови (рис. 9). Для своих исследований ученые использовали разные дозировки препарата — оказалось, что чем выше доза NTLA-2001, тем более впечатляющим было снижение концентрации TTR [26].
Авторы публикации утверждают, что их методика универсальна и превосходит по эффективности даже препараты, основанные на антисенс-технологии — подавлении синтеза мутантного транстиретина на стадии транскрипции [20].
На этом преимущества NTLA-2001 не заканчиваются. Этот препарат подходит для лечения любых форм амилоидоза (в том числе и сердечных!), а не только тех, что неизбежно приводят к болезни Альцгеймера. Будучи моногенным заболеванием, ATTR-амилоидоз представляет собой идеальную мишень для применения CRISPR-Cas9-опосредованного редактирования генов in vivo. Другое преимущество заключается в том, что NTLA-2001 — это на данный момент единственное в данном направлении лечение однократной дозой! Другие терапевтические подходы требуют пожизненного приема препаратов. Кроме того, исследование не выявило каких-либо серьезных побочных эффектов и ограничений для назначения. Исследования на трансгенных мышах выявили стойкий эффект NTLA-2001. Авторы публикации заявляют, что даже способность гепатоцитов к делению не стала проблемой для сохранения длительного эффекта препарата: после резекции 2/3 печени у подопытных животных и последующей полной регенерации органа процент отредактированных генов в новых гепатоцитах не уменьшился. У обезьян однократное редактирование TTR также привело к почти полному устранению экспрессии белка новообразованными гепатоцитами [26].
Безусловно, нам нужно с разумной осторожностью относиться к подобным новостям и помнить, что это лишь первая фаза клинических исследований, проведенных всего лишь на шести пациентах, но уж больно обнадеживающе выглядят эти промежуточные результаты, ведь человеку всегда хочется верить в лучшее и надеяться, что список неизлечимых болезней станет чуть короче. Однако антисенс-терапия тоже не стоит на месте: в начале 2022 года результаты клинических испытаний на здоровых добровольцах принесли обнадеживающие результаты и в этой области.
Найти смысл в бессмыслице
Четвертый инновационный подход к лечению амилоидоза был разработан на основе антисмысловых технологий [1], [27]. В пару к уже одобренному в 2018 году в Европейском союзе антисенс-олигонуклеотидному препарату инотерсену эплонтерсен, появившийся в результате научной коллаборации компаний Ionis Pharmaceuticals и AstraZeneca, представляет собой таргетную РНК-терапию, останавливающую выработку белка TTR и, как следствие, предотвращающую его накопление в различных тканях и органах. Происходит это за счет действия фермента рибонуклеазы H1, приводящей к остановке транскрипции участков РНК — своеобразной молекулы-посредника, служащей матрицей для производства в организме любого белка, в данном случае — TTR.
Производители препарата уверены, что эплонтерсен может стать лучшим в своем классе средством для остановки транстиретин-опосредованного амилоидоза и лечения этого смертельного заболевания. Клинические исследования препарата показали, что он эффективен для лечения как наследственного, так и дикого типов амилоидоза. Ученые изучали активность действующего вещества на примере трансгенных мышей, несущих человеческий ген мутантного TTR (Ile84Ser), а также на яванских макаках и, на последней стадии испытаний, на здоровых людях-добровольцах. Как у подопытных животных, так и у испытуемых добровольцев количество TTR в плазме крови снижалось на 80–96% [28]. Отсутствие каких-либо проблем с переносимостью препарата по итогам месячного курса лечения позволило Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) присвоить эплонтерсену статус орфанного препарата для экспериментальной терапии амилоидоза.
Ученые смотрят в будущее с оптимизмом и уже готовят 3 фазу клинических испытаний своей разработки, в которой эплонтерсен будет тестироваться на взрослых с наследственной ATTR-кардиомиопатией и амилоидозом AATR дикого типа — формой заболевания, не связанной с какими-либо известными современной науке генетическими мутациями. Компания Ionis Pharmaceuticals уже уже подала заявку на проведение исследования и активно ведет набор пациентов для своей работы. Вероятно, совсем скоро мы увидим окончательные показатели эффективности этого подхода к лечению — развязка близка.
Когда орфанное заболевание — не приговор (но все-таки проблема)
Проблемы диагностики ATTR-амилоидоза, увы, вовсе не уникальны и до боли знакомы многим пациентам с орфанными заболеваниями. Порой врачи действительно не могут заподозрить амилоидоз сердца, и сложно их в этом винить — вероятность обычному кардиологу или терапевту встретить пациента с ATTR-амилоидозом хотя бы раз в своей жизни примерно равна вероятности выпадения решки 16 раз подряд при подбрасывании монетки.
Не меньшее везение требуется и пациентам с редкими болезнями. Им должно посчастливиться попасть грамотному доктору с достаточным арсеналом оборудования, который заметит все «красные флажки» и правильно подтвердит диагноз. Им должно повезти добраться до этого доктора не слишком поздно и не испортить здоровье ни промедлением, ни неподходящим лечением. Им должна улыбнуться удача с существованием этой терапии вообще — и хотя бы тут у пациентов с ATTR-амилоидозом есть не только шанс, но и выбор. И самое главное, у них должно удачно сложиться с финансированием этой терапии. Ведь, несмотря на наличие нескольких вариантов лечения, они все еще очень дороги.
Нейту Арчибальду очень повезло. Ему достались лучшие врачи по отличной страховке, которые рано заподозрили неладное и предложили наилучшие варианты лечения. Нам же остается надеяться, желать и работать над тем, чтобы удача для пациентов с амилоидозом сердца играла куда меньшую роль.
Вклад авторов: Юлия Вяхирева — введение в амилоидозы; Маргарита Шарова — диагностика ATTR-амилоидоза; Денис Новиков — лечение ATTR-амилоидоза.
Литература
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Gorevic P. D. (2018). Overview of amyloidosis. UpToDate;
- Jean D. Sipe, Merrill D. Benson, Joel N. Buxbaum, Shu-ichi Ikeda, Giampaolo Merlini, et. al.. (2016). Amyloid fibril proteins and amyloidosis: chemical identification and clinical classification International Society of Amyloidosis 2016 Nomenclature Guidelines. Amyloid. 23, 209-213;
- Victoria E Thomas, Justin Smith, Merrill D Benson, Noel R Dasgupta. (2019). Amyloidosis: diagnosis and new therapies for a misunderstood and misdiagnosed disease. Neurodegenerative Disease Management. 9, 289-299;
- Hiroyuki Yamamoto, Tomoki Yokochi. (2019). Transthyretin cardiac amyloidosis: an update on diagnosis and treatment. ESC Heart Failure. 6, 1128-1139;
- Josef Finsterer, Stephan Iglseder, Julia Wanschitz, Raffi Topakian, Wolfgang N. Löscher, Wolfgang Grisold. (2019). Hereditary transthyretin-related amyloidosis. Acta Neurol Scand. 139, 92-105;
- Hartmut H. Schmidt, Márcia Waddington-Cruz, Marc F. Botteman, John A. Carter, Avijeet S. Chopra, et. al.. (2018). Estimating the global prevalence of transthyretin familial amyloid polyneuropathy. Muscle Nerve. 57, 829-837;
- The Inaugural Amyloidosis Forum Panelists, Melanie Blank, Michelle Campbell, John O. Clarke, Raymond Comenzo, et. al.. (2020). The Amyloidosis Forum: a public private partnership to advance drug development in AL amyloidosis. Orphanet J Rare Dis. 15;
- Ronald M. Witteles, Sabahat Bokhari, Thibaud Damy, Perry M. Elliott, Rodney H. Falk, et. al.. (2019). Screening for Transthyretin Amyloid Cardiomyopathy in Everyday Practice. JACC: Heart Failure. 7, 709-716;
- Автор главного треугольника медицины;
- Min-Ho Lee, Seung-Pyo Lee, Yong-Jin Kim, Dae-Won Sohn. (2013). Incidence, Diagnosis and Prognosis of Cardiac Amyloidosis. Korean Circ J. 43, 752;
- Y. Kasirye, J. R. Manne, N. Epperla, S. Bapani, R. Garcia-Montilla. (2012). Apical Hypertrophic Cardiomyopathy Presenting as Recurrent Unexplained Syncope. Clinical Medicine & Research. 10, 26-31;
- James A. White, Nowell M. Fine. (2016). Recent Advances in Cardiovascular Imaging Relevant to the Management of Patients with Suspected Cardiac Amyloidosis. Curr Cardiol Rep. 18;
- Marianna Fontana, Andrej Ćorović, Paul Scully, James C. Moon. (2019). Myocardial Amyloidosis. JACC: Cardiovascular Imaging. 12, 2345-2356;
- V. B. Sergienko, S. N. Tereshchenko, A. A. Ansheles, I. V. Zhirov, A. A. Safiullina. (2018). NUCLEAR IMAGING IN THE DIAGNOSIS OF CARDIAC AMYLOIDOSIS. Racionalʹnaâ farmakoterapiâ v kardiologii. 14, 94-100;
- IssaMenge Kuria, SamuelNguku Gitau, KhalidBashir Makhdomi. (2019). Bone scintigraphy imaging of cardiac amyloidosis. World J Nucl Med. 18, 314;
- Frederick L. Ruberg, Mathew S. Maurer, Daniel P. Judge, Steven Zeldenrust, Martha Skinner, et. al.. (2012). Prospective evaluation of the morbidity and mortality of wild-type and V122I mutant transthyretin amyloid cardiomyopathy: The Transthyretin Amyloidosis Cardiac Study (TRACS). American Heart Journal. 164, 222-228.e1;
- Gustaf Herlenius, Henryk E. Wilczek, Marie Larsson, Bo-Göran Ericzon. (2004). Ten years of international experience with liver transplantation for familial amyloidotic polyneuropathy: results from the familial amyloidotic polyneuropathy world transplant registry. Transplantation. 77, 64-71;
- Gustaf Herlenius, Henryk E. Wilczek, Marie Larsson, Bo-Göran Ericzon. (2004). Ten years of international experience with liver transplantation for familial amyloidotic polyneuropathy: results from the familial amyloidotic polyneuropathy world transplant registry. Transplantation. 77, 64-71;
- Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!;
- Yvette N. Lamb, Emma D. Deeks. (2019). Tafamidis: A Review in Transthyretin Amyloidosis with Polyneuropathy. Drugs. 79, 863-874;
- Petar M. Seferovic, Piotr Ponikowski, Stefan D. Anker, Johann Bauersachs, Ovidiu Chioncel, et. al.. (2019). Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 21, 1169-1186;
- C. E. Bulawa, S. Connelly, M. DeVit, L. Wang, C. Weigel, et. al.. (2012). Tafamidis, a potent and selective transthyretin kinetic stabilizer that inhibits the amyloid cascade. Proceedings of the National Academy of Sciences. 109, 9629-9634;
- Mathew S. Maurer, Jeffrey H. Schwartz, Balarama Gundapaneni, Perry M. Elliott, Giampaolo Merlini, et. al.. (2018). Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med. 379, 1007-1016;
- Просто о сложном: CRISPR/Cas;
- Julian D. Gillmore, Ed Gane, Jorg Taubel, Justin Kao, Marianna Fontana, et. al.. (2021). CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 385, 493-502;
- Есть ли смысл в антисенсах?;
- Elizabeth J. Ackermann, Shuling Guo, Merrill D. Benson, Sheri Booten, Sue Freier, et. al.. (2016). Suppressing transthyretin production in mice, monkeys and humans using 2nd-Generation antisense oligonucleotides. Amyloid. 23, 148-157.