Сложно ли сделать рабочий белок?
24 февраля 2015
Сложно ли сделать рабочий белок?
- 395
- 0
- 1
Человек картирует всё! Даже пространство последовательностей рабочего интерфейса бактериального белка PhoQ.
Рисунок в полном размере.
-
Автор
-
Редактор
Ученые из Массачусетского технологического института исследовали, сколькими способами можно сконструировать рабочий вариант последовательности белка, отвечающей за распознавание его мишени. Оказалось, что природа «освоила» довольно ограниченную область пространства вариантов, которыми можно было получить рабочую структуру. Причины такой ограниченности стали ясны при анализе структуры пространства вариантов.
Белок PhoQ — обычный, можно даже сказать, рядовой фермент бактерии Escherichia coli — сенсор, располагающийся на ее внутренней мембране. Его работа — модифицировать другой белок под названием PhoP в зависимости от концентрации ионов Mg2+ в периплазматическом пространстве. PhoQ связывается с PhoP через четыре своих аминокислоты, образуя то, что называется гордыми словами «интерфейс взаимодействия». Сколькими способами природа могла создать функциональный интерфейс взаимодействия рядового белка PhoQ?
Белки строятся из 20 различных аминокислот, каждая из которых теоретически может находиться в любом месте цепочки. Простой расчет показывает, что четыре позиции с 20 вариантами в каждой дают 160000 потенциальных комбинаций аминокислот интерфейса, формирующих так называемое пространство последовательностей [1]. Но сколько из них смогло бы узнавать белок-партнер PhoQ? Ученые из Массачусетского технологического института решили проверить это напрямую [2]. Они получили огромную коллекцию мутантов со всеми возможными комбинациями остатков в четырех позициях белок-белкового интерфейса PhoQ. У всех полученных бактерий к тому же был синтетический ген желтого флуоресцентного белка , который активировался модифицированным белком PhoP. То есть если интерфейс между PhoQ и PhoP был рабочим, PhoQ успешно модифицировал PhoP, запускался синтез желтого флуоресцентного белка. Такие флуоресцирующие клетки отбирали и анализировали, каким из вариантов белка PhoQ они обладают. Этот вариант отмечался как рабочий.
Разноцветные собратья «стандартного» зеленого флуоресцентного белка и их новейшие применения описаны в статье «Флуоресцентные белки: разнообразнее, чем вы думали!» [3] — Ред.
Если из четырех аминокислот заменяли лишь одну, то набор функциональных («разрешенных») вариантов получался довольно ограниченным — лишь 16. Всего же было обнаружено 1659 рабочих комбинаций «интерфейсных» аминокислот. В первой позиции у функциональных вариантов могли стоять лишь две аминокислоты, во второй и третьей — по семь, в четвертой — пять. Если бы одиночные замены в каждой позиции были произвольны (не влияли бы друг на друга), то всего получилось бы 2×7×7×5=490 функциональных вариантов. Но из этих гипотетических было обнаружено лишь 104 реальных плюс 1555 совершенно других, тоже рабочих, вариантов. Получается, что бóльшая часть рабочих вариантов возникала путем череды замен, «неразрешенных» по одиночке. Зато в правильном контексте — в компании с другими мутациями — замена, которая портила интерфейс, если была одна, становилась снова допустимой. Две или более мутации, по одиночке способные сломать интерфейс, вместе могли дать рабочий вариант.
Было ли что-то общее у всех возможных способов сделать рабочий белок-белковый интерфейс? По крайней мере, можно было найти некоторые закономерности. Белок-белковый интерфейс PhoQ состоит не из идущих подряд остатков аминокислот, а из пары остатков и другой пары, расположенной через две аминокислоты от первой. Между первой и второй, а также между первой и третьей аминокислотами интерфейса были корреляции: к примеру, гистидин в первой позиции чаще всего сочетался с лейцином или метионином в третьей. Первый и второй остатки интерфейса стоят рядом, поэтому понятно, что некоторые варианты их пары могут быть неудобными для формирования интерфейса (две соседние боковые группы аминокислот могут мешать друг другу). А первый и третий остатки интерфейса находятся как раз на расстоянии одного витка α-спирали в белковой цепочке, так что тоже оказываются рядом и поэтому должны определенным образом сочетаться. Получается, уже структура интерфейса диктовала определенные ограничения на возможные наборы аминокислот, из которых ее можно сконструировать.
Чтобы посмотреть, как связаны между собой потенциальные варианты интерфейса, ученые построили граф, каждой вершине которого соответствовала определенная четверка аминокислот, дающая рабочий вариант (рис. 1). Линиями связывались вершины, отличающиеся одной аминокислотой; 79 вариантов из 1658 не соединялись с природной последовательностью — то есть к ним вообще нельзя прийти эволюционным путем, не получив в качестве промежуточного варианта нерабочий белок. Путь к 1151 варианту оказался более извилистым, чем можно было предположить, сравнивая их последовательности. Даже если они выглядели довольно похожими, иногда прийти от одной к другой можно было только через длинную цепочку изменений: ведь нужно, чтобы все промежуточные варианты были рабочими.
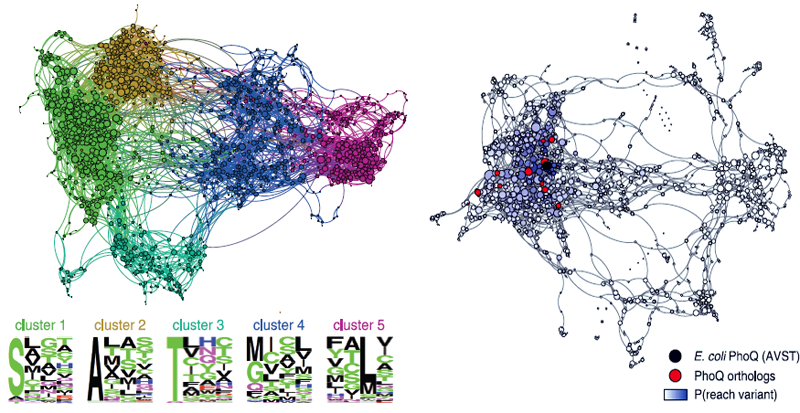
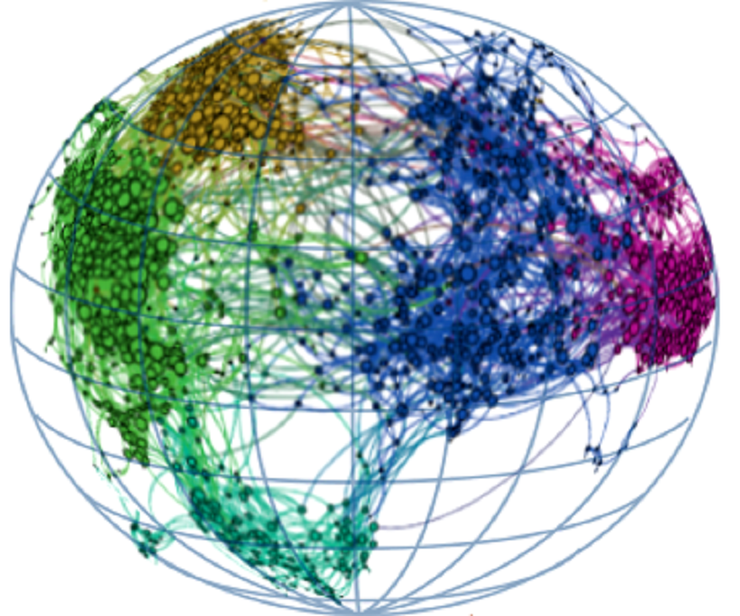
Рисунок 1. Пространство вариантов белок-белкового интерфейса PhoQ. На левом графе соединены функциональные варианты, различающиеся одной аминокислотой (формируют 5 кластеров), а на правом — одной нуклеотидной заменой в соответствующей последовательности ДНК (цветовая шкала P отражает вероятность достижения конкретного варианта из исходной точки (AVST) за 20 мутаций).
Еще более усложнялась картина, если учитывались изменения в ДНК, соответствующие аминокислотным заменам (ведь мутации происходят именно в ДНК, а не в белках). Каждая аминокислота кодируется тремя нуклеотидами ДНК , и то, что на графе с аминокислотами представлялось прямым путем, могло потребовать нескольких замен нуклеотидов. Каждый из промежуточных вариантов, опять же, должен был давать рабочий белок. В графе, учитывающем замену нуклеотидов, а не аминокислот, уже к целым 260 вариантам невозможно было прийти от природного, не получая нерабочих промежуточных версий. Средняя длина пути между вариантами тоже увеличилась при рассмотрении замен нуклеотидов, а не аминокислот. В общем, сложность путей к некоторым вариантам тоже ограничивает возможности природы.
О реализации наследственной информации, синонимичных и предпочтительных кодонах, а также о «глубинном» родстве кодонов с аминокислотами читайте: «Такие разные синонимы» [4], «У истоков генетического кода: родственные души» [5] — Ред.
На графе было видно пять кластеров, соответствующих группам вариантов, наиболее связанным между собой. В одном из них располагался природный вариант белок-белкового интерфейса PhoQ, и в нем же находились интерфейсы, которыми распознают свои мишени аналогичные белки ближайших родственников E.coli. Получается, в своих поисках природа исследовала лишь небольшую, относительно изолированную часть пространства последовательностей. И теперь мы лучше понимаем, почему.
Литература
- «Элементы»: «Расширение белковой вселенной продолжается;
- Anna I. Podgornaia, Michael T. Laub. (2015). Pervasive degeneracy and epistasis in a protein-protein interface. Science. 347, 673-677;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Такие разные синонимы;
- У истоков генетического кода: родственные души.