
Флуоресцентные белки: разнообразнее, чем вы думали!
18 мая 2014
Флуоресцентные белки: разнообразнее, чем вы думали!
- 9694
- 3
- 10
«Флуоресцентные бéлки в клетке»
-
Автор
-
Редакторы
При упоминании флуоресцентных белков люди чаще всего представляют себе разноцветные клетки, забавные рисунки бактериями на чашках Петри, в крайнем случае, целые флуоресцирующие организмы — от медуз до кошек, — эдакая цветная палитра. Однако область применения этого замечательного инструмента расширяется с каждым годом, — как и разнообразие самих белков. В этой статье мы поговорим о новых поколениях флуоресцентных белков и рассмотрим некоторые интересные методы на их основе.
— Ой, я и не знала, что коты такие умные бывают.
Я думала, они только на деревьях кричать умеют.
— Подумаешь, я еще и вышивать могу... и на машинке тоже...
«Трое из Простоквашино».
Светящиеся белки из забавного явления довольно быстро превратились в ценный объект для науки, когда были созданы флуоресцентные микроскопы. (Флуоресцентная микроскопия — это метод получения увеличенного изображения с использованием люминесценции возбуждённых атомов и молекул образца. Подробнее о разных видах микроскопий можно прочитать в статьях «“Нарисуем” живую клетку» [27] и «Лучше один раз увидеть, или микроскопия сверхвысокого разрешения» [28].)
Оказалось, что родоначальник большинства используемых белков — зеленый флуоресцентный белок (GFP) из медузы Aequorea victoria (подробнее о его замечательной судьбе — в статье «Флуоресцирующая Нобелевская премия по химии» [29]), — равно как и его гомологи из различных морских животных, являются прекрасными маркерами для визуализации живых клеток и организмов.
Главной особенностью флуоресцентных белков является способность формировать флуорофорную группу автокаталитически, без привлечения внешних кофакторов и ферментов — другими словами, они могут светиться внутри клетки сами по себе. Независимое созревание, в сочетании с низкой токсичностью и высокой стабильностью, позволяет использовать флуоресцентные белки в самых разных организмах, в которых исходно они не синтезировались (рис. 1).
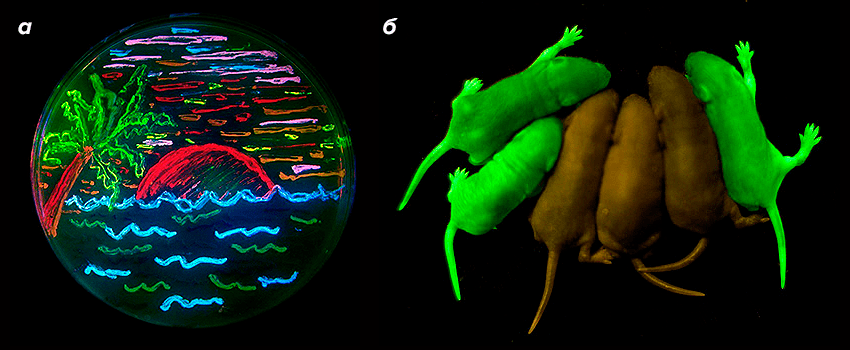
Рисунок 1. Флуоресцентное «творчество». а — «Рисунок» бактериями, экспрессирующими гены различных флуоресцентных белков, на чашке петри. б — Мыши, несущие ген зеленого флуоресцентного белка, и обычные мыши.
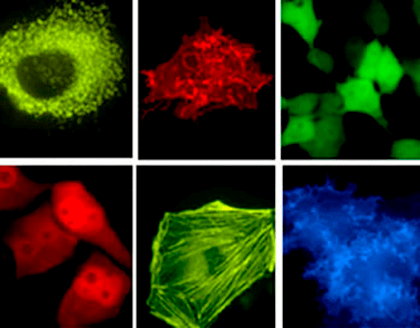
Рисунок 2. Визуализация различных компонент живых клеток с помощью флуоресцентных белков
Сейчас ученые используют GFP и его варианты и гомологи во многих методах для изучения организации и функционирования живых систем. Флуоресцентные белки, слитые в одной рамке считывания с интересующими белками, позволяют наблюдать за их локализацией, передвижением, оборотом и даже «старением» (т.е. временем, прошедшим после белкового синтеза). Нуклеиновые кислоты тоже могут быть помечены — с помощью РНК- или ДНК-связывающих белковых доменов.
Многие лаборатории сосредотачивают свои усилия на идентификации и создании флуоресцентных белков с новыми характеристиками и улучшенными свойствами: разнообразие существующих в настоящее время белков покрывает практически весь видимый спектр. В этой статье мы поговорим о новых поколениях флуоресцентных белков и рассмотрим некоторые интересные способы их применения, выходящие за рамки методики слияния GFP-подобного белка с интересующим объектом, — и последующего наблюдения за локализацией этого объекта с помощью микроскопа (рис. 2).
«Светящий теплом»
В настоящее время существует целая «палитра» белков, родственных знаменитому GFP, — от синих до дальнекрасных. Однако, флуоресцентные белки, принадлежащие другим крупным семействам, тоже довольно широко распространены.
iRFP — белок, флуоресцирующий не в видимой области спектра, а в инфракрасной (фактически, «отвечающий на свет теплом»), — был получен в 2011 году [1]. Его максимум поглощения находится в дальнекрасной области спектра (690 нм), а пик флуоресценции — в инфракрасной (713 нм). iRFP был получен на основе фитохрома из бактерии Rhodopseudomonas palustris (фитохромы — это фоточувствительные рецепторы с довольно консервативным белковым ядром, к которому нековалентно присоединяется тетрапиррольный хромофор). Из двух доменов фитохрома, скорректированных вдобавок точечными мутациями, и был создан iRFP.
Преимущество бактериофитохромов заключается в том, что их кофактор (например, биливердин) участвует в нормальном метаболизме гема млекопитающих. Визуализация различных процессов в этих организмах in vivo важна для таких задач как количественная и неинвазивная оценка роста и метастазирования опухоли, изучение экспрессии генов, отслеживание бактериальной инфекции и т.д. Вкратце, — можно наблюдать за этими процессами, поместив флуоресцентный белок под определенный промотор, который активируется только в конкретных условиях, или в опухолевые клетки; тогда регистрация сигнала от белка будет означать, что промотор активен, или что клетки трансформировались, или что определенный молекулярный путь запустился.
Визуализация глубоких тканей с помощью GFP-подобных белков, к сожалению, сильно затруднена из-за сильного поглощения света гемоглобином и меланином кожи. Оптимальный флуоресцентный белок для имиджинга in vivo должен обладать максимумами поглощения и флуоресценции в дальнекрасной-инфракрасной области, в которой поглощение света тканью минимально; таким образом, iRFP удовлетворяет данным условиям.
Помимо спектра, полностью подходящего для данных задач, iRFP отличается высокой внутриклеточной стабильностью и низкой цитотоксичностью. В совокупности с отсутствием необходимости добавления извне биливердинового хромофора, iRFP является отличным кандидатом для работы с млекопитающими in vivo, что уже было показано учеными нескольких стран. Группа Верхуши локализовала его в мышиной печени; Лю и др. изучали с помощью iRFP рак простаты (тоже на мышах) [2], а Хок и др. количественно оценивали рост опухоли in vivo [3]. Скорее всего, в ближайшее время будут разработаны и другие методики изучения различных клеточных процессов, использующие iRFP в своей основе.
Когда цвет один, но это не проблема
Несмотря на богатство палитры флуоресцентных белков, бывает так, что ее не хватает, — например, когда ученым необходимо отслеживать множество одновременно происходящих процессов (как в методике Brainbow), или когда те или иные каналы по каким-либо причинам использовать нельзя.
Для этого случая существует особая методика, которая позволяет различать объекты, помеченные разными белками одного цвета. Дело в том, что даже если максимумы флуоресценции двух белков близки и попадают в одну и ту же полосу пропускания фильтра на микроскопе, можно выбрать другое свойство, по которому они существенно различаются. Одно из таких часто используемых свойств — время жизни флуоресценции. Время жизни — это средний период времени, в течение которого флуорофор находится в возбужденном состоянии. Грубо говоря, после поглощения фотона один белок переизлучит другой фотон в среднем через меньшее время, а другой — через большее.
С помощью FLIM (Fluorescence lifetime imaging microscopy — микроскопии времени жизни флуоресценции) можно проследить за каждым фотоном, который будет выпущен образцом, и построить кривую зависимости количества испускаемых фотонов от времени. Поскольку время жизни флуоресценции флуорофора (τ) зависит от его непосредственного молекулярного окружения, технологию FLIM используют в клеточной биологии для измерения физиологических параметров в клетке, например, клеточного pH, концентраций ионов и мембранного потенциала [4], [5].
В настоящий момент главное применение FLIM заключается в измерении белок-белковых взаимодействий с помощью Фёрстеровского резонансного переноса энергии (FRET; см. «Рулетка для спектроскописта» [30]) между двумя флуоресцентно-меченными белками (поскольку присутствие акцептора влияет на время жизни флуоресценции донора) [6].
Кроме исследования изменений времени жизни одной конкретной метки, FLIM также начали использовать для количественного отображения пространственного и фракционного распределения двух невзаимодействующих флуоресцентных меток с разными временами жизни. В идеальном случае затухание флуоресценции моноэкспоненциально; в такой ситуации возможно различить два или три белка с известными временами жизни флуоресценции, математически проанализировав полученную кривую и разделив ее на пики, соответствующие каждому из образцов. После этого с помощью компьютерных программ каждый из белков можно покрасить в свой псевдоцвет, для облегчения визуального восприятия (рис. 3).
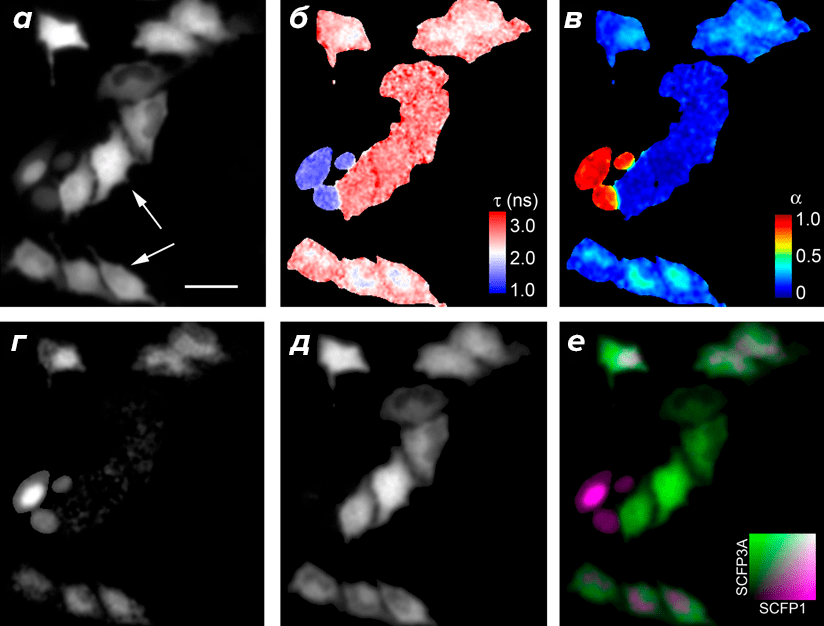
Рисунок 3. Белки SCFP1 и SCFP3A, отличающиеся временем жизни флуоресценции, в клетках HeLa. а — Флуоресцентная микрофотография клеток, экспрессирующих SCFP1-NLS и SCFP3A-NES — или только SCFP1-NLS. Стрелки указывают на клетки, которые нельзя различить по распределению флуоресценции. б — Карта времени жизни флуоресценции. в — Карта фракционного вклада SCFP1 во флуоресценцию в стационарном состоянии. г и д — Микроснимки фракционного молярного распределения SCFP1-NLS и SCFP3A-NES, соответственно. е — Наложение г и д, где SCFP1-NLS окрашен фиолетовым, а SCFP3A-NES — зеленым.
Флуоресцентные таймеры
Белки начинают флуоресцировать после укладки белковой цепи и созревания хромофора, которое включает несколько последовательных ковалентных модификаций, занимающих довольно много времени, особенно у оранжевых и красных белков (рис. 4) [7]. Обычно именно стадия созревания хромофора является лимитирующей для того, чтобы белок начал флуоресцировать. В зависимости от вида флуоресцентного белка, концентрации кислорода и температуры фолдинг может длиться от нескольких минут до целых дней, как в случае флуоресцентных таймеров.
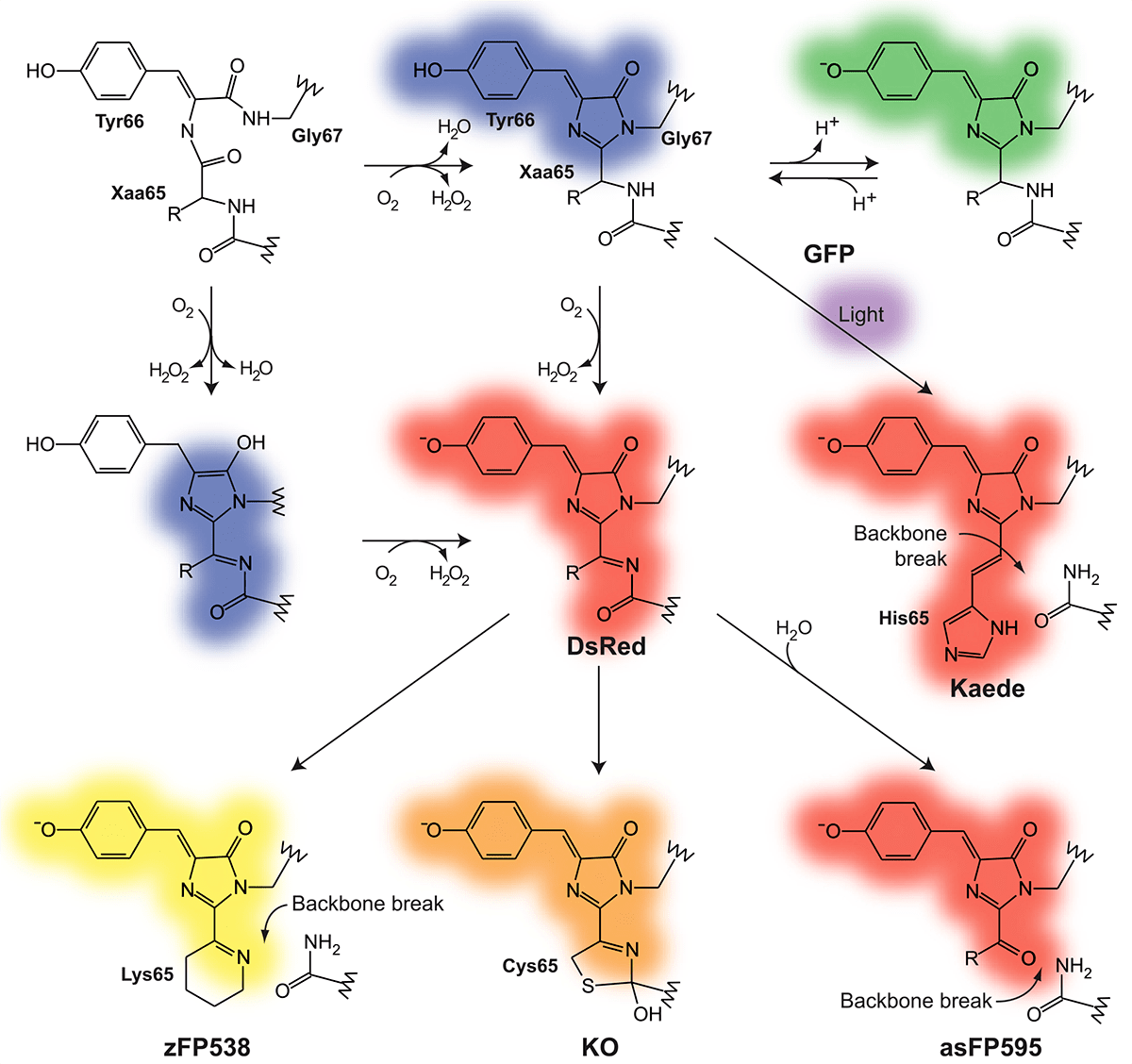
Рисунок 4. Химические структуры и пути созревания хромофоров GFP-подобных белков, встречающихся в природе
Для практического использования скорость созревания до яркого и стабильного флуоресцентного сигнала должна быть достаточно большой. У большей части флуоресцентных белков время полусозревания длится от ~40 минут до 1–2 часов, что достаточно для мечения клеток, органелл и интересующих белков — и для различных количественных экспериментов. Впрочем, для некоторых особых применений (например, для ранней регистрации активации промоторов, мечения интересующих белков с коротким временем жизни или наблюдения за единичными актами трансляции) необходимы флуоресцентные белки с очень высокой скоростью фолдинга. Например, быстро созревающие желтые флуоресцентные белки позволяют напрямую наблюдать за продукцией единичной молекулы белка в реальном времени [8].
Целый ряд возможностей, которые и по сей день изучены в недостаточной степени, обеспечивается так называемыми флуоресцентными таймерами — белками, которые меняют цвет флуоресценции в течение жизни, таким образом позволяя определить время их экспрессии в ретроспективе. Что важно, различные флуоресцентные таймеры характеризуются разнообразными скоростями фолдинга — от минут до часов и даже дней — и таким образом, подходят для изучения процессов по различным временным шкалам.
Первый флуоресцентный таймер DsRed-E5 был опубликован в 2000 году [9]. В течение нескольких часов после синтеза DsRed-E5 обладает флуоресценцией в зеленой области спектра, но потом превращается в красную форму (рис. 5). Эти изменения происходят благодаря тому, что некоторые хромофоры в тетрамере созревают в зеленую GFP-подобную форму вместо красной, и их зеленая флуоресценция доминирует, пока более медленно созревающие красные хромофоры не появятся и не «украдут» возбуждающую энергию от зеленых с помощью крайне эффективного внутритетрамерного Фёрстеровского переноса энергии (FRET) [10].
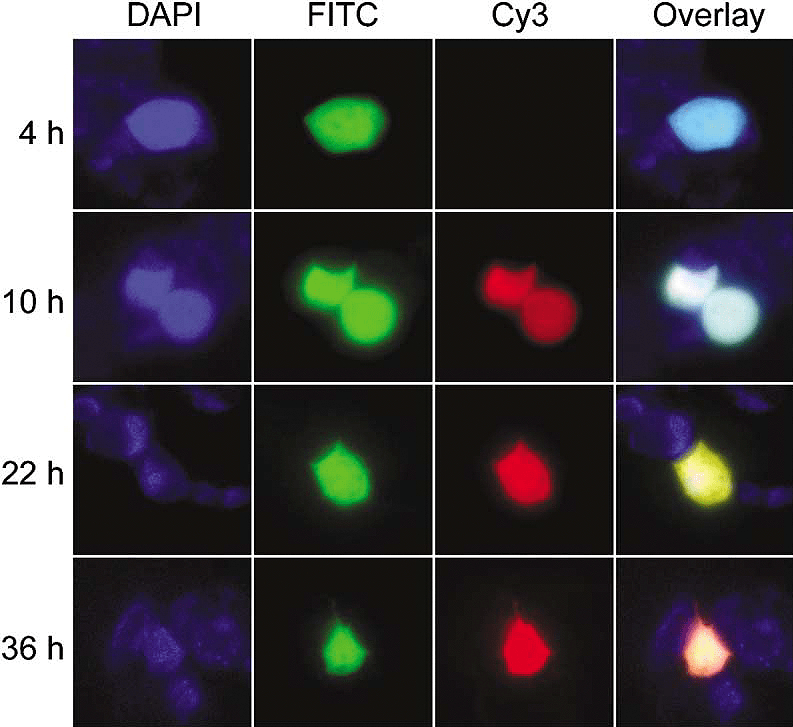
Рисунок 5. Визуализация цветов эмиссии флуоресцентного таймера DsRed-E5NA после индукции в системе Tet-On в человеческих клетках HEK293. В качестве контрольного белка использовали DAPI, а наблюдали за изменением соотноше-ния зеленого к красному сигналов (каналы FITC и Cy3 соответственно).
Таким образом, ткани, клетки или органеллы, которые окрашены зеленым, означают недавнюю продукцию DsRed-E5, в то время как красная флуоресценция отмечает области, в которых белок был синтезирован по крайней мере несколько часов назад. Отношение интенсивности красной флуоресценции к зеленой пропорционально возрасту синтезированного белка и таким образом может отмечать время, прошедшее с момента активации соответствующего промотора. На практике, это обеспечивает способ наблюдения за динамикой экспрессии генов в различных тканях [11]; позволяет отделить клетки, в которых промотор недавно активировался, от клеток с постоянной активностью данного промотора [12]; кроме того, с помощью такого таймера можно анализировать распределение органелл в зависимости от возраста [13] и отслеживать перемещение белков [14].
Светом можно не только возбуждать, но и переключать!
Фотоактивируемые флуоресцентные белки (ФАФБ) представляют собой отдельный класс белков, чьи флуоресцентные свойства могут быть «включены» с помощью импульса света определенной длины волны. Возбуждаясь из несветящегося состояния или меняя цвет, ФАФБ могут служить селективными фотометками белков, органелл, клеток и тканей. В ходе эксперимента можно активировать конкретную фракцию ФАФБ, также как и выбрать когда — и определить интересующий регион. Активированные ФАФБ можно визуализировать в отдельном спектральном канале, при этом неактивированные молекулы остаются «невидимыми». Это свойство обеспечивает уникальную возможность для точного мечения и отслеживания интересующих объектов в живых системах, увеличивая соотношение сигнал/шум и для флуоресцентной микроскопии высокого разрешения.
Плотное окружение хромофора у GFP-подобных белков может стабилизировать его в различных конформациях и значительно влиять на его спектральные характеристики, определяя его состояние протонирования, коэффициент экстинкции и квантовый выход флуоресценции, также как и точное положение пиков возбуждения/эмиссии. Таким образом, цис-транс переходы хромофора, в сочетании с конформационными перестройками близлежащих аминокислот, могут привести к обратимым светоиндуцируемым фотоконверсиям, которые значительно меняют спектральные свойства данного белка.
Необратимые изменения спектральных характеристик становятся возможными, если энергия поглощенного протона приводит к химической реакции внутри конкретного флуоресцентного белка, — например, к расщеплению пептидной связи в хромофоре [15] или декарбоксилированию 222 глутаминовой кислоты, которая играет ключевую роль в сети водородных связей вокруг хромофора [16]. Кроме того, недавно были описаны необратимые фотоконверсии, которые случаются при определенных условиях у тех белков, которые ранее считались не фотоактивируемыми. В частности, описано окислительное покраснение практически для всех зеленых флуоресцентных белков [17]. При интенсивном или двухфотонном возбуждении происходит красная → зеленая или оранжевая → дальнекрасная фотоконверсия у белков DsRed, mKate, mKO и mOrange, механизм которой пока не изучен. Некоторым из этих конверсий в будущем может найтись практическое применение.
«Опасные» флуоресцентные белки.
В настоящее время активно развивается область флуоресцентных белков, которые под действием света испускают активные формы кислорода (АФК; о некоторых их интересных аспектах можно почитать в статье «Активный кислород: друг или враг, или о пользе и вреде антиоксидантов» [31]). АФК могут быть использованы для локальной инактивации целевых белков, избирательного снижения жизнеспособности клеток и для изучения внутриклеточной сигнализации активными формами кислорода. В данной статье я расскажу о двух таких белках: miniSOG и KillerRed.
MiniSOG
MiniSOG (mini Singlet Oxygen Generator) — фототоксичный зеленый флуоресцентный флавопротеин, примерно вдвое меньший по размеру, чем GFP (всего лишь 106 аминокислот), — был получен в результате точечных замен в LOV2-домене белка фототропина-2 из Arabidopsis [18]. Модифицированный LOV-домен, как и исходный (рецептор синего света), связывает флавинмононуклеотид, который, будучи возбужден синим светом, передает энергию триплетному кислороду, который превращается в более «опасный» синглетный кислород.
Максимальное поглощение происходит при длине волны 448 нм с плечом у 473 нм, т.е. в синем свете. Возбуждение miniSOG приводит к эмиссии зеленого света: два пика длиной волны 500 и 528 нм (рис. 6). MiniSOG в растворе ведет себя как мономерный белок, и в составе химерных белков не нарушает их локализации (рис. 7).
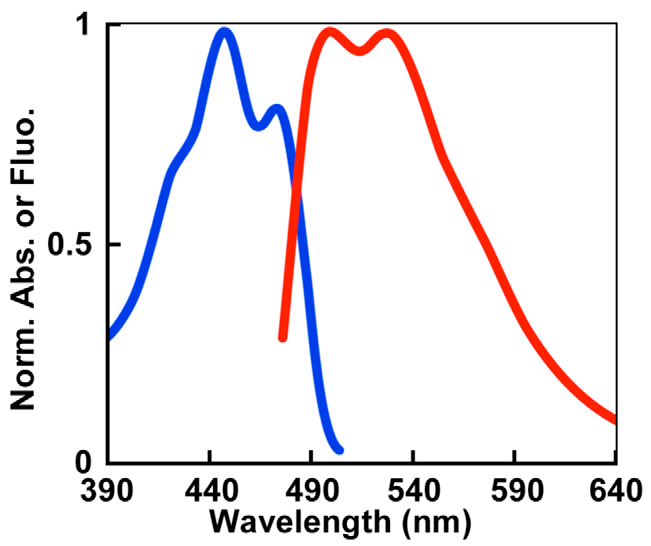
Рисунок 6. Спектры miniSOG. Спектр поглощения (синий) и эмиссии (красный) белка miniSOG.
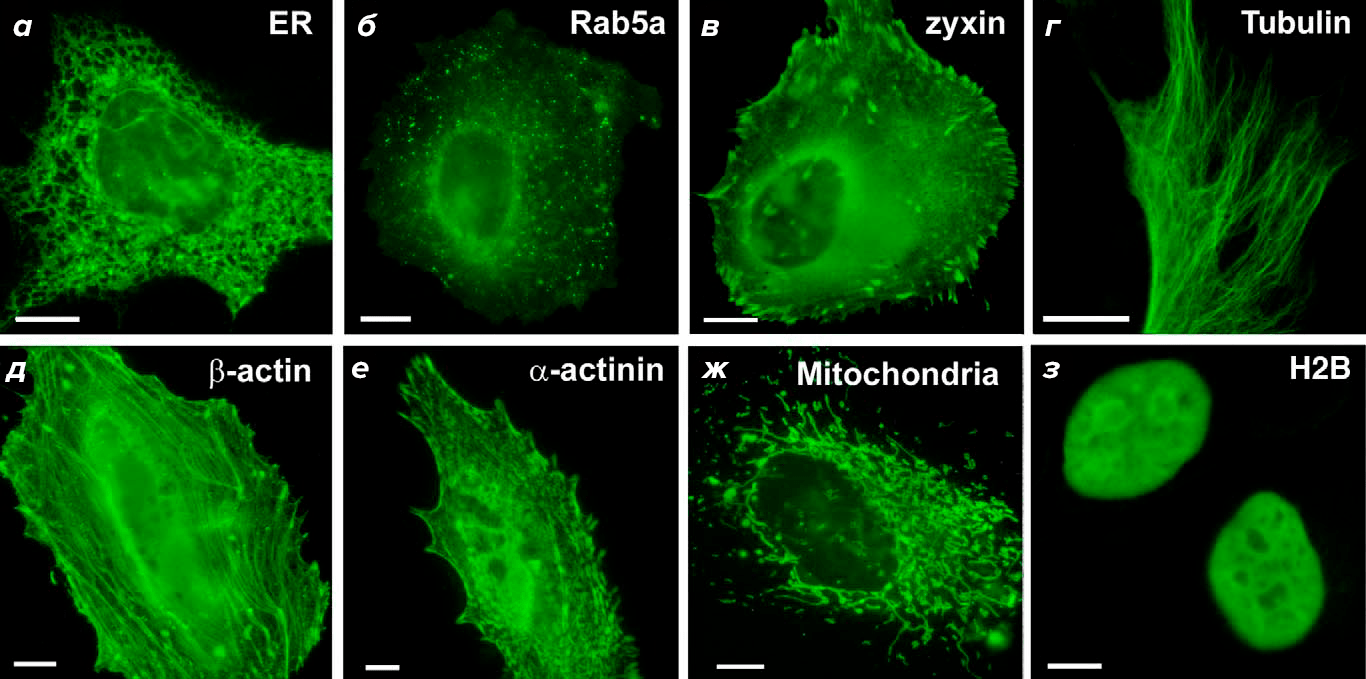
Рисунок 7. Полученные с помощью конфокальной микроскопии фотографии miniSOG в различных субклеточных локализациях: а — в эндоплазматическом ретикулуме; б — слитым с Rab5A; в — слитым с зиксином; г — слитым с тубулином; д — слитым с β-актином; е — слитым с α-актином; ж — в митохондрии; з — слитым с гистоном H2B.
В темноте miniSOG не оказывает негативного влияния на клетки, однако на свету может вызывать токсический эффект вплоть до ее гибели, в зависимости от локализации (рис. 8) [19].
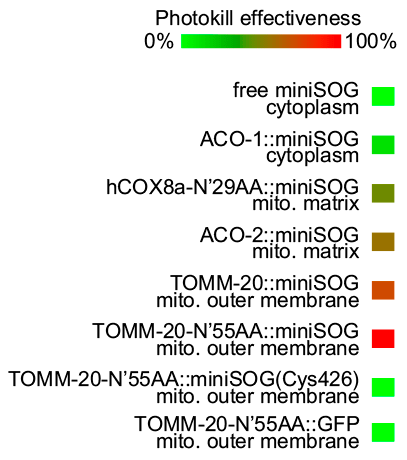
Рисунок 8. Токсический эффект miniSOG в зависимости от его локализации: ACO-1 — цитоплазматическая аконитаза; hCOX8a — субъединица 8а человеческой цитохром С оксидазы; ACO-2 — митохондриальная аконитаза; TOMM-20 — главный рецептор импорта полипептидов в митохондрию.
Однако, как показано выше, miniSOG при освещении отнюдь не всегда приводит к клеточной гибели; это указывает на возможность использования miniSOG не в качестве «орудия убийства», а как обычный источник синглетного кислорода. Подробнее о токсических свойствах miniSOG можно почитать в статье «Флуоресцентный белок miniSOG убивает клетки светом» [32].
KillerRed
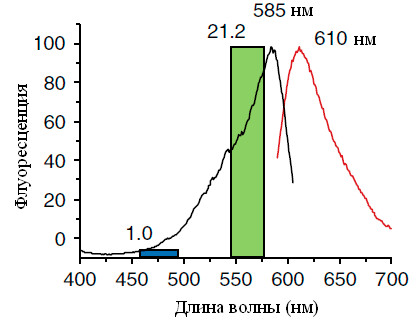
Рисунок 9. Спектры возбуждения (черная линия) и флуоресценции (красная линия) KillerRed. Синий и зеленый прямоугольники показывают относительный фототоксический эффект при облучении синим (460–490 нм) и зеленым (540–580 нм) светом мощностью 35 мВт/см2 соответственно. Данные над прямоугольниками показывают количество раз, в которое уменьшилось число живых клеток E. coli после 30-минутного облучения.
KillerRed — фототоксичный димерный красный флуоресцентный мутант хромобелка anm2CP из гидроидной медузы (максимумы возбуждения и эмиссии — 585 и 610 нм, соответственно). Роль хромофора в определении фототоксических свойств была установлена с помощью теста на бактериях: он показал, что зеленый свет убивает клетки гораздо эффективнее синего. Эти результаты соответствуют спектру поглощения/возбуждения [20] (рис. 9).
GFP и его гомологи является универсальными метками, которые могут быть слиты с целевыми белками, в том числе и ядерными, без влияния на жизнеспособность клетки. Благодаря чему наблюдается повышение фототоксических свойств KillerRed по сравнению с другими GFP-подобными белками? На данный момент нет точных объяснений этому феномену, но есть предположения, связанные со структурой белка KillerRed. Недавно полученное изображение высокого разрешения выявляет уникальный канал, соединяющий DsRed-подобный хромофор с внешней средой, в который помещается восемь молекул воды (рис. 10) [21].
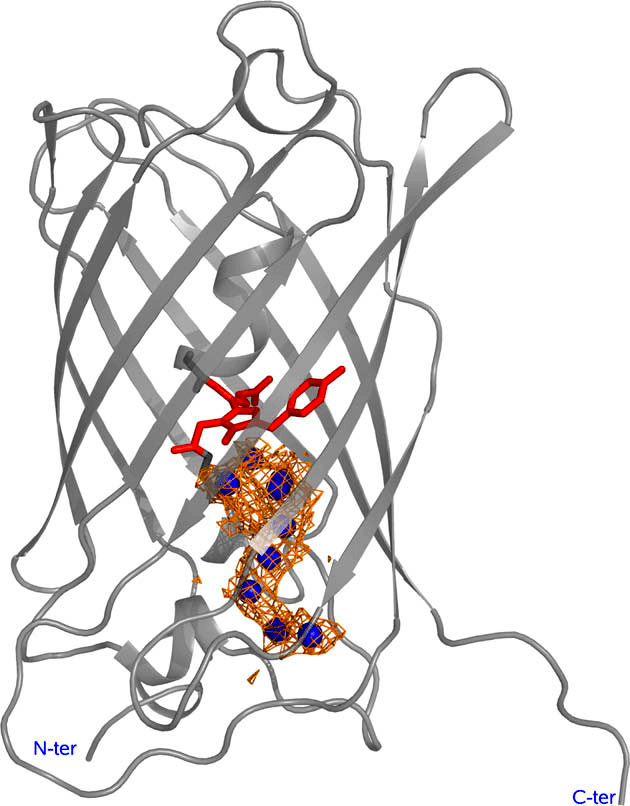
Рисунок 10. Пространственная структура мономера KillerRed. Пептидный остов отмечен серым цветом, хромофор (Gln65—Tyr66—Gly67) — красным. Углубление, формирующее канал, показано в виде оранжевой сетки, охватывающей молекулы воды (синие сферы).
Исходя из данных анализа структуры, можно выдвинуть гипотезу о реакции кислорода с возбужденным хромофором, которая привела бы к образованию супероксид-анион-радикала (O2•−) [22]. Образование O2•− может быть объяснено реакцией переноса электрона от хромофора к кислороду, оставляющей хромофор в состоянии радикала. Эта гипотеза подтверждается недавним открытием того факта, что флуоресцентные белки являются светоиндуцируемыми донорами электронов [17]. АФК, генерируемые KillerRed, могут затем реагировать со слитым с ним белком [23].
Эффективный фотосенсибилизатор должен защищать себя от АФК-опосредованного повреждения. Удивительная особенность KillerRed заключается в большом количестве серусодержащих остатков (6 цистеинов и 10 метионинов). Возможно, именно они играют роль в защите от фотоиндуцированного окисления.
Как уже было сказано ранее, KillerRed — димеризующийся белок; поэтому, будучи слитым с другими белками, он может приводить к потере их функциональности. Так, например, экспрессия химерного гена H2A—KillerRed даже без облучения приводит к утрате способности клеток делиться [24]. Для того чтобы избежать этой ситуации, используется тандемная версия KillerRed, содержащая две копии белка, соединенных гибким линкером. Для других димерных белков было показано, что в таком случае они формируют внутримолекулярные димеры и тем самым ведут себя как псевдомономерные метки [25], что подтвердилось и в данном случае [22].
Как и для других фотосенсибилизаторов, уровень фототоксичности и эффект белка KillerRed зависит от внутриклеточной локализации. KillerRed, слитый с сигналом направления в митохондрию, запускает апоптоз; будучи слитым с сигналом меристилирования, на плазматической мембране приводит, в основном, к некрозу [20]. Будучи слит с гистоном H2B, KillerRed при облучении вызывает активацию системы репарации клетки [22].
Совсем недавно, в 2013 году, с помощью нескольких точечных мутаций был получен мономерный вариант KillerRed (под названием SuperNova) [26]. Его цитоплазматическая экспрессия, как и экспрессия KillerRed, не мешает делению клеток, а уровень фототоксичности при этом довольно высок, что позволяет, в частности, функциональный анализ целевых белков с помощью технологии CALI (chromophore-assisted light-inactivation) без недостатка в виде димеризации, присущей исходному варианту KillerRed.
Безусловно, в своей статье я рассмотрела лишь небольшую часть возможностей применения флуоресцентных белков. В настоящее время это одна из наиболее динамично развивающихся областей молекулярной биологии как фундаментальной науки, с одной стороны, а с другой — как прикладной методологии. Флуоресцентные белки продолжают активно исследовать, благодаря чему они становятся все более технологичными инструментами как для самих исследований, так и для практического применения в биотехнологиях и медицине. Поиск и создание новых интересных форм и разнообразных методов, основанных на использовании флуоресцентных белков, наверняка приведут к неожиданным интригующим открытиям.
Литература
- Grigory S Filonov, Kiryl D Piatkevich, Li-Min Ting, Jinghang Zhang, Kami Kim, Vladislav V Verkhusha. (2011). Bright and stable near-infrared fluorescent protein for in vivo imaging. Nat Biotechnol. 29, 757-761;
- Yujie Lu, Chinmay D. Darne, I-Chih Tan, Grace Wu, Nathaniel Wilganowski, et. al.. (2013). In vivoimaging of orthotopic prostate cancer with far-red gene reporter fluorescence tomography andin vivoandex vivovalidation. J. Biomed. Opt. 18, 101305;
- Andreas K Hock, Pearl Lee, Oliver DK Maddocks, Susan M Mason, Karen Blyth, Karen H Vousden. (2014). iRFP is a sensitive marker for cell number and tumor growth in high-throughput systems. Cell Cycle. 13, 220-226;
- Hai-Jui Lin, Petr Herman, Joseph R. Lakowicz. (2003). Fluorescence lifetime-resolved pH imaging of living cells. Cytometry. 52A, 77-89;
- Theodorus W.J. Gadella, Thomas M. Jovin, Robert M. Clegg. (1993). Fluorescence lifetime imaging microscopy (FLIM): Spatial resolution of microstructures on the nanosecond time scale. Biophysical Chemistry. 48, 221-239;
- Gert-Jan Kremers, Erik B. van Munster, Joachim Goedhart, Theodorus W.J. Gadella. (2008). Quantitative Lifetime Unmixing of Multiexponentially Decaying Fluorophores Using Single-Frequency Fluorescence Lifetime Imaging Microscopy. Biophysical Journal. 95, 378-389;
- Dmitriy M. Chudakov, Mikhail V. Matz, Sergey Lukyanov, Konstantin A. Lukyanov. (2010). Fluorescent Proteins and Their Applications in Imaging Living Cells and Tissues. Physiological Reviews. 90, 1103-1163;
- J. Yu. (2006). Probing Gene Expression in Live Cells, One Protein Molecule at a Time. Science. 311, 1600-1603;
- A. Terskikh. (2000). "Fluorescent Timer": Protein That Changes Color with Time. Science. 290, 1585-1588;
- Vladislav V Verkhusha, Dmitry M Chudakov, Nadya G Gurskaya, Sergey Lukyanov, Konstantin A Lukyanov. (2004). Common Pathway for the Red Chromophore Formation in Fluorescent Proteins and Chromoproteins. Chemistry & Biology. 11, 845-854;
- Rossana Mirabella, Carolien Franken, Gerard N.M. van der Krogt, Ton Bisseling, René Geurts. (2004). Use of the Fluorescent Timer DsRED-E5 as Reporter to Monitor Dynamics of Gene Activity in Plants. Plant Physiol.. 135, 1879-1887;
- T. Miyatsuka, Z. Li, M. S. German. (2009). Chronology of Islet Differentiation Revealed By Temporal Cell Labeling. Diabetes. 58, 1863-1868;
- Michele Solimena, Hans-Hermann Gerdes. (2003). Secretory granules: and the last shall be first…. Trends in Cell Biology. 13, 399-402;
- P. V. Lidsky, S. Hato, M. V. Bardina, A. G. Aminev, A. C. Palmenberg, et. al.. (2006). Nucleocytoplasmic Traffic Disorder Induced by Cardioviruses. Journal of Virology. 80, 2705-2717;
- R. Ando, H. Hama, M. Yamamoto-Hino, H. Mizuno, A. Miyawaki. (2002). An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences. 99, 12651-12656;
- J. Nathan Henderson, Rinat Gepshtein, Josef R. Heenan, Karen Kallio, Dan Huppert, S. James Remington. (2009). Structure and Mechanism of the Photoactivatable Green Fluorescent Protein. J. Am. Chem. Soc.. 131, 4176-4177;
- Alexey M Bogdanov, Alexander S Mishin, Ilia V Yampolsky, Vsevolod V Belousov, Dmitriy M Chudakov, et. al.. (2009). Green fluorescent proteins are light-induced electron donors. Nat Chem Biol. 5, 459-461;
- Xiaokun Shu, Varda Lev-Ram, Thomas J. Deerinck, Yingchuan Qi, Ericka B. Ramko, et. al.. (2011). A Genetically Encoded Tag for Correlated Light and Electron Microscopy of Intact Cells, Tissues, and Organisms. PLoS Biol. 9, e1001041;
- Y. B. Qi, E. J. Garren, X. Shu, R. Y. Tsien, Y. Jin. (2012). Photo-inducible cell ablation in Caenorhabditis elegans using the genetically encoded singlet oxygen generating protein miniSOG. Proceedings of the National Academy of Sciences. 109, 7499-7504;
- Maria E Bulina, Dmitriy M Chudakov, Olga V Britanova, Yurii G Yanushevich, Dmitry B Staroverov, et. al.. (2006). A genetically encoded photosensitizer. Nat Biotechnol. 24, 95-99;
- Philippe Carpentier, Sebastien Violot, Laurent Blanchoin, Dominique Bourgeois. (2009). Structural basis for the phototoxicity of the fluorescent protein KillerRed. FEBS Letters. 583, 2839-2842;
- Ekaterina O. Serebrovskaya, Tatiana V. Gorodnicheva, Galina V. Ermakova, Elena A. Solovieva, George V. Sharonov, et. al.. (2011). Light-induced blockage of cell division with a chromatin-targeted phototoxic fluorescent protein. Biochemical Journal. 435, 65-71;
- Maria E Bulina, Konstantin A Lukyanov, Olga V Britanova, Daria Onichtchouk, Sergey Lukyanov, Dmitriy M Chudakov. (2006). Chromophore-assisted light inactivation (CALI) using the phototoxic fluorescent protein KillerRed. Nat Protoc. 1, 947-953;
- Waldemar Waldeck, Gabriele Mueller, Manfred Wiessler, Manuela Brom, Katalin Tóth, Klaus Braun. (2009). Autofluorescent Proteins as Photosensitizer in Eukaryontes. Int. J. Med. Sci.. 365-373;
- Nathan C Shaner, Robert E Campbell, Paul A Steinbach, Ben N G Giepmans, Amy E Palmer, Roger Y Tsien. (2004). Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22, 1567-1572;
- Kiwamu Takemoto, Tomoki Matsuda, Naoki Sakai, Donald Fu, Masanori Noda, et. al.. (2013). SuperNova, a monomeric photosensitizing fluorescent protein for chromophore-assisted light inactivation. Sci Rep. 3;
- «Нарисуем» живую клетку;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Флуоресцирующая Нобелевская премия по химии;
- Рулетка для спектроскописта;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Флуоресцентный белок miniSOG убивает клетки светом.






