Сосудистые катастрофы и травмы ЦНС: можно ли спасти поврежденный мозг
05 сентября 2025
Сосудистые катастрофы и травмы ЦНС: можно ли спасти поврежденный мозг
- 1747
- 0
- 8
Лишенные питания и кислорода нейроны после ишемического инсульта обречены на гибель, если не вмешаться как можно быстрее после первых симптомов и не восстановить кровоток в поврежденной области.
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
Мозг — это центр управления организмом, и разрушение мозга грубо ломает управление, превращая здорового человека в инвалида или даже убивая его. В одной из предыдущих статей спецпроекта мы разбирали, какие механизмы лежат в основе повреждения мозговой ткани при нейродегенеративных заболеваниях. Но есть еще одна угроза — физическое разрушение мозга из-за внешних травм или нарушений кровоснабжения. Помимо непосредственного ущерба мозговой ткани, в этом случае запускается каскад вторичных процессов, которые многократно усиливают первоначальные нарушения. Восстановление мозга после такой катастрофы — Святой Грааль нейромедицины, одновременно желанный и недостижимый. Аневризмы, травмы и инсульты не выбирают «удобный момент». Они возникают резко, без предупреждения, и их последствия часто необратимы. В отличие от медленно прогрессирующих болезней вроде Альцгеймера или Паркинсона, эти состояния требуют экстренного вмешательства — и от скорости реакции зависит дальнейшая судьба человека. В этой статье мы подробно разберем различные типы физических повреждений мозга и современные способы их лечения.
Нейрофармакология

Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Партнер спецпроекта — биотехнологическая компания LEENERS. Современные исследовательские лаборатории LEENERS — это место, где совершаются научные открытия и рождаются лекарственные препараты нового поколения.
Для описания уязвимостей нервной системы как нельзя лучше подходит известная максима Quod me nutrit me destruit («Что меня питает — то и убивает»). Мозг требует больше ресурсов, чем любой другой орган, ему постоянно нужны кислород и глюкоза, а значит — разветвленная сеть сосудов для их доставки. Но такое мощное кровоснабжение не только кормит, но и создает уязвимость: сосуды могут порваться или закупориться, в результате чего мозговая ткань повреждается из-за кровоизлияния или недостатка кровоснабжения, а на месте повреждения запускается воспалительная реакция, которая разрушает ткань даже после восстановления кровотока. Кроме того, несмотря на защиту в виде мощных костей черепа, мозг может быть травмирован физически, и нарушения тогда схожи с теми, что возникают при инсульте. Разберем эти нарушения подробнее.
Какие бывают повреждения мозговой ткани
Есть несколько типов повреждений мозговой ткани. Аневризмы и инсульты возникают из-за нарушений системы кровоснабжения мозга и потому называются цереброваскулярными заболеваниями. Травмы же возникают из-за внешних повреждений: падений, автокатастроф и так далее.
Аневризма — это локальное выпячивание истонченной стенки сосуда мозга, его ослабленный участок. Пока она цела, симптомы обычно отсутствуют, и только особенно крупные аневризмы давят на окружающие ткани так сильно, что иногда возникают неврологические симптомы.
Разрыв аневризмы приводит к внезапному массивному кровоизлиянию, которое называется геморрагическим инсультом. Также геморрагический инсульт может возникнуть из-за других повреждений сосудов, не связанных с аневризмой.
Помимо геморрагических инсультов бывают ишемические, и это — более частый случай. При ишемическом инсульте просвет артерии блокируется эмболом (инородным телом, чаще всего тромбом), доступ кислорода и глюкозы к нейронам перекрывается, и они гибнут.
Травмы ЦНС возникают от внешнего удара или резкого ускорения или замедления. Они непосредственно раздавливают или разрывают мозговую ткань и кровеносные сосуды. Это первичное повреждение часто запускает вторичную ишемию из-за сосудистого спазма или тромбоза, еще больше усугубляя положение.
Если травмы возникают из-за внешних причин, не поддающихся медицинскому исследованию и контролю, то причины цереброваскулярных заболеваний можно исследовать и в некоторой степени контролировать — поговорим об этом в следующем разделе.
Причины цереброваскулярных заболеваний
Патологии мозговых сосудов формируются по двум основным сценариям.
В первом случае проблема заложена генетически — при синдромах Марфана или Элерса–Данлоса стенки артерий теряют эластичность, а при заболеваниях типа синдрома CADASIL постепенно разрушаются мелкие церебральные сосуды.
Во втором случае нарушения накапливаются с годами: холестериновые отложения сужают просвет артерий, и повышенное давление создает постоянную нагрузку, пока система не даст сбой.
Генетические причины
Синдром Марфана возникает из-за мутаций в гене FBN1, который кодирует белок фибрилин-1 — основной строительный элемент волокон соединительной ткани. Патологические мутации нарушают структуру белка, делая микрофибриллы менее устойчивыми к нагрузкам. Особенно страдает сосудистая система: ослабленные стенки артерий легко растягиваются, формируя выпячивания — аневризмы [1].
Синдром Элерса—Данлоса сосудистого типа развивается из-за молекулярного дефекта в коллагене III типа — основном структурном белке сосудистой стенки. Мутация в гене COL3A1 вносит изменение в структуру коллагена: аргинин заменяется на цистеин. Цистеин, в отличие от аргинина, образует дополнительные химические связи, которые нарушают правильное скручивание белковых цепей. Вместо упорядоченной спирали получается деформированная структура, похожая на перекрученный канат [2]. Хрупкость сосудов приводит к формированию аневризм и их разрыву в раннем возрасте.
Риск сосудистых катастроф мозга повышают и другие моногенные заболевания. Например, при синдроме CADASIL мутации в гене NOTCH3 приводят к постепенному разрушению мозговых сосудов из-за гипертрофии гладкомышечных клеток. Близкий механизм — у синдрома CARASIL, но здесь дефект в гене HTRA1 нарушает структуру срединного слоя артерий [3].
Особую группу составляют заболевания с накоплением патологических веществ. При болезни Фабри [4] в сосудах откладываются липиды, которые их закупоривают, а при церебральной амилоидной ангиопатии — белок амилоид, что делает артерии хрупкими. Митохондриальные нарушения вроде синдрома MELAS проявляются иначе: дефект энергетического обмена в клетках по не изученным до конца причинам приводит к инсультоподобным эпизодам.
Каждое из этих генетических заболеваний имеет свой уникальный молекулярный механизм, но все они в конечном итоге увеличивают вероятность сосудистых катастроф.
Атеросклероз
Атеросклероз — главная причина ишемических инсультов. Это процесс образования жировых бляшек на стенке артерий.
Все начинается с того, что избыток «плохого» холестерина (ЛПНП, липопротеины низкой плотности) [5] проникает под внутреннюю оболочку сосуда. На эти отложения реагируют иммунные клетки — моноциты, они превращаются в макрофаги и пытаются «съесть» холестерин, но вместо этого сами превращаются в пенистые клетки, переполненные жировыми каплями, и застревают под оболочкой.
В результате под сосудистой оболочкой формируется плотная бляшка. Она растет, покрывается кальциевым налетом и сужает просвет сосуда. Кусочки бляшки могут отрываться и путешествовать по кровотоку, пока не застрянут в узком месте — например, в сосуде мозга, вызывая закупорку и инсульт.
Атеросклероз развивается с возрастом или под влиянием генетических факторов, но главные причины управляемы: курение, давление и малоподвижность. Отказ от вредных привычек и движение снижают риск даже при плохой наследственности.
Анатомические факторы риска повреждений ЦНС
Подробно о строении ЦНС говорилось в другой статье спецпроекта [6]. Нас же сейчас особенно интересуют оболочки мозга и его кровоснабжение. ЦНС окружают три мозговые оболочки: твердая (dura mater), паутинная (tunica arachnoidea) и мягкая (pia mater). Твердая оболочка отделяется от черепа эпидуральным пространством, между твердой и паутинной оболочкой находится субдуральное пространство, паутинная оболочка и мягкая разделены субарахноидальным пространством. Именно на нем мы и сосредоточим свое внимание.
Субарахноидальное пространство заполнено жидкостью, которая образуется в сосудистых сплетениях желудочков мозга по принципу, напоминающему почечную фильтрацию. Эта жидкость омывает головной и спинной мозг и работает как амортизатор — при ударах или резких движениях гасит колебания, защищая нежную нервную ткань от повреждений.
Через твердую оболочку проходит множество артерий, но ветвиться они начинают именно в субарахноидальном пространстве. Места бифуркации сосуда — это места изменения потока, а значит, увеличения турбулентности и механического напряжения стенок сосуда, что может привести к его истончению и образованию аневризмы (рис. 1) [7]. Поэтому чаще всего разрыв аневризмы — это кровоизлияние в субарахноидальном пространстве.
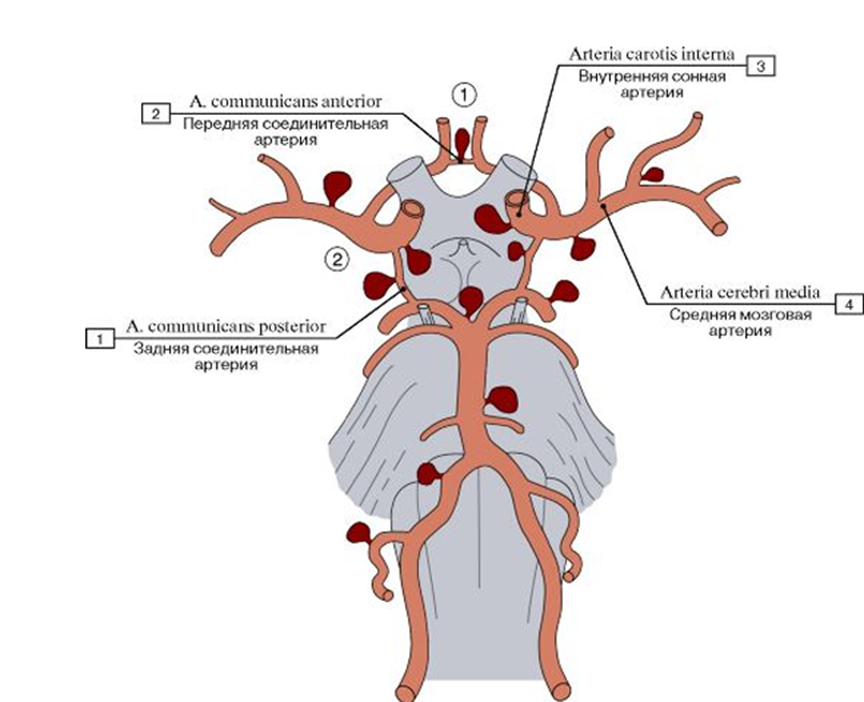
Рисунок 1. Места закладки мешотчатых аневризм сосудов артериального круга мозга.
Но такое активное ветвление — не абсолютное зло. На самом деле это «эволюционный предохранитель» от ишемических инсультов. Мозг имеет сеть коллатеральных артерий, например, артериальный круг мозга. Если одну артерию закупорило, коллатеральные пути доставляют кровь в обход тромба, защищая мозг от повреждения из-за нехватки кислорода (ишемического инсульта). Варианты нормы артериального круга показаны на рис. 2.
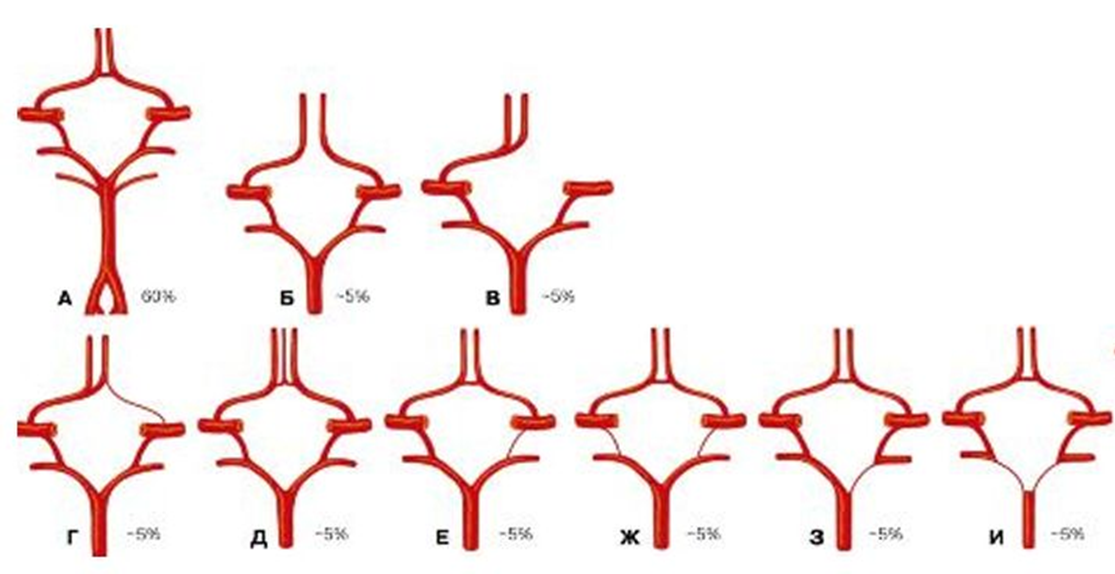
Рисунок 2. Варианты артериального круга.
(А) — в большинстве случаев артериальный круг образован следующими артериями: передней, средней и задней мозговыми артериями; передней и задней соединительными артериями; внутренней сонной и базилярной.
(Б) — иногда передняя соединительная артерия отсутствует.
(В) — обе передние мозговые артерии могут начинаться от одной внутренней сонной артерии (правой или левой).
(Г) — гипоплазия правой или левой передних мозговых артерий.
(Д) — вариант передних мозговых артерий.
(Е) — задняя соединительная артерия (правая или левая) может отсутствовать или быть недоразвита с одной стороны.
(Ж) — обе или одна задние соединительные артерии могут отсутствовать или быть недоразвитыми (гипоплазия).
(З) — задняя мозговая артерия (одна или обе) может отсутствовать или быть недоразвита с одной стороны.
(И) — одна или обе задние мозговые артерии могут отсутствовать или быть недоразвитыми. Передние мозговые артерии могут отходить от общего ствола.
Теперь, разобрав причины цереброваскулярных заболеваний, поподробнее рассмотрим каждое из них, их диагностику и возможные способы лечения.
Аневризмы
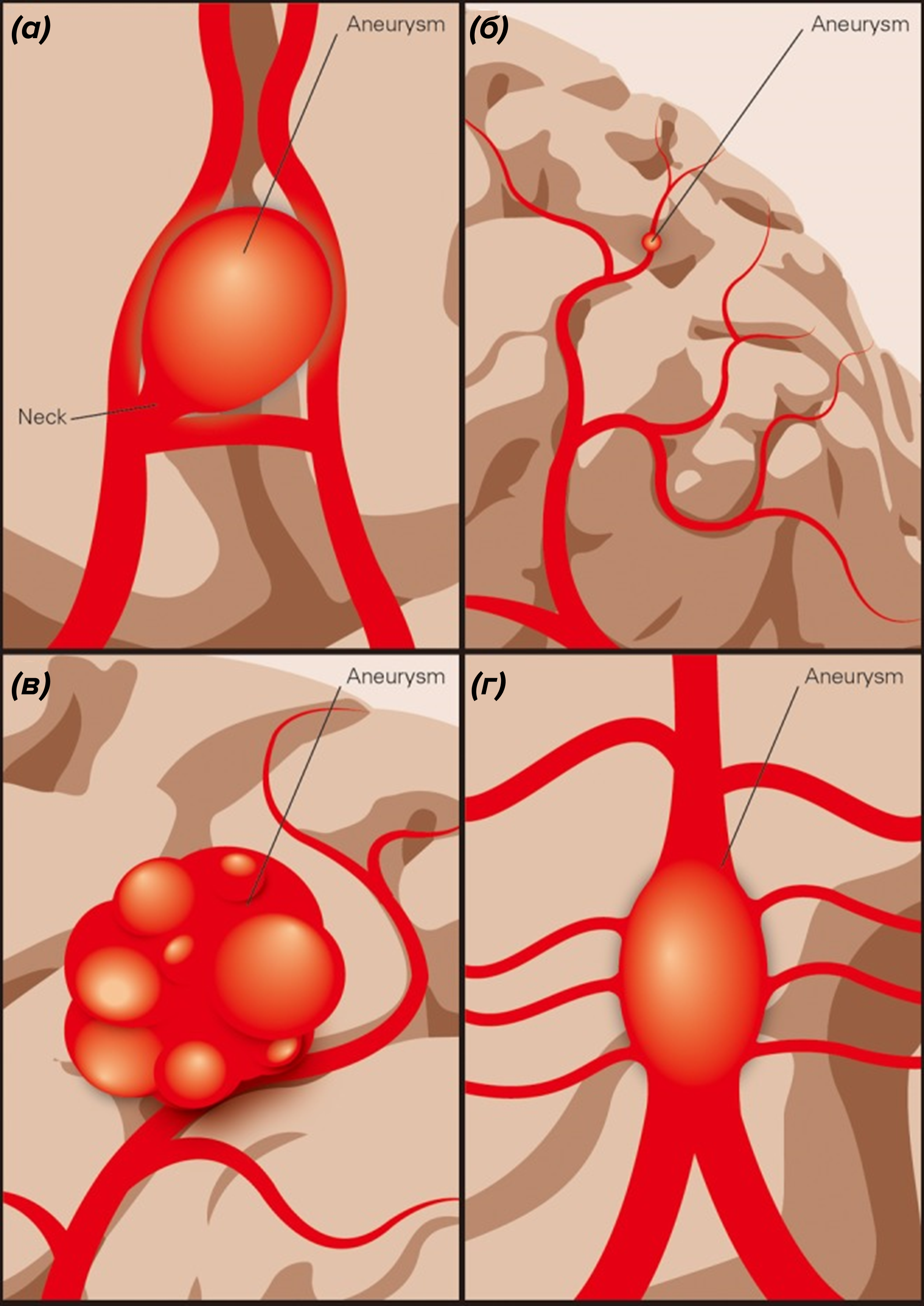
Рисунок 3. Типы внутричерепных аневризм. (а) — мешотчатая, (б) — микроаневризма, (в) — гигантская аневризма, (г) — веретенообразная.
Аневризмы сосудов мозга различаются по форме, размеру и расположению. Наиболее распространены мешотчатые аневризмы — они составляют 90% всех случаев. Такая аневризма напоминает пузырь на стенке артерии и состоит из трех частей: шейки, тела и купола. Купол — самое тонкое место, где чаще всего происходит разрыв [8].
Реже встречаются веретенообразные аневризмы. Они равномерно расширяют артерию по всей окружности, сохраняя ее трехслойное строение (рис. 3) [9].
По величине аневризмы делят на микроаневризмы (≤3 мм в диаметре), обычного размера (4–15 мм), большие (16–25 мм) и гигантские (>25 мм) (рис. 3) [8]. Чаще всего их обнаруживают в передней мозговой, соединительной, внутренней сонной или средней мозговой артериях. Примерно у каждого одиннадцатого пациента, которому диагностировали одну аневризму в головном мозге, обнаруживаются еще несколько [8].
Диагностика аневризм
Аневризмы сосудов головного мозга в большинстве случаев протекают бессимптомно до момента разрыва. Исключение — гигантские аневризмы, которые давят на окружающие ткани так сильно, что возникают неврологические симптомы: боль за глазом, онемение лица, слабость мимических мышц, расширение зрачка и проблемы со зрением — от двоения в глазах до частичной слепоты. Эти симптомы появляются постепенно и усиливаются по мере роста аневризмы.
Неразорвавшиеся аневризмы ищут с помощью КТ-ангиографии, детально визуализирующей сосуды, а если пациенту не подходят йодсодержащие контрасты, используют МР-ангиографию [10]. Если аневризма обнаружилась, риск ее разрыва оценивают с помощью 4D-МРТ [10], которая показывает гемодинамику. Методика VWI-МРТ [10] делает видимой саму стенку сосуда. Если после контраста участки светятся — там воспаление и истончение. Точечные сигналы особенно опасны, скорее всего, там скоро произойдет разрыв. Для сложных случаев используют ферумокситол-МРТ. [10] Здесь контраст — микрочастицы железа, которые поглощаются макрофагами. Быстрое накопление частиц в течение 24 часов — сигнал о почти неизбежном разрыве.
Разрыв аневризмы — это прежде всего потеря сознания или сильнейшая головная боль, которую многие называют «невыносимой». Одновременно может появиться тошнота, невозможность наклонить голову вперед из-за напряжения мышц шеи, болезненная реакция на свет. У части пациентов за неделю-две до разрыва бывают предупреждающие признаки — кратковременные приступы сильной головной боли, вызванные небольшими подтеканиями крови из истонченной стенки сосуда.
При подозрении на разрыв экстренно выполняют КТ. В первые 24 часа КТ выявляет кровь в 95% случаев, определяет ее объем, распределение и локализацию разрыва (точность ~78%) [11]. После 4–7 дней чувствительность КТ снижается. В этот период эффективнее МРТ — она выявляет продукты распада крови. МР-ангиография при этом дополнительно выявляет само место разрыва [11].
Для подтверждения субарахноидального кровоизлияния, когда методы визуализации не дают однозначного ответа, применяют люмбальную пункцию. В ходе этой процедуры врач тонкой иглой берет образец спинномозговой жидкости из позвоночного канала. Если жидкость красновато-желтая, а тем более с кровью, — это показатель недавнего разрыва аневризмы, возможно, небольшой, незаметной на КТ. Однако процедура требует осторожности — при повышенном внутричерепном давлении она может быть опасна.
Лечение аневризм
Лечат аневризмы двумя основными способами. Крупные аневризмы клипируют [12] — на шейку накладывают металлическую клипсу. Этот метод эффективен, но требует трепанации черепа и несет риски осложнений. Альтернатива — эндоваскулярная эмболизация, когда через сосуды к аневризме проводят микроспирали, вызывающие ее тромбирование. При широкой шейке аневризмы используют вспомогательные техники: временный баллон, удерживающий спирали во время установки (рис. 4а), или постоянный стент, который либо фиксирует спирали, либо перенаправляет поток крови от аневризмы (рис. 4б). Этот менее травматичный метод чаще применяют у пожилых пациентов и при труднодоступных локализациях. Эндоваскулярная эмболизация, будучи малоинвазивной процедурой, редко приводит к серьезным послеоперационным осложнениям [13]. Большинство пациентов после такого вмешательства не требуют длительного интенсивного наблюдения.
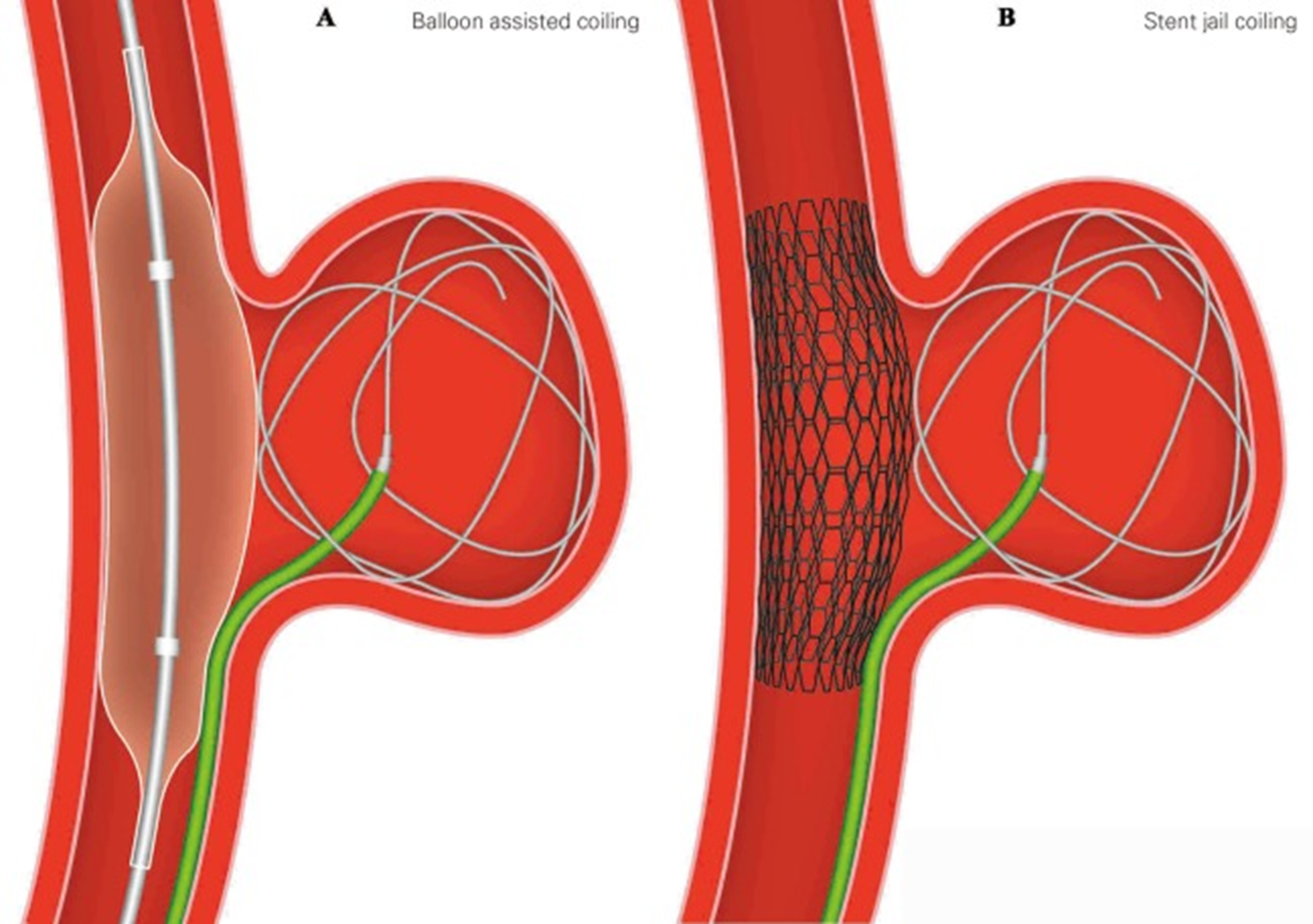
Рисунок 4. Схематическое изображение эндоваскулярной эмболизации: (а) — баллонная ангиопластика, (б) установка стента.
Разрыв аневризмы часто связан с хроническим воспалением. Ключевые игроки здесь — макрофаги. Они делятся на два типа: провоспалительные M1 и противовоспалительные M2, запускающие восстановление. В неразорвавшихся аневризмах M1 и M2 макрофаги присутствуют поровну. В разорвавшихся — M1 резко преобладают [14].
Дисбаланс M1/M2 и активация тучных клеток явно связаны с разрывом аневризм, однако причинно-следственная связь остается не до конца ясной: то ли дисбаланс вызывает разрыв, то ли он, наоборот, возникает из-за воспалительной реакции, запущенной разрывом [14].
M1-макрофаги выбрасывают белок TNF-α, заставляющий мышечные клетки сосуда производить матриксные металлопротеиназы (ММР), которые разъедают каркас сосуда. Одновременно страдает производство коллагена и эластина. Кроме того, M1-макрофаги привлекают нейтрофилы и тучные клетки, усиливающие воспалительные каскады, и замыкается порочный круг воспаления [14].
Есть несколько способов повлиять на этот процесс.
Один способ — сдвиг поляризации макрофагов к M2-фенотипу. Основная мишень — рецептор PPARγ [15]. Данные преимущественно на животных показывают: активация PPARγ (например, с помощью его агониста пиоглитазона [16]) способствует переходу макрофагов в противовоспалительное M2-состояние. M2-макрофаги снижают выработку провоспалительных цитокинов и способствуют стабилизации стенки сосуда [16].
Другой способ — подавление активации M1-макрофагов. Ключевая мишень — воспалительный комплекс NLRP3. Его активация запускает выброс цитокинов, усиливающих M1-поляризацию и воспаление. Блокирование NLRP3 ослабляет M1-воспаление в экспериментальных моделях (у мышей с дефицитом NLRP3). Специфические ингибиторы NLRP3 для лечения церебральных аневризм у людей находятся на стадии доклинических исследований.
Геморрагический инсульт
Геморрагический инсульт — это примерно 10–20% случаев всех инсультов; как мы уже обсуждали выше, он развивается из-за разрыва мозгового сосуда либо аневризмы и последующего кровоизлияния в ткань мозга либо в пространство под его оболочками. Этот тип инсульта часто протекает тяжелее ишемического [17].
Геморрагический инсульт проявляется остро, его симптомы зависят от локализации и объема кровоизлияния. Общемозговые признаки включают интенсивную, внезапную «громоподобную» головную боль (особенно характерную для субарахноидальных кровоизлияний), рвоту (чаще при поражении мозжечка или ствола) и снижение сознания вплоть до комы. Тяжесть состояния часто отражает размер гематомы и степень внутричерепной гипертензии [17].
Логика диагностики такая же, как при диагностике разрыва аневризмы. КТ быстро верифицирует кровоизлияние.
Тактика лечения зависит от размера и расположения гематомы и общего состояния пациента. В острой стадии врачи сосредотачиваются на стабилизации жизненно важных показателей и снижении внутричерепного давления [17].
Для лечения геморрагического инсульта используют хирургическое вмешательство. Операция необходима, так как гематомы сильно сдавливают мозг, смещая его структуры, и могут блокировать отток спинномозговой жидкости, вызывая гидроцефалию. Особенно опасны кровоизлияния в мозжечке — они способны спровоцировать остановку дыхания из-за сдавления ствола мозга.
Технически операции проводятся либо классическим открытым способом через трепанационное отверстие, либо малоинвазивными методами. Последние включают стереотаксическую аспирацию под томографическим контролем. Это малотравматичная операция на мозге, при которой врач с помощью тонкой иглы удаляет кровь из глубины мозга.
При гематомах, ассоциированных с сосудистыми изменениями или аневризмами, одновременно с эвакуацией сгустка может выполняться эмболизация или клипирование. Это предотвращает рецидив кровоизлияния [18].
Ишемический инсульт
Ишемические инсульты составляют подавляющее большинство случаев инсульта (80–90%) и возникают, как мы уже говорили, вследствие закупорки артерии, питающей мозг, что приводит к прекращению кровотока (ишемии) участка мозговой ткани.
Диагностика начинается с оценки характерных симптомов: внезапной слабости в конечностях, асимметрии лица, нарушений речи и координации. При появлении этих признаков требуется срочное обследование.
В больнице первым делом должны сделать КТ, чтобы исключить геморрагический инсульт. Но ишемию КТ может не заметить в первые часы [19].
Наиболее чувствительный метод ранней диагностики ишемии — МРТ с диффузионно-взвешенными изображениями. Этот метод улавливает ишемию уже через 30–60 минут [19], показывая зону, где движение молекул воды нарушено из-за цитотоксического отека. Дополнительные режимы (перфузия, ангиография) помогают оценить кровоток и найти тромб.
Для механического удаления тромба (тромбэктомии) в бедренной артерии делают микропрокол и через него ведут катетер к тромбу в сонной или средней мозговой артерии. Дальше тромб захватывается с помощью гибких стент-ретриверов, раскрывающихся внутри сгустка, или «засасывается» аспирационными катетерами с отрицательным давлением. Сразу после извлечения тромба устанавливают стент, расширяющий проток сосуда и поэтому предотвращающий его повторную закупорку [20].
Фармацевтическое лечение ишемических инсультов
Когда артерия в мозге закупоривается тромбом, клетки в зоне полного отсутствия кровотока («ядро инфаркта») гибнут за считанные минуты. Вокруг них находится «зона риска» — клетки, которые еще живы, но «оглушены» из-за нехватки кислорода и могут выжить, если кровоток восстановить быстро. Однако с каждой минутой в этой зоне накапливаются токсины, развивается отек и воспаление. К 4,5 часам после закупорки почти вся зона риска погибает или повреждается настолько, что восстановление невозможно. Одновременно стенки сосудов в поврежденной зоне становятся хрупкими [21]. В первые часы после инсульта пациенту обычно вводят тромболитик, который при наилучшем варианте развития событий разрушает тромб и восстанавливает кровоток в закупоренной артерии. Тромболитик, введенный после 4,5 часов, уже не успеет спасти значимую ткань, но с высокой вероятностью вызовет опасное кровоизлияние в ослабленные сосуды. Поэтому польза от препарата резко падает, а риск — критически возрастает, делая его введение неоправданным. К сожалению, в большинстве случаев пациенты не доезжают до больницы достаточно быстро, чтобы успеть сделать КТ и ввести тромболитик.
Альтеплаза — первый одобренный препарат для тромболизиса при ишемическом инсульте; долгое время она оставалась «золотым стандартом». Это синтетический (рекомбинантный) вариант человеческого тканевого активатора плазминогена. Препарат избирательно связывается с фибрином в тромбе, превращает плазминоген в плазмин, который расщепляет фибрин и восстанавливает кровоток. Важно, что альтеплаза требует введения капельницей в течение часа.
Ее более современный аналог — Тенектеплаза. Это модифицированная версия того же белка с тремя ключевыми аминокислотными заменами, которые делают ее устойчивее к естественным ингибиторам в крови, поэтому достаточно однократного введения инъекцией. Это преимущество ускоряет процесс, что критически важно при последующем переходе к эндоваскулярному вмешательству.
При лечении ишемических инсультов в некоторых странах, включая Россию и государства Восточной Европы, продолжают применяться пептидные препараты типа Церебролизина и Кортексина. Эти средства позиционируются как нейропротекторы, способные защитить мозг от повреждений в острейший период. Однако клинические исследования говорят об обратном [22].
Анализ показал, что добавление Церебролизина или его аналога Кортексина к стандартной терапии (антиагреганты, контроль давления) не снижает общую смертность в течение 90 дней после инсульта. Более того, было выявлено увеличение риска серьезных нефатальных осложнений (таких как инфаркт миокарда, пневмония или тромбоэмболии) у пациентов, получавших Церебролизин. Учитывая отсутствие доказанной пользы, потенциальный риск нежелательных явлений и этические вопросы дальнейших испытаний, где пациенты получают препарат без ожидаемой выгоды, напрашивается вывод о нецелесообразности рутинного применения этих пептидных препаратов при остром ишемическом инсульте.
Помимо пептидных препаратов, в клинических исследованиях не показали эффективности многие другие группы соединений: антиоксиданты, ноотропы (например, пирацетам), блокаторы NMDA-рецепторов, кальциевые антагонисты (нимодипин, никардипин, фародипин). На каждый из этих классов возлагались большие надежды после успеха в доклинических исследованиях [23], где они показывали хорошие результаты по восстановлению животных после экспериментального инсульта, но все они не оправдались [24].
Реабилитация после инсульта
В первые месяцы после инсульта даже при наилучшем раскладе проблемы с балансом, головокружение и неустойчивость при ходьбе остаются серьезными барьерами для возвращения к обычной жизни. Современная реабилитация предлагает два перспективных подхода для борьбы с этими последствиями: вестибулярную реабилитацию и тренировки с использованием виртуальной реальности [20], [25].
Вестибулярная реабилитация фокусируется на переобучении центральной нервной системы правильно обрабатывать сигналы от вестибулярного аппарата. Пациент выполняет движения головой, удерживая взгляд на неподвижной мишени — это тренирует стабильность взгляда и снижает иллюзию движения окружающего мира. Другие упражнения направлены на улучшение баланса: перенос веса тела в разных направлениях, удержание равновесия в стойке с уменьшенной опорой или с закрытыми глазами, что заставляет организм больше полагаться на вестибулярные сигналы. Также практикуется специфическая ходьба — с изменениями скорости, направления, поворотами, иногда на слегка неустойчивых поверхностях или с синхронными движениями головы.
Другой подход — тренировки с виртуальной реальностью. Пациент взаимодействует с виртуальным миром через специальное оборудование. Например, становясь на платформу-балансир. Его задача — выполнить игровое задание: пройти по узкому виртуальному мосту, маневрировать на лыжной трассе, удержать равновесие на качающейся платформе или «поймать» объекты, смещая центр тяжести. Система в реальном времени визуализирует последствия движений пациента. Эта немедленная и наглядная обратная связь позволяет пациенту осознанно корректировать свою позу и движения. Программа постепенно усложняется — увеличивается скорость, добавляются отвлекающие факторы или уменьшается виртуальная опора [25]. Выбор оптимального метода зависит от ведущей проблемы пациента: при выраженном головокружении предпочтение стоит отдать вестибулярной терапии, а при приоритете восстановления устойчивости и ходьбы — виртуальной реальности. Их комбинация также может быть перспективной, обеспечивая комплексное воздействие на ключевые постинсультные нарушения. Ключ к успеху — систематичность занятий и прогрессивное усложнение задач под руководством специалиста.
Механические повреждения нервной ткани
Механические повреждения возникают при прямом физическом воздействии — ударах, сдавлениях или разрывах нервной ткани. Черепно-мозговая или спинномозговая травма не только разрушает нейроны и их отростки, но и запускает каскад вторичных процессов: отек, нарушение кровоснабжения и нейровоспаление.
Главная проблема восстановления — природные ограничения ЦНС. В отличие от периферических нервов, нейроны головного и спинного мозга почти не регенерируют. Виной тому особые белки (Nogo-A, MAG, Omgp [26]), которые в норме стабилизируют нейронные сети для их корректной работы, но после травмы блокируют рост новых аксонов. Они активируют внутриклеточные сигналы, буквально «тормозя» восстановление.
Травмы центральной нервной системы делятся на два типа: черепно-мозговые травмы и травмы спинного мозга.
Черепно-мозговые травмы возникают при ударе по голове. По тому, повреждены ли кости черепа, их разделяют на открытые и закрытые. Открытые травмы опасны прямым повреждением мозга и риском заражения. Закрытые травмы возникают при ударе без перелома костей; повреждение мозга происходит из-за его смещения внутри черепа, что приводит к ушибам, разрыву нервных волокон, сдавлению отеком или гематомой. Тяжесть ЧМТ может быть разной: от легкого сотрясения с временными симптомами до тяжелых повреждений с кровоизлияниями и отеком, которые вызывают долговременные, иногда пожизненные нарушения.
ЧМТ часто нарушают циркуляцию спинномозговой жидкости, чьи амортизирующие свойства в норме смягчают удары. Травма может спровоцировать спайки, блокирующие отток ликвора и ведущие к посттравматической гидроцефалии — опасному скоплению жидкости в желудочках мозга. Переломы основания черепа иногда создают ликворные фистулы — каналы для истечения спинномозговой жидкости через нос или уши, значительно повышая риск бактериального менингита [27], [28].
Травмы спинного мозга случаются при повреждении позвоночника. Их тоже можно разделить на проникающие (когда нарушается целостность позвоночного канала, и мозг повреждается напрямую) и закрытые (повреждение возникает из-за смещения, сдавления позвонками или кровоизлияния). Очень важно, на каком уровне произошла травма — шейном, грудном или пояснично-крестцовом. Чем выше повреждение, тем серьезнее последствия: травмы шеи могут затронуть дыхание и движение всех конечностей, в то время как травмы поясницы влияют в основном на ноги и функции таза (рис. 5).
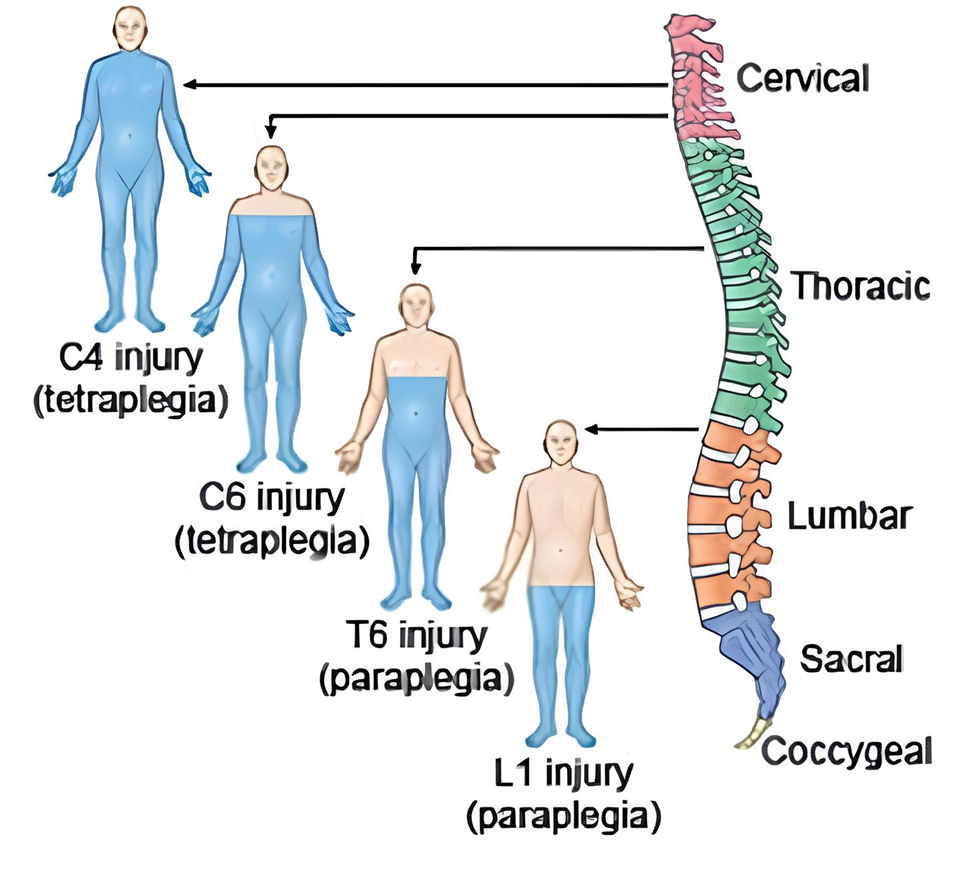
Рисунок 5. Нарушение иннервации туловища в зависимости от уровня повреждения спинного мозга.
Диагностика травм ЦНС
Врачи оценивают состояние пациентов с травмами ЦНС при помощи специальных шкал. При черепно-мозговых травмах применяют шкалу комы Глазго [29], которая по реакции глаз, речи и движений позволяет определить тяжесть состояния. Для спинальных травм используют шкалу ASIA [30], оценивающую сохранность мышечной силы и чувствительности. Когда состояние пациента стабилизируется, для прогноза восстановления применяют шкалу исходов Глазго [31], показывающую общий уровень реабилитации, и более детальную шкалу MPAI [32], учитывающую когнитивные функции и способность к повседневной деятельности.
При ударе по голове врачи сразу проверяют реакцию по шкале Глазго. Они смотрят, как человек открывает глаза, говорит и двигается. Эти проверки повторяют каждые 4 часа, чтобы заметить ухудшение.
Для диагностики травмы делают КТ. Ищут кровоизлияния, переломы черепа или смещение мозга. Если состояние пациента вдруг становится хуже — например, он перестает отвечать на вопросы, у него расширяются или становятся разными по размеру зрачки — снимок КТ делают срочно повторно, чтобы не пропустить новое кровотечение или нарастающий отек.
Для оценки ликвородинамики и при подозрении на инфекционный процесс после травмы выполняют люмбальную пункцию. Повышенный уровень белка и увеличение числа лейкоцитов в ликворе свидетельствуют о воспалении или инфекции [27], [28].
Лечение травм ЦНС
Лечение при травме головы всегда зависит от того, что показали осмотр и снимки. Если внутри черепа обнаруживается большое скопление крови, угрожающее жизни, или мозг сильно сдавлен из-за отека, необходима операция. Хирурги удаляют кровяной сгусток, а иногда временно убирают небольшой участок кости черепа, чтобы дать опухшему мозгу пространство и снизить опасное давление. Если основная проблема — отек мозга, врачи могут назначить капельницы с особыми растворами (например, концентрированной соленой водой), которые помогают «вытянуть» лишнюю жидкость из мозговой ткани [27], [28].
Нарушения циркуляции ликвора требуют направленной терапии. Посттравматическую гидроцефалию корригируют хирургически, чаще всего установкой вентрикулоперитонеального шунта: тонкую силиконовую трубку проводят от желудочков мозга в брюшную полость, где ликвор безопасно всасывается. При ликворных фистулах начальная тактика включает строгий постельный режим, чтобы дать фистуле зарасти самой; при сохранении истечения более 3–5 дней показано хирургическое закрытие дефекта.
При повреждении спины врачи проверяют чувствительность кожи и силу мышц в конечностях. Это помогает понять уровень травмы. Для точной диагностики делают снимки: рентген покажет переломы, МРТ — повреждение нервов или дисков.
Лечение травмы спинного мозга преследует две главные цели: снять давление с нервной ткани и стабилизировать поврежденный позвоночник, чтобы предотвратить новые повреждения. Если на снимках видно, что спинной мозг или нервные корешки сдавлены костным фрагментом или смещенным позвонком, и есть неврологические нарушения (слабость, потеря чувствительности), часто требуется срочная операция. Хирурги осторожно удаляют то, что давит на нервы, и фиксируют позвонки специальными металлическими конструкциями, чтобы позвоночник был стабильным. Если операция не нужна сразу или как первый этап, позвоночник обездвиживают жестким корсетом или воротником.
В современном мире в диагностику и лечение травм центральной нервной системы, особенно черепно-мозговых, активно внедряются новые технологии [33]. Искусственный интеллект уже доказал свою силу в анализе медицинских изображений: алгоритмы глубокого обучения с высокой точностью выявляют на КТ и МРТ критические изменения — внутричерепные кровоизлияния, переломы черепа или признаки дислокации мозга. Это не просто автоматизация рутины: ИИ снижает риск человеческих ошибок, например, пропуска сопутствующих патологий из-за «удовлетворения поиском», и ускоряет принятие решений о срочной операции или госпитализации.
Однако в интенсивной терапии, где требуется интерпретация динамических и разнородных данных, технологии сталкиваются с вызовами: сложность валидации, недостаточная прозрачность работы алгоритмов и нехватка стандартизированных наборов данных для обучения.
Восстановление поврежденной мозговой ткани
Миф о том, что нервные клетки не восстанавливаются, давно уже развеян: изучены стволовые нервные клетки и естественные процессы обновления нервной ткани в некоторых областях ЦНС. Однако восстановление поврежденной мозговой ткани после травм или сосудистых катастроф — немного другая история [34]. Хотя решения пока нет, последние исследования дают надежду на серьезный прогресс в этой области.
Восстановление нейронов требует устойчивой доставки нейротрофических факторов (BDNF, NGF, NT-3) — ключевых молекул для роста аксонов и возобновления нервных связей. Однако естественный период жизни этих факторов в организме очень короток, а гематоэнцефалический барьер серьезно ограничивает их попадание в поврежденную зону. Прямые инъекции часто не работают, вещества быстро рассеиваются, не успевая оказать значимый эффект.
Для преодоления этих ограничений используют наночастицы. Липидные и полимерные наночастицы размером менее 180 нм эффективно проникают через барьер, доставляя нейротрофические факторы BDNF, NGF и NT-3 прямо к очагу поражения. Доклинические исследования подтверждают их потенциал: BDNF активирует путь BDNF-TrkB-CREB, восстанавливая миелиновые оболочки; NGF стимулирует рост аксонов; NT-3 улучшает двигательные функции, реорганизуя нейронные сети. Результатом становится восстановление подвижности и снижение воспаления.
Стволовые клетки, в частности мезенхимальные (МСК) и нейральные (НСК), демонстрируют значительный потенциал для лечения травм спинного мозга [35]. Их ключевое преимущество — способность к длительной секреции нейротрофических факторов после генетической модификации. Клетки, модифицированные для экспрессии BDNF, NT-3 или GDNF, обеспечивают локальную доставку этих белков в зону повреждения, что подтверждено экспериментами на животных.
Однако трансплантированные клетки склонны мигрировать из-за тока спинномозговой жидкости и воспалительных процессов. Для решения этой проблемы применяют биоматериальные каркасы: коллагеновые, фибриновые, хитозановые или синтетические полимеры. Эти структуры обеспечивают пролонгированное высвобождение нейротрофинов и создают матрицу для роста аксонов. В исследованиях на крысах и собаках комбинация модифицированных клеток с каркасами сокращала объем поражения, увеличивала плотность миелинизированных аксонов и улучшала двигательные функции. Критическое ограничение — неэффективность метода при полных анатомических разрывах спинного мозга. Тем не менее, стратегия комбинирования генетически модифицированных стволовых клеток с биоматериалами остается перспективным направлением для восстановления частично поврежденного спинного мозга.
Хотя оптимальное время начала терапии и необходимая длительность поддержки требуют дальнейшего изучения, эти стратегии успешно решают главные проблемы доставки. Убедительные доклинические результаты обеспечивают переход многих разработок на стадию клинических испытаний, открывая реальные перспективы для лечения тяжелых повреждений ЦНС, но в клиническую практику эти разработки пока не внедрены.
Заключение
Повреждения центральной нервной системы — одна из самых сложных медицинских проблем нашего времени. Но наука не стоит на месте: современные методы лечения становятся все более точными и эффективными.
Сегодня у врачей есть целый арсенал средств — от экстренной тромболитической терапии при инсультах до микрохирургических операций при аневризмах. А на горизонте уже видны новые перспективные направления: клеточная терапия, таргетная нейропротекция, персонализированные подходы к лечению.
Даже при серьезных повреждениях нервная система сохраняет некоторую способность к восстановлению. Ключевые факторы успеха — своевременная помощь и грамотная реабилитация.
Будущее в этой области медицины выглядит обнадеживающе. Ученые продолжают раскрывать механизмы работы мозга, разрабатывать новые методы диагностики и лечения. И хотя до полной победы над повреждениями ЦНС еще далеко, каждый новый день приносит нам все больше возможностей помогать тем, кто в этом нуждается.
Литература
- Dianna M. Milewicz, Alan C. Braverman, Julie De Backer, Shaine A. Morris, Catherine Boileau, et. al.. (2021). Marfan syndrome. Nat Rev Dis Primers. 7;
- Fransiska Malfait, Clair Francomano, Peter Byers, John Belmont, Britta Berglund, et. al.. (2017). The 2017 international classification of the Ehlers–Danlos syndromes. American J of Med Genetics Pt C. 175, 8-26;
- Justyna Chojdak-Łukasiewicz, Edyta Dziadkowiak, Sławomir Budrewicz. (2021). Monogenic Causes of Strokes. Genes. 12, 1855;
- Болезнь Фабри: частая среди редких;
- Хороший, плохой, злой холестерин;
- Ликбез по ЦНС;
- Билич Г. Л., Крыжановский В. А. Атлас анатомии человека. В 3-х томах. Том 2: Внутренние органы. М.: «ГЭОТАР-Медиа», 2013. — 824 с.;
- Крылов В.В., Природов А.В. Аневризмы сосудов головного мозга. Неврология. 1, 3–8;
- Junjie Zhao, Hao Lin, Richard Summers, Mingmin Yang, Brian G. Cousins, Janice Tsui. (2018). Current Treatment Strategies for Intracranial Aneurysms: An Overview. Angiology. 69, 17-30;
- Clémence Maupu, Héloïse Lebas, Yacine Boulaftali. (2022). Imaging Modalities for Intracranial Aneurysm: More Than Meets the Eye. Front. Cardiovasc. Med.. 9;
- Borislav Radić. (2021). Diagnostic and Therapeutic Dilemmas in the Management of Intracranial Aneurysms. ACC;
- Sh.Sh. Eliava, S.B. Yakovlev, Yu.V. Pilipenko, An.N. Konovalov, K.G. Mikeladze, et. al.. (2021). Unruptured asymptomatic brain aneurysms: modern approaches to the choice of surgical method and treatment outcomes. Vopr. neirokhir.. 85, 6;
- Minna Niskanen, Timo Koivisto, Jaakko Rinne, Antti Ronkainen, Sanna Pirskanen, et. al.. (2005). Complications and Postoperative Care in Patients Undergoing Treatment for Unruptured Intracranial Aneurysms. Journal of Neurosurgical Anesthesiology. 17, 100-105;
- David Hasan, Nohra Chalouhi, Pascal Jabbour, Tomoki Hashimoto. (2012). Macrophage imbalance (M1 vs. M2) and upregulation of mast cells in wall of ruptured human cerebral aneurysms: preliminary results. J Neuroinflammation. 9;
- Lingmin Shao, Xingping Qin, Jia Liu, Zhihong Jian, Xiaoxing Xiong, Renzhong Liu. (2017). Macrophage Polarization in Cerebral Aneurysm: Perspectives and Potential Targets. Journal of Immunology Research. 2017, 1-7;
- David M. Hasan, Robert M. Starke, He Gu, Katina Wilson, Yi Chu, et. al.. (2015). Smooth Muscle Peroxisome Proliferator–Activated Receptor γ Plays a Critical Role in Formation and Rupture of Cerebral Aneurysms in Mice In Vivo. Hypertension. 66, 211-220;
- Unnithan A., Das J., Mehta P. Hemorrhagic Stroke. Treasure Island (FL): StatPearls Publishing, 2025;
- Steven M. Greenberg, Wendy C. Ziai, Charlotte Cordonnier, Dar Dowlatshahi, Brandon Francis, et. al.. (2022). 2022 Guideline for the Management of Patients With Spontaneous Intracerebral Hemorrhage: A Guideline From the American Heart Association/American Stroke Association. Stroke. 53;
- Kangping Song, Min Guan, Wenxian Li, Zhen Jing, Xiaomei Xie, et. al.. (2019). Acute ischemic stroke patients with diffusion-weighted imaging-Alberta Stroke Program Early Computed Tomography Score ≤ 5 can benefit from endovascular treatment: a single-center experience and literature review. Neuroradiology. 61, 451-459;
- Кулеш, С.Д., Васильчук, Л.Ф., Хоперский, П.Г., Мальевская, А.С.. (2023). Mechanical Thrombectomy in Ischemic Stroke: Current State of the Problem. Literature Review. Неврология и нейрохирургия. Восточная Европа. 422-428;
- Brian Scott Alper, Gary Foster, Lehana Thabane, Alex Rae-Grant, Meghan Malone-Moses, Eric Manheimer. (2020). Thrombolysis with alteplase 3–4.5 hours after acute ischaemic stroke: trial reanalysis adjusted for baseline imbalances. BMJ EBM. 25, 168-171;
- Liliya Eugenevna Ziganshina, Tatyana Abakumova, Dilyara Nurkhametova, Kristina Ivanchenko. (2023). Cerebrolysin for acute ischaemic stroke. Cochrane Database of Systematic Reviews. 2023;
- Neha Dhir, Bikash Medhi, Ajay Prakash, Manoj Kumar Goyal, Manish Modi, Sandeep Mohindra. (2020). Pre-clinical to Clinical Translational Failures and Current Status of Clinical Trials in Stroke Therapy: A Brief Review. CN. 18, 596-612;
- Grace YY Chia, Selvie Yeo, Jamie SY Ho, Eric Jou, Leonard LL Yeo, Benjamin YQ Tan. (2023). Neuroprotective agents in acute ischemic stroke. Explor Neuroprot Ther. 47-70;
- Vishal Sana, Misbah Ghous, Muhammad Kashif, Abdulaziz Albalwi, Rashida Muneer, Mahnoor Zia. (2023). Effects of vestibular rehabilitation therapy versus virtual reality on balance, dizziness, and gait in patients with subacute stroke: A randomized controlled trial. Medicine. 102, e33203;
- E. A. Kovrazhkina, L. V. Stakhovskaya, O. D. Razinskaya, A. V. Serdyuk. (2018). Inhibitors of CNS regeneration, their physiological role and participation in pathogenesis of diseases. Z. nevrol. psikhiatr. im. S.S. Korsakova. 118, 143;
- Vivek Sanker, Mrinmoy Kundu, Sarah El Kassem, Ahmad El Nouiri, Mohamed Emara, et. al.. (2023). Posttraumatic hydrocephalus: Recent advances and new therapeutic strategies. Health Science Reports. 6;
- Mathias T., Levy J., Fatakia A., McCoul ED. (2016). Contemporary Approach to the Diagnosis and Management of Cerebrospinal Fluid Rhinorrhea. Ochsner J. 16, 136–142;
- Matis G., Birbilis T. (2008). The Glasgow Coma Scale—a brief review. Past, present, future. Acta Neurol Belg. 108, 75–89;
- Baranowski P. (2000). Application of the International Standards for the Neurological and Functional Classification of Spinal Cord Injuries (the ASIA scale). Ortop Traumatol Rehabil. 30, 31–34;
- Lindsay Wilson, Kim Boase, Lindsay D. Nelson, Nancy R. Temkin, Joseph T. Giacino, et. al.. (2021). A Manual for the Glasgow Outcome Scale-Extended Interview. Journal of Neurotrauma. 38, 2435-2446;
- David L. Ripley, Cindy Harrison-Felix, Melissa Sendroy-Terrill, Christopher P. Cusick, Amy Dannels-McClure, Clare Morey. (2008). The Impact of Female Reproductive Function on Outcomes After Traumatic Brain Injury. Archives of Physical Medicine and Rehabilitation. 89, 1090-1096;
- Maria José Uparela-Reyes, Lina María Villegas-Trujillo, Jorge Cespedes, Miguel Velásquez-Vera, Andrés M. Rubiano. (2024). Usefulness of Artificial Intelligence in Traumatic Brain Injury: A Bibliometric Analysis and Mini-review. World Neurosurgery. 188, 83-92;
- Aikeremujiang Muheremu, Li Shu, Jing Liang, Abudunaibi Aili, Kan Jiang. (2021). Sustained delivery of neurotrophic factors to treat spinal cord injury. Translational Neuroscience. 12, 494-511;
- Bogdan Costăchescu, Adelina-Gabriela Niculescu, Marius Gabriel Dabija, Raluca Ioana Teleanu, Alexandru Mihai Grumezescu, Lucian Eva. (2022). Novel Strategies for Spinal Cord Regeneration. IJMS. 23, 4552.