Болезнь Фабри: частая среди редких
14 апреля 2023
Болезнь Фабри: частая среди редких
- 2751
- 0
- 8
Редкость орфанных заболеваний порой заставляет пациента чувствовать себя ребенком, заблудившимся в лесу непонятных и пугающих симптомов.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
-
Иллюстратор
Термин «орфанные заболевания» в этом году отмечает свое сорокалетие, однако многие болезни из этого класса патологий были впервые описаны еще до начала XX века. В новой статье нашего Спецпроекта, посвященного проблеме редких недугов, мы расскажем об одном из представителей обширной группы лизосомных болезней накопления, носящем имя немецкого дерматолога Йоханнеса Фабри. Сегодня мы постараемся разобраться с тем, почему пословица «много — не мало» в реальности далеко не всегда оказывается правдивой.
Орфанные заболевания

Пациенты с орфанными заболеваниями страдают в одиночестве и смятении. Они чувствуют себя изгоями «стандартной» медицины. Мечты о том, что их заболевание «усыновит» какая-нибудь компания, и лекарство, наконец, будет разработано — то, что не дает им впасть в отчаяние.
Статья создана при поддержке «Петровакс» — биотехнологической компании полного цикла.
Стратегия компании направлена на разработку, развитие производства и импортозамещение лекарственных средств и вакцин для лечения социально значимых заболеваний, таких как орфанные, онкологические, аутоиммунные и инфекционные.
В 1897 году в городскую больницу Дортмунда за помощью обратился 13-летний подросток по имени Эмиль Хонке. Его беспокоили небольшие, похожие на сыпь узелки фиолетового цвета, разросшиеся по задней поверхности коленного сустава. Симптом появился в девятилетнем возрасте; со временем эта «сыпь» распространилась на бедра и вверх, на туловище. Поначалу это было единственной жалобой, но, взрослея, маленький Эмиль становился все слабее, стал меньше двигаться и все чаще отказывался от пищи. Само по себе состояние кожи не доставляло ему дискомфорта — ни зуда, ни жжения, ни боли ребенок не испытывал. Мать и отец Эмиля были вполне здоровы, однако после расспросов доктора вспомнили, что дед мальчика по отцовской линии умер в 49 лет от почечной недостаточности. К сожалению, в 90-х годах XIX века подобный комментарий не мог серьезно заинтересовать врачей. Генетические законы Грегора Менделя были «воскрешены» примерно в это же время, но работы де Фриза, Корренса и Чермака еще не успели обратить на себя внимание диагностов.
Опубликованные в 1866 году, работы Менделя не снискали славы среди современников прямо «здесь и сейчас». Принципы наследования стали важным инструментом объяснения множества биологических явлений лишь спустя три десятка лет, после подтверждения их корректности тремя независимыми исследователями [1].
Осмотрев Эмиля, дерматолог Йоханнес Фабри описал состояние пациента как случай узелковой геморрагической пурпуры — одного из распространенных воспалительных заболеваний стенок сосудов. Фабри наблюдал за состоянием мальчика в стационаре на протяжении нескольких дней и не нашел серьезных причин задерживать ребенка в больнице еще дольше. И когда спустя 17 лет Хонке вновь появился на пороге клиники, жалуясь на ухудшение здоровья, удивлению доктора не было предела (рис. 1) [2].
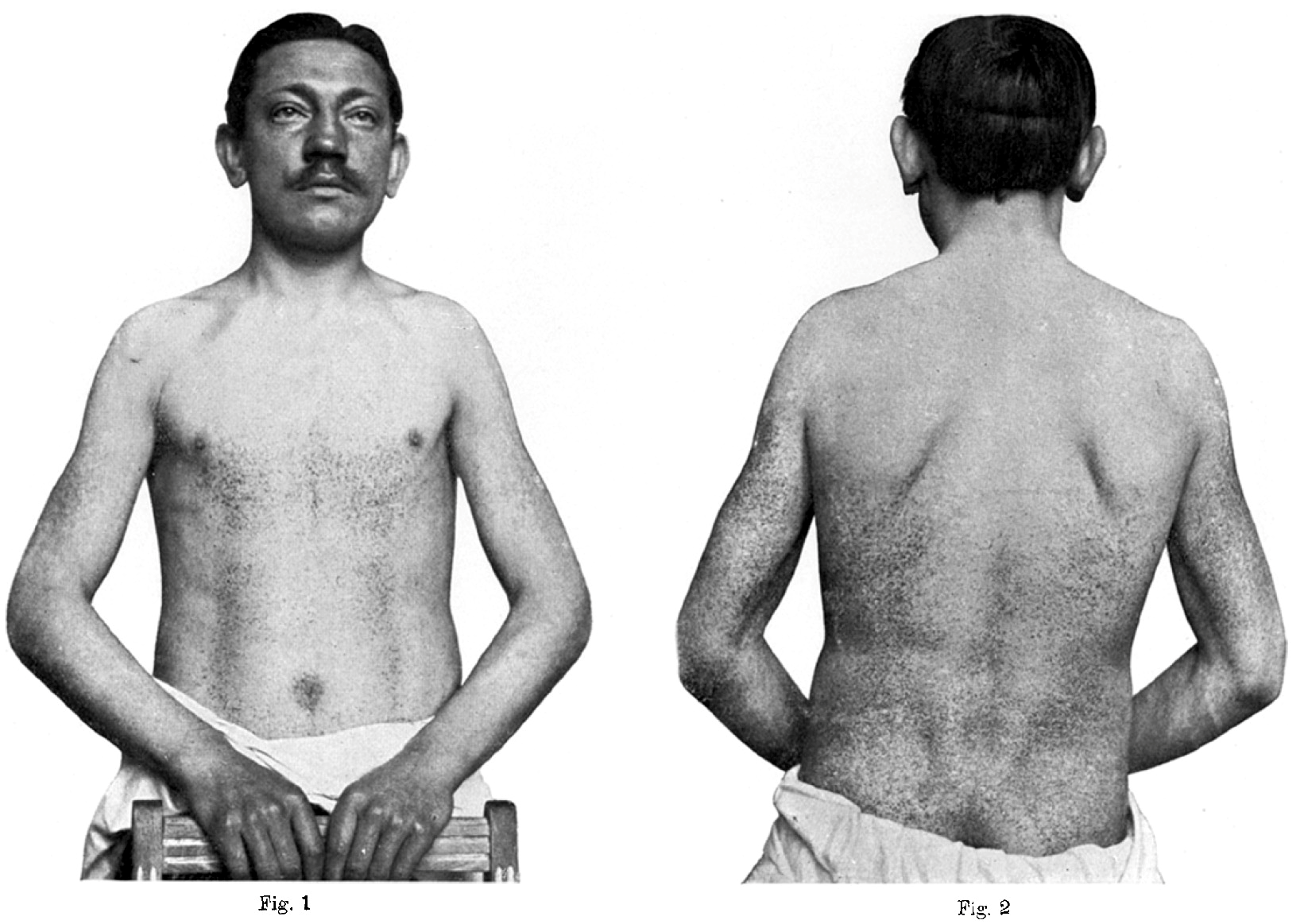
Рисунок 1. Эмиль Хонке во время второго визита к доктору Фабри.
Мы полностью потеряли этот случай из виду и, конечно, были очень удивлены, когда в этом году пациент снова явился на обследование. Симптомы явно прогрессировали за это время: пурпура распространилась на всю спину и руки. Однако из анамнеза следует подчеркнуть, что кожное заболевание не помешало ему заниматься своей профессией маляра и шахтера.
Йоханнес Фабри: «О клинике и этиологии ангиокератомы», 1916 г. [2]
На этот раз пациент был обследован тщательнее, и Фабри удалось обнаружить в моче пациента альбумин, что явно указывало на заболевание почек. Однако доктор не придал этой находке внимания. В конце XIX века дерматология все еще оставалась преимущественно описательной наукой, а важность сопутствующих симптомов и взаимосвязь между ними были чаще всего неизвестны. Фабри заключил, что вряд ли состояние пациента напрямую угрожает его жизни, но и надежды на излечение почти не было, — ведь патологические изменения кожи с годами лишь усиливались. В самом конце своей жизни Фабри вернулся к размышлениям об этом случае и предположил, что проблемы его загадочного пациента могут быть связаны с эмбриональными пороками развития, но приблизиться к разгадке такой подход не помог. Эмиль Хонке умер в 43 года, так и не узнав истинную причину своего недуга. Доктор пережил своего пациента на два года и в своих записях лишь отметил, что причиной смерти послужила неуточненная патология легких. Вероятно, мы уже никогда не узнаем, было ли это связано с тем самым редким заболеванием или нет; природа недуга Хонке осталась загадкой и для самого Фабри. Наследственная природа болезни, унаследовавшей имя доктора Фабри, была открыта лишь в 1965 году благодаря классическим работам Кена Хашимото — спустя 37 лет после смерти пациента [3].
Современная медицина относит болезнь Фабри (БФ) к лизосомным болезням накопления (ЛБН) — одной из самых обширных групп орфанных заболеваний (см. врезку далее). Патология связана с нарушениями функции лизосом вследствие врожденного дефекта гена GLA, кодирующего α-галактозидазу А (α-GAL) — фермента, ответственного за утилизацию гликосфинголипидов. В норме они входят в состав клеточных мембран, и их углеводная группа отвечает за распознавание клетками друг друга и передачу сигналов между ними. Мутация же нарушает нормальную утилизацию гликосфинголипидов и приводит к их избыточному накоплению [4].
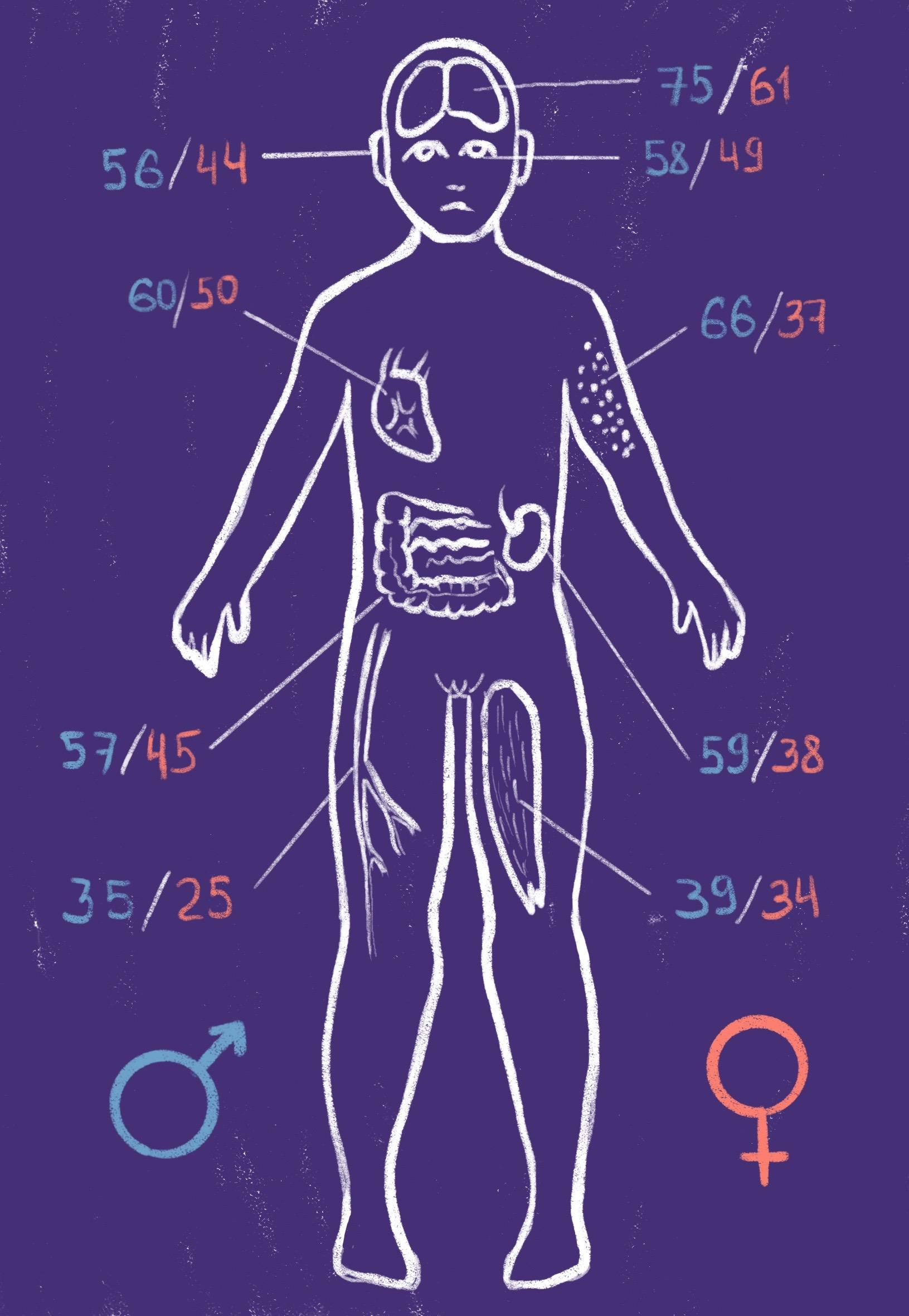
Рисунок 2. Течение болезни Фабри. Полиорганный характер заболевания обусловливает сложность ранней симптоматической диагностики вследствие большого количества вовлеченных в патогенез органов и тканей. Цифры на рисунке соответствуют процентовке встречаемости поражений того или иного органа/системы у пациентов (синим цветом обозначены процентные значения для мужчин, красным — для женщин).
рисунок Валерии Кузык по [5]
Гликосфинголипиды входят в состав всех клеточных мембран, а значит, многие органы могут быть подвержены заболеванию, однако с разной интенсивностью. Наиболее частые симптомы — неврологические. Также нередко у больных отмечаются сердечно-сосудистые, глазные, желудочно-кишечные, дерматологические, слуховые и почечные проявления. До начала XX века основными причинами смерти среди пациентов с болезнью Фабри были почечная недостаточность у мужчин (42%) и цереброваскулярные заболевания у женщин (25%). Появление ферментозаместительной терапии (ФЗТ) изменило эту картину: после 2007 года сердечно-сосудистые заболевания были основной причиной смерти как у мужчин (34%), так и у женщин (57%). Если бы Эмилю Хонке повезло родиться в наше время, смерть его деда от болезни почек, безусловно, насторожила бы докторов (рис. 2) [5].
Безусловно, пациентам с болезнью Фабри приходится сталкиваться с проблемами, общими для всех людей с орфанными заболеваниями — мы рассказали об этом подробно в вводной статье спецпроекта «Редко, но метко: орфанные заболевания как вызов современной медицине» [6]. Нехватка эпидемиологических данных, сложность дифференциальной диагностики и высокая стоимость лекарств — это лишь немногое, с чем сталкивается человек, обремененный редкой патологией. Однако в случае БФ есть ряд проблем, стоящих особняком. Зачастую причиной обращения к доктору служит приступообразная боль (криз Фабри) в руках и ногах, причину которой юные пациенты не могут ничем объяснить [7]. Примерно в этом же возрасте (от 5 до 15 лет) начинает проявляться и классический симптом, настороживший родителей Эмиля Хонке. Ангиокератомы в виде группы красно-фиолетовых приподнимающихся над поверхностью кожи очагов обычно располагаются на ягодицах, в паховой области, на пупке и на верхних участках бедер (рис. 3) [8].
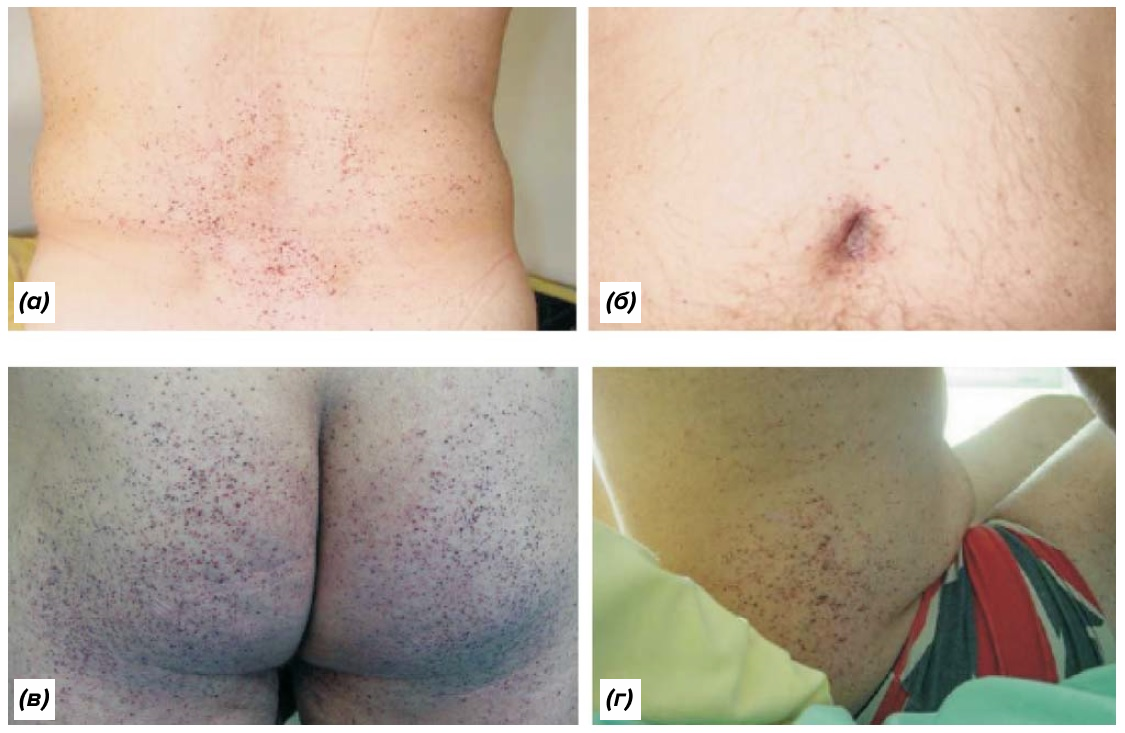
Рисунок 3. Появление ангиокератом — один из наиболее ярких симптомов болезни Фабри. В типичных случаях они располагаются в поясничной области (а), в ягодичных областях (в), в районе паха, на боках (г) и на коже бедер. Реже их распространенность может быть ограничена более локальной зоной, такой как, например, пупок (б).
Болезнь Фабри встречается в различных популяциях по всему миру. Исследователи полагают, что общемировые данные, плавающие от 1:476 000 до 1:117 000, на самом деле могут быть сильно занижены. Например, массовый неонатальный скрининг, проведенный в Италии и Тайване, показал удивительно высокую частоту БФ среди новорожденных мальчиков за счет мутаций, вызывающих нетипичные формы болезни с поздним дебютом. Специалисты считают, что в этих странах болезнь Фабри встречается поразительно часто: у одного из 3100 новорожденных в Италии, в Тайване же показатели заболеваемости вовсе зашкаливали — врачи регистрировали патологию с частотой 1:1500 [9]. Дальнейшие исследования помогли установить, что болезнь Фабри в этих случаях может быть вызвана совершенно разными поломками гена GLA, такими как p.F113L, p.N215S и IVS4+919G>A — a cуммарно их описано уже больше 1000! Ген α-галактозидазы А расположен на длинном плече X-хромосомы и может подвергаться как нонсенс, так и миссенс мутациям, затрагивающими разные сайты белка. Примечательно, что многие из них являются уникальными для каждой семьи. Более того, даже среди кровных родственников учеными были отмечены значительные различия в выраженности симптомов: одна и та же миссенс-мутация вполне могла вызывать как легкую, так и классическую форму болезни [10]. Все это создает дополнительные сложности для прогнозирования течения заболевания, даже если удастся понять, какая именно часть фермента была сломана.
Последняя из перечисленных мутаций — IVS4+919G>A — ответственна за развитие кардиологического типа болезни, проявляющегося в зрелом возрасте. Такой вариант распространен меньше остальных, и, как правило, характерен только для определtнных, когда-то изолированных общин людей. Клиническую же значимость остальных мутаций еще предстоит установить [11]. Разнообразие вариантов генетических поломок и широта поражаемых болезнью систем определяют важность ранней генетической диагностики, которая сейчас применяется лишь в некоторых странах.
Наследование: проблема Х
Болезнь Фабри передается детям от родителей сцеплено с Х-хромосомой. Такой тип наследования предполагает, что мужчины, несущие мутантный ген, способны передавать его только дочерям. Все сыновья больного останутся здоровыми, так как получат от отца Y-хромосому, а X-хромосому унаследуют от здоровой матери. У гетерозиготных по данному признаку женщин вероятность передачи дефектного гена всем потомкам при каждом зачатии будет составлять 50%. В таком случае все сыновья, унаследовавшие дефектный ген, будут страдать болезнью Фабри. Однако ситуация с дочерьми несколько сложнее. Гипотеза Мари Лайон утверждает, что на ранних этапах эмбриогенеза одна из двух копий X-хромосом, имеющихся в клетках самок млекопитающих, становится неспособной к переносу генетической информации с ДНК на РНК. Генетический материал, содержащийся в такой хромосоме, в итоге не будет способен кодировать синтез мутантного белка, и заболевание не разовьется. Логично предположить, что одни дочери в таком случае будут поражены болезнью, а другим повезет остаться бессимптомными носительницами замолчавшей пораженной хромосомы (рис. 5).
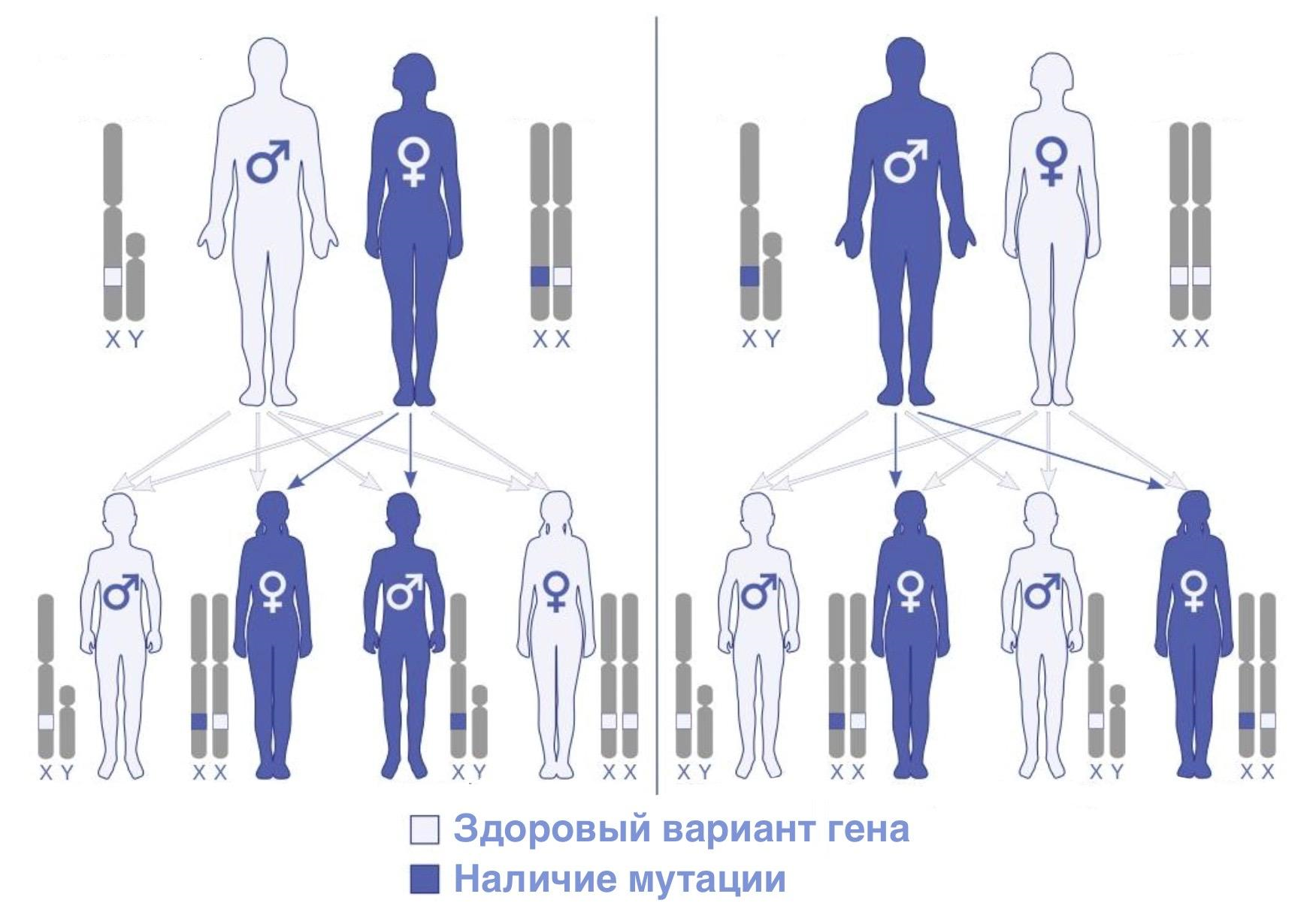
Рисунок 5. Схема Х-сцепленной передачи гена, отвечающего за развитие болезни Фабри. Слева — модель, учитывающая мать-носительницу мутантного гена; справа — модель, показывающая ситуацию, возникающую в случае обнаружения больного отца в семейной истории.
В то же время, результаты современных когортных клинических исследований говорят, что в наследственном механизме передачи болезни Фабри есть еще больше сюрпризов. У женщин, считавшихся когда-то бессимптомными носительницами, в какой-то момент могут проявляться симптомы болезни разной степени тяжести.
Известно, что чаще всего одна из двух Х-хромосом «выключается» в половине соматических клеток женщины, но в некоторых ситуациях этот баланс нарушается, и формируется так называемый мозаичный фенотип [16]. Ученые считают, что такой перекос происходит либо совершенно случайно в процессе эмбриогенеза, либо на более поздних стадиях онтогенеза по причине возникновения мутаций. Анализ экспрессии практически всех генов Х-хромосомы показал, что в среднем около 15% генов избегают выключения и экспрессируются как в активных, так и неактивных Х-хромосомах [17]. В результате у 5–20% на первый взгляд здоровых женщин со временем могут проявляться симптомы из-за феномена перекоса в Х-инактивации. Болезнь может протекать совершенно по-разному, симптоматика и тяжесть зависят от пропорций в возникнувшем дисбалансе между молчащими и активными генами в «больной» и в здоровой хромосоме. Именно этим объясняется столь неоднородное проявление аллеля, отвечающего за развитие патологии — примерно у 70% женщин-носительниц мутантного гена GLA в одной из Х-хромосом проявляются те или иные симптомы болезни Фабри. Кроме того, описаны крайне редкие случаи гомозиготных по мутации пациенток — в обеих хромосомах таких женщин обнаруживались поврежденные гены GLA [18]. Ученые полагают, что причиной тому могли послужить близкородственные браки, и считают, что болезнь у таких пациенток будет протекать гораздо тяжелее. Вообще, причины возникновения наследственных заболеваний довольно часто связаны с эффектом основателя, заключающемся в резком снижении генетического разнообразия вследствие географической или социокультурной изоляции людей. Ярким примером здесь может служить феномен 40 финских наследственных заболеваний, но и болезнь Фабри, по-видимому, не исключение. Широкая группа семейных патологий закрепилась исключительно в популяции этнических финнов примерно 2000–4000 лет назад, мутация же α-галактозидазы А оказалась моложе [19].
Коллектив ученых обратил внимание и на то, что один из вариантов позднего кардиологического фенотипа БФ очень часто встречается среди тайваньских мужчин (с частотой 1 к 1500!). В процессе исследования был проанализирован геном неродственных 33 мужчин, проживающих не только в Тайване, но и в других странах Азии: Китае, Японии, Вьетнаме, Сингапуре, Малайзии и других. Итого был обнаружен общий для всех пациентов гаплотип — группа аллелей в одной половой хромосоме, несущая мутацию IVS4+919G>A. Именно она оказалась ответственна за развитие болезни Фабри по сердечному типу в зрелом возрасте не только у тайваньцев, но и у китайцев и японцев. Выяснилось, что IVS4+919G>A встречается в популяции населения Юго-Восточной Азии значительно чаще, чем все другие варианты генетических поломок, связанных с БФ. Анализ генетических карт гаплотипов привел ученых к удивительному выводу — обнаруженная мутация возникла у одного-единственного человека примерно 800 лет назад и впоследствии закрепилась у населения чуть ли не всех стран Азии. Прийти к такому смелому выводу авторам работы помог факт проживания в Китае рядом с основателем мутационной линии IVS4+919G>A носителей огромного количества разнообразных гаплотипов, не затронутых этой поломкой, в то время как все носители мутации обладали одним и тем же гаплотипом.
Генетическая колода тасуется причудливо: мы можем утверждать, что очень разные люди проживали на одной территории в одно и то же время и, казалось бы, большинство вариантов развития событий привело бы к растворению этого фенотипа в ряду поколений. Однако в реальности жизнь распорядилась иначе. Математически низкие шансы совсем не помешали возникнувшей в одном человеке мутации за 800 лет захватить популяцию большинства азиатских стран и сделать кардиологический тип наиболее распространенным вариантом болезни Фабри в Азии [20].
Диагностика: дела семейные
Диагностика болезни Фабри может быть разнонаправленной и учитывать различные аспекты проявления патологии в зависимости от выраженности симптомов и пола пациента. Назначение ферментозаместительной терапии возможно только в том случае, если болезнь подтверждена сразу целым спектром методов: определением активности α-галактозидазы А, анализом клинических проявлений, наличием заболевания у родственников, а также по данным гистологических исследований. Неонатальный скрининг новорожденных на наличие мутации, к сожалению, проводится довольно редко и применяется сейчас лишь в Италии, Тайване и Японии. Ранняя диагностика важна: на сегодняшний день получены убедительные доказательства значительной эффективности начала терапии в детском возрасте по сравнению с более поздними назначениями ФЗТ, когда часть органов уже повреждена [21].
До назначения сложных лабораторных испытаний стоит начать с составления подробной родословной пациента. В российской популяции БФ была диагностирована почти у половины из 292 обследованных членов семей пациентов с диагнозом болезни Фабри. К сожалению, значительная доля таких успешных случаев скрининга приходится на пациентов диализных центров. Это ярко свидетельствует о слишком позднем выявлении патологии, когда почки больного уже не справляются самостоятельно со своей функцией (рис. 6) [22].
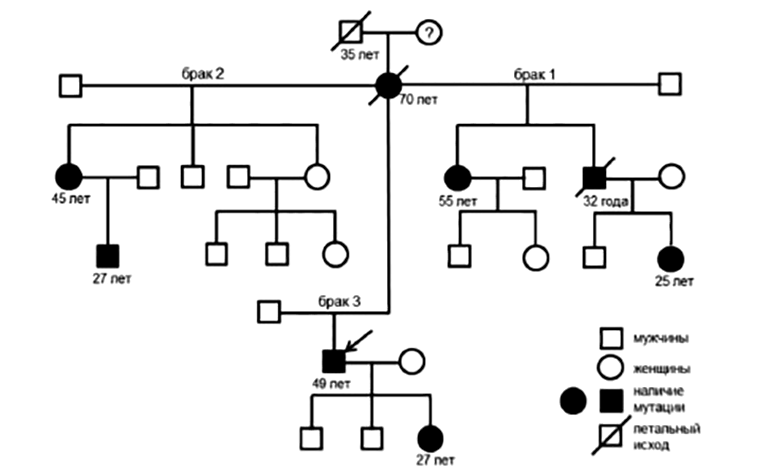
Рисунок 6. Родословная 49-летнего пациента с БФ, диагностированной при скрининге в диализных отделениях. Дед пробанда умер в 35 лет от заболевания сердца (со слов пациента), брат — в возрасте 32 лет от осложнений хронической почечной недостаточности. У 27-летней дочери и 25-летней племянницы выявлена такая же мутация гена GLA и снижение активности α-галактозидазы А при отсутствии клинических проявлений БФ. У младшей сестры (45 лет) также обнаружена мутация гена GLA. При сборе анамнеза установлено, что у пациентки с детства отмечались нейропатические боли в кистях и стопах и сниженное потоотделение. Пациентке рекомендовано начало ФЗТ. Старшая сестра (55 лет) также с 10 лет отмечала нейропатические боли в руках и ногах и боли в крупных суставах. При обследовании выявлена та же мутация GLA, начальные признаки поражения почек и сердца. Племянник с такой же мутацией GLA и сниженной активностью α-галактозидазы А с 5 лет отмечал жгучие боли в кистях и стопах и плохую переносимость жаркой погоды. Таким образом, диагноз БФ был поставлен пяти родственникам пробанда, давно жаловавшимся на симптомы, но не проходившим ранее обследование.
Знание об Х-сцепленном механизме наследования и на ранних этапах позволяет исключить из диагностики родственников, у которых генетическое исследование не имеет смысла. Например, при БФ мутантный ген, расположенный на Х-хромосоме, не передается от отца сыну. Этот, казалось бы, наглядный и простой прием все же имеет несколько тонкостей. Например, нам нужно помнить о возможности наличия рассмотренного выше мозаичного фенотипа у женщин — ведь отсутствие симптомов далеко не всегда исключает диагноз БФ. Кроме того, на практике периодически приходится сталкиваться с утаиванием пациентами фактов о биологическом отцовстве, что может серьезно запутать ситуацию в семейном скрининге женщин.
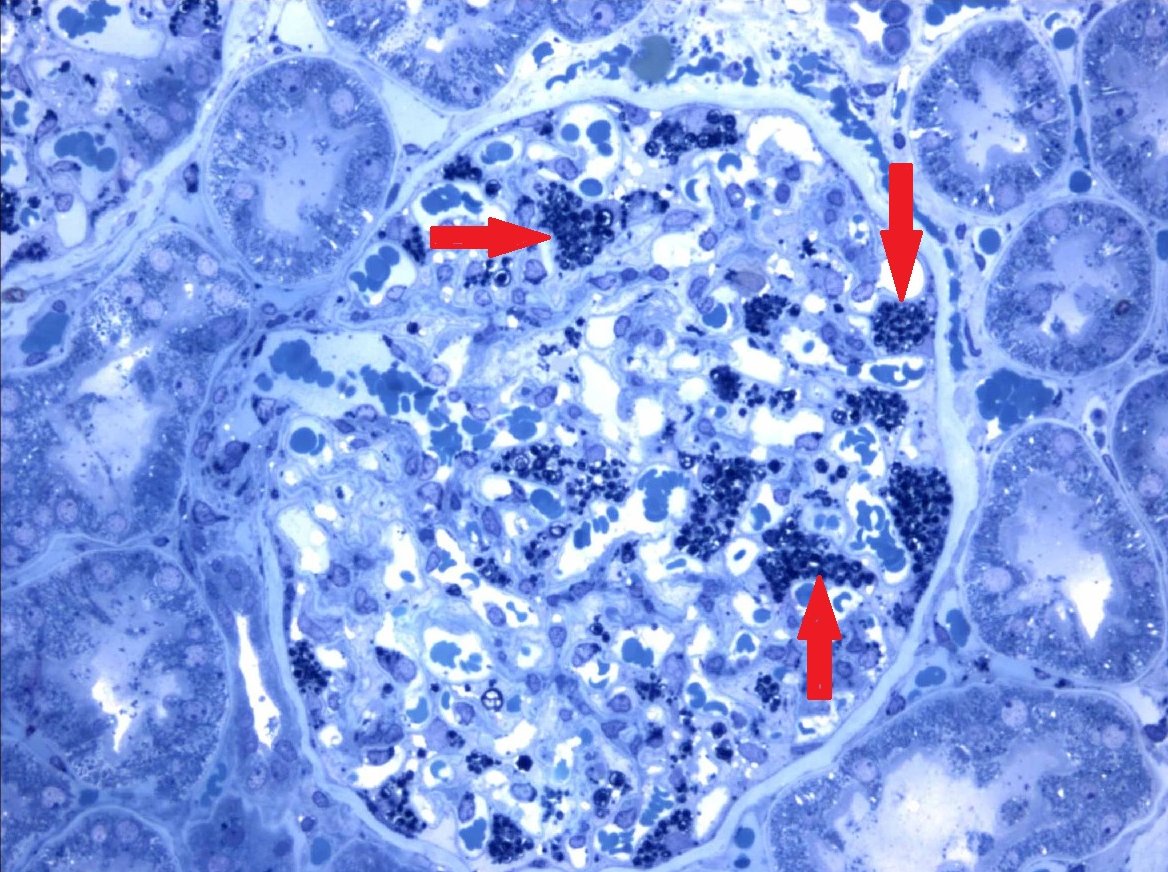
Специфическая диагностика также может быть показана пациентам, имеющим ассоциированные с клиникой болезни Фабри патологии. Обследование также стоит пройти людям, перенесшим инсульт в молодом возрасте, страдающим полинейропатиями с неустановленными до этого причинами, особенно если тотальные заболевания нервной системы сопровождаются еще и иными расстройствами глаз, почек, кожи или сердечно-сосудистой системы. Таким людям, в числе прочего, может быть назначена биопсия почек, способная показать накопления сфинголипидов в лизосомах (рис. 7) [23], [24].
Поскольку нервная и сердечно-сосудистая системы крайне часто страдают при БФ, то часто назначают функциональные обследования головного мозга и сердца, такие как компьютерная и магнитно-резонансная томографии, эхокардиография. Однако полиорганный характер болезни Фабри не позволит остановиться лишь на этом. Без «золотого стандарта» диагностики — определения активности α-галактозидазы А — добиться получения разрешения на начало специфической терапии все же не удастся. Особенно это исследование важно для пациентов мужского пола, так как в их случае исключен мозаичный бессимптомный фенотип болезни. У женщин же активность GLA может и не выходить за рамки нормы, поэтому в качестве завершающего звена все же придется обратиться к генотипированию [25]. Современные данные свидетельствуют об актуальности широкого внедрения в диагностику еще одного метода — анализа уровня накопления гликосфинголипидов (Gb3 и Lyso-Gb3) в плазме крови больного. Проведенные в 2021 году исследования установили, что эти биомаркеры заметно коррелируют с тяжестью течения болезни и благоприятностью дальнейшего прогноза (рис. 8) [26].
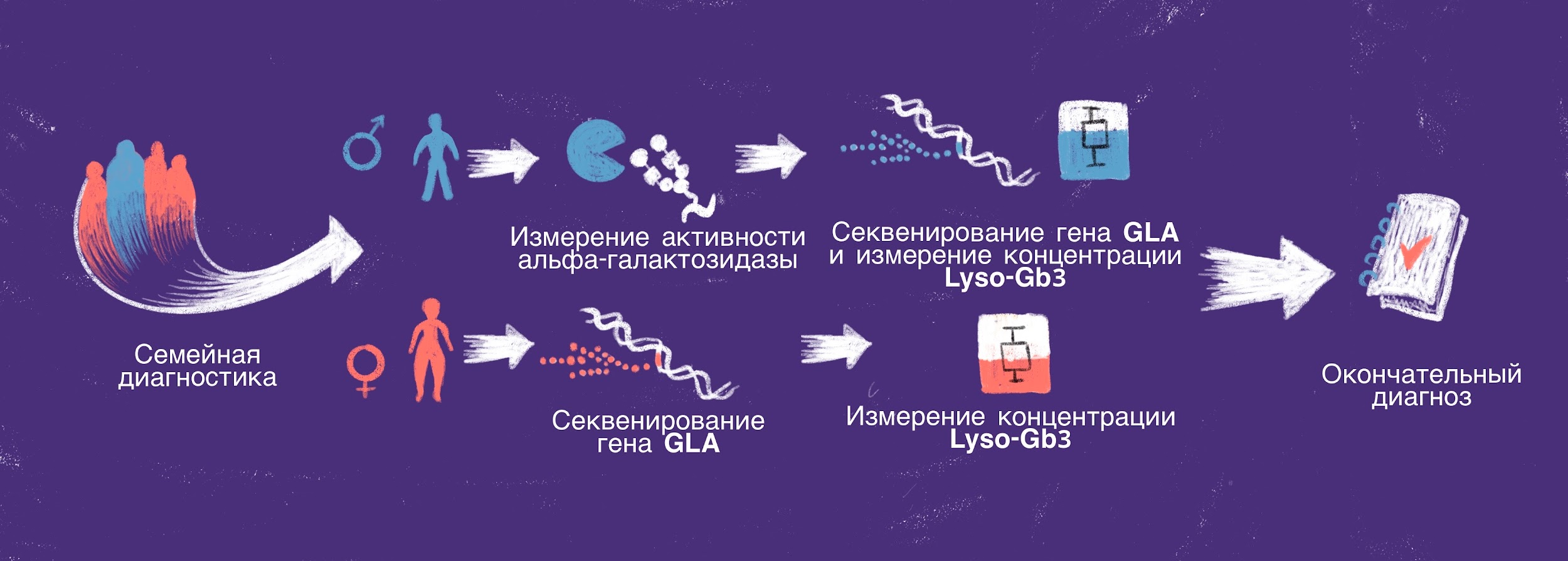
Рисунок 8. Логика организации диагностических мероприятий для выявления болезни Фабри.
рисунок Валерии Кузык
Удобство биохимических методов диагностики заключается в том, что для работы специалистам вполне достаточно сухого пятна крови на бумаге. Такой материал очень удобно транспортировать, он не требователен к условиям хранения. Это является несомненным плюсом для больших стран, где пациентам в ином случае пришлось бы тратиться на дорогу до диагностического центра.
К сожалению, достижения науки пока не решают всех проблем. Заболевание может проявляться по-разному (как и в случае многих других орфанных патологий); симптомы схожи с другими, более частыми болезнями; а заметное нарушение функции почек и сердца не характерно для пациентов детского возраста и раннего скрининга. Даже в наше время диагностика может сильно затянуться, и пациенты часто обследуются у нескольких специалистов для постановки окончательного диагноза. До обнаружения биомаркеров (активности фермента и количества накапливаемых липидов) в среднем диагностика болезни Фабри для пациентов обоих полов занимала около 15 лет [27]! Сейчас же этот период времени значительно сократился и составляет в среднем 5–6 лет [28].
Важно обращать пристальное внимание на весь комплекс проблем и не пренебрегать семейным скринингом, особенно если человек относится к группе риска наследования БФ или проявляет ряд типичных симптомов [8]. Мы помним, что, когда Йоханнес Фабри встретил Эмиля Хонке во второй раз, доктор обнаружил у своего повзрослевшего пациента выделение значительного количества белка с мочой. Именно протеинурию современные специалисты считают одним из самых достоверных предвестников резкого ухудшения состояния у мужчин старше 30 [29] (табл. 1).
| Орган/система | Симптом |
|---|---|
| Нервная система |
|
| Желудочно-кишечный тракт |
|
| Кожа |
|
| Глаза |
|
| Почки |
|
| Сердце |
|
Время, разумеется, играет большую роль. Анализ биомаркеров указывает на тесную связь между положительным прогнозом и ранним началом терапии: у 62 пациентов из 81 наблюдалось значительное снижение болевого синдрома и улучшение общего качества жизни [30]. Результаты работы международного проекта FOS (Fabry Outcome Survey), занимающегося мониторингом болезни в разных странах, показали, что ранняя терапия не только замедляет прогрессирование почечной недостаточности и кардиомиопатии, но и значительно снижает риск развития осложнений в будущем, грозящих пациенту инфарктом и переводом на диализ.
Лечение: заменить то, что сломано
Долгое время терапия болезни Фабри носила лишь симптоматический характер и была направлена главным образом на облегчение болевых приступов. Все попытки избавить больных от ангиокератом с помощью лазерной терапии не увенчались успехом, ведь они не затрагивали истинную причину появления сосудистых опухолей [31]. До того, как гемодиализ и трансплантация почек стали широко доступны, средний возраст смерти мужчин с БФ составлял 41–42 года. Примечательно, что Эмиль Хонке прожил как раз 43, а его дед — 49 лет, что вполне соответствует этим данным [32].
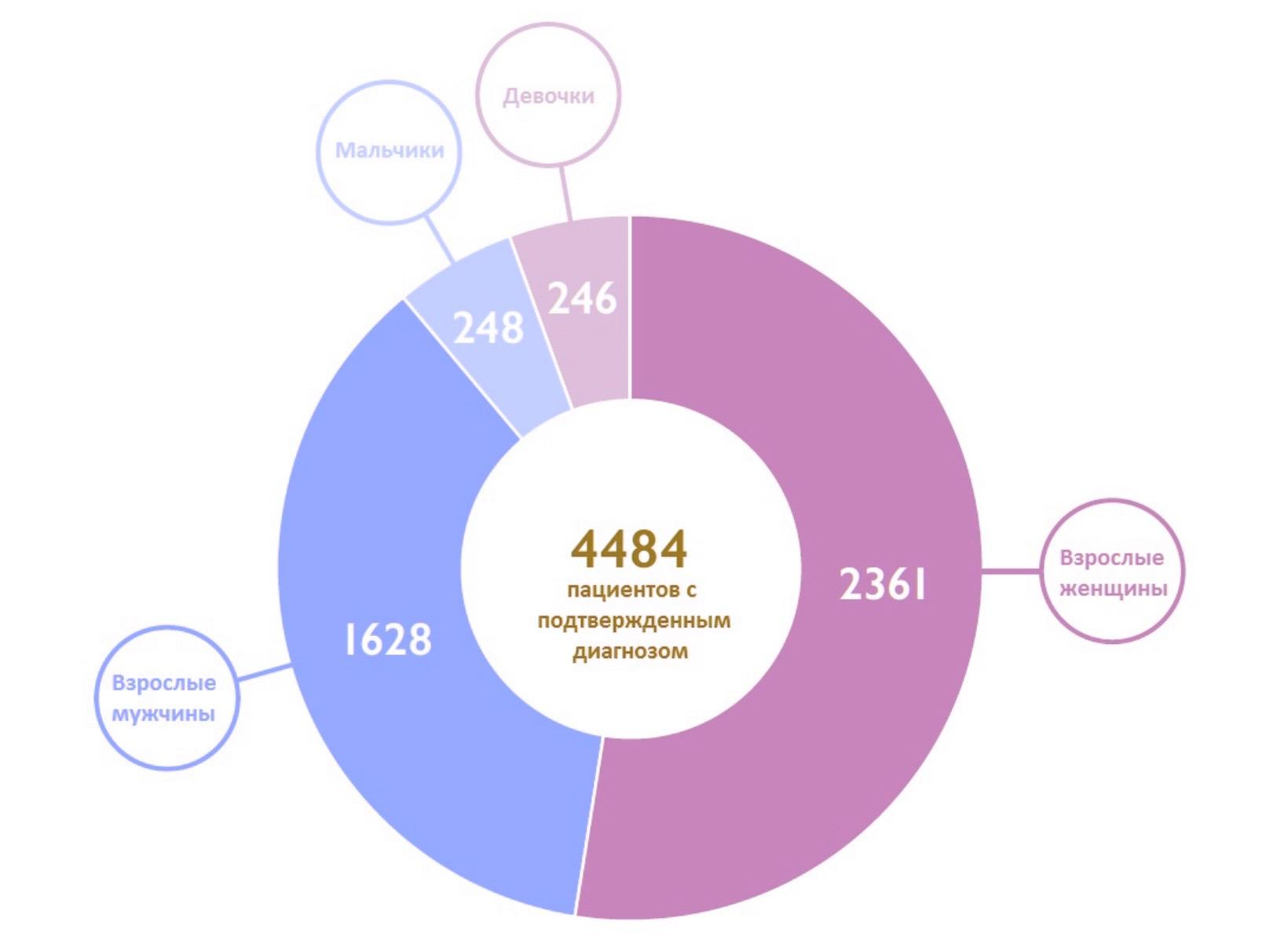
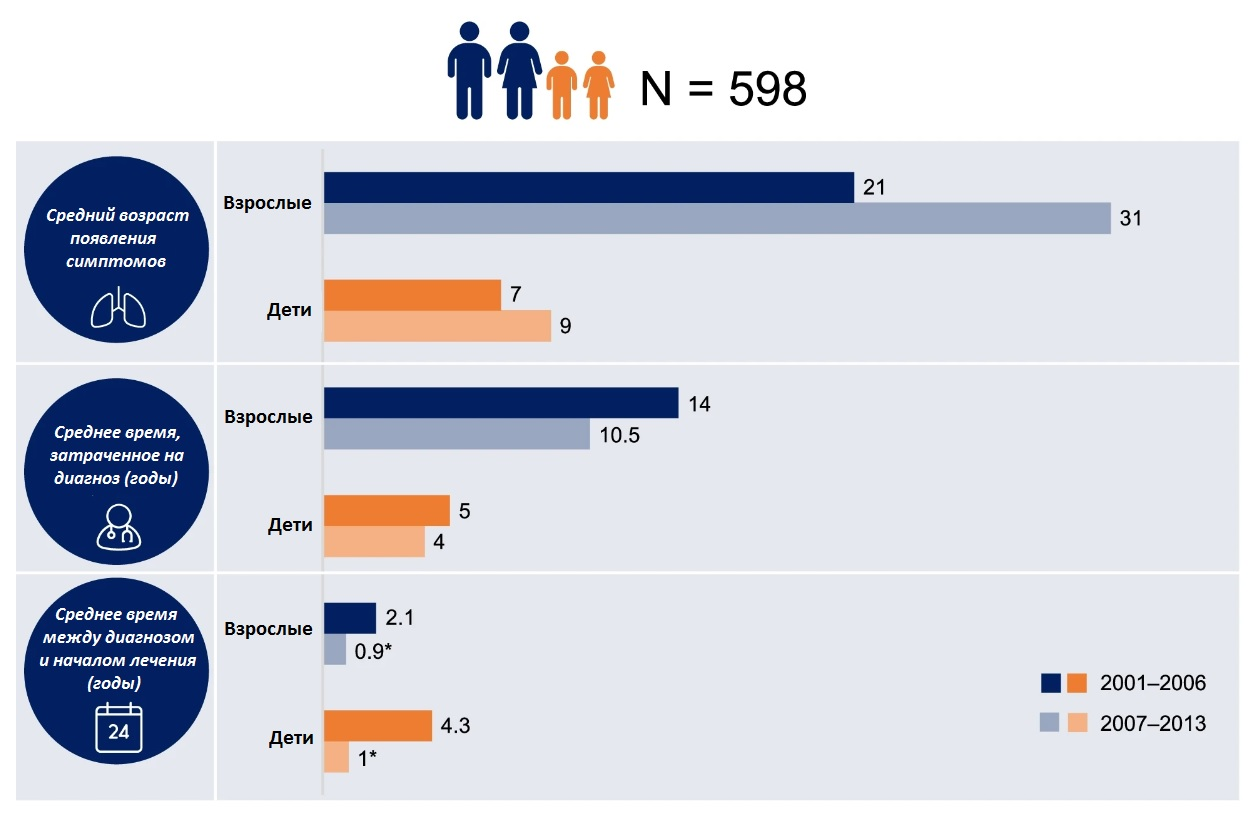
Переломный момент в жизни пациентов, обремененных болезнью Фабри, наступил в самом начале XXI века — именно в 2001 году больным в Европе стал доступен принципиально новый подход к лечению — ферментзаместительная терапия [33]. Проект Fabry Outcome Survey появился в то же самое время: по данным этой международной ассоциации, сейчас в мире зарегистрировано 4484 пациента с подтвержденным диагнозом (рис. 9А). Кроме того, в последние годы удалось добиться значительного сокращения затраченного на диагностику времени, что позволило приступать к лечению на 5–6 лет раньше, чем это было 20 лет назад (рис. 9Б) [34].
Время в этом случае невероятно ценно. Известно, что с каждым отсроченным годом терапии риск летального исхода стремительно нарастает: у мужчин с БФ инсульты случаются в среднем в возрасте всего лишь 39 лет [35]. Начинать лечение как можно раньше критически важно, пока накопление сфинголипидов еще не успело причинить непоправимый вред органам человека. Современная медицина предлагает больным несколько подходов к медикаментозной терапии.
- Первый класс препаратов, основанный на уже упоминавшемся ранее ферментозаместительном механизме (ФЗТ), призван при регулярном внутривенном введении заменить собой поломанный вследствие мутации природный фермент и нормализовать процесс утилизации липидов в лизосомах. В России с 2009 г. зарегистрированы два лекарственных препарата для ферментзаместительной терапии БФ: агалсидаза-бета («Фабразим») и агалсидаза-альфа («Реплагал»). Оба препарата представляют собой рекомбинантную человеческую α-галактозидазу А — фермент, в котором последовательность аминокислот такая же, как в эндогенном ферменте. Вариант «бета» получают с применением технологии рекомбинантной ДНК на клетках китайского хомячка, вариант «альфа» — из линии клеток человека HT1080 [36].
- Второй подход к терапии связан с природой миссенс-мутаций, приводящих к нестабильности вновь синтезированных лизосомальных ферментов. Сломанная α-галактозидаза А в чистом виде сохраняет каталитическую активность, но лишена возможности транспорта к месту действия в клетке. Мутантный фермент задерживается в эндоплазматическом ретикулуме (ЭПР) и разрушается в связи с измененной конформацией. Белки-шапероны способны помочь энзиму восстановить свою структуру и заставить его работать правильно. На этом механизме основано действие препарата «Мигаластат», принимаемого перорально [37].
- Третий вариант ориентирован не на фермент, а на его субстрат — накапливаемые в лизосоме липиды. Известно, что все гликосфинголипиды образуются из общего предшественника — церамида. Некоторые биологические соединения (в частности, иминосахара) способны ингибировать этот этап биосинтеза. В результате образование гликосфинголипидов снижается до уровня, доступного действию мутантного фермента [38] (рис. 8).
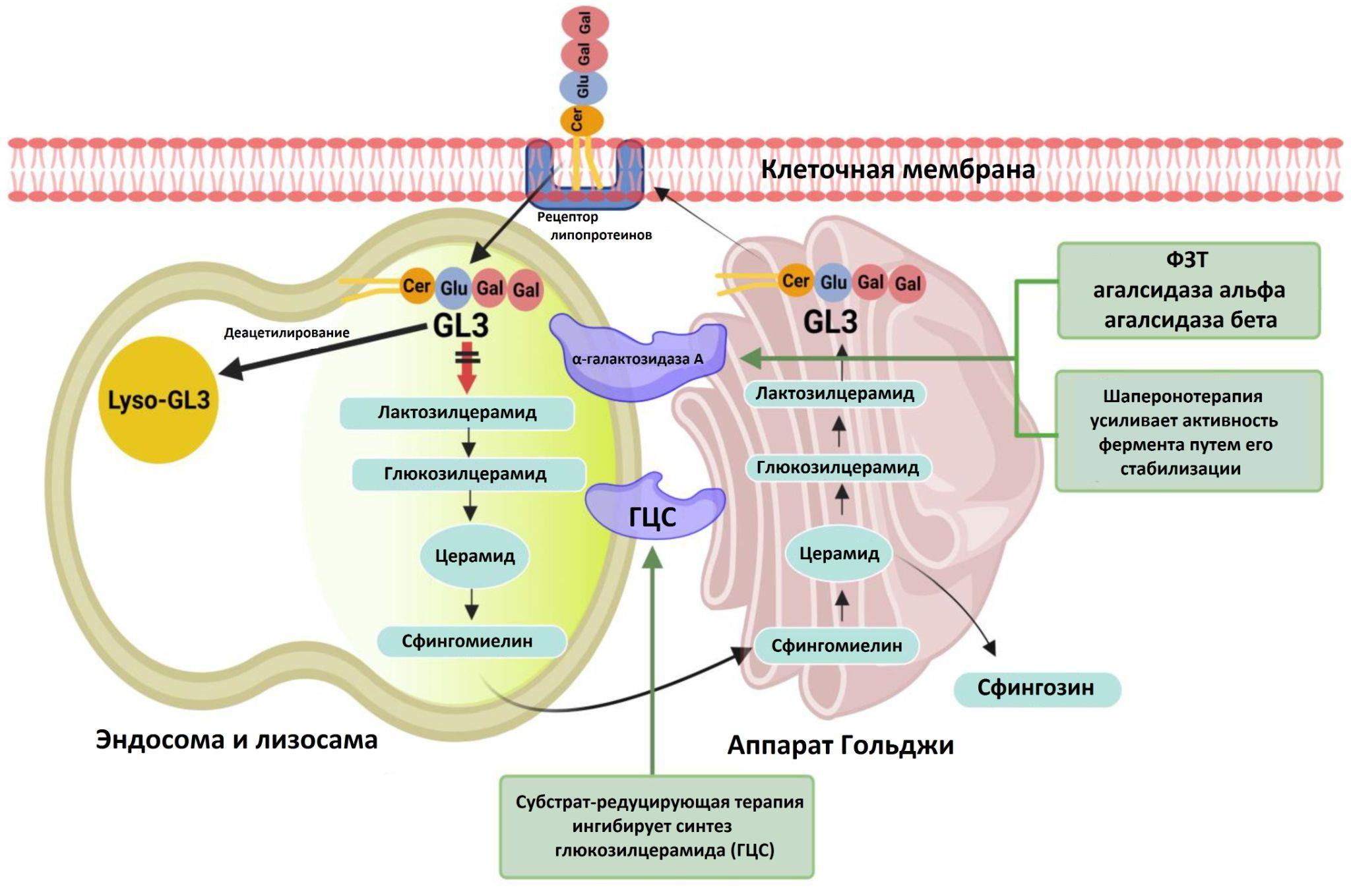
Рисунок 10. Принцип работы трех типов препаратов для терапии болезни Фабри. В процессе ФЗТ происходит замена мутантного фермента рекомбинантным (агалсидаза-α или агалсидаза-β). Шаперон (мигаластат) специфично связывается с активными концами α-галактозидазы А и стабилизирует их, способствуя тем самым правильной доставке фермента в лизосомы, что приводит к росту уровня энзиматической активности. Субстрат-редуцирующая терапия (луцерастат или венглустат) вызывает ингибирование синтеза глюкозилцерамида и уменьшает накопление гликосфинголипидов, в том числе глюкозилцерамида и глоботриаозилцерамида (GL3).
Обозначения липопротеинов: Cer — церамиды, Gal — галактоманнаны, Glu — глюкозилцерамиды (все три — субстраты α-галактозидазы А); Lyso-GL3 — биомаркер прогрессирования болезни Фабри.
Несмотря на достаточно широкий спектр подходов к лечению болезни Фабри, подавляющее большинство пациентов получают лечение именно препаратами ферментозаместительной терапии. Агалсидазу-ꞵ получают через экспрессию рекомбинантной ДНК в клетках яичников китайских хомячков (СНО), а агалсидазу-α— путем генной инженерии культивированных человеческих фибробластов кожи. Эти два соединения обладают сходной аминокислотной последовательностью, однако система экспрессии СНО производит белок значительно эффективнее, чем метод получения варианта α (рис. 11).
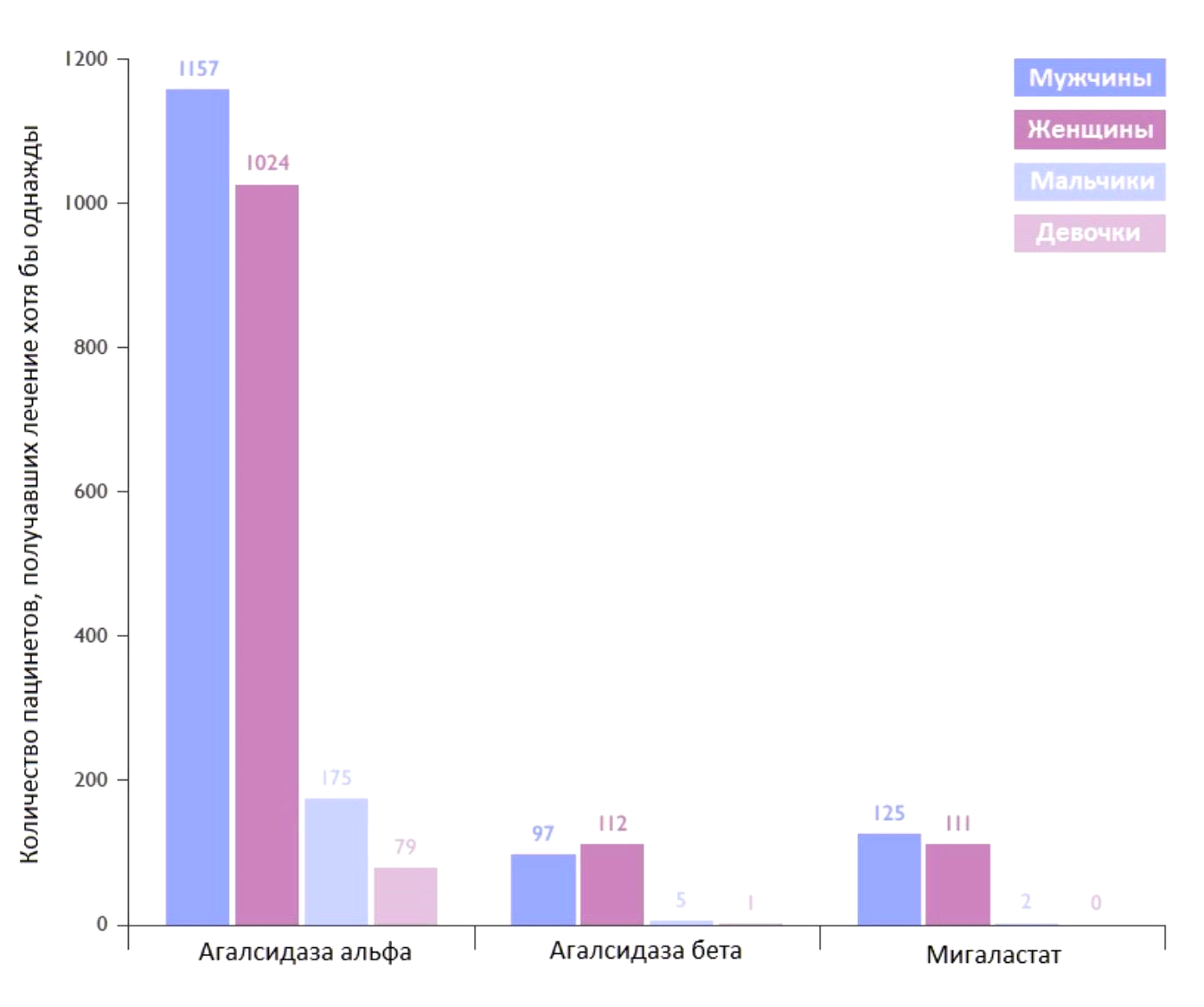
Рисунок 11. Количество пациентов, получавших хотя бы одну дозу какого-либо из одобренных препаратов, направленных на лечение болезни Фабри (по всемирным данным на 2020 год).
адаптировано из брифинга FOS
Несмотря на значительно бóльшую популярность «альфы» во всемирной практике, в России складывается несколько иная ситуация. По данным IQVI, в РФ агалсидаза бета набирает популярность: если в 2017 году было реализовано 3529 доз «альфа» и 897 «бета», в 2022-м количество проданных препаратов составило 5743 и 4754 доз, соответственно; мигаластат же не применяется в России вовсе. В Ежегодном бюллетене экспертного совета по редким орфанным заболеваниям зарегистрировано 246 пацинетов, страдающих сфинголипидозами Фабри и Ниманна—Пика. К сожалению, организаторы здравоохранения не разводят эти две патологии и представляют по ним объединенные отчеты в виде формулировки «другие сфинголипидозы». Всего же в России на данный момент получают медикаментозное лечение в виде ферментзаместительной терапии 73% (около 150 человек) от числа всех зарегистрированных больных, 63 человека лечатся сейчас агалсидазой бета.
Итак, биохимически лекарства похожи, но фармакологические отличия между ними все-таки есть. Препараты имеют различную схему дозировки: агалсидаза-α назначается из расчета 0,2 мг на 1 кг массы тела пациента, вариант β показано принимать в более высоких объемах — 1,0 мг/кг. Разница в дозировке может насторожить, однако кохрейновский обзор не нашел достоверных отличий между агалсидазами α и β по частоте проявления побочных эффектов [40]. Логично предположить, что более высокая дозировка поспособствует ускоренному формированию иммунного ответа на искусственно синтезированный чужеродный белок, и некоторые исследования это подтвердили — у пациентов, принимавших агалсидазу-β, антитела образовывались действительно быстрее. Тем не менее, их количество все же не снижало терапевтическую эффективность препарата [41]. Кроме того, уровни содержания в плазме крови биомаркеров болезни Фабри (уже известных нам Lyso-Gb3 и Gb-3) снизились после перевода на лечение с помощью ꞵ-пациентов, длительное время принимавших агалсидазу-α. Падение уровня биомаркера оказалось значительным — после смены схемы количество Lyso-Gb3 у сменивших препарат с α на β уменьшилось в среднем на 30% [42].
Особенно заметно этот эффект проявился у пациентов с нетипичной, сердечной формой течения болезни. Казалось бы, это напрямую демонстрирует лучший фармакодинамический эффект агалсидазы-β. Но ученых заинтересовала выраженная эффективность агалсидазы-β в отношении снижения липидной нагрузки на сердце. Группа из Нидерландов решила подробнее рассмотреть возможность терапии неклассического варианта болезни Фабри, используя универсальный кардиологический параметр — индекс массы миокарда левого желудочка (ИММЛЖ). Эта величина характеризует многие патологические процессы, и ее изменение (обычно в сторону увеличения) может говорить о неблагоприятном прогнозе течения патологии и повышенном риске серьезных осложнений. Было установлено, что ИММЛЖ достоверно уменьшился после первого года лечения именно у пациентов, принимавших агалсидазу-β [41].
Помимо этого известно, что агалсидаза-β отсрочивает время появления первого клинического события (возникновения диагностируемой острой почечной недостаточности, инфаркта или инсульта). На протяжении длительного когортного исследования такие явления были отмечены у 19,4% принимавших α против 13,3% принимавших β [43].
Генная терапия
Ферментозаместительная терапия дает действительно неплохие результаты; единственный ее недостаток связан с постоянной привязкой пациента к лекарству: принимать агалсидазу больному необходимо раз в две недели в течение всей жизни. Один из перспективных подходов к лечению болезни Фабри связан с генной терапией. На «Биомолекуле» существует целый спецпроект, посвященный этому направлению медицины: «Генная терапия: познакомьтесь с лекарствами будущего» [44]. Ученые заметили, что при болезни Фабри некоторые клетки все-таки могут производить функциональный белок, но количество его невелико. Разнообразие пораженных органов и тканей может зависеть и от желания клеток, экспрессирующих мутантную и нормальную Х-хромосому, «пообщаться» друг с другом путем переноса здорового фермента в больную клетку с помощью эндоцитоза. Вылечить себя таким образом наш организм, к сожалению, не может, но частично исправить дефекты в мутантных клетках этот природный механизм все-таки стремится, а значит, ему можно как-то помочь [45]. Например, с помощью лентивирусных векторов (LV) [46] можно добиться встраивания участков ДНК, кодирующих нормальную α-галактозидазу А в гемоцитобласты. Эти предшественники всех остальных клеток крови содержатся в костном мозге большинства костей. Они могут дать начало форменным элементам, производящим α-GAL в очень большом количестве, достаточном для эндоцитозной передачи в пораженные ткани. Уже сейчас уже проходит I стадия клинических испытаний на людях, результаты которой обещают опубликовать в 2024 году [47].
Информация о потенциально высокой токсичности лентивирусов побудила другие исследовательские группы к разработке терапии, основанной на других, более новых принципах. Например, доставка генов в пораженные клетки может реализовываться и при помощи аденоассоциированных вирусов (AAV) [48], введение вектора в воротную вену печени мышей позволило добиться 20–35% повышения у активности фермента и практически полной нормализации биомаркера Gb3 у модельных животных [49]. Технология редактирования генома CRISPR/Cas9 также рассматривается как один из перспективных методов лечения. Низкая иммуногенность метода почти не стимулирует выработку антител на введенный препарат. Еще в 2017 году ученым удалось добиться практически полного удаления Gb3 из соединительной ткани подопытных животных, доказав, что такой подход вполне возможно реализовать на широкой практике [50] (рис. 10).
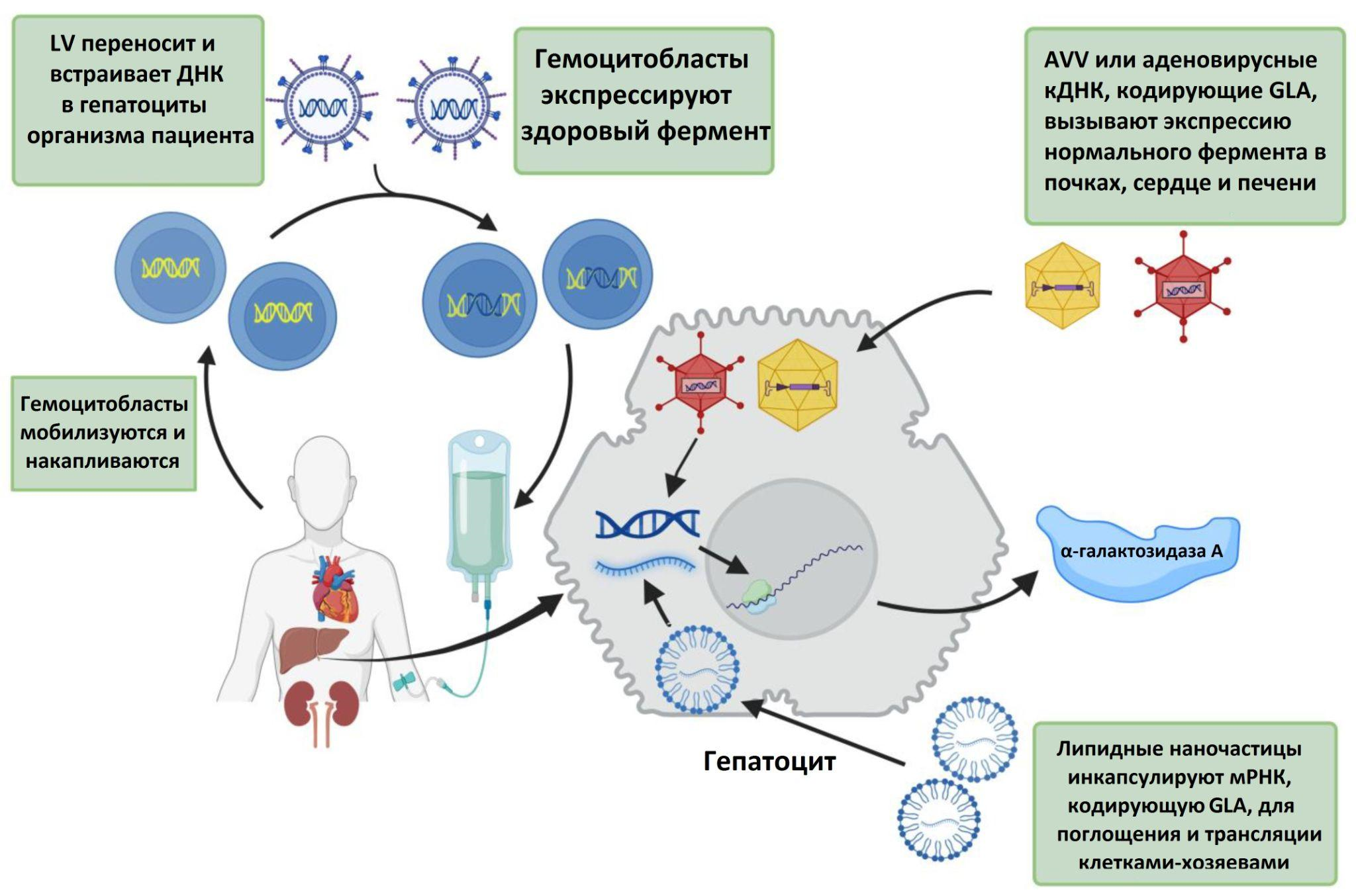
Рисунок 12. Логика работы перспективных методов генной терапии болезни Фабри. Первым шагом является стимуляция увеличения количества гемоцитобластов (HSPC) и интеграция кДНК GLA в ДНК хозяина с использованием лентивируса (LV). Отредактированные HSPC трансплантируют обратно в костный мозг для экспрессии α-галактозидазы A (α-GAL). Аденоассоциированный вирус (AAV) или аденовирус также можно использовать для переноса кДНК GLA в клетки-мишени. мРНК GLA человека и помещенная в липидные наночастицы — еще один безопасный метод эндогенной экспрессии α-GAL. Методы CRISPR/Cas позволяют встраивать мРНК в геном пациента для долгосрочной экспрессии фермента.
Проблемы, с которыми может столкнуться генная терапия в лечении болезни Фабри, связаны все с той же полиорганной природой заболевания. На данный момент не существует векторов мРНК/кДНК, прицельно ориентированных на сердечную мышцу или, например, на почки. Однако если генная терапия все-таки станет широкодоступной, она будет иметь преимущество из-за долговременной выработки нормального фермента в сверхвысоких дозах (достаточного для того, чтобы здоровые клетки смогли поделиться им с пораженными) и отсутствия антител против α-GAL [51].
Сто лет пути
Эмиль Хонке, знакомством с которым мы начинали наш рассказ, умер почти век назад и, к сожалению, не смог получить какую-либо помощь. Сегодня врачей обязательно насторожили бы особенности его семейного анамнеза, кожные симптомы и, особенно, протеинурия, появившаяся в столь раннем возрасте. То, что в далеком 1897 году Йоханнес Фабри записал в своем дневнике, современные специалисты непременно назвали бы классическим случаем, однако многое еще только предстоит выяснить. Орфанные заболевания изучать трудно всегда. Невысокая численность пациентов, пестрота вовлеченных в патогенез органов и симптомов, а также хронический характер течения делают исследование болезни Фабри сложной задачей для специалистов разных профилей.
Долгосрочное влияние заместительной ферментной терапии на риск осложнений пока еще невозможно оценить. Однако уже сейчас они помогают больным облегчить их состояние, и разработки не стоят на месте: набор одобренных надзорными органами средств только растет, что, несомненно, позволяет с оптимизмом смотреть в будущее. Сейчас семейный скрининг позволяет сузить круг обследуемых родственников пациента и вовремя заподозрить потенциальную угрозу. Опыт массового обследования новорожденных в Италии, Тайване и Японии помог установить ряд неспецифичных вариантов течения болезни, дебютирующих во взрослом возрасте, когда помочь больному уже сложнее. Появление международных комьюнити, таких как FOS, — несомненно позитивная тенденция для людей, страдающих от орфанных заболеваний. За последние 20 лет ситуация с болезнью Фабри кардинально изменилась — теперь принять участие в исследовании своего недуга и получить помощь значительно проще. Разработка методов генной терапии потенциально способна помочь совершить еще один значительный шаг вперед в нашей борьбе с болезнью. Клинические испытания на людях уже идут и, возможно, вскоре мы будем говорить о терапии, не требующей пожизненного приема препаратов, как об общепринятой. Пока же основная задача врачей и организаторов здравоохранения заключается в как можно более раннем выявлении болезни, ведь именно обеспечение пациентов доступными препаратами — основной фактор продления жизни и улучшения ее качества.
Литература
- Ермолаев А.И. (2022). О роли Менделя в истории биологии (к 200-летию Грегора Менделя). Историко-биологические исследования. 4, 176–186;
- John Fabry. (1916). Zur Klinik und Ätiologie des Angiokeratoma. Arch. f. Dermat.. 123, 294-307;
- H. Fabry. (2001). An historical overview of Fabry disease. J Inherit Metab Dis. 24, 3-7;
- Липидный фундамент жизни;
- A Mehta, J T R Clarke, R Giugliani, P Elliott, A Linhart, et. al.. (2009). Natural course of Fabry disease: changing pattern of causes of death in FOS - Fabry Outcome Survey. Journal of Medical Genetics. 46, 548-552;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Abdella M. Habib, James J. Cox. (2015). Pain in Fabry disease: Plasma lipids sensitise nociceptors. Neuroscience Letters. 594, 161-162;
- Dominique P Germain. (2010). Fabry disease. Orphanet Journal of Rare Diseases. 5, 30;
- Wuh-Liang Hwu, Yin-Hsiu Chien, Ni-Chung Lee, Shu-Chuan Chiang, Robert Dobrovolny, et. al.. (2009). Newborn screening for Fabry disease in Taiwan reveals a high incidence of the later-onsetGLAmutation c.936+919G>A (IVS4+919G>A). Hum. Mutat.. 30, 1397-1405;
- Dana Doheny, Ram Srinivasan, Silvere Pagant, Brenden Chen, Makiko Yasuda, Robert J Desnick. (2018). Fabry Disease: prevalence of affected males and heterozygotes with pathogenic GLA mutations identified by screening renal, cardiac and stroke clinics, 1995–2017. J Med Genet. 55, 261-268;
- Ting-Rong Hsu, Sheng-Che Hung, Fu-Pang Chang, Wen-Chung Yu, Shih-Hsien Sung, et. al.. (2016). Later Onset Fabry Disease, Cardiac Damage Progress in Silence. Journal of the American College of Cardiology. 68, 2554-2563;
- Руку, ногу и сердце: редкий АТТR-амилоидоз;
- Raphaël Borie, Bruno Crestani, Alice Guyard, Olivier Lidove. (2021). Interstitial lung disease in lysosomal storage disorders. Eur Respir Rev. 30, 200363;
- Curtis R. Coughlin, Michael A. Swanson, Kathryn Kronquist, Cécile Acquaviva, Tim Hutchin, et. al.. (2017). The genetic basis of classic nonketotic hyperglycinemia due to mutations in GLDC and AMT. Genetics in Medicine. 19, 104-111;
- Kimitoshi Nakamura, Kiyoko Hattori, Fumio Endo. (2011). Newborn screening for lysosomal storage disorders. Am. J. Med. Genet.. 157, 63-71;
- Геномная головоломка: открой в себе мозаика;
- Laura Carrel, Huntington F. Willard. (2005). X-inactivation profile reveals extensive variability in X-linked gene expression in females. Nature. 434, 400-404;
- Adriana Rodríguez-Marí, M. José Coll, Amparo Chabás. (2003). Molecular analysis in Fabry disease in Spain: Fifteen novel GLA mutations and identification of a homozygous female. Hum. Mutat.. 22, 258-258;
- A Sajantila, A H Salem, P Savolainen, K Bauer, C Gierig, S Pääbo. (1996). Paternal and maternal DNA lineages reveal a bottleneck in the founding of the Finnish population.. Proc. Natl. Acad. Sci. U.S.A.. 93, 12035-12039;
- Kung-Hao Liang, Yung-Hsiu Lu, Chih-Wei Niu, Sheng-Kai Chang, Yun-Ru Chen, et. al.. (2020). The Fabry disease-causing mutation, GLA IVS4+919G>A, originated in Mainland China more than 800 years ago. J Hum Genet. 65, 619-625;
- Dominique P. Germain, Perry M. Elliott, Bruno Falissard, Victor V. Fomin, Max J. Hilz, et. al.. (2019). The effect of enzyme replacement therapy on clinical outcomes in male patients with Fabry disease: A systematic literature review by a European panel of experts. Molecular Genetics and Metabolism Reports. 19, 100454;
- E. Tao, A. Moiseev, P. Novikov, N. Bulanov, N. Nosova, S. Moiseev. (2020). Efficacy of family screening in Fabry diseasein the Russian population. CPT. 29, 34-39;
- Linda van der Tol, Einar Svarstad, Alberto Ortiz, Camilla Tøndel, João Paulo Oliveira, et. al.. (2015). Chronic kidney disease and an uncertain diagnosis of Fabry disease: Approach to a correct diagnosis. Molecular Genetics and Metabolism. 114, 242-247;
- Гермэйн Д. П., Смирнов К. А. (2012). Болезнь Фабри. Нефрология. 16, 9–53;
- G.E. Linthorst, M.A. De Rie, K.H. Tjiam, J.M.f.G. Aerts, K.P. Dingemans, C.E.M. Hollak. (2004). Misdiagnosis of Fabry disease: importance of biochemical confirmation of clinical or pathological suspicion. Br J Dermatol. 150, 575-577;
- Albina Nowak, Felix Beuschlein, Visnuka Sivasubramaniam, David Kasper, David G Warnock. (2022). Lyso-Gb3 associates with adverse long-term outcome in patients with Fabry disease. J Med Genet. 59, 287-293;
- William R. Wilcox, João Paulo Oliveira, Robert J. Hopkin, Alberto Ortiz, Maryam Banikazemi, et. al.. (2008). Females with Fabry disease frequently have major organ involvement: Lessons from the Fabry Registry. Molecular Genetics and Metabolism. 93, 112-128;
- Rossella Parini, Guillem Pintos-Morell, Julia B Hennermann, Ting-Rong Hsu, Nesrin Karabul, et. al.. (2020). <p>Analysis of Renal and Cardiac Outcomes in Male Participants in the Fabry Outcome Survey Starting Agalsidase Alfa Enzyme Replacement Therapy Before and After 18 Years of Age</p>. DDDT. Volume 14, 2149-2158;
- C. M. Eng, J. Fletcher, W. R. Wilcox, S. Waldek, C. R. Scott, et. al.. (2007). Fabry disease: Baseline medical characteristics of a cohort of 1765 males and females in the Fabry Registry. J of Inher Metab Disea. 30, 184-192;
- D. G. Warnock, A. Ortiz, M. Mauer, G. E. Linthorst, J. P. Oliveira, et. al.. (2012). Renal outcomes of agalsidase beta treatment for Fabry disease: role of proteinuria and timing of treatment initiation. Nephrology Dialysis Transplantation. 27, 1042-1049;
- Matthias M??hrenschlager, Markus Braun-Falco, Johannes Ring, Dietrich Abeck. (2003). Fabry Disease. American Journal of Clinical Dermatology. 4, 189-196;
- Colombi A., Kostyal A., Bracher R., Gloor F., Mazzi R., Thölen H. (1967). Angiokeratoma corporis diffusum—Fabry's disease. Helv Med Acta. 34, 67–83;
- Stephen Waldek, Manesh R. Patel, Maryam Banikazemi, Roberta Lemay, Philip Lee. (2009). Life expectancy and cause of death in males and females with Fabry disease: Findings from the Fabry Registry. Genetics in Medicine. 11, 790-796;
- Ricardo Reisin, Amandine Perrin, Pablo García-Pavía. (2017). Time delays in the diagnosis and treatment of Fabry disease. Int J Clin Pract. 71, e12914;
- Isabel De Brabander, Laetitia Yperzeele, Chantal Ceuterick-De Groote, Raf Brouns, Robert Baker, et. al.. (2013). Phenotypical characterization of α-galactosidase A gene mutations identified in a large Fabry disease screening program in stroke in the young. Clinical Neurology and Neurosurgery. 115, 1088-1093;
- Robert J. Desnick. (2003). Fabry Disease, an Under-Recognized Multisystemic Disorder: Expert Recommendations for Diagnosis, Management, and Enzyme Replacement Therapy. Ann Intern Med. 138, 338;
- Elena M. Sánchez-Fernández, José M. García Fernández, Carmen Ortiz Mellet. (2016). Glycomimetic-based pharmacological chaperones for lysosomal storage disorders: lessons from Gaucher, GM1-gangliosidosis and Fabry diseases. Chem. Commun.. 52, 5497-5515;
- T. D. Butters, R. A. Dwek, F. M. Platt. (2003). New Therapeutics for the Treatment of Glycosphingolipid Lysosomal Storage Diseases. Advances in Experimental Medicine and Biology. 219-226;
- Muhammad Umer, Dinesh K. Kalra. (2023). Treatment of Fabry Disease: Established and Emerging Therapies. Pharmaceuticals. 16, 320;
- Regina El Dib, Huda Gomaa, Raíssa Pierri Carvalho, Samira E Camargo, Rodrigo Bazan, et. al.. (2016). Enzyme replacement therapy for Anderson-Fabry disease. Cochrane Database of Systematic Reviews. 2017;
- Maarten Arends, Marieke Biegstraaten, Christoph Wanner, Sandra Sirrs, Atul Mehta, et. al.. (2018). Agalsidase alfa versus agalsidase beta for the treatment of Fabry disease: an international cohort study. J Med Genet. 55, 351-358;
- Albina Nowak, Olivier Dormond, Véronique Monzambani, Uyen Huynh-Do, Frédéric Barbey. (2022). Agalsidase-β should be proposed as first line therapy in classic male Fabry patients with undetectable α-galactosidase A activity. Molecular Genetics and Metabolism. 137, 173-178;
- S.M. Sirrs, D.G. Bichet, R. Casey, J.T.R. Clarke, K. Lemoine, et. al.. (2014). Outcomes of patients treated through the Canadian Fabry disease initiative. Molecular Genetics and Metabolism. 111, 499-506;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Barbara R. Migeon. (2006). The Role of X Inactivation and Cellular Mosaicism in Women's Health and Sex-Specific Diseases. JAMA. 295, 1428;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Aneal Khan, Dwayne L. Barber, Ju Huang, C. Anthony Rupar, Jack W. Rip, et. al.. (2021). Lentivirus-mediated gene therapy for Fabry disease. Nat Commun. 12;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Sung-Chul Jung, Ina P. Han, Advait Limaye, Ruian Xu, Monique P. Gelderman, et. al.. (2001). Adeno-associated viral vector-mediated gene transfer results in long-term enzymatic and functional correction in multiple organs of Fabry mice. Proc. Natl. Acad. Sci. U.S.A.. 98, 2676-2681;
- Sheng-Kai Chang, Yung-Hsiu Lu, Yun-Ru Chen, Yu-Ping Hsieh, Wei-Jou Lin, et. al.. (2017). AB043. Correction of the GLA IVS4+919 G>A mutation with CRISPR/Cas9 deletion strategy in fibroblasts of Fabry disease. Ann. Transl. Med.. 5, AB043-AB043;
- Toshihiro Takenaka, Gangjian Qin, Roscoe O. Brady, Jeffrey A. Medin. (1999). Circulating alpha-Galactosidase A Derived from Transduced Bone Marrow Cells: Relevance for Corrective Gene Transfer for Fabry Disease. Human Gene Therapy. 10, 1931-1939.