Суточные ритмы, кишечная микробиота и новое прочтение классики — о чем писали онкологи на прошлой неделе
22 мая 2024
Суточные ритмы, кишечная микробиота и новое прочтение классики — о чем писали онкологи на прошлой неделе
- 738
- 1
- 7
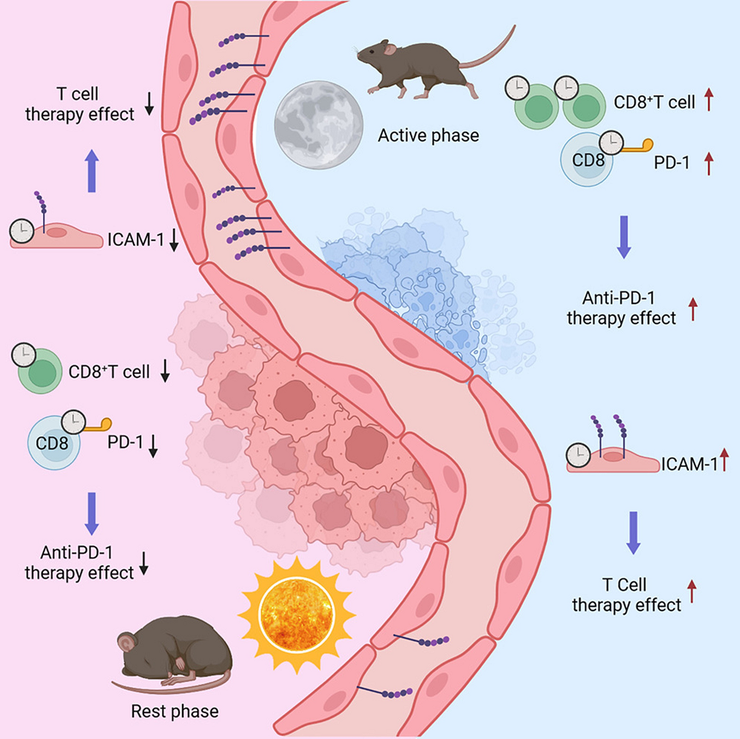
Контринтуитивно — сон лечит не все! В активную фазу жизни — а для мыши это ночное время — цитотоксические Т-клетки более активно борются со злокачественной опухолью.
-
Автор
-
Редакторы
Темы
В нужное время и в нужном месте — чем не максима онкотерапии? Новые исследования показывают, что нужное время может быть даже специфическим временем суток, когда организм лучше готов бороться со злокачественными клетками. А нужного места можно достигнуть разными способами, даже если лекарство в твоих руках имеет более чем полувековую историю.
За циркадными ритмами [1] скрываются сложные биохимические процессы не только в организме, но и внутри отдельных клеток. И оказалось, что ответ на иммунотерапию онкологических заболеваний тоже подвержен суточным ритмам. Международную группу ученых из Швейцарии, Бельгии, США, Китая и Германии озадачил вопрос, зависит ли количество лейкоцитов, проникающих в раковую опухоль, от времени суток. Свои догадки они проверили на модельных животных — и действительно, вечером количество CD8+ цитотоксических Т-клеток и естественных киллеров, которые наиболее важны для иммунного ответа на злокачественное новообразование, оказалось выше. Но речь не только о естественных киллерах и CD8+ Т-клетках — в статье в журнале Cell представлена более подробная и сложная картина [2]. В частности, сообщается, что локально руководят этим процессом эндотелиальные клетки, и это не связано с изменением в пролиферации лейкоцитов или тем, что днем они активнее гибнут. Более того, вечерняя более активная инфильтрация иммунных клеток в опухоль оказалась не зависящей от увеличения объема кровотока или размера опухоли. Это открытие может применяться в терапии неоплазий — ученые подсадили мышам опухолевые клетки и вводили им CAR-T-клетки в определенное время суток. Эффективность терапии также была выше в когорте с вечерним введением иммунотерапии.
Один из центральных белков циркадного ритма — BMAL1. В настоящее время известно более десятка компонентов его положительной и отрицательной регуляции. Один из них — орфанный, то есть с неизвестным лигандом, рецептор RORA. Однако что-то все-таки известно об этом белке: в частности, благодаря работе китайских ученых, опубликованной в журнале Cancer Research, мы теперь знаем, что у некоторых больных с меланомой наблюдается снижение экспрессии гена, кодирующего этот рецептор [3]. По утверждению исследователей, это коррелирует с худшим прогнозом по сравнению с теми пациентами, у которых экспрессия RORA в норме или повышена. Оказалось, что RORA может подавлять экспрессию лиганда PD-L1, в норме оберегающего клетки тела (и плода в случае беременности) от атаки Т-лимфоцитами. Снижение экспрессии PD-L1 не позволяет опухолевым клеткам мимикрировать под здоровые клетки организма и таким образом спасаться от иммунного ответа. Подавление иммунных чекпоинтов на опухолевых клетках прочно вошло в тренды современной онкотерапии, поэтому действие RORA было проверено вкупе с блокированием другого иммунного чекпоинта CTLA4 — если уж нападать на опухоль, то системно, тем более что комбинированная блокада PD-L1 и CTLA4 показала свою эффективность [4]. Данные эксперимента показывают, что использование агониста RORA вместе с терапевтическими антителами [5] к CTLA4 подавляет рост опухоли in vivo.
В другом исследовании [6], проведенном на немелкоклеточном раке легкого (NSCLC), PD-L1 вновь показал свою опасность. Ученые из Южной Кореи обнаружили, что в опухолевых клетках сигнальные пути, влияющие на эпителиально-мезенхимальный переход (ЭМП), находятся в прямой зависимости от уровня экспрессии PD-L1. Переход опухолевых клеток из эпителиального состояния в мезенхимальное опасен тем, что это механизм развития метастаз во вторичных очагах отдаленных органов. Исследователи так и пишут, что PD-L1 способствует пролиферации, миграции и инвазии злокачественных клеток легкого — читай, развитию метастаз, а значит, и сниженному проценту выживаемости при немелкоклеточном раке легкого с высокой экспрессией PD-L1. Также ученым удалось обнаружить, что в случае высокого уровня экспрессии PD-L1 дедифференцирующиеся клетки, претерпевающие ЭМП, подавляют иммунный ответ на опухоль, способствуют инфильтрации Т-регуляторных клеток и поляризации макрофагов в М2 состояние, которое также характеризуется как проопухолевое. Все это снижает экспансию цитотоксических CD8+ Т-клеток в опухоль, — то есть подавляет иммунный ответ организма на неоплазию. Из всего этого в работе делается вывод, что опухолевые клетки с высоким уровнем экспрессии PD-L1 будут способствовать худшему ответу на иммунотерапию, в частности, на блокаду иммунных чекпоинтов.
Новый способ привлечения CD8+ Т-клеток в опухоль придумали ученые из США. Для того, чтобы активировать цитотоксические лимфоциты, специфичные к опухоль-ассоциированным антигенам, они решили спровоцировать презентацию этих антигенов на молекулах неполиморфного главного комплекса гистосовместимости (HLA-E). Эти неканонические молекулы главного комплекса гистосовместимости (MHC) часто оказываются активированы на многих раковых клетках. Главная функция всех молекул MHC — презентация антигенов Т-клеткам [7]. В отличие от канонических молекул HLA, данный представитель семейства — HLA-E — обладает весьма ограниченным полиморфизмом в популяции, что делает его гораздо более привлекательной целью для терапевтических приложений, чем классические молекулы HLA с выраженным полиморфизмом. Ученые предлагают вызывать совместимые с HLA-E Т-лимфоциты, специфические к широко представленным опухоль-ассоциированным антигенам, с помощью генетических конструкций на основе векторов цитомегаловируса. Свои догадки они проверили на макаках-резус и опубликовали результаты в Science Advance [8].
Однако не иммунотерапией единой. Оригинальный взгляд на предсказание ответа на лечение предложили ученые из Китая в журнале Molecular Cancer. С развитием и удешевлением технологий высокопроизводительного секвенирования все больше возможностей открывается для анализа кишечной микробиоты и ее связей с самыми разными частями организма — от ЖКТ до головного мозга [9]. С применением технологий машинного обучения исследователи проанализировали кишечную микробиоту при колоректальном раке и раке желудка, но главной целью был, как ни странно, рак молочной железы. Разработанная в недрах нейросети и под контролем ученых система типирования и оценки разнообразия микробиоты, как утверждается, позволяет эффективно прогнозировать ответ на неадъювантную терапию. Идея базируется на том, что кишечная микробиота через общие с организмом-хозяином метаболиты, а следовательно, и сигнальные пути, оказывает влияние на протекание широкого ряда заболеваний. Чем рак хуже? Оказалось, что ничем. В статье утверждается, что предлагаемый метод позволил выявить новый подтип рака молочной железы, который был назван «сложным» и характеризовался более разнородным иммунным окружением опухоли и накоплением большего количества генетических мутаций. Но при всем этом он не был ассоциирован с худшим прогнозом. Чтобы расширить арсенал биоинформатических данных и валидировать свой метод, ученые прибегли к технологиям single cell и пространственной транскриптомики.
Омиксные технологии [10] в виде ДНК-фрагментомики, то есть исследования внеклеточных фрагментов ДНК в плазме крови, использовали для диагностики и характеризации рака поджелудочной железы и желчного тракта. Исследование проводилось на пациентах с холангиокарциномой, раком желчного пузыря и раком поджелудочной железы. Внеклеточные фрагменты ДНК попадают в плазму из распадающихся клеток — опухолевые клетки не только живут и пролиферируют, но и умирают. А диагностика на основе ДНК-фрагментомики кажется многообещающей не только при онкологии, но и при беременности [11] или инфекционных заболеваниях. Возможно, работа, опубликованная в Journal of Experimental and Clinical Cancer Research, ляжет в основу нового метода раннего обнаружения неоплазий [12].
И, наконец, несмотря на вполне понятное увлечение многообещающей иммунотерапией, лечение с помощью химиотерапии остается актуальным ответом на злокачественные новообразования. Опасность в том, что химиотерапевтические препараты токсичны не только для раковых клеток, но и для соматических. Разница лишь в том, что обычно они ориентированы на характерные для опухолевых клеток черты, например, ускоренную пролиферацию — скажем, связывая молекулы тубулина и препятствуя их полимеризации [13], можно остановить процесс деления клетки, потому что хромосомы не смогут разойтись к двум полюсам, которые должны будут стать ядрами двух новых клеток. Проблема в том, что такие препараты, например, винкристин, не делают различия между тем, какие клетки делятся — раковые или любые другие клетки организма. Поэтому, например, частым побочным эффектом химиотерапии является временная потеря волос. Однако эффективность химиотерапии не позволяет отказаться от нее в пользу других, пока еще менее широко применимых способов лечения онкологических заболеваний, поэтому, чтобы уменьшить ее побочные эффекты, ученые ищут способы адресной доставки химиотерапевтических препаратов к опухолевым клеткам. Использовать экзосомы из стволовых клеток как наноконтейнеры для антираковых препаратов предложили ученые из Египта в журнале Scietific Reports [14].
Больше статей:
- Assessing the distribution of cancer stem cells in tumorspheres [15] — о топографии и закономерностях в распределении раковых стволовых клеток в опухоли.
- Comprehensive genomic and transcriptomic characterization of high-grade gastro-entero-pancreatic neoplasms [16] — секвенирование нового поколения для определения геномных закономерностей в гастроэнтеропанкреотических опухолях.
- Hypoxia- and Postirradiation reoxygenation-induced HMHA1/ARHGAP45 expression contributes to cancer cell invasion in a HIF-dependent manner [17] — об экспрессии гена HMHA1 в условиях гипоксии после радиотерапии и последующей инвазии опухолевых клеток.
- Menopausal hormone therapy and breast cancer risk: a population-based cohort study of 1.3 million women in Norway [18] — гормональная терапия во время менопаузы и риск развития рака молочной железы.
- Prostate Cancer Incidence and Mortality in Men Exposed to α1-Adrenoceptor Antagonists [19] — (популяционное исследование) антагонисты α1 адренорецептора часто используются для лечения доброкачественных опухолей предстатетельной железы. Вызывает ли это риск развития злокачественных новообразований простаты?
- PSMD9 promotes the malignant progression of hepatocellular carcinoma by interacting with c‑Cbl to activate EGFR signaling and recycling [20] — белок PSMD9 как онкомаркер гепатоцеллюлярной карциномы, позволяющий прогнозировать течение заболевания.
- Transcriptomic analysis‑guided assessment of precision‑cut tumor slices (PCTS) as an ex‑vivo tool in cancer research [21] — о том, какие изменения претерпевает срез опухоли в течение 72 часов культивации и как это влияет на получаемые результаты в экспериментах ex vivo.
Литература
- Найдена связь между обменом веществ и циркадным ритмом;
- Chen Wang, Qun Zeng, Zeynep Melis Gül, Sisi Wang, Robert Pick, et. al.. (2024). Circadian tumor infiltration and function of CD8+ T cells dictate immunotherapy efficacy. Cell;
- Dandan Liu, Benliang Wei, Long Liang, Yue Sheng, Shengjie Sun, et. al.. (2024). The Circadian Clock Component RORA Increases Immunosurveillance in Melanoma by Inhibiting PD-L1 Expression. Cancer Research;
- Margaret K. Callahan, Michael A. Postow, Jedd D. Wolchok. (2015). CTLA-4 and PD-1 Pathway Blockade: Combinations in the Clinic. Front. Oncol.. 4;
- Терапевтические моноклональные антитела;
- Hyein Jeong, Jaemoon Koh, Sehui Kim, Seung Geun Song, Soo Hyun Lee, et. al.. (2024). Epithelial−mesenchymal transition induced by tumor cell-intrinsic PD-L1 signaling predicts a poor response to immune checkpoint inhibitors in PD-L1-high lung cancer. Br J Cancer;
- Иммунитет: борьба с чужими и… своими;
- Ravi F. Iyer, Marieke C. Verweij, Sujit S. Nair, David Morrow, Mandana Mansouri, et. al.. (2024). CD8 + T cell targeting of tumor antigens presented by HLA-E. Sci. Adv.. 10;
- Livia H. Morais, Henry L. Schreiber, Sarkis K. Mazmanian. (2021). The gut microbiota–brain axis in behaviour and brain disorders. Nat Rev Microbiol. 19, 241-255;
- Факты и легенды о мультиомиксных технологиях;
- Внеклеточная ДНК приподнимает завесу тайны беременности;
- Xiaohan Shi, Shiwei Guo, Qiaonan Duan, Wei Zhang, Suizhi Gao, et. al.. (2024). Detection and characterization of pancreatic and biliary tract cancers using cell-free DNA fragmentomics. J Exp Clin Cancer Res. 43;
- «Зоопарк» ингибиторов тубулина;
- Ahmed H. Farouk, Ahmed Aref, Belal A. Fathy, Ahmed N. Abdallah. (2024). Stem cells derived exosomes as biological nano carriers for VCR sulfate for treating breast cancer stem cells. Sci Rep. 14;
- Jerónimo Fotinós, María Paula Marks, Lucas Barberis, Luciano Vellón. (2024). Assessing the distribution of cancer stem cells in tumorspheres. Sci Rep. 14;
- Valentina Angerilli, Giovanna Sabella, Michele Simbolo, Vincenzo Lagano, Giovanni Centonze, et. al.. (2024). Comprehensive genomic and transcriptomic characterization of high-grade gastro-entero-pancreatic neoplasms. Br J Cancer;
- Peter W. T. Lee, Tatsuya Suwa, Minoru Kobayashi, Hui Yang, Lina R. Koseki, et. al.. (2024). Hypoxia- and Postirradiation reoxygenation-induced HMHA1/ARHGAP45 expression contributes to cancer cell invasion in a HIF-dependent manner. Br J Cancer;
- Nathalie C. Støer, Siri Vangen, Deependra Singh, Renée T. Fortner, Solveig Hofvind, et. al.. (2024). Menopausal hormone therapy and breast cancer risk: a population-based cohort study of 1.3 million women in Norway. Br J Cancer;
- Lars Björnebo, Shirin Razdan, Andrea Discacciati, Thorgerdur Palsdottir, Markus Aly, et. al.. (2024). Prostate Cancer Incidence and Mortality in Men Exposed to α1-Adrenoceptor Antagonists. JNCI: Journal of the National Cancer Institute;
- Yuting Su, Lili Meng, Chao Ge, Yuqi Liu, Chi Zhang, et. al.. (2024). PSMD9 promotes the malignant progression of hepatocellular carcinoma by interacting with c-Cbl to activate EGFR signaling and recycling. J Exp Clin Cancer Res. 43;
- Sumita Trivedi, Caitlin Tilsed, Maria Liousia, Robert M. Brody, Karthik Rajasekaran, et. al.. (2024). Transcriptomic analysis-guided assessment of precision-cut tumor slices (PCTS) as an ex-vivo tool in cancer research. Sci Rep. 14.