
Свой среди чужих, чужой среди своих: как система BREX защищает бактерию от фагов и самой себя
20 декабря 2018
Свой среди чужих, чужой среди своих: как система BREX защищает бактерию от фагов и самой себя
- 1165
- 0
- 4
Бактерии развили множество систем защиты от бактериофагов, о большинстве которых мы знаем очень мало
картина Beth Waltz
-
Автор
-
Редактор
Темы
Арсенал защитных инструментов бактерий, с помощью которых они дают отпор фагам, не исчерпывается хорошо изученными системами рестрикции-модификации и CRISPR/Cas: существует множество других защитных систем, изученных значительно хуже. Исследователи из Центра наук о жизни Сколтеха и других организаций вплотную занялись одной из таких систем, которая известна как BREX (от англ. bacteriophage exclusion). Хотя механизм ее работы всё еще неизвестен, ученые смогли понять, как эта система распознает, какую ДНК нужно разрушить, а какую — нет. В этой статье мы не только разберемся в известных деталях функционирования системы BREX, но и побеседуем с первым автором публикации в Nucleic Acid Research — Юлией Гордеевой, которая, кстати, на момент выполнения работы была только студенткой-магистрантом Сколтеха.
О системах CRISPR/Cas уже сейчас написаны тонны литературы, посвященной как фундаментальным деталям их функционирования, так и применению их в качестве инструмента для редактирования геномов . О системах рестрикции-модификации, также вносящих свой вклад в защиту бактерий от чужеродной ДНК, вспоминают реже, но, несмотря на это, они известны довольно давно и изучены достаточно подробно. Ключевые компоненты систем рестрикции-модификации — эндонуклеазы рестрикции, или попросту рестриктазы, — стали незаменимыми молекулярно-биологическими инструментами для внесения разрезов в ДНК.
«Биомолекула» не раз писала о фундаментальных механизмах работы столь нашумевшей системы CRISPR/Cas [1], [2]. А обзор других защитных систем бактерий от фагов приводится в статье [3].
Однако защитные системы бактерий не ограничиваются этими двумя примерами, есть и многие другие. К сожалению, об этих системах мы знаем очень мало. Любопытно, что некоторые из них были описаны еще в 80-х годах прошлого века, но впоследствии о них забыли. Например, как рассказывает Юлия Гордеева, система BREX (bacteriophage exclusion) имеет весьма непростую историю изучения:
Все началось еще в 1982 году со статьи Татьяны Чиненовой [4] о новой системе, помогающей стрептомицетам защищаться от фага, которую назвали Pgl (phage growth limitation). Но к настоящему моменту никто так и не разгадал загадку действия этой системы. Известно, что система состоит из четырех генов, которые кодируют щелочную фосфатазу (PglZ), метилазу (PglX), киназу (PglW) и АТФазу (PglY). Далее с развитием биоинформатики и увеличением интереса к защитным системам в 2011 году в «островках защиты» прокариот нашли целое семейство, общим для которого является наличие щелочной фосфатазы (PglZ) и метилазы (PglX) [5]. Это семейство назвали BREX и разделили на шесть типов в зависимости от состава остальных четырех генов.
Ученые из Сколтеха и других исследовательских центров заинтересовались системой BREX. По словам Юлии, с помощью биоинформатики наличие этой системы удалось предсказать для почти 10% секвенированных к настоящему моменту геномов прокариот. Показано, что, если в клетки Bacillus subtilis, не имеющие своей системы BREX, вставить ее, устойчивость клеток к фагам многократно возрастает [6]. В чем же здесь дело? На каком этапе система блокирует размножение фага: на стадии его проникновения в клетку или позже, на стадии репликации и сборки новых вирусных частиц?
В качестве модельного организма ученые взяли кишечную палочку Escherichia coli, а в качестве модельного фага — модифицированный фаг λ, несущий мутацию в гене cI, который отвечает за переход фага к лизогенной стратегии, и имеющий ген устойчивости к антибиотику хлорамфениколу взамен гена bor, кодирующего липопротеин внешней фаговой оболочки [7]. Благодаря мутации в гене cI исследователи получили фагов, которые при температуре 30 °С ведут себя как лизогенные, а при 37 °С и выше — как литические. Гены системы BREX клонировали из дикого штамма E. coli HS в плазмиду pBREXAL (рис. 1), которую вводили в клетки лабораторного штамма E. coli, от природы собственной системы BREX не имеющего (такие клетки мы будем обозначать BREX+). Клетки E. coli, трансформированные контрольной плазмидой, не несущей генов системы BREX, мы будем обозначать BREX– [7].
О том, что такое клонирование генов, можно прочитать в статье «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [8].
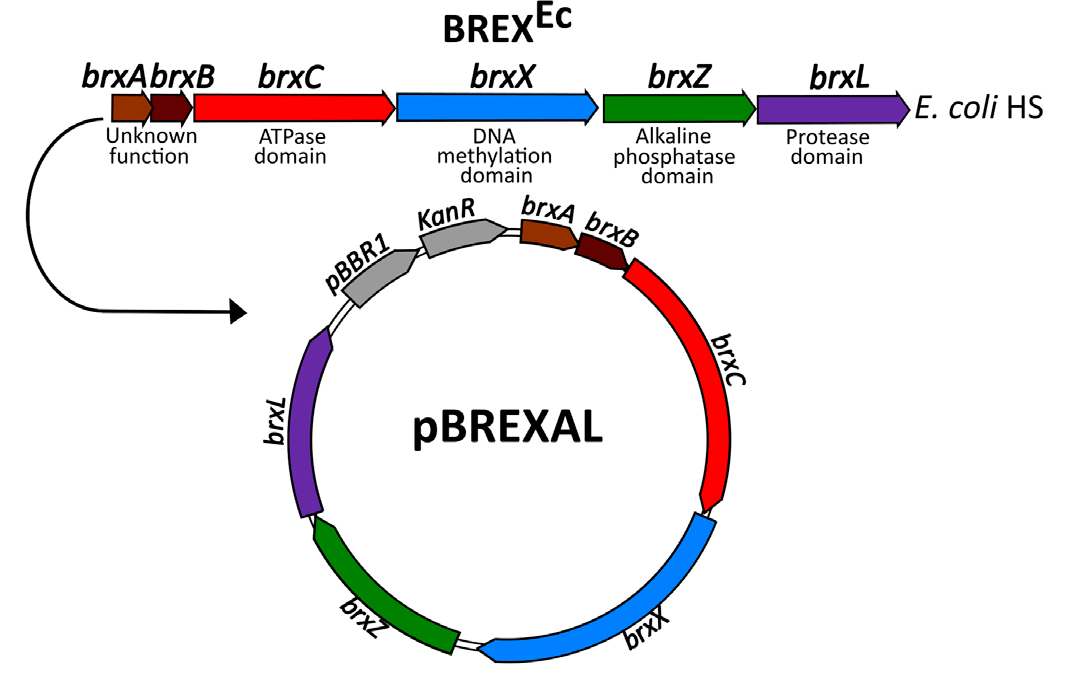
Рисунок 1. Система BREX штамма E. coli HS и созданная на ее основе плазмида, использовавшаяся в работе. pBBR1 — ориджин репликации, KanR — ген устойчивости к антибиотику канамицину.
Оказалось, что в обычных условиях клетки BREX+ и BREX– растут нормально, но первые оказались в 100 раз устойчивей к фагу λ по сравнению со вторыми при температуре 37 °С, когда фаг вел себя как литический. Таким образом выяснили, что система BREX обеспечивает защиту от литических фагов, то есть тех, которые при заражении клетки немедленно запускают собственное воспроизведение и в конце концов убивают клетку. Авторы работы предположили, что BREX действует на репликацию ДНК, так как этот процесс необходим для образования новых вирусных частиц.
А как обстоит дело с лизогенными фагами, которые интегрируются в бактериальный геном и до поры до времени ведут себя тихо, переходя на литический путь лишь в особых условиях? Дело в том, что для лизогенного пути необходимости в репликации фаговых геномов нет.
Как мы помним, использованный в работе фаг λ содержал ген устойчивости к хлорамфениколу, поэтому бактерии, в геном которых он интегрировался, должны были стать устойчивыми к этому антибиотику. Клетки E. coli заразили фагом и высеяли на чашки со средой, содержащей хлорамфеникол, чтобы отобрать только те, в геном которых встроился фаг. Затем в эти клетки ввели либо плазмиду pBREXAL, либо контрольную плазмиду, чтобы получить клетки BREX+ и BREX–, и инкубировали в жидкой культуре при температуре 30 °С, когда фаг продолжает вести себя как лизогенный. Затем культуру перенесли в термостат с температурой 42 °С, что должно было бы вызвать индукцию лизогенного фага и его превращение в литический (а следовательно, и репликацию фаговой ДНК). Однако, судя по финальному числу колоний, в клетках и BREX+, и BREX– индукция лизогенного фага проходила одинаково (клетки разрушались с одинаковой скоростью), поэтому исследователи заключили, что BREX-система не оказывает никакого влияния на индукцию лизогенных фагов. Следовательно, она действует не на уровне репликации, а влияет на жизненный цикл фага на каких-то других этапах.
Далее исследователи смогли пронаблюдать процесс инфицирования воочию с помощью флуоресцентного микроскопа . Для визуализации фага ген белка его капсида «сшили» с геном желтого флуоресцентного белка, а ДНК полностью метилировали Dam-метилтрансферазой (которая пришивает метильную группу к остатку аденина в мотиве GATC). Бактериальные же клетки, наоборот, метилирования ДНК лишили удалением Dam-метилазы, но добавили ген белка SeqA, сшитый с геном синего флуоресцентного белка. Необходимо это было для того, чтобы белок SeqA, который взаимодействует только с метилированной или полуметилированной ДНК по сайтам действия той самой Dam-метилазы, не связывался с хозяйской ДНК (неметилированной), а реагировал только на введение чужеродной ДНК (метилированной).
О современных методах микроскопии можно прочитать в статье «12 методов в картинках: микроскопия» [9].
Таким образом, при заражении клетки BREX– в ней сначала выявлялась одна светящаяся синяя точка, сигнализирующая о процессе впрыскивания (инъекции) фаговой ДНК, которая на более поздних этапах (при выборе фагом литического пути) превращалась в две, соответствующие двум частично метилированным копиям фага λ, связанным с SeqA (что говорило о начале процесса репликации фага). Наконец, в цитоплазме зараженной клетки начинали выявляться желтые точки — вирусные белки. Подобная картина наблюдалась в случае BREX– клеток, погибающих от фаговой инфекции. У тех BREX– клеток, в которых фаг выбрал путь лизогенизации, наблюдалась только одна синяя светящаяся точка и отсутствовали желтые сигналы (рис. 2).
При заражении клеток BREX+ флуоресцентных сигналов не наблюдалось вовсе, что свидетельствовало о том, что в них фаговая ДНК или не проникала, или быстро разрушалась сразу после впрыскивания. При этом такие клетки оставались живыми, поскольку, как показало окрашивание иодистым пропидием, их мембраны не повреждались.
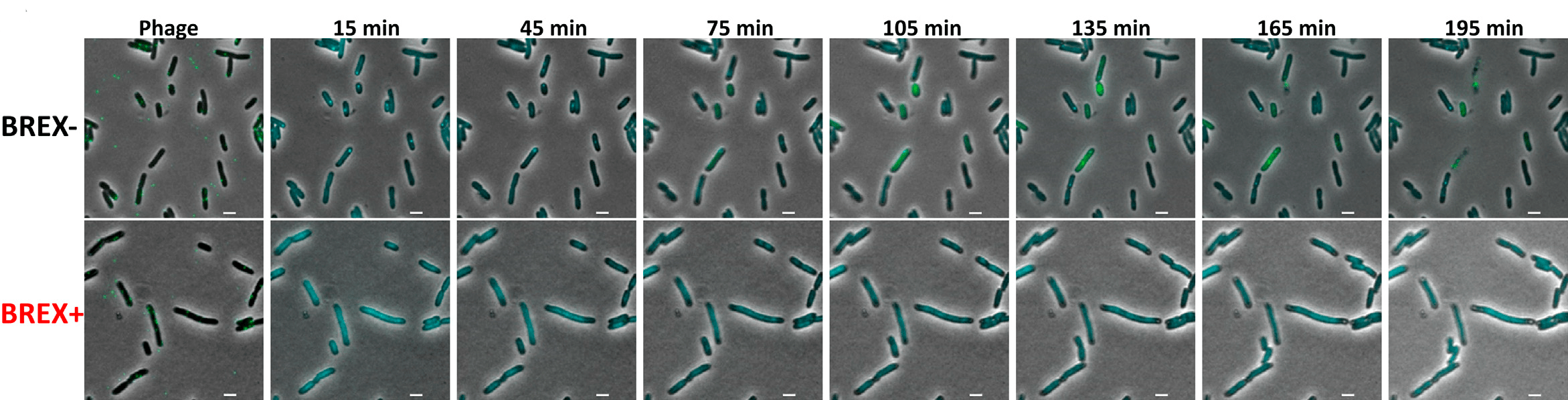
Рисунок 2. В клетках BREX+ так и не появлялось свечение вирусных белков, регистрируемых в клетках BREX–
Однако самое интересное заключается в том, что те немногие фаги, которые побывали в лизогенном состоянии в клетках BREX+ (после эксперимента по лизогенизации, описанного выше), после индукции стали устойчивы к действию системы BREX и вызывали гибель клеток BREX+ при последующем заражении! Секвенирование на платформе PacBio показало, что у таких «непобедимых» фагов все 18 мотивов GGTAAG в геноме метилированы по пятому остатку аденозина (в отличие от Dam-метилазы, которая модифицирует аденин в мотиве GATC). У фагов же, индуцированных из клеток BREX–, подобной модификации не было. Любопытно, что у дикого штамма E. coli HS, от которого была взята система BREX, наблюдалось точно такое же метилирование генома в тех же мотивах. По-видимому, с помощью такого метилирования бактерия отличает собственную ДНК от ДНК фагов, которую нужно разрушить. При этом один из генов системы BREX, brxX, кодирует метилтрансферазу, которая, как оказалось, и метилирует аденозин в геномах фагов. Функцию белкового продукта гена brxX удалось установить довольно быстро: в клетках, имеющих систему BREX без этого гена, специфическое метилирование аденозина не обнаруживалось, поэтому белок BrxX, скорее всего, является метилтрансферазой.
Подробнее о современных методах секвенирования можно почитать в статье «12 методов в картинках: секвенирование нуклеиновых кислот» [10].
У читателя может возникнуть вопрос: какой же смысл в защитной системе, которая сама же и вызывает устойчивость к себе? Ответ простой: фагов-счастливчиков, способных заразить клетки BREX+, ничтожно мало — менее 1%. А способных интегрироваться в геном и того меньше — 0,01%.
А каковы роли других генов системы BREX? Чаще всего, чтобы узнать функцию гена, получают мутантов, лишенных этого гена, и изучают их отличия от нормальных организмов. Делеция гена brxA не оказала никакого эффекта ни на защиту от фагов, ни на метилирование фаговой или геномной ДНК. Делеции генов brxB, brxC и brxZ делали систему BREX нефункциональной во всех смыслах: она больше не обеспечивала защиту от фагов и не вносила специфическую эпигенетическую метку ни в клеточную, ни в фаговую ДНК. Если экспрессировать гены системы BREX поодиночке, то в случае генов brxA, brxB, brxC и brxZ наблюдалась одна и та же картина: скорость роста бактериальной культуры не менялась, но и система BREX не обеспечивала защиту от фагов. А вот белковый продукт гена brxL оказался крайне токсичным: бактериальные клетки погибали вскоре после начала его экспрессии.
Исследователи смогли установить еще одну любопытную деталь: оказывается, гликозилирование (то есть присоединение углеводных фрагментов) фаговой ДНК защищает их от BREX-системы! В частности, система BREX бессильна против фага T4, у которого остатки цитозина в геномной ДНК гидроксиметилированы и гликозилированы. При этом от фага T4, у которого гидроксиметилцитозины в ДНК не гликозилированы, система BREX защищает весьма эффективно.
Механизм распознавания «своего» и «чужого» у систем BREX и рестрикции-модификации очень схож. Однако Юлия отмечает и ряд существенных различий между системами:
Наличие генов, кодирующих киназу, АТФазу и фосфатазу, подразумевает новый механизм избавления от фага и, возможно, новые ферменты с интересными функциями. Он может пригодиться как инструмент молекулярной биологии или даже найти медицинское применение.
Сама Юлия планирует и дальше заниматься разгадкой механизма работы BREX-систем, а именно, понять, как же эта система уничтожает фагов. Несомненно, впереди нас ждет еще много захватывающих открытий, касающихся не только BREX-системы, но и других защитных систем прокариот.
Литература
- Просто о сложном: CRISPR/Cas;
- CRISPR-системы: иммунизация прокариот;
- Противофаговая линия Мажино в клетках прокариот: новые открытия;
- Chinenova T.A., Mkrtumian N.M., Lomovskaia N.D. (1982). Genetic characteristics of a new phage resistance trait in Streptomyces coelicolor A3(2). Genetika. 18, 1945–1952;
- K. S. Makarova, Y. I. Wolf, S. Snir, E. V. Koonin. (2011). Defense Islands in Bacterial and Archaeal Genomes and Prediction of Novel Defense Systems. Journal of Bacteriology. 193, 6039-6056;
- T. Goldfarb, H. Sberro, E. Weinstock, O. Cohen, S. Doron, et. al.. (2015). BREX is a novel phage resistance system widespread in microbial genomes. The EMBO Journal. 34, 169-183;
- Gordeeva J., Morozova N., Sierro N., Isaev A., Sinkunas T., Tsvetkova K. et al. (2018). BREX system of Escherichia coli distinguishes self from non-self by methylation of a specific DNA site. Nucleic Acids Res. doi: 10.1093/nar/gky1125;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- 12 методов в картинках: микроскопия;
- 12 методов в картинках: секвенирование нуклеиновых кислот.






