Противофаговая линия Мажино в клетках прокариот: новые открытия
20 февраля 2018
Противофаговая линия Мажино в клетках прокариот: новые открытия
- 1771
- 0
- 6
-
Автор
-
Редактор
Гонка вооружений между бактериями и фагами, вероятно, не закончится никогда. Ни одна из сторон не выйдет из этой войны окончательным победителем. Все, на что могут рассчитывать противоборствующие лагеря — динамическое равновесие.
У ученых есть резон внимательно наблюдать за ходом бактериально-фаговых баталий и исследовать представленные на поле боя молекулярные механизмы. Например, после обнаружения системы CRISPR-Cas в генной инженерии произошел самый настоящий переворот.
В январе 2018 года израильские исследователи из Института Вейцмана сообщили в журнале Science об открытии у бактерий десяти неизвестных ранее защитных механизмов: девяти противофаговых и одного противоплазмидного. Некоторые из этих систем используют компоненты бактериальных жгутиков и конденсин-подобных комплексов. Кроме того, авторы предоставили свидетельства в пользу общности происхождения древних компонентов геномов бактерий, растений и простейших животных. Без сомнения, исследование открыло новые перспективы для редактирования бактериального генома [1].
Как устроен «иммунитет» бактерий?
Прокариоты используют разные механизмы противофаговой и противоплазмидной защиты. Одни из них изучены достаточно хорошо, другие открыли недавно и только начали исследовать.
Система адаптивной защиты CRISPR-Cas
Состоит из коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и ассоциированных с ними белков Cas. CRISPR были открыты еще в 1980 году, но разобраться в их функции удалось лишь в 2007-м. Пока идентифицировано три механизма CRISPR; лучше всего изучен тип II. Суть механизма состоит в том, что геном бактериофага или плазмида разрезается на фрагменты, которые включаются в локус CRISPR. При следующем проникновении в клетку тех же ДНК происходит транскрипция локуса с образованием особой crRNA (CRISPR-РНК). Она работает почти как антитела в иммунной системе человека: специфически распознает «враждебный» генетический материал и «натравливает» на него эндонуклеазу Cas. Последняя разрезает ДНК «захватчика» на безопасные фрагменты (рис. 1) [2–4].
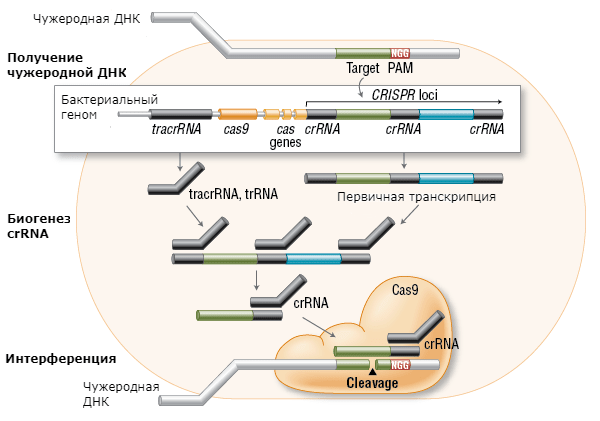
Рисунок 1. Механизм действия системы CRISPR-Cas.
Система рестрикции-модификации
Аналог врожденного иммунитета, обнаруженный учеными у бактерий более полувека назад. В классическом виде она включает два фермента: эндонуклеазу рестрикции (REase) и метилтрансферазу, или метилазу, (MTase). Расправа над бактериофагом происходит следующим образом. Изначально MTase метилирует (присоединяет метильную группу к нуклеотидам) собственную ДНК бактерии в определенных местах — сайтах рестрикции (то есть разрезания эндонуклеазой). Чужой же генетический материал попадает в клетку неметилированным. Далее в дело вступает эндонуклеаза: фермент находит неметилированные сайты рестрикции и вносит в ДНК двухцепочечный разрыв (рис. 2). Получается как в библейском сюжете, когда ангел поражал египетских первенцев в домах без особого знака на дверях [5], [6].
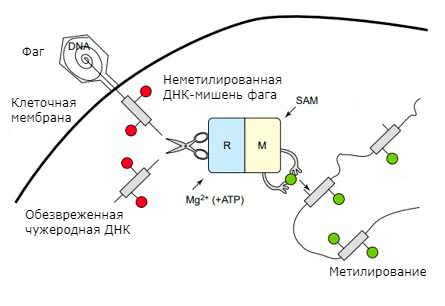
Рисунок 2. Механизм действия системы рестрикции-модификации.
Система абортивной инфекции (Abi)
Своего рода бактериальный «апоптоз». Оказывается, прокариотам не чужд альтруизм. Существует более 20 механизмов, с помощью которых бактериальная клетка убивает себя либо останавливает свой метаболизм, предотвращая распространение инфекции в общей популяции. Система Abi кодируется преимущественно мобильными генетическими элементами, включая плазмиды и профаги [5], [7], [8].
BREX
Защитный механизм, открытый в 2014 году. Ученые получили из Bacillus cereus генную кассету с шестью генами и интегрировали ее в геном Bacillus subtilis. Донорские гены помогли микроорганизму выработать резистентность к разным видам фагов, как вирулентным, так и умеренным. Предположительно, гены в кассете кодируют домены lon-подобной протеазы, щелочной фосфатазы, РНК-связывающего белка, ДНК-метилазы, АТФазы, а также белок с неизвестной функцией (рис. 3). Система BREX подавляет репликацию фаговой ДНК, не приводя к ее разрушению или деградации [9].
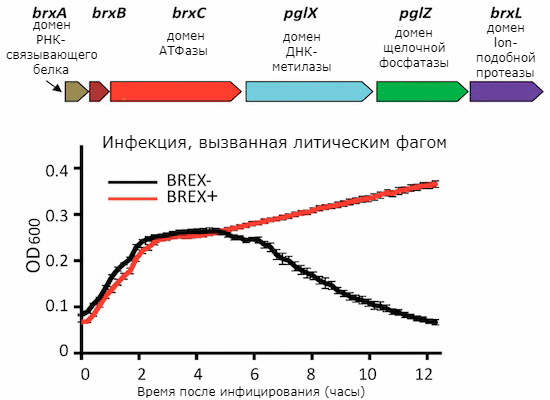
Рисунок 3. Система защиты BREX.
Прокариотические белки Argonaute (pAgo)
Относительно простая и довольно эффективная система защиты бактериальных клеток от чужеродного белка. В эукариотических клетках белки Ago играют ключевую роль в РНК-интерференции [10]. В 2014 году журнал Nature опубликовал статью, в которой ученые сообщали об открытии ДНК-интерференции с участием Ago у прокариот [11]. В ходе изучения микроорганизма Thermus thermophilus было установлено, что, когда в бактериальную клетку проникают чужеродные плазмиды, белок TtAgo образует комплекс с малой интерферирующей ДНК (siDNA) длиной 13–25 нуклеотидов и использует ее для связывания и расщепления комплементарных ей плазмидных ДНК-мишеней. При этом TtAgo умеет различать геномную и «чужую» ДНК. В 2017 году похожие свойства обнаружили у белков PfAgo (Pyrococcus furiosus) и MjAgo (Methanocaldococcus jannaschii) [12].
DISARM
Еще одна недавно открытая защитная система бактерий с не до конца изученным механизмом действия. Известно, что она включает четыре гена, кодирующих ДНК-метилазу, домен фосфолипазы D (PLD), домен хеликазы, домен DUF1998 и еще один ген с неизвестной функцией. DISARM работает по тому же принципу, что система рестрикции-модификации. При переносе DISARM от Bacillus paralicheniformis в Bacillus subtilis система обеспечивала защиту от всех трех семейств «хвостатых» бактериофагов Caudovirales [13].
Разные бактерии предпочитают использовать разные системы защиты. Так, система рестрикции-модификации есть у 75% прокариот, CRISPR-Cas — у 40%. BREX и pAgo встречаются реже — примерно у 10% бактерий и архей [1].
Ответ бактериофагов
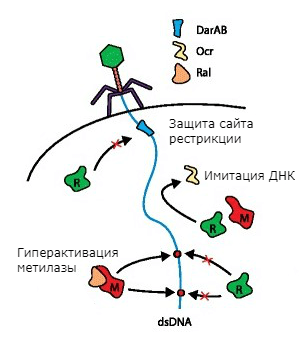
Рисунок 4. Механизмы защиты фагов от системы рестрикции-модификации.
Бактерии изобретательны, но и фаги не дремлют. Они постоянно пытаются найти брешь в обороне, создают хитрые механизмы для нейтрализации защиты. И, нужно признать, у них это неплохо получается.
Так, в геномах некоторых бактериофагов закодированы короткие белки, которые подавляют или модулируют работу системы рестрикции-модификации. Атакуя Escherichia coli, фаг P1 впрыскивает в ничего не подозревающую бактерию не только свою ДНК, но и белки DarA и DarB. Они защищают сайты рестрикции фага. Бактериофаг T7 кодирует протеин Ocr, который, маскируясь под ДНК, связывает клеточные эндонуклеазу рестрикции и метилазу. Фаг лямбда использует белок Ral, чтобы вызвать гиперактивацию клеточной метилазы и с ее помощью оперативно обеспечить защиту своего генетического материала от рестрикции (рис. 4) [14].
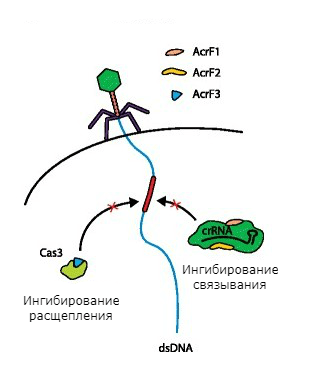
Рисунок 5. Механизмы защиты фагов от системы CRISPR-Cas.
Против системы CRISPR-Cas фаги используют белки анти-CRISPR (Acr) [15]. В качестве примера можно привести три белка Acr синегнойного бактериофага, который поражает синегнойную палочку. Эта бактерия использует для самообороны тип I-F системы CRISPR-Cas. Два белка — Acr1 и Acr2 — связываются с комплексом crRNA, не давая ему вступить во взаимодействие с ДНК фага. А белок Acr3 связывается с хеликазой-нуклеазой Cas3, предотвращая деградацию ДНК-мишени (рис. 5).
Интересно, что белки Acr обладают высокой степенью специфичности. Они не подавляют «иммунитет» кишечной палочки, которая также использует подтип системы I-F. Не происходит подавления и у синегнойных палочек, использующих другой тип CRISPR-Cas — I-E [14].
Выяснили, что некоторые фаги обходят и систему BREX. Но какие механизмы они выработали для защиты, еще предстоит изучить [9].
Трансплантация генов и божественные имена
Известно, что гены «иммунной системы» прокариот склонны группироваться на определенных участках генома. Так, гены, кодирующие ферменты рестрикции, часто обнаруживают в окрестностях генов системы абортивной инфекции и других защитных систем. Такие зоны генома называются защитными островками [1].
Ученые из Института Вейцмана предположили, что на защитных островках есть еще немало белых пятен. Возможно, существуют неизвестные защитные системы, гены которых следуют общей тенденции и находятся в пределах островков [1].
Для того чтобы проверить свое предположение, ученые исследовали более 14 тыс. семейств белков в 45 тыс. геномов прокариот. После тщательного «кастинга» осталось 335 семейств-кандидатов [1].
Проверку потенциальных защитных систем решили провести на двух микроорганизмах: Escherichia coli (штамм MG1655) и Bacillus subtilus (штамм BEST7003), в чьих геномах не обнаружили исследуемых генов. Для того чтобы перенесенные гены начали функционировать, в качестве доноров использовали мезофильные микроорганизмы, филогенетически наиболее близкие к реципиентам. Для контроля ученые повторили процедуру с пятью уже известными защитными системами: тремя типами системы рестрикции-модификации, системой абортивной инфекции и системой токсин-антитоксин [1].
После того как реципиенты получили новые гены, их подвергли атаке «коктейля», в состав которого входили 10 фагов Bacillus subtilus и 6 фагов Escherichia coli. У 9 систем обнаружили способность защищать микроорганизм как минимум от одного бактериофага [1].
Новые защитные системы назвали в честь богов из разных мифологий. Отдельного внимания заслуживают три из них [1].
Zorya
Систему назвали в честь славянской богини. Гены этой системы встречаются в бактериальном геноме вблизи генов семейства pfam15611. Система Zorya бывает двух типов. Первый тип (zorABCD) включает 4 гена: zorA, zorB, zorC (собственно, pfam15611, функция которого неизвестна) и zorD. Второй тип (zorABE) лишен генов zorC и zorD, но включает в дополнение к двум первым третий ген zorE. Ученые обнаружили, что гены zorA и zorB содержат домены протеинов, которые показывают отдаленную, но четкую гомологию с доменами в генах motA и motB. Последние кодируют мембранные протеины, которые входят в состав жгутикового двигателя (рис.6) [1].
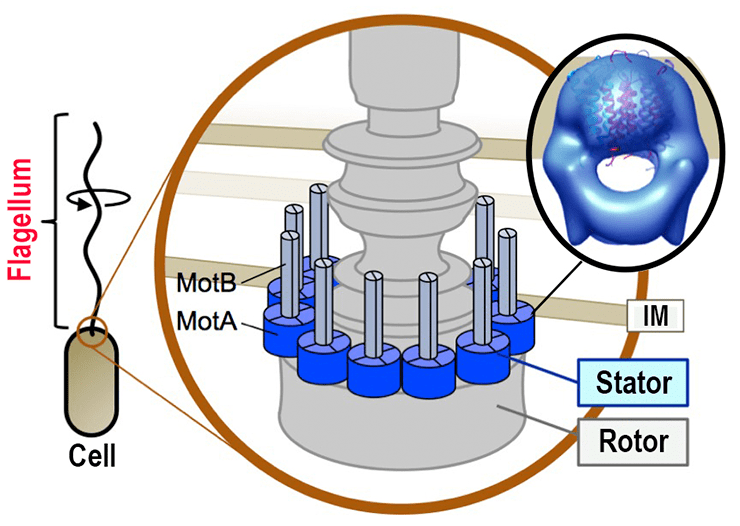
Рисунок 6. Роль протеинов MotA и MotB в составе жгутикового двигателя.
Система MotAB формирует статическую часть, внутри которой вращается жгутик, а также протонный канал, благодаря которому вырабатывается энергия для вращения [1].
Ученые предположили, что продукты генов zorC, zorD и zorE принимают участие в поиске и инактивации чужеродного генетического материала, а если они не срабатывают, ZorA и ZorB открывают протонный канал, что приводит к деполяризации и гибели клетки. Иными словами, Zorya может работать как разновидность системы абортивной инфекции [1].
Thoeris

Рисунок 7. Разновидности рецепторов опознавания паттернов в клетках эукариот:
- TLR — Toll-подобные рецепторы;
- NLR — Nod-подобные рецепторы;
- CLR — лектины С-типа;
- RLR — RIG-I-подобные рецепторы.
Система получила свое название в честь древнеегипетского бога деторождения и плодородия. Она представлена двумя генами, встречающимися в области pfam08937: thsA и thsB (собственно, включающий pfam08937, также известный как TIR-домен — Toll-интерлейкиновый рецептор). Система Thoeris роднит бактерии с эукариотами: TIR-домен является важной составляющей врожденного иммунитета у растений, беспозвоночных и млекопитающих [1], [16].
У животных TIR-домен зачастую формирует внутриклеточный компонент связанных с мембраной Toll-подобных рецепторов (рис. 7). Израильские ученые выдвинули гипотезу, согласно которой система Thoeris — это предшественница системы рецепторов опознавания паттернов, представленной в том числе Toll-подобными рецепторами. Рецепторы опознавания паттернов представляют собой белки, которые находятся на поверхности иммунных клеток эукариот и распознают стандартные молекулярные структуры (паттерны) патогенов [1], [17], [18].
Druantia
Систему назвали в честь галльской богини. Druantia представлена геном, кодирующим очень большой белок, содержащий домен DUF1998 с неизвестной функцией, а также «следы» хеликазы и мотив Walker A/B, указывающий на использование АТФ. Обычно этому большому гену предшествует один из трех типов набора генов, у которых не идентифицированы домены и функции [1].
Огромный размер системы Druantia говорит о ее сложной функции, а почти полное отсутствие распознаваемых доменов — о том, что она не похожа ни на одну известную защитную систему прокариот [1].
Защита от чужеродных плазмид
Помимо девяти противофаговых, ученые обнаружили у бактерий одну новую систему защиты от плазмид. Ее назвали Wadjet — по имени древнеегипетского божества. Все три известных типа системы представлены четырьмя генами: jetA, jetB, jetC и jetD. Оказалось, что первые три имеют структурную гомологию с генами конденсинов MukF, MukE и MukB. Конденсины отвечают за организацию и расхождение хромосом при делении клетки [1].
Ученые выдвинули гипотезу о том, что гены jetABC произошли от mukBEF и стали специализироваться на защитной функции. Возможно, их продукты, используя свои свойства конденсинов, препятствуют правильной сегрегации чужеродных плазмид и тем самым предотвращают их передачу дочерним клеткам [1], [19].
Перспективы
Точка в изучении бактериально-фаговой гонки вооружений не поставлена. Скорее, у исследователей из Института Вейцмана получилось большое многоточие. Наверняка известны еще далеко не все защитные системы бактерий. Некоторые из них по тем или иным причинам могли не проявить себя в ходе исследования: ведь даже уже известные защитные механизмы, которые ученые использовали для контроля, оказались эффективны лишь в половине случаев [1].
Кто знает, может быть, настанет день, когда будет открыта очередная защитная система прокариот, и с ее помощью удастся совершить переворот в молекулярной биологии, в тени которого затеряется даже слава знаменитой CRISPR-Cas.
Литература
- Shany Doron, Sarah Melamed, Gal Ofir, Azita Leavitt, Anna Lopatina, et. al.. (2018). Systematic discovery of antiphage defense systems in the microbial pangenome. Science. eaar4120;
- M. Jinek, K. Chylinski, I. Fonfara, M. Hauer, J. A. Doudna, E. Charpentier. (2012). A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science. 337, 816-821;
- CRISPR-эпопея и ее герои;
- Просто о сложном: CRISPR/Cas;
- Kimberley D. Seed. (2015). Battling Phages: How Bacteria Defend against Viral Attack. PLoS Pathog. 11, e1004847;
- Mark R Tock, David TF Dryden. (2005). The biology of restriction and anti-restriction. Current Opinion in Microbiology. 8, 466-472;
- Ron L. Dy, Rita Przybilski, Koen Semeijn, George P.C. Salmond, Peter C. Fineran. (2014). A widespread bacteriophage abortive infection system functions through a Type IV toxin–antitoxin mechanism. Nucleic Acids Research. 42, 4590-4605;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- T. Goldfarb, H. Sberro, E. Weinstock, O. Cohen, S. Doron, et. al.. (2015). BREX is a novel phage resistance system widespread in microbial genomes. The EMBO Journal. 34, 169-183;
- Обо всех РНК на свете, больших и малых;
- Daan C. Swarts, Matthijs M. Jore, Edze R. Westra, Yifan Zhu, Jorijn H. Janssen, et. al.. (2014). DNA-guided DNA interference by a prokaryotic Argonaute. Nature. 507, 258-261;
- Gavin G. Rutledge, Cristina V. Ariani. (2017). Finding the needle in the haystack. Nat Rev Micro. 15, 136-136;
- Gal Ofir, Sarah Melamed, Hila Sberro, Zohar Mukamel, Shahar Silverman, et. al.. (2018). DISARM is a widespread bacterial defence system with broad anti-phage activities. Nat Microbiol. 3, 90-98;
- John van der Oost, Stan J. J. Brouns. (2015). CRISPR sabotage. Genome Biol. 16;
- Анти-CRISPR: ответ вирусов;
- Surekha Nimma, Thomas Ve, Simon J. Williams, Bostjan Kobe. (2017). Towards the structure of the TIR-domain signalosome. Current Opinion in Structural Biology. 43, 122-130;
- Pattern recognition receptors. British society for immunology;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- T. Hirano. (2005). SMC proteins and chromosome mechanics: from bacteria to humans. Philosophical Transactions of the Royal Society B: Biological Sciences. 360, 507-514.