Термофорез
03 июля 2015
Термофорез
- 3063
- 2
- 0
Аллегория. Облака-молекулы устремляются прочь от солнечного тепла.
Рисунок в полном размере.
-
Автор
-
Редакторы
Термофорез — движение молекул в градиенте температур — давно используется в химии и физике для изучения коллоидных растворов. Добавив инфракрасный лазер к флуоресцентному микроскопу, разработчики метода добились локальных изменений температуры и возможности тут же регистрировать изменения сигнала от молекул. Метод окрестили микроскопическим термофорезом, и в 2010 году он дебютировал в биологии. Метод позволяет делать точные количественные оценки самых разных бимолекулярных взаимодействий (например, белок–лиганд, белок–белок, белок–нуклеиновая кислота и т.д.). Измерения можно проводить непосредственно в биологических жидкостях, что приближает условия к естественным, исключает необходимость иммобилизации молекул и просто экономит время. Всё это делает микроскопический термофорез привлекательным методом как для фундаментальных исследований, так и для биомедицинских приложений.
Теоретическое введение
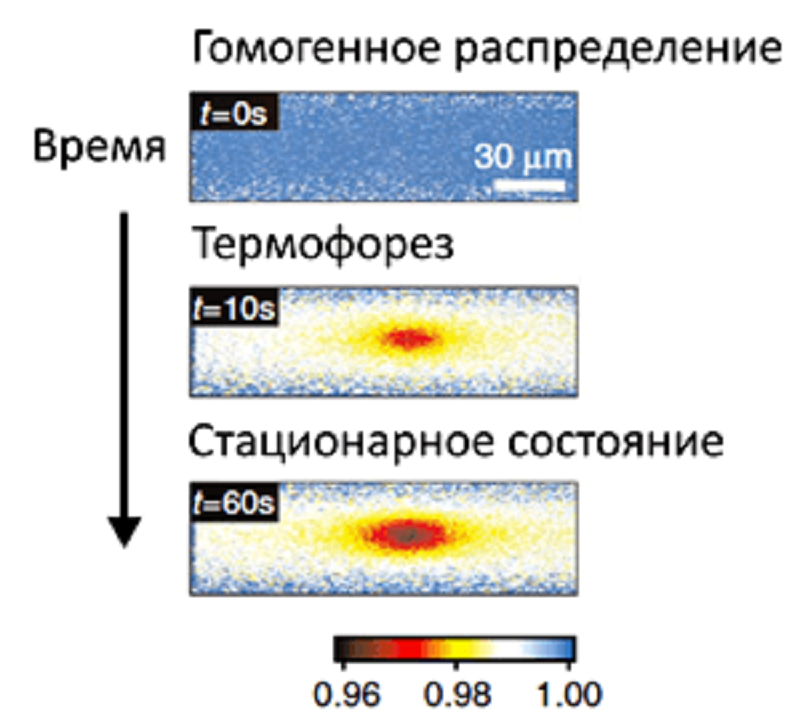
Метод микроскопического термофореза (МСТ, англ. microscale thermophoresis, MST) основан на движении молекул в градиенте температур (греч. Θερμη — тепло, φορεω — переношу). Температурный градиент достигается освещением капилляра с исследуемыми молекулами инфракрасным (ИК) лазером. В зоне нагрева частицы движутся быстрее и «расталкивают» друг друга. Поэтому поток частиц устремляется в более холодные области капилляра (рис. 1А), и их концентрация в зоне нагрева снижается (рис. 1Б) [1], [2]. Изменение концентрации регистрируют по снижению флуоресценции в зоне нагрева. По сути, с помощью МСТ измеряют динамику изменения концентрации молекул в зоне нагрева. Метод позволяет определять наличие комплексов и силу взаимодействия молекул, потому что связывание молекул друг с другом приводит к изменению их подвижности в температурном градиенте.
Предыстория
Как и многое в биологии, термофорез уже давно известен и используется в физике и коллоидной химии. Эффект термофореза в газовых смесях впервые наблюдал сэр Джон Тиндаль (John Tyndall) в 1870 году, а в 1882 термофорезом заинтересовался Лорд Рэлей (Rayleigh). В жидкостях этот же эффект наблюдал немецкий физиолог Карл Фридрих Вильгельм Людвиг (Carl Ludwig) в 1856 году, а теоретическое описание процесса предложил Шарль Сорé (Charles Soret) спустя 20 лет. Поэтому часто термофорез называют эффектом Сорé (или Людвига-Соре), а также термодиффузией. Большой вклад в теорию эффекта внес академик Б.В. Дерягин [3]. Интересно, что при всей кажущейся «лабораторности» термофорез причастен к таким процессам, как движение облаков и туманов и даже разделение изотопов в лаве [4].
Как поставить МСТ-эксперимент?
Метод МСТ в современном виде появился сравнительно недавно, в 2010 году [2], [5]. Он был коммерциализирован компанией Nano Temper Technologies. Из-за простоты и удобства использования он завоевал сердца многих исследователей, и на сегодняшний день уже опубликовано несколько протоколов по изучению аффинности различных молекул методом МСТ (например, [6]). Это позволяет новичкам быстро освоить метод и использовать его наравне с другими привычными биохимическими процедурами.
О чем говорят фазы термофоретической кривой?
Что можно определить по фазам термофореза, показано в таблице 1. Следует заметить, что и термофорез, и Т-скачок могут нести в себе информацию об образовании комплексов. Чувствительность фазы Т-скачка зависит от выбора метки и буфера: например, флуоресценция метки может зависеть от температуры. Поэтому исследователю нужно принять решение, рассматривать ли обе фазы вместе или же по отдельности (подробнее о выборе — в статьях [10], [11]).
| Фаза | Что влияет на фазу? | Что можно определить по фазе? |
|---|---|---|
| Т-скачок | Изменение собственной флуоресценции метки в результате изменения микроокружения при образовании комплекса | Число комплексов, «жесткость» структуры |
| Термофорез | Всё, что изменяет коэффициент диффузии и термофоретическую подвижность молекул: размер, заряд, изменения в гидратной оболочке и др. | Число комплексов |
| Обратная диффузия | Гидродинамический радиус | Размер молекул |
| Конвекция | Масса молекул | Агрегация |
Какие выводы можно сделать?
По зависимости числа комплексов от концентрации молекулы-партнёра (лиганда) можно рассчитать константу диссоциации Kd с высокой точностью. Константа диссоциации — это та концентрация лиганда, при которой половина молекул белка уже связалась с лигандом. Чем меньше Kd — тем выше сродство молекул друг к другу.
Но этим не исчерпываются возможности метода. По поведению молекул во время МСТ-эксперимента можно определить олигомеризацию или агрегацию, а также изменение конформации молекул.
МСТ и другие методы: плюсы и минусы
На сегодняшний день для определения аффинности используют методы, основанные на адсорбции или химическом прикреплении исследуемых молекул к поверхности. Например, плазмонный резонанс основан на значительном усилении интенсивности флуоресценции или комбинационного рассеяния молекул вблизи наночастиц золота или серебра [12], [13]. Этот метод очень чувствителен и позволяет проводить множество измерений в день (до 7000), однако прикрепление молекул к поверхности металла происходит не без последствий... Аналогичная ситуация характерна для иммуноферментного анализа (ИФА, англ. ELISA). Флуоресцентная корреляционная спектроскопия (FCS) основана на изменении коэффициента диффузии молекул при образовании комплекса, что ограничивает выбор исследуемых молекул. Например, присоединение низкомолекулярных соединений или ионов к макромолекулам в большинстве случаев не влияет на коэффициент диффузии последних. «Золотым стандартом» измерения Кd является изотермическая калориметрия (ITC). Однако она требует большой концентрации образца, строгого подбора буферных растворов и обладает очень низкой производительностью (от 3 до 25 измерений в день) [14]. Интерферометрия обратного рассеяния, как и предыдущий метод, позволяет исследовать молекулярные взаимодействия в максимально естественных условиях и применима даже для мембранных рецепторов. Основная трудность — это правильная интерпретация данных, так как на сигнал влияет показатель преломления среды [15].
МСТ обладает рядом преимуществ перед перечисленными методами:
- Требуется малая концентрация образца;
- Можно исследовать взаимодействие молекул в условиях, близких к естественным: клеточном лизате и сыворотке крови;
- Можно исследовать взаимодействие практически любых молекул: от ионов до белковых агрегатов, взаимодействие белков с нуклеиновыми кислотами, фосфолипидами, ионами;
- Быстро, просто; константа диссоциации рассчитывается автоматически.
Из ограничений, присущих МСТ, можно назвать необходимость флуоресценции исследуемого вещества. Для этого нужно использовать флуоресцентные метки, так что МСТ уже не может претендовать на абсолютную неинвазивность. Можно использовать и собственную флуоресценцию образца (например, триптофановую флуоресценцию белков), но только с условием, что спектры флуоресценции молекулы и ее партнёра не перекрываются [2], [14].
Как используется термофорез?
Влияние среды на аффинность молекул
Одно из основных преимуществ МСТ состоит в том, что проводить измерения можно в растворах любого состава. Работать можно даже в клеточном лизате или сыворотке крови, т.е. практически in situ. Однако при работе в сложных биологических смесях необходимо учитывать их возможное влияние на результаты. Например, в сыворотке крови содержится большое количество сывороточного альбумина, который способен связывать множество разных молекул, тем самым снижая их концентрацию (рис. 3а). Поэтому константы связывания, полученные в буферном растворе без альбумина и в сыворотке крови, будут отличаться. В качестве примера на рисунке 3 (б и г) показаны кривые связывания протеинкиназы А (ПКА) со своим ингибитором кверцетином в солевом буферном растворе и в сыворотке крови разной концентрации. Как оказалось, поведение кверцетина сильно зависит от среды: его сродство к ПКА падает в зависимости от концентрации сыворотки. При этом вид кривой, полученной в сыворотке крови и в чистом растворе сывороточного альбумина, совпадает.
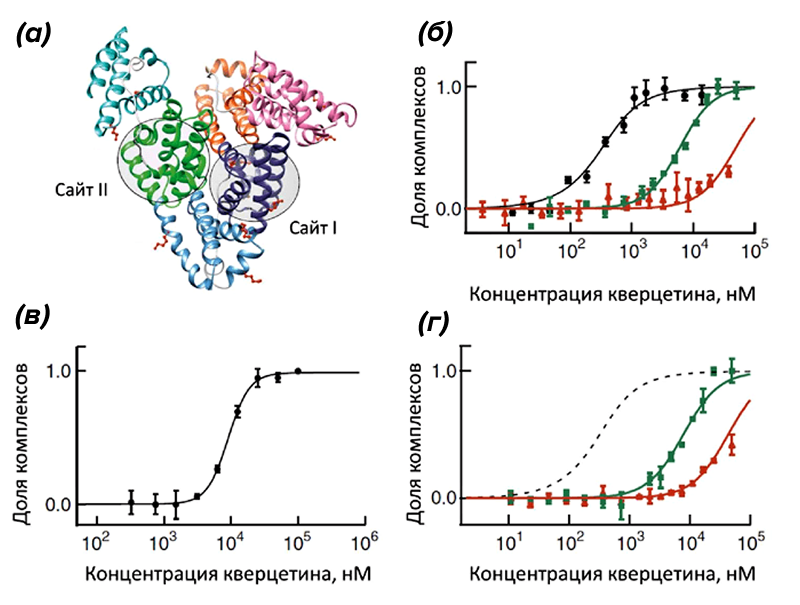
Рисунок 3. Влияние среды на аффинность молекул. (а) — строение бычьего сывороточного альбумина (БСА) с двумя основными сайтами связывания. (б) — взаимодействие ингибитора кверцетина с цАМФ-зависимой протеинкиназой А (ПКА) в буфере (черные кружки), 5-процентной сыворотке крови (зеленые квадраты) и 30-процентной сыворотке крови (красные треугольники). В этом случае Kd сильно сдвигается: в буфере она составляет 0,13 мкМ, в 5-процентной сыворотке — 6 мкМ, а в 30-процентной — уже 50 мкМ. (в) — кривая связывания флуоресцентно меченного сывороточного альбумина с кверцетином. (г) — подтверждение причастности сывороточного альбумина к изменению сродства кверцетина к ПКА. В буферный раствор для измерений МСТ исследователи добавляли альбумин в той концентрации, которая характерна для 5-процентной и 30-процентной сыворотки крови. Кривая связывания обозначена в первом случае зелеными квадратами, во втором — красными треугольниками. Пунктиром показано взаимодействие кверцетина с ПКА в буфере. Сравнивая изображения ((б)) и ((г)), которые оказались почти идентичными, исследователи пришли к выводу, что именно сывороточный альбумин влияет на изменение аффинности кверцетина к ПКА.
рисунок из [2], адаптирован
Сам факт сильной зависимости поведения молекул от условий среды стимулирует научное сообщество отдавать предпочтение методам, позволяющим работать в более естественных (нативных) условиях.
Белки и нуклеиновые кислоты
Так как МСТ позволяет работать в клеточном лизате, необходимость в сложных процедурах выделения и очистки белков во многих случаях отпадает. Это важно при исследовании тех белков, которые с большим трудом поддаются очистке и выделению, не теряя своих свойств, — например, белков, взаимодействующих с нуклеиновыми кислотами. В первую очередь речь идет о транскрипционных факторах (ТФ).
Известно, например, что ТФ семейства STAT, участвующие во множестве регуляторных процессов, после активации связываются с определенными последовательностями ДНК, т.н. GAS (Interferon-gamma activated sequence). Однако константу диссоциации STAT-белков с этими последовательностями напрямую измерить не удавалось. Также не было известно, связываются ли они с другими участками ДНК. В ходе работы [6], в которой изучали аффинность транскрипционного фактора STAT3 в активном и неактивном состоянии к различным последовательностям нуклеотидов в клеточном лизате, было показано, что сродство активной и неактивной формы к разным участкам ДНК отличается, причем неожиданным образом.
Кроме того, МСТ позволяет исследовать сродство аптамеров к молекулам-мишеням, что может найти широкое применение как в фундаментальной науке, так и в медицинской диагностике. Например, в работе [16] изучали активность ДНК-аптамеров, связывающих тромбин, in vivo (в плазме крови).
Еще одно направление исследований, требующее численных характеристик взаимодействия белков с нуклеиновыми кислотами, — это изучение устройства хроматина. Так, в 2012 году Томас Шуберт и его коллеги раскрыли механизм взаимодействия белка деконденсации хроматина дрозофилы Df31 с нуклеосомами. Оказывается, Df31 связывается с гистонами Н1 и Н2 только в присутствии хроматин-ассоциированных мякРНК (рис. 4). При этом был наконец-то отброшен вариант связывания Df31 непосредственно с ДНК [17].
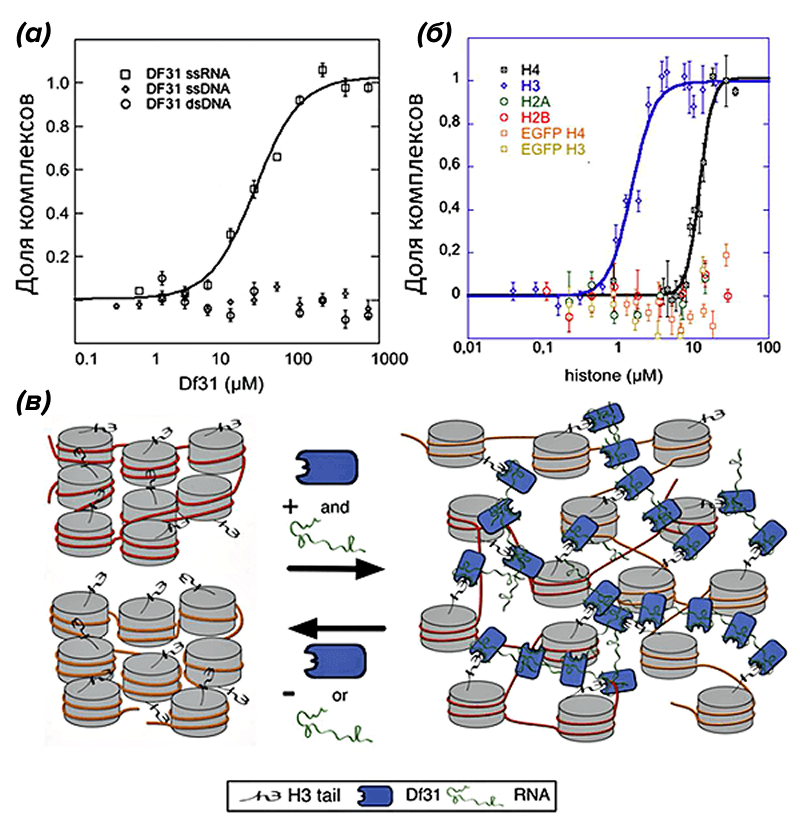
Рисунок 4. МСТ для изучения устройства хроматина. (а) — кривая связывания фактора деконденсации хроматина Df31 с одноцепочечной РНК (ssRNA) обозначена квадратами, с одноцепочечной ДНК (ssDNA) — ромбами, с двухцепочечной ДНК (dsDNA) — кружками. Как видно, Df31 взаимодействует только с ssRNA. (б) — кривая связывания Df31с гистонами Н4 обозначена черными квадратами, с Н3 — синими ромбами. Кd с гистоном Н3 меньше, следовательно, сродство выше. Связывания с другими гистонами не наблюдается: добавление Н2А обозначено зелеными кружками, Н2В — красными. Отрицательный контроль: кривая связывания зеленого флуоресцентного белка (EGFP) с гистоном Н4 обозначена красными квадратами, с Н3 — желтыми. (в) — модель компактизации хроматина рибонуклеопротеидным комплексом РНК+Df31+гистон Н3.
рисунок из [17], адаптирован
Белок-белковые взаимодействия
Хотя МСТ позволяет исследовать связывание самых разных молекул, всё же ключевым типом взаимодействий, происходящим в клетках, являются белок-белковые взаимодействия. Качественная и количественная оценка белок-белковых взаимодействий является краеугольным камнем в установлении последовательности каскадных реакций и построении метаболических моделей. Это имеет особое значение для белков или белковых доменов со множественной специфичностью. В этом контексте МСТ может оказаться неплохим «мостиком» между протеомикой и интерактомикой, то есть между определением «что же в клетке есть» и осознанием «что с чем взаимодействует» (всевозможные -омики подробно разбираются в статье «„Омики“ — эпоха большой биологии» [18]).
Рассмотрим пример. В 2013 году Пауль Майкут с соавторами выбрали для изучения SH2-домен тирозинкиназ семейства Src («сарк») [19]. У белков, содержащих SH2-домены, «глаза разбегаются» от многообразия возможных партнёров. SH2-домен узнает фосфотирозин целого спектра белков, поэтому участвует в трансмембранной передаче сигнала, активации киназных каскадов и, в конце концов, регуляции экспрессии генов. Это и создает основную трудность изучения подобных белков, ведь во многих случаях не известны ни очередность взаимодействия, ни длительность, ни требования к посттрансляционной модификации. Авторы статьи предложили эффективный и быстрый способ получения качественной и количественной информации о белок-белковых взаимодействиях, который состоит из двух этапов. Первый этап — качественный, на нем используют белковую преципитацию (соосаждение, англ. pull-down), то есть осаждение белков из раствора с помощью их белковых партнёров. Для этого этапа подойдет также любой другой метод, например, современный иммуноферментный анализ с временным разрешением DELFIA (принцип метода и видео можно найти на сайте PerkinElmer). После того как отброшены все потенциальные партнёры, не оправдавшие себя, начинается второй этап — количественный, то есть определение Кd всех исследуемых белок-белковых комплексов методом МСТ. После этого можно делать выводы об очередности и длительности взаимодействий в каскаде реакций (рис. 5).
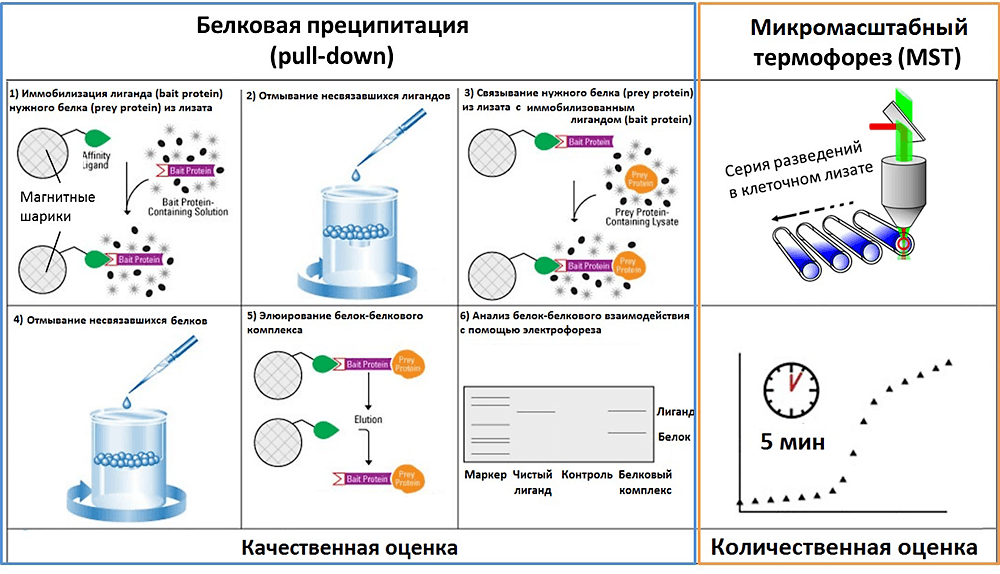
Рисунок 5. Комбинация методов изучения аффинности. Протокол белковой преципитации (pull-down assay) показан в синей рамке слева, протокол МСТ — в оранжевой рамке справа.
рисунок создан на основе материалов сайта компании Life Technologies и статьи [8]
Другой пример — это еще более сложный каскад реакций, связанный с транскрипционным фактором NF-kB [20]. В норме NF-kB ингибируется белком IkB. При поступлении внеклеточного сигнала киназа IKK фосфорилирует этот ингибитор, вызывая присоединение к нему полиубиквитинового хвоста — «метки смерти» для белка [21], [22]. Это приводит к деградации ингибитора в протеасоме. Без ингибитора NF-kB поступает в ядро и активирует экспрессию целого ряда генов. Для демонстрации своего подхода авторы статьи [20] выбрали регуляторную субъединицу киназы IKK и изучили ее взаимодействие с полиубиквитиновым хвостом.
Мембраны и мембранные белки
Кроме растворимых белков, МСТ позволяет исследовать белки мембранные. Например, в работе [10] представлен способ изучения слияния липосом, содержащих два трансмембранных рецептора: v-SNARE (синаптобревин) и комплекс белков t-SNARE (SNAP25) и синтаксина. Белки v-SNARE (от слова «везикулярный», vesicle) и t-SNARE (от слова «целевой», target) — это ключевые белки, обеспечивающие слияние мембран: они связываются, образуют комплекс, похожий на застежку-молнию, и стягивают мембраны до тех пор, пока те не сольются (рис. 6). Схема эксперимента приведена в подписи к рисунку.
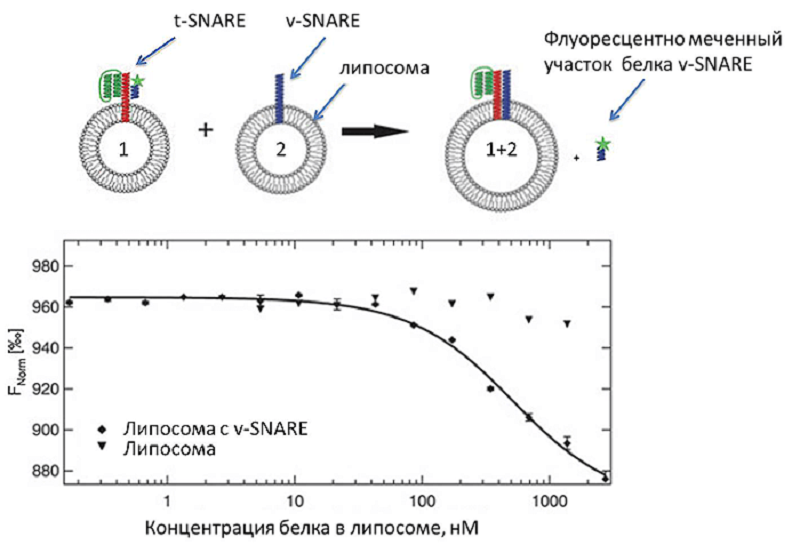
Рисунок 6. Слияние липосом. Сверху показана схема эксперимента: липосомы с комплексом t-SNARE (липосома 1) соединяли с кусочком белка v-SNARE с флуоресцентной меткой (показана звездочкой). В раствор добавляли липосомы, содержащие целый трансмембранный белок v-SNARE (липосома 2), который вытеснял флуоресцентный пептид. Образовав прочный комплекс, v-SNARE и t-SNARE вызывали слияние мембран липосом, о чем можно было судить по увеличению флуоресценции вытесненного пептида. Внизу показана кривая слияния липосом (или связывания рецепторов). Ромбами обозначена кривая слияния липосомы 1 с липосомой 2. Треугольниками показано отсутствие слияния липосомы 1 с липосомой без рецептора.
Другим важным направлением изучения мембранных процессов является исследование липид-белковых взаимодействий, где с недавних пор также используют МСТ. Например, в работе [23] авторы конструировали липосомы разного липидного состава и изучали взаимодействие липосом с антибактериальным пептидом I-RW методом МСТ (рис. 7).
Белки и малые молекулы
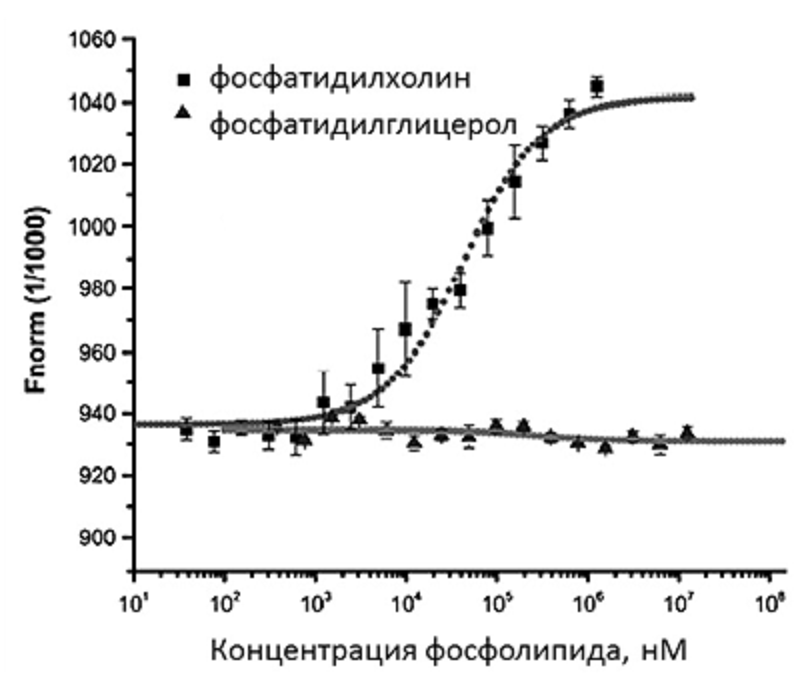
Рисунок 7. Исследование липид-белковых взаимодействий. Кривая связывания антибактериального пептида I-RW с фосфолипидами в 1-процентном БСА. Квадратами обозначена кривая для отрицательно заряженного фосфатидилглицерола, треугольниками — для положительно заряженного фосфатидилхолина.
МСТ открывает широкие перспективы для изучения взаимодействия белков с нуклеиновыми кислотами, липидами и другими белками. А благодаря тому, что при расчетах Kd учитывают изменение целого ряда параметров (размера, заряда и гидратной оболочки) исследуемых молекул, метод МСТ позволяет изучать связывание белков с малыми молекулами и даже ионами, что не под силу другим методам. На рисунке 9 показано взаимодействие ионов кальция с кальмодулином (КМ). Присоединение кальция не влияет ни на флуоресценцию, ни на молекулярный вес КМ, а приводит только к изменению его конформации и перестройке гидратной оболочки, что отражается на его термофоретической подвижности, которую фиксируют в ходе МСТ-эксперимента.
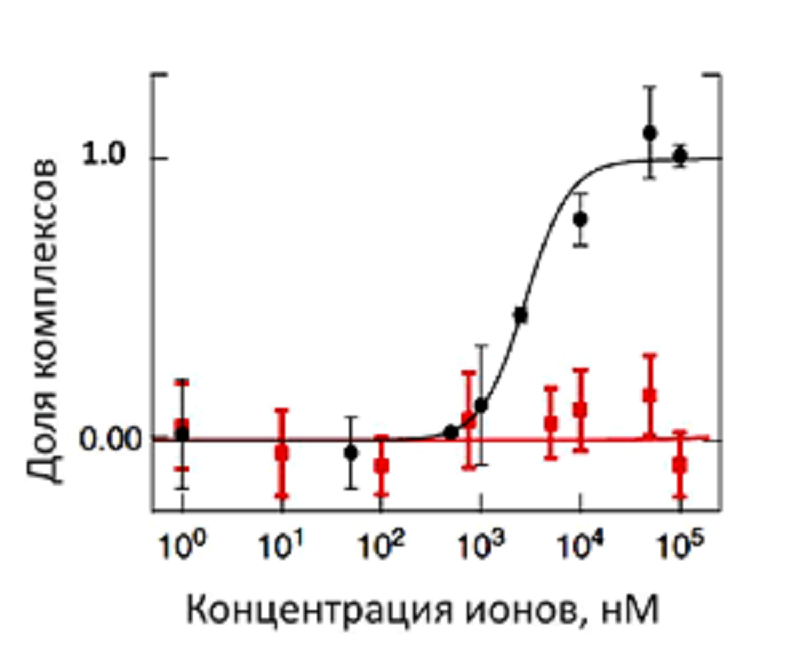
Рисунок 8. Исследование связывания ионов. Кривая связывания флуоресцентно меченного кальмодулина (КМ) с ионом кальция (черные кружки). С ионом магния (красные квадраты) КМ не связывается.
Такая особенность метода делает его привлекательным для драг-дизайна, то есть конструирования лекарственных препаратов с заданным действием (подробно об этом направлении рассказано в статье «Драг-дизайн: как в современном мире создаются новые лекарства» [24]). В драг-дизайне важны понятия мишени (белка-фермента или рецептора, на который нужно воздействовать) и лекарства (обычно — низкомолекулярного агента). Основной задачей драг-дизайна является подбор пары мишень-лекарство и характеристика их взаимодействия.
Показателен пример с препаратами от гепатита С. Для борьбы с этой инфекцией используют разные вещества-ингибиторы (лекарства), которые действуют на вирусный белок NS5A (мишень), но определить механизмы связывания лекарства и мишени долгое время не удавалось. Пока в 2014 году австралийские ученые с помощью МСТ не показали специфичность связывания ингибиторов с одним из доменов вирусного белка NS5A [25]. Кроме того, авторы выяснили, что именно делает ингибитор — блокирует связывание NS5A с РНК, что не позволяет вирусу приступить к репликации (рис. 9).
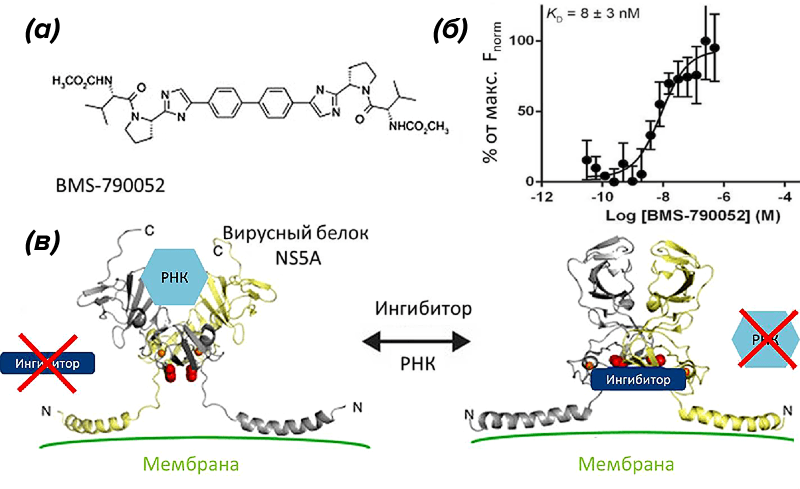
Рисунок 9. МСТ в драг-дизайне. (а) — один из современных ингибиторов белка NS5A вируса гепатита С. (б) — кривая связывания вирусного белка с ингибитором и полученная Kd. (в) — механизм действия ингибиторов.
рисунок из [25], с изменениями
Другие области применения МСТ
Денатурация белков
МСТ применяется не только для определения аффинности, но и для других задач — например, для изучения денатурации белков. В таблице 2 приведена сравнительная характеристика двух классических методов, которые используют для изучения денатурации белков, — ядерного магнитного резонанса (ЯМР) и флуоресцентной спектроскопии — и МСТ. Метод МСТ позволяет получать идентичные результаты при меньших затратах.
| ЯМР | Флуоресцентная спектроскопия | МСТ | |
|---|---|---|---|
| Минимальная концентрация белка | 50 мкМ | 5 мкМ | 0,1 мкМ |
| Минимальный объем пробы | 5 мл | 8 мл | 0,2 мл |
| Время регистрации | 1-3 дня | 2-4 часа | 25 мин |
| Ограничения | Только для малых белков; необходимость изотопного мечения | Только для белков с заметным изменением флуоресценции | Только для белков с собственной флуоресценцией |
| Выбор буфера | Только апротонные растворители | Рацемические смеси не допустимы | Любой |
ПЦР в эпоху зарождения жизни
Термофорез — настолько увлекательная вещь, что вызывает приливы вдохновения и желания приоткрыть завесы самых сокровенных тайн. Отвлекаясь от основной темы обзора, я бы хотела рассказать о любопытной гипотезе происхождения жизни.
Для изучения активности генов нет метода привычнее, чем полимеразная цепная реакция (ПЦР). Не вдаваясь в подробности, обозначу три основные стадии ПЦР: 1) плавление ДНК при 94 °С; 2) отжиг праймеров при 60 °С; 3) синтез новых цепей ДНК при 72 °С. Нетрудно заметить, что стадии различаются температурой. Это связано с тем, что ДНК очень чувствительна к температуре. Более того, температуры плавления и отжига праймеров сильно зависят от нуклеотидного состава молекулы ДНК. При этом температура последней стадии определяется активностью используемой ДНК-полимеразы. Важно, что реакцию проводят не один раз, а циклически (около 30 повторов).
В 2010 году ученые из Мюнхенского университета Людвига-Максимилиана предложили изящное и нетривиальное применение термофорезу в сочетании с конвекцией для реализации ПЦР (рис. 10). Более того, они высказали предположение, что именно так и происходила амплификации генетического материала в термальных источниках на заре жизни на Земле [26].
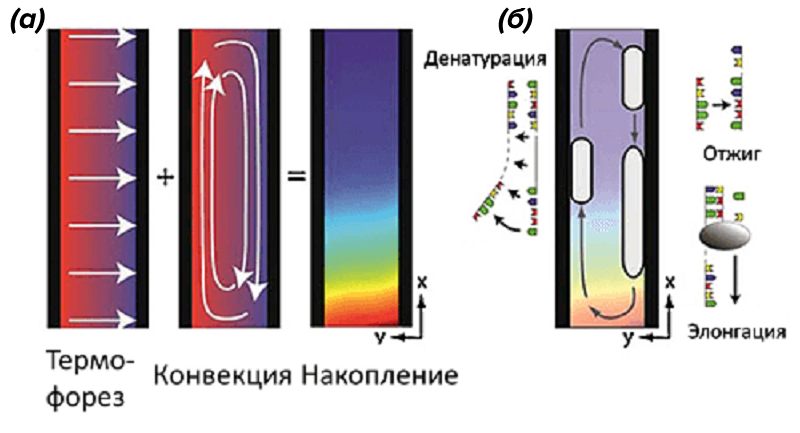
Рисунок 10. Репликация и накопление ДНК в результате конвекции и термофореза. А — Капилляр с ДНК освещается ИК-лазером. Под действием термофореза молекулы движутся вправо (в более холодную область), остывают и под действием конвекции опускаются на дно, где происходит их накопление. Б — Конвекция — движущая сила циклических процессов изменения температуры, необходимых для ПЦР. ДНК реплицируется в каждом конвекционном цикле.
рисунок из [26], адаптирован
Заключение
Микроскопический термофорез (МСТ) основан на измерении подвижности молекул в температурном градиенте. Образование комплекса молекулы с лигандом приводит к изменению свойств молекулы: заряда, размера, гидратной оболочки и т.д. Это влияет на термофоретическую подвижность. Сопоставляя термофоретические кривые для молекул при разной концентрации лиганда, программное обеспечение вычисляет константу диссоциации, характеризующую силу взаимодействия молекулы с лигандом (аффинность).
В этом обзоре мы познакомились с техникой эксперимента и интерпретацией данных. Разобрались, как отличаются межмолекулярные взаимодействия in situ в сложных биологических смесях от взаимодействий тех же молекул в буферных растворах. И рассмотрели примеры, показывающие, как с помощью МСТ можно проводить точные измерения самых разных бимолекулярных взаимодействий: белок-белковых, белок-липидных, взаимодействий белков с низкомолекулярными агентами, ионами, нуклеиновыми кислотами и т.д. Ввиду удобства использования и широты применимости микроскопический термофорез непременно завоюет расположение ученых и будет служить во благо науки.
Литература
- de Saint Vincent M.R., Delville J.-P. Microfluidic transport driven by opto-thermal effects. In: Advances in Microfluidics / ed. by Kelly R.T. Shangai: InTech, 2012. P. 1–28;
- Christoph J. Wienken, Philipp Baaske, Ulrich Rothbauer, Dieter Braun, Stefan Duhr. (2010). Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun. 1;
- Баканов С.П., Дерягин Б.В., Ролдугин В.И. (1979). Термофорез в газах. Успехи физических наук. 2, 255–278;
- Gerardo Dominguez, Gautam Wilkins, Mark H. Thiemens. (2011). The Soret effect and isotopic fractionation in high-temperature silicate melts. Nature. 473, 70-73;
- Philipp Baaske, Christoph J. Wienken, Philipp Reineck, Stefan Duhr, Dieter Braun. (2010). Optical Thermophoresis for Quantifying the Buffer Dependence of Aptamer Binding. Angew Chem Int Ed. 49, 2238-2241;
- Lyuba Khavrutskii, Joanna Yeh, Olga Timofeeva, Sergey G. Tarasov, Samuel Pritt, et. al.. (2013). Protein Purification-free Method of Binding Affinity Determination by Microscale Thermophoresis. JoVE;
- Соболев А.С. (2000). Как измеряют подвижность макромолекул в живых клетках. Соросовский образовательный журнал. 4, 2–6;
- Crispin G. Alexander, Randy Wanner, Christopher M. Johnson, Dennis Breitsprecher, Gerhard Winter, et. al.. (2014). Novel microscale approaches for easy, rapid determination of protein stability in academic and commercial settings. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1844, 2241-2250;
- Karina Zillner, Moran Jerabek-Willemsen, Stefan Duhr, Dieter Braun, Gernot Längst, Philipp Baaske. (2012). Microscale Thermophoresis as a Sensitive Method to Quantify Protein: Nucleic Acid Interactions in Solution. Methods in Molecular Biology. 241-252;
- Moran Jerabek-Willemsen, Chistoph J. Wienken, Dieter Braun, Philipp Baaske, Stefan Duhr. (2011). Molecular Interaction Studies Using Microscale Thermophoresis. ASSAY and Drug Development Technologies. 9, 342-353;
- Susanne A.I. Seidel, Patricia M. Dijkman, Wendy A. Lea, Geert van den Bogaart, Moran Jerabek-Willemsen, et. al.. (2013). Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59, 301-315;
- Розенкранц А.А. Измерение межмолекулярных взаимодействий при помощи поверхностного плазмонного резонанса на приборе Biacore X // Методическое пособие центра коллективного пользования ИБГ РАН / под ред. Георгиева П.Г. Москва, 2013;
- Миграция энергии плазмонного резонанса: вторая жизнь оптической спектроскопии;
- Crispin G. Alexander, Randy Wanner, Christopher M. Johnson, Dennis Breitsprecher, Gerhard Winter, et. al.. (2014). Novel microscale approaches for easy, rapid determination of protein stability in academic and commercial settings. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1844, 2241-2250;
- Лазерно-интерференционная слежка за мембранными белками;
- Anna M. Varizhuk, Vladimir B. Tsvetkov, Olga N. Tatarinova, Dmitry N. Kaluzhny, Vladimir L. Florentiev, et. al.. (2013). Synthesis, characterization and in vitro activity of thrombin-binding DNA aptamers with triazole internucleotide linkages. European Journal of Medicinal Chemistry. 67, 90-97;
- Thomas Schubert, Miriam Caroline Pusch, Sarah Diermeier, Vladimir Benes, Elisabeth Kremmer, et. al.. (2012). Df31 Protein and snoRNAs Maintain Accessible Higher-Order Structures of Chromatin. Molecular Cell. 48, 434-444;
- «Омики» — эпоха большой биологии;
- Paul Majkut, Iris Claußnitzer, Helmut Merk, Christian Freund, Christian P. R. Hackenberger, Michael Gerrits. (2013). Completion of Proteomic Data Sets by Kd Measurement Using Cell-Free Synthesis of Site-Specifically Labeled Proteins. PLoS ONE. 8, e82352;
- Michelle Vincendeau, Daniel Krappmann, Kamyar Hadian. (2015). In Vitro Detection of NEMO–Ubiquitin Binding Using DELFIA and Microscale Thermophoresis Assays. Methods in Molecular Biology. 311-320;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Lanlan Yu, Qiannan Fan, Xiu Yue, Yexuan Mao, Lingbo Qu. (2015). Activity of a novel-designed antimicrobial peptide and its interaction with lipids. J. Pept. Sci.. 21, 274-282;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- David B. Ascher, Jerome Wielens, Tracy L. Nero, Larissa Doughty, Craig J. Morton, Michael W. Parker. (2014). Potent hepatitis C inhibitors bind directly to NS5A and reduce its affinity for RNA. Sci Rep. 4;
- Christof B. Mast, Dieter Braun. (2010). Thermal Trap for DNA Replication. Phys. Rev. Lett.. 104.