
Тик-так по-шведски. Нобелевская премия за циркадные ритмы
02 октября 2017
Тик-так по-шведски. Нобелевская премия за циркадные ритмы
- 13397
- 0
- 7
-
Авторы
-
Редакторы
Сегодня утром, 2 октября, в Каролинском Университете в Швеции объявили лауреатов Нобелевской премии по физиологии и медицине за 2017 год. Ими стали американские исследователи Джеффри Холл, Майкл Росбаш и Майкл Янг. Премия будет вручена «за открытие молекулярных механизмов контроля циркадных ритмов». Что же это за ритмы и какие механизмы ими управляют? Почему это настолько важно?
— Наступает ночь. Город засыпает, просыпается мафия.
То, что активность живых существ зависит от времени суток, было известно испокон веков. Все знают, что коровы пасутся днем, петухи кричат утром, а котята хватают спящих людей за пятки в два часа ночи. У каждого вида живых существ, от одноклеточных цианобактерий до огромных многотонных китов и вековых деревьев, периоды активности сменяются периодами отдыха, в определенное время дня выбрасываются те или иные гормоны, листья сворачиваются и разворачиваются как по часам. Но что это за часы? Какова их природа? Немало копий было сломано за те 300 лет, что люди пытались ответить на эти вопросы. Нобелевскую премию в этом году заслуженно дали людям, которые поставили если не точку, то как минимум жирную черту, разделившую науку о механизмах, обусловливающих циркадные ритмы, на «до» и «после».
История вопроса
Наиболее логичным ответом на вопрос, откуда берется эта периодическая активность, представляются солнечные часы. Мол, солнце встает, активность «дневных» видов повышается, а «ночных» снижется. Основным регулятором является освещенность, а также сопутствующие ей факторы — рост и падение температуры, смена направления ветра и все в том же духе. Эта парадигма активно применялась еще древними римлянами, день которых начинался в момент восхода солнца над горизонтом, а ночь — в момент захода. Так как и день, и ночь состояли из 12 часов, длина часа у римлян зависела как от того, ночной это час или дневной, так и от времени года.
Первым проверить, действительно ли именно внешние факторы определяют активность живых существ, взялся французский астроном Жан-Жак де Меро в начале 18 века. В качестве модельного организма он использовал мимозу, которая очень явно реагирует на смену дня и ночи — в светлое время ее маленькие нежные листочки развернуты к солнцу, а в темное сложены и опущены вниз. Де Меро поместил мимозу в темный ящик и с удивлением наблюдал, как еще около недели она своевременно сворачивала и разворачивала листочки несмотря на отсутствие стимуляции светом (рис. 1). На основе этого он сделал предположение, что ритм этого процесса задается изнутри, а не снаружи.
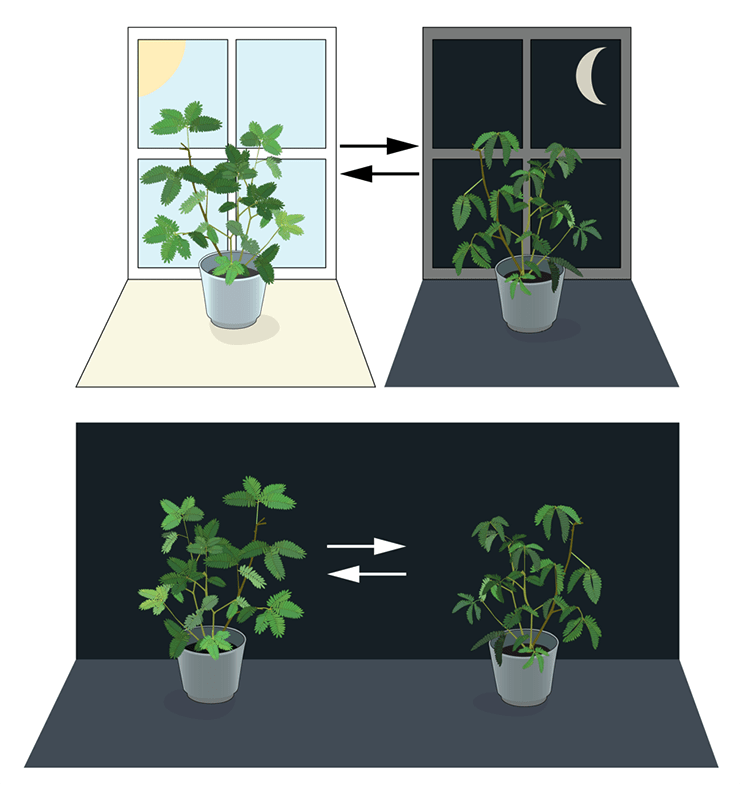
Рисунок 1. Опыт Де Меро. Астроном заметил, что мимоза сохраняет способность утром разворачивать листочки, а ночью сворачивать их обратно даже без воздействия солнечного света.
Как чаще всего происходит в таких случаях, новое явление до поры до времени было забыто, а в начале 20 века переоткрыто. На протяжении многих десятилетий велись жаркие дебаты между идеологами «внутренних часов» и «факторов среды», пока в 1971 году не была опубликована прорывная статья калифорнийских ученых, где они показали, что циркадные ритмы имеют генетическую природу. Идея нетривиальная, так как даже сторонники «внутренних часов» считали, что если они и имеют генетическую природу, то число задействованных генов должно быть очень велико, и повлиять мутациями на этот признак значимо не выйдет.
В качестве модели использовали плодовых мушек дрозофил. Время было дикое, амплификаторы [1] и секвенаторы [2] еще не изобрели, а вместо пипеток в лабораториях были каменные топоры. Экспериментаторы лили на яйца мушек мутагены, вызывая изменения в случайных генах. И сумели получить три разных по «ритмике» линии дрозофил. Первая линия имела циркадный ритм продолжительностью 28 часов, вторая — 19 часов, а в третьей обычно ритмические параметры вообще не подчинялись никакому заметному циклу (рис. 2). Путем долгих изысканий методами классической генетики исследователи смогли локализовать ответственный за изменения участок. Это оказался ген в половой Х-хромосоме, который был назван period [3]. На тот момент, в отсутствие молекулярных методов, двигаться дальше было невозможно. Что это за ген и как он работает — осталось загадкой.

Рисунок 2. Мутантные дрозофилы с нарушенными циркадными ритмами. Различные мутации в гене period могут изменить продолжительность циркадного цикла в бóльшую или меньшую сторону или даже полностью его уничтожить.
За что же дали Нобеля?
В середине 1980-х, когда каменные топоры уже отошли на второй план, а в лабораториях биологов робко обживались первые амплификаторы, в США над проблемой циркадных ритмов работали две группы. Первая под руководством Джеффри Холла и Майкла Росбаша трудилась в Брандейском университете в Массачусетсе, вторая под руководством Майкла Янга — в университете Рокфеллера в Нью-Йорке. Примерно одновременно эти группы смогли клонировать ген period, секвенировать и изучить его последовательность. Первые данные о структуре гена и кодируемого им белка не дали ясного ответа о механизмах его работы, породив множество курьезных теорий.
Непонятно было, прежде всего, на каком уровне действовал этот ген. Бóльшая часть строившихся тогда предположений относила его продукт, получивший название PER, к мембранным белкам, которые либо регулируют доступ в клетку какого-либо действующего вещества извне, либо изменяют характер взаимодействия клеток между собой. Одно было ясно — должен существовать некоторый осциллятор с периодом в 24 часа и его работа должна быть напрямую связана с белком PER.
И этот осциллятор был найден — им оказался, как ни странно, сам белок PER. Холл и Росбаш показали, что в нейронах мухи концентрация этого белка имеет 24-часовую цикличность с пиком около полуночи. Такому же циклу оказалась подвержена мРНК этого белка, однако пик ее концентрации оказался сдвинут на несколько часов раньше по отношению к пику белка (обычно такие пики должны совпадать). Исследователи получили нонсенс-мутантов по этому белку (при этом мРНК синтезируется, а белок — нет) и увидели, что при этом периодические изменения концентрации мРНК пропадают. Вывод последовал незамедлительно — белок PER является ядерным модулятором транскрипции и блокирует собственный синтез (рис. 3а).
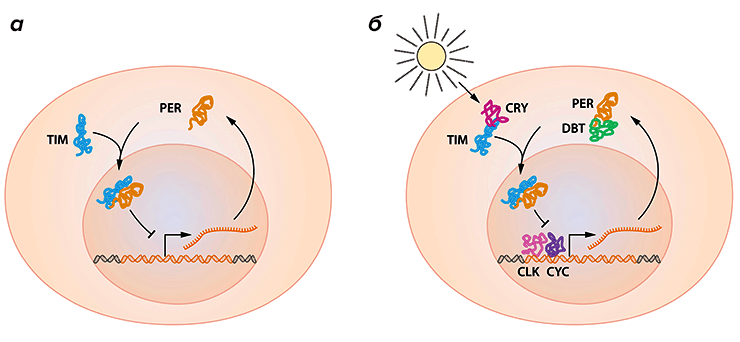
Рисунок 3. В организме действует осциллятор, состоящий из белков, негативно регулирующих экспрессию собственной мРНК. За счет разветвленной системы положительных и отрицательных регуляторов осциллятор имеет период примерно в 24 часа и может подстраивать свою работу под изменения светового дня.
На основе этого вывода предложили гипотезу TTFL (Transcription-Translation Feedback Loop — транскрипционно-трансляционной обратной связи). Согласно этой гипотезе, осциллятор, отвечающий за циркадные ритмы, состоит из одного или нескольких белков, которые контролируют собственную экспрессию при помощи негативной регуляции транскрипции и/или трансляции. Было понятно, что один ген period не способен полностью построить циркадный ритм, ему нужны партнеры.
Этих партнеров обнаружил Майкл Янг. Он выявил ген, названный им timeless, мРНК и продукт которого (белок TIM) также подвергались 24-часовым осцилляциям. Оказалось, что белки PER и TIM могут попасть в ядро только провзаимодействовав друг с другом. Один без другого работать не способен и даже более того — без связи они моментально разрушаются в протеасоме. Вместе же они попадают в ядро и блокируют собственную экспрессию (рис. 3а).
В дальнейшем обнаружили также и позитивные регуляторы экспрессии этих генов, что еще сильнее усложнило картину. Выявили и взаимосвязи со средовыми факторами. Те, кто пересекал в ходе путешествий множество часовых поясов, знают, что при этом организм поначалу не может подстроиться под новый световой день, но через несколько дней циркадные ритмы синхронизируются с реальностью, и жизнь снова становится прекрасна, а сон крепок.
За такую настройку, как оказалось, отвечает целый набор белков-регуляторов, воздействующих на все тот же осциллятор PER-TIM (рис. 3б). Например, Янг обнаружил белок CRY, который активируется в ответ на повышение внешней освещенности, связывает TIM и отправляет его на деградацию. Таким образом, раннее или позднее утро меняют характеристики пика TIM, что в свою очередь меняет профиль экспрессии PER. Через несколько дней циркадный ритм стабилизируется в новом положении.
Все эти данные и успешно подтвержденные гипотезы довольно сильно изменили наше понимание циркадных ритмов. Теория о внутреннем осцилляторе была однозначно подтверждена благодаря усилиям Холла, Росбаша и Янга, за что они вполне заслуженно получили Нобелевскую премию [4]. Но исследования этой интересной области все еще продолжаются.
Не мухами едиными...
Мухи — это, конечно, хорошо, но что там у млекопитающих вообще и у человека в частности? У нас всё оказалось похоже в общем, но отлично в деталях. Циркадные ритмы у млекопитающих делятся на центральные и периферические. Центральным регулятором выступает супрахиазматическое ядро гипоталамуса в головном мозге [5]. При изменении ритма освещенности оно первое перестраивает свой цикл активности системы белков PER. Под контролем этого ядра идет выделение мелатонина (гормона сна) в эпифизе, через который оно регулирует циркадные ритмы в остальных тканях организма.
На белки циркадного каскада оказались завязаны многие физиологические функции клеток и тканей (рис. 4). Например, утром инсулиновый ответ поджелудочной железы на потребление углеводов более яркий, чем вечером. И это даже не получается объяснить ночной «голодовкой» — животные, которым 24 часа с постоянной скоростью вводили в кровь глюкозу, имели наименьший ее уровень (и наибольший уровень инсулина) утром. Аналогично меняется усвоение жиров и белков. Таким образом, совет «не есть после 18», столь частый в фитнес-журналах, оказывается, имеет под собой физиологическое обоснование [6].
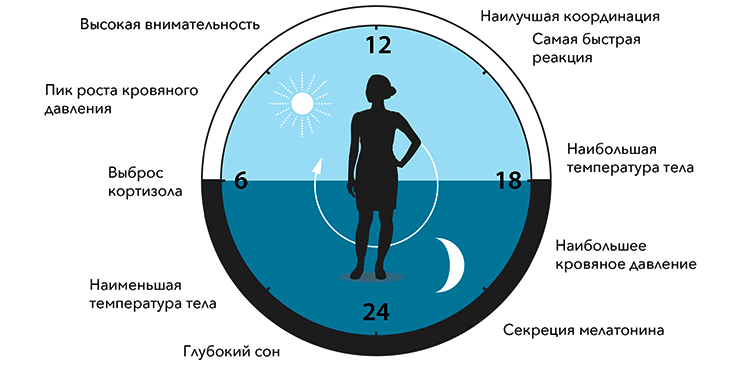
Рисунок 4. Многие аспекты функционирования человеческого организма зависят от времени суток и контролируются циркадными ритмами.
[4], рисунок адаптирован
Циркадные ритмы вообще влияют почти на все области нашей физиологии. От времени суток зависят наша работоспособность, уровни почти всех основных гормонов, заболевания и так далее. Разумеется, уже есть группы, осваивающие гранты в вопросах связи нарушенных циркадных ритмов и рака, нейродегенеративных и сердечно-сосудистых заболеваний [7] и других интересных тем.
Очень перспективными являются исследования связи циркадных ритмов и старения. Известно, что супрахиазматическое ядро с возрастом деградирует и к старости работает уже не так регулярно. Старые люди достоверно хуже адаптируются к смене часовых поясов, хуже переносят вынужденное бодрствование и восстанавливаются во время сна. На грызунах исследователи показали, что нарушение генов циркадных ритмов ведет к значительному снижению продолжительности их жизни и, что довольно интересно, к более раннему появлению «старческих» заболеваний [8].
Дальнейшее развитие
В настоящий момент циркадная биология развивается бешеными темпами. Изучают варианты фармакологического воздействия на циркадные ритмы, особенно нарушенные вследствие перелетов, возраста или заболеваний. В аптеках уже можно купить препараты мелатонина для путешественников.
Хотя система TTFL, основанная на белках PER и TIM, является самой заметной среди циркадных часов, она не является единственной [9]. C момента совершения основных открытий группами Холла/Росбаша и Янга было открыто еще несколько вариантов. Например, система белков Kai, управляющая циркадными ритмами цианобактерий, основана не на синтезе/распаде, а на фосфорилировании/дефосфорилировании ключевого белка KaiC [10]. Благодаря этому, данную систему удалось воспроизвести в пробирке — смешение всех необходимых белков и их субстратов привело к возникновению молекулярных часов без участия живой клетки.
Да и сама система TTFL еще не изучена до предела. То, что мы обнаружили осциллятор и разобрались в тонкостях его работы и регуляции — это, конечно, прекрасно. Но остается еще масса вопросов касательно его взаимодействия с различными биохимическими каскадами и физиологическими функциями наших клеток. Так что для будущих исследователей тут есть еще масса работы.
Литература
- 12 методов в картинках: полимеразная цепная реакция;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Konopka R.J. and Benzer S. (1971). Clock mutants of Drosophila melanogaster. Proc. Natl. Acad. Sci. USA. 68, 2112–2116;
- Ibáñez C. (2017). Scientific background discoveries of molecular mechanisms controlling the circadian rhythm. Nobelprize.org;
- «Проснись!» — «Усни...» — «Проснись!» — «Усни...» — «Проснись!»;
- Satchidananda Panda. (2016). Circadian physiology of metabolism. Science. 354, 1008-1015;
- Молекулярные часы нашего сердца;
- Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни;
- Прообраз биологических часов;
- T. Kondo. (2007). A Cyanobacterial Circadian Clock Based on the Kai Oscillator. Cold Spring Harbor Symposia on Quantitative Biology. 72, 47-55.






