
Трансляционные исследования в нейробиологии
25 ноября 2019
Трансляционные исследования в нейробиологии
- 1612
- 0
- 6
Пересекая «долину смерти». Преодоление разрыва между фундаментальными и клиническими медицинскими исследованиями — задача трансляционной науки.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Эта статья расскажет о том, что такое трансляционные исследования и какую роль они играют в фундаментальной науке и в исследованиях, проводимых в клинике. Вы также на конкретных примерах узнаете, какие существуют направления трансляционных исследований в нейронауках.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Клинические, фундаментальные и трансляционные исследования
Что мы знаем о заболеваниях мозга и откуда? Какую информацию мы можем почерпнуть из клинических исследований, а какую — из экспериментальных научных работ? Как грамотно перенести результаты исследований от пробирки и лабораторной мыши к использованию во врачебной практике? Оказывается, последним вопросом занимается отдельная область медицинской науки — трансляционная медицина, о которой и пойдет речь в этой статье. Но сначала разберемся с терминами.
Как известно, задачей фундаментальных научных исследований является понимание природы и ее законов. Подобные исследования не преследуют практических целей, хотя любое фундаментальное научное знание дает возможность решить множество практических задач. И поиском таких решений занимаются прикладные исследования. Клинические исследования (clinical trials) [2] изучают эффективность определенных терапевтических вмешательств/препаратов или новых медицинских технологий при определенных заболеваниях (подробнее о клинических исследованиях см. [3]). Если взять шире, то научные исследования, проводимые в клинике (clinical research), ставят перед собой цель в целом углубить знания о болезнях человека. Исследования в клинике всегда проводятся на человеке (или материале, полученном от живого человека — образцах ткани или, например, когнитивных феноменах) [4].
Однако, между фундаментальными исследованиями и исследованиями, проводимыми в клинике, существует огромная пропасть, названная Nature «долиной смерти» [1]. Такие исследования проводятся, как правило, независимо разными группами ученых, что приводит, с одной стороны, к непониманию практических задач клинических врачей учеными, занимающимися фундаментальной наукой, и наоборот — к незнанию результатов фундаментальных исследований врачами, занимающимися исследованиями в клинике. Кроме того, исследования на человеке имеют серьезные ограничения, поскольку молекулярные и клеточные уровни организации мозга практически недоступны для прямого изучения на живом человеке. Зачастую заболевания изучают только на образцах, взятых при аутопсии (после смерти), либо на материале, полученном в результате операции или биопсии (взятом при жизни). Подробнее о микроскопии — основном методе изучения тканей человека — см. [5]. Неврологические заболевания также могут изучаться по косвенным показателям (по изменениям в крови, ликворе или даже в слезах [6]).
Преодоление «долины смерти» — задача трансляционных исследований. Под трансляционными исследованиями понимают научные работы, цель которых — перенос новых знаний о механизмах работы мозга и его заболеваниях, полученных в лаборатории, в сферу разработки и применения новых методов диагностики, лечения или предотвращения заболеваний человека [4], [7]. Обозначенное направление переноса знания — от лабораторного стола с пробирками к постели пациента — называется bench-to-bedside (рис. 1).

Рисунок 1. Направления трансляционных исследований
[1], рисунок с изменениями
Очевидно, что для изучения механизмов заболевания ученым в лаборатории необходимо как можно более точно смоделировать болезнь человека на животном. Воспроизведение определенных симптомов болезни человека на лабораторной мыши или даже в отдельно взятых нейронах в чашке Петри также является задачей трансляционных исследований, которые носят название bedside-to-bench (рис. 1). К таким исследованиям, например, относятся работы с целенаправленным изменением генов мыши, если известно, что такие изменения приводят к заболеванию у человека (подробнее об исследованиях на мышах см. [8]; о методах, применяемых в нейробиологии в целом, см. [9]). Изучение таких мышей может многое сказать о роли мутаций в развитии заболеваний у человека. Давайте теперь рассмотрим несколько примеров трансляционных исследований.
Активность нейронов и содержание кислорода в крови
Первым примером будет работа, показавшая зависимость степени активации нейронов и увеличения BOLD-сигнала при использовании функциональной МРТ [10], [11]. В физиологических работах на животных часто используют метод регистрации электрической активности отдельных нейронов (single unit recording), для чего тонкий электрод вживляется в мозг непосредственно вблизи изучаемого нейрона. Это позволяет понять, при каких условиях тот или иной нейрон проявляет активность (иначе говоря, генерирует потенциал действия — сигнал, который передается другим нейронам). За изучение функции мозга именно таким методом у крыс в свободном поведении [12] группа ученых из Норвегии получила Нобелевскую премию в области физиологии или медицины в 2014 году («за описание механизмов пространственной памяти у крыс») [13].
Но можно ли подобные эксперименты переносить непосредственно на человека? Вживление электродов человеку для изучения функции нейронов очень ограничено, хотя такие работы существуют. К примеру, «нейроны Дженнифер Энистон» — реагирующие активацией при предъявлении изображений известной актрисы — обнаружены именно при помощи инвазивной регистрации отдельных нейронов у пациентов во время обследования и хирургического лечения эпилепсии [14].
Для изучения активности мозга при определенной когнитивной нагрузке, будь то предъявление фотографий или ориентация в пространстве, в исследованиях на здоровых людях используют функциональную МРТ (фМРТ). Метод безопасен и не требует никаких инвазивных вмешательств. Но проблема в том, что он не регистрирует напрямую активность нейрона, как это делает электрод, а регистрирует так называемый BOLD-сигнал (blood-oxygen-level-dependent), проще говоря — степень насыщения крови кислородом в локальном участке мозга. Предполагается, что степень оксигенации зависит от средней активности нейронов в этой области (подробнее о работе нейрона см. [15]), так как для работы нейронов нужна энергия — глюкоза и кислород. Но на самом деле это утверждение не очень очевидно. Потреблять кислород могут не только активные нейроны, но и нейроны, которые получают подпороговые сигналы, по силе недостаточные для формирования потенциала действия (то есть такие нейроны остаются неактивными, но имеют высокий уровень метаболизма, связанный с активным изменение мембранного потенциала). Кроме того, в мозге потребляют энергию [16] и все другие клетки, например, клетки глии, число которых в мозге превышает число нейронов [17]!
Как же связана активность нейронов (число потенциалов действия за секунду) и уровень сигнала фМРТ (BOLD-сигнал)? Ответить на этот вопрос вызвались ученые из США и опубликовали результаты в 2000 году [11]. Для проверки гипотезы, что BOLD-сигнал фМРТ напрямую зависит от активности нейронов, авторы использовали следующий дизайн эксперимента. В качестве исследуемой области выбрали область зрительной коры V5 [18], которая содержит группы нейронов, специфично активирующихся определенным направлением движения зрительного стимула. В качестве стимула использовали экран с движущимися точками с постепенно увеличивающейся долей точек, движущихся в одном направлении (что заставляет нейроны в V5 постепенно повышать свою активность). Первым этапом исследователи показали при помощи фМРТ на человеке, что BOLD-сигнал возрастает при увеличении доли точек, движущихся в одном направлении. Вторая часть исследования была проведена на обезьянах также с использованием фМРТ — ученые убедились, что BOLD-сигнал у обезьян изменяется аналогичным образом и в тех же условиях. И далее исследователи при помощи электродов регистрировали отдельные нейроны у этих обезьян в зрительной коре и показали линейную зависимость их активности от доли движущихся в одном направлении точек на экране. Таким образом было показано, что степень активации нейронов при регистрации их активности электродом и BOLD-сигнал фМРТ связаны линейно (то есть возрастают пропорционально). Эти выводы подтверждаются и в другом исследовании на обезьянах с одновременной регистрацией фМРТ и нейронов уже другой области зрительной коры (V1), реагирующей на плавное изменение контрастности изображений (рис. 2) [19].
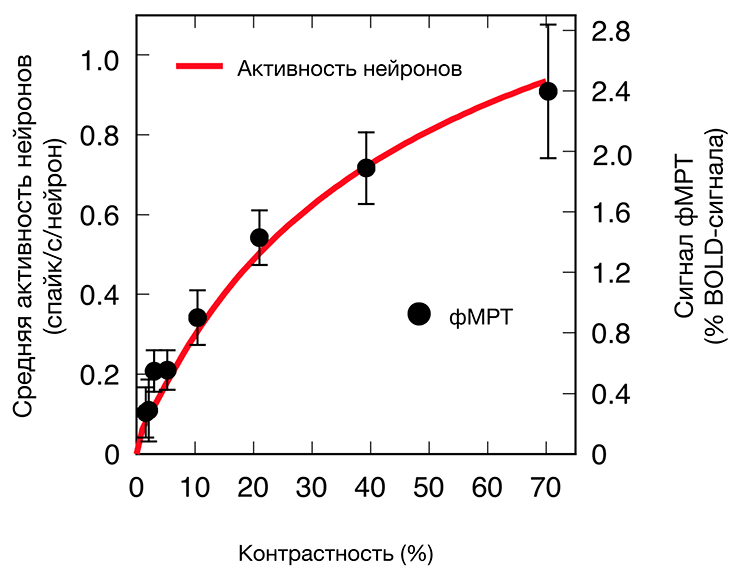
Рисунок 2. Изменение сигнала фМРТ человека пропорционально изменению активности нейронов обезьяны в ответ на один и тот же изменяющийся зрительный стимул. Черными точками обозначены средние значения активности зрительной коры человека (область V1) на фМРТ при разной контрастности предъявляемого изображения («усы» у точек обозначают ±1 стандартную ошибку среднего). Красная кривая отражает среднюю активность нейронов в зрительной коре обезьяны (область V1), регистрируемую при помощи электродов.
Пусть вас не смущает, что приведенные работы выполнены на здоровых людях и не менее здоровых обезьянах. Функциональная МРТ в клинике применяется при изучении многих заболеваний — в том числе показано снижение сигнала от гиппокампа при таком виде деменции, как болезнь Альцгеймера [20], что может использоваться в диагностике заболевания. Сложно переоценить значение таких трансляционных исследований — это важная ступень, ведущая нас от результатов фундаментальных исследований на животных к исследованиям на человеке (bench-to-bedside).
Механизмы врожденного нистагма у человека
Примером трансляционной работы bedside-to-bench может являться исследование по изучению механизмов врожденного нистагма, проведенное в девяти разных научных и клинических центрах Швейцарии, Венгрии и Дании в 2016 году [21]. Нистагм — непроизвольные колебательные движения глаз в сторону. В неврологии появление нистагма тесно связано с повреждением периферической вестибулярной системы (внутреннего уха, вестибулярного нерва) или центральной нервной системы (определенных отделов ствола головного мозга и мозжечка). Появление спонтанного нистагма в неврологической практике говорит о том, что нарушена функция вестибулярного аппарата. Оптокинетический рефлекс — это физиологический нистагм, возникающий при наблюдении за движущимися объектами (например, его можно увидеть у человека, который смотрит в окно движущегося автомобиля или поезда). Кроме вышеперечисленных, существует и врожденный нистагм, связанный с определенными мутациями. Наличие определенных аллелей гена FRMD7 встречаются у более чем половины пациентов с врожденным нистагмом.
Авторы статьи [21] поставили перед собой вопрос — каким именно образом возникает нистагм у пациентов с мутацией в гене FRMD7? И пришли к неожиданным результатам. Первое, что сделали исследователи, — описали схожий фенотип у людей с врожденным нистагмом, имеющих мутацию в изучаемом гене, и мышей с намеренно вызванной такой же мутацией, — и у тех, и у других наблюдали потерю горизонтального оптокинетического рефлекса (рис. 3). Наличие у мышей патологического фенотипа крайне важно для исследования (а вдруг обнаруженная у человека мутация все-таки ни при чем?).
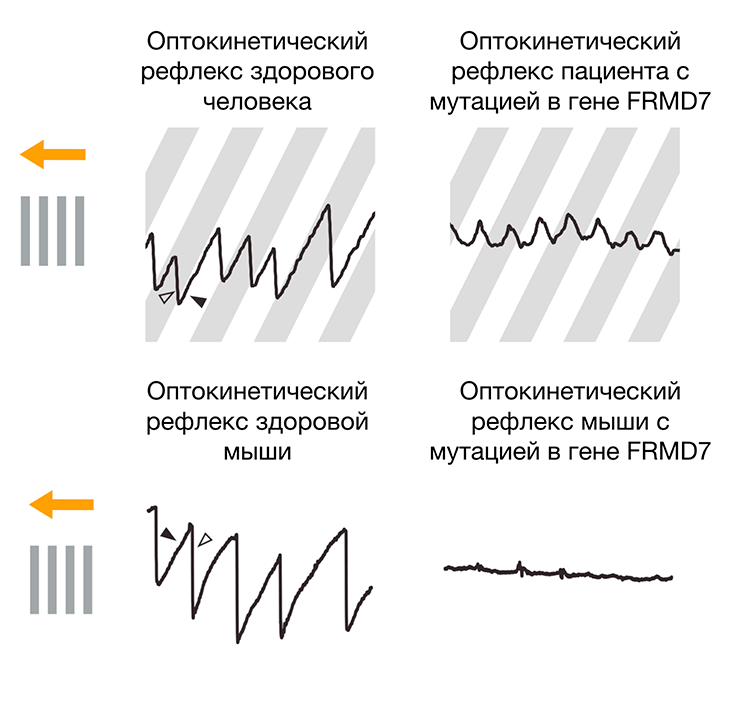
Рисунок 3. Фенотип при наличии мутации в гене FRMD7 у человека и мыши. Для сравнения приведен оптокинетический рефлекс здоровых человека и мыши. Наличие мутации вызывает потерю оптокинетического рефлекса при предъявлении движущегося объекта (схематично такой объект изображен в левой части рисунка, направление движения отмечено стрелкой).
Далее авторы провели серию экспериментов, показавших, что нарушение функции происходит не в мозге и даже не в вестибулярном аппарате — а в сетчатке глаза! Сетчатка — световоспринимающая часть глаза, состоящая из нескольких слоев нервных клеток, которые не только кодируют изображение и передают его по зрительному нерву в мозг, но и проводят достаточно сложную предварительную обработку поступающих сигналов. Сетчатка содержит вставочные тормозные нейроны, которые способны подавить активность других клеток сетчатки. Оказалось, что изучаемый ген FRMD7 экспрессируется именно в тормозных нейронах сетчатки, что было показано при помощи гибридизации мРНК этого гена на препарате сетчатки (in situ hybridisation). Но каким образом это может быть связано с оптокинетическим рефлексом? В сетчатке также имеются ганглиозные клетки, чувствительные только к горизонтальному направлению движения зрительного стимула в определенную сторону (похожи на те нейроны зрительной коры V5, которые были описаны в предыдущей части этой статьи). У мышей с мутацией ученые показали нарушение связи тормозных клеток сетчатки с ганглиозными нейронами, различающими направление зрительного стимула. Сделать это можно, если одновременно регистрировать очень тонкой пипеткой активность тормозного и ганглиозного нейронов (whole-cell patch) при предъявлении мыши движущегося стимула. Дело в том, что пока одна часть ганглиозных клеток активируется стимулом, ганглиозные нейроны в противоположной части сетчатки должны быть «выключены» тормозными нейронами. Именно этого в эксперименте у мышей с мутацией не происходило (рис. 4).
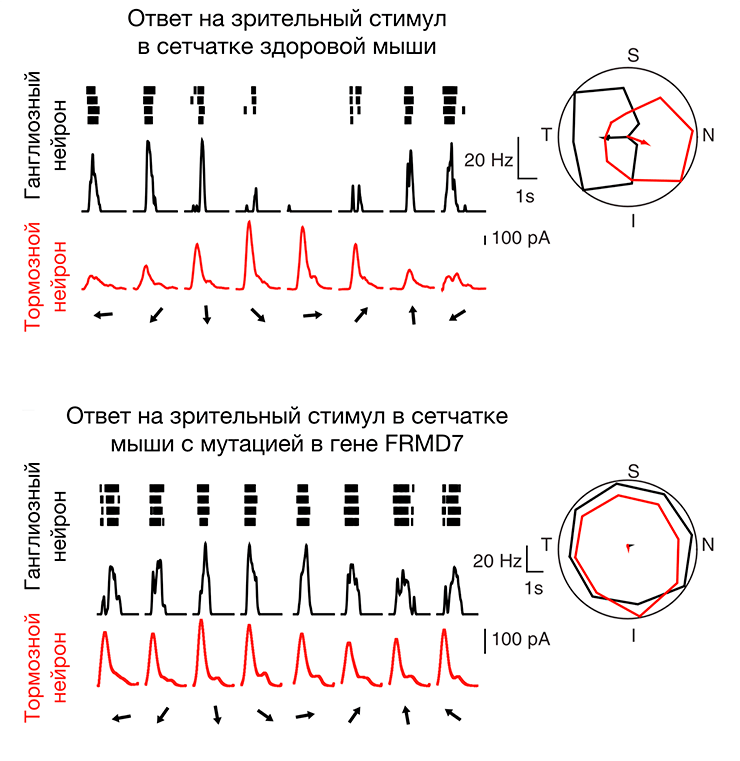
Рисунок 4. Активность нейронов сетчатки мыши при предъявлении движущегося зрительного стимула (направление движения стимула показано черными стрелками). У здоровой мыши тормозные нейроны (их активность показана красным цветом) подавляют активность ганглиозных нейронов (изображены черным цветом) в сетчатке при определенном направлении стимула, чего не происходит у мышей с мутацией. Слева в круге схематично изображена представленность активности тормозных и ганглиозных нейронов сетчатки (поля зрения обозначены: N — nasalis (носовая); T — temporalis (височная); S — superior (нижняя); I — inferior (верхняя)). На схеме видно, что при наличии мутации нарушается в норме асимметричное распределение возбуждения и торможения, что и является причиной нарушения восприятия направления движения стимула в сетчатке.
Таким образом, нарушение функции тормозных нейронов в сетчатке вызывало потерю способности различать направление движения стимула в ней и, как следствие, — потерю оптокинетического рефлекса. Такой путь от обнаружения генетической мутации у человека к намеренной генетической мутации у мыши с доказательством наличия физиологического дефекта у мыши и последующим выявлением причины и является трансляционной наукой bedside-to-bench. При этом путь в этой небольшой области далеко не закончен — неизвестно, какие молекулярные каскады привели к нарушению функции нейронов в сетчатке у крыс с мутацией в гене FRMD7, — а понимание этого необходимо для разработки методов коррекции врожденного нистагма у человека.
Заключение
Исследования, проводимые в клинике, и фундаментальная наука имеют большой разрыв. Преодолеть его — задача трансляционных исследований, которые проводятся в двух направлениях:
- моделирование симптомов заболеваний человека на животных;
- перенос обнаруженных механизмов или способов лечения заболеваний из эксперимента в медицинскую практику.
Трансляционные исследования служат «розеттским камнем» [22], позволяющим двум очень разным областям науки говорить на одном языке и создавать всё более эффективные инструменты борьбы с болезнями.
Литература
- Declan Butler. (2008). Translational research: Crossing the valley of death. Nature. 453, 840-842;
- Clinical research. (2017). NIH;
- С миру по нитке: как соединились компоненты клинического исследования;
- Doris McGartland Rubio, Ellie E. Schoenbaum, Linda S. Lee, David E. Schteingart, Paul R. Marantz, et. al.. (2010). Defining Translational Research: Implications for Training. Academic Medicine. 85, 470-475;
- 12 методов в картинках: микроскопия;
- Suzanne Hagan, Eilidh Martin, Amalia Enríquez-de-Salamanca. (2016). Tear fluid biomarkers in ocular and systemic disease: potential use for predictive, preventive and personalised medicine. EPMA Journal. 7;
- Steven H. Woolf. (2008). The Meaning of Translational Research and Why It Matters. JAMA. 299;
- Мышь против всех болячек;
- 12 методов в картинках: нейробиология;
- David J. Heeger, Alex C. Huk, Wilson S. Geisler, Duane G. Albrecht. (2000). Spikes versus BOLD: what does neuroimaging tell us about neuronal activity?. Nat Neurosci. 3, 631-633;
- Geraint Rees, Karl Friston, Christof Koch. (2000). A direct quantitative relationship between the functional properties of human and macaque V5. Nat Neurosci. 3, 716-723;
- May-Britt Moser, David C. Rowland, Edvard I. Moser. (2015). Place Cells, Grid Cells, and Memory. Cold Spring Harb Perspect Biol. 7, a021808;
- GPS в нашем мозге: Нобелевская премия по физиологии или медицине 2014;
- R. Quian Quiroga, L. Reddy, G. Kreiman, C. Koch, I. Fried. (2005). Invariant visual representation by single neurons in the human brain. Nature. 435, 1102-1107;
- Мозг, общение нейронов и энергетическая эффективность;
- Прожорливый мозг;
- Purves D., Augustine G.J., Fitzpatrick D. et al. Neuroscience (2nd Edition). Sunderland (MA): Sinauer Associates, 2001;
- Semir Zeki. (2015). Area V5 — microcosm of the visual brain. Front. Integr. Neurosci.. 9;
- Nikos K. Logothetis, Jon Pauls, Mark Augath, Torsten Trinath, Axel Oeltermann. (2001). Neurophysiological investigation of the basis of the fMRI signal. Nature. 412, 150-157;
- Wolk D. and Dickerson B. (2018). Clinical features and diagnosis of Alzheimer disease. UpToDate;
- Keisuke Yonehara, Michele Fiscella, Antonia Drinnenberg, Federico Esposti, Stuart Trenholm, et. al.. (2016). Congenital Nystagmus Gene FRMD7 Is Necessary for Establishing a Neuronal Circuit Asymmetry for Direction Selectivity. Neuron. 89, 177-193;
- Jessica A. Bolker. (2017). Animal Models in Translational Research: Rosetta Stone or Stumbling Block?. BioEssays. 39, 1700089.







