
Мышь против всех болячек
04 сентября 2019
Мышь против всех болячек
- 1230
- 1
- 5
Мыши — не только персонажи мультфильмов, но и важные объекты исследований. Кадр из советского мультсериала «Кот Леопольд».
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Эта статья расскажет об одних из самых популярных модельных животных — мышах, — о том, почему и как их используют в биомедицинских исследованиях различных заболеваний, например, инфекционных, рака и болезни Альцгеймера. Пристегните ремни, поехали!
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Школьная» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Партнер номинации — Некоммерческая школа «Летово».

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
С самых ранних времен человек, чтобы понять, как устроен мир, почему мы болеем, как лечить ту или иную болезнь, проводил опыты на животных. Опыты на животных (animal testing) — использование животных в экспериментах для изучения воздействия каких-либо «переменных» (ударов электрическим током, громкого шума, радиации, микроорганизмов, лекарственных препаратов и пр.) на поведение или объект (клетки, ткани, органы и т.д.) .
В статье «Грызун особого назначения» мы уже рассказывали о крысах — модельных животных в современной биологии [51]. — Ред.
Самые ранние упоминания об экспериментах на животных относятся к III и IV векам до н.э. Аристотель и Эрасистрат — одни из первых ученых, проводивших эксперименты на животных. Гален, древнеримский медик, хирург и философ, препарировал коз и свиней и за это даже получил прозвище «отец вивисекции» (вивисекция — проведение прижизненных хирургических операций над животными). Авензоар, арабский медик, живший в XII веке, практиковавший диссекцию (вскрытие) животных, предложил проводить эксперименты над животными как метод тестирования хирургических процедур перед применением их на людях.
Животных неоднократно использовали на протяжении всей истории науки. Луи Пастер, французский химик и микробиолог, продемонстрировал микробную природу некоторых заболеваний, искусственно вызвав сибирскую язву у овцы (рис. 1). Роберт Кох, немецкий микробиолог, проводил эксперименты на морских свинках и выяснил, что туберкулез вызывает бактерия Mycobacterium tuberculosis, впоследствии названная в честь него палочкой Коха [1], [2]. Российский физиолог Иван Петрович Павлов известен тем, что использовал собак для изучения условных рефлексов.

Рисунок 1. Луи Пастер и лабораторные кролики
В современном мире лабораторные животные не утратили своей значимости. Теперь они — незаменимые объекты исследований. Лабораторные животные, как и раньше, используются для решения различных научных вопросов — от фундаментальной науки до разработки и оценки новых лекарственных средств, методов лечения заболеваний и вакцин.
Современна и перспективна сейчас биомедицина. Биомедицина — это направление на стыке медицины и биологии, в основе которого лежит использование идей и технологий, разработанных при помощи биохимии, иммунологии, клеточной биологии и других биологических наук, для решения медицинских проблем. Как раз в биомедицинских исследованиях играют важную роль модельные организмы — те организмы, которых используют в качестве моделей для изучения свойств, процессов или явлений живой природы. Они позволяют ученым изучать человеческие заболевания быстрее, дешевле и в большем размере, чем на самих людях или на человеческих клетках и тканях [3].
Стоит заметить, что тестирование новых методов борьбы с различными заболеваниями, лекарственных препаратов на животных не является альтернативой испытаниям на людях. Но отказ от использования модельных организмов в доклинических исследованиях может привести к большому количеству смертей людей, участвующих в клинических испытаниях, проводимых без доклинической подготовки. Вследствие чего меньше людей будет добровольно принимать участие в клинических исследованиях [4].
Эта статья посвящена одним из самых используемых модельных организмов — мышам. Ученые из широкого спектра биомедицинских областей используют мышей как модельных животных из-за их близкого генетического и физиологического сходства с людьми, а также из-за легкости, с которой мышиным геномом можно манипулировать и анализировать. Хотя, например, дрожжи, черви и мухи-дрозофилы являются отличными моделями для изучения клеточного цикла и многих процессов развития, мыши — лучшие инструменты для исследования иммунной, эндокринной, нервной, сердечно-сосудистой, скелетной и других сложных физиологических систем, которыми обладают млекопитающие [5].
«Виновник торжества» — Мышь
Хотя мышь и человек внешне не похожи друг на друга, они оба являются млекопитающими и с точки зрения биологии очень похожи. Почти все гены у мышей имеют гомологи у человека. Мы развиваемся одинаково из сперматозоидов и яйцеклеток, обладаем такими же органами (мозг, сердце, почки и т.д.), а также схожими сердечно-сосудистой, пищеварительной, эндокринной, иммунной, опорно-двигательной и другими системами. По сравнению с людьми лабораторные мыши живут недолго, около двух лет, и это позволяет изучать развитие хронических заболеваний в течение жизни, а также процессы, связанные со старением организма. Поскольку ученые изучали лабораторных мышей более 100 лет, об их биологии и генетике известно достаточно много. Подобно людям и многим другим млекопитающим, у мышей развиваются заболевания, которые поражают различные органы, включая рак, атеросклероз, гипертонию, диабет, остеопороз и глаукому. Кроме того, некоторые заболевания, которые поражают людей, но обычно не поражают мышей, например, муковисцидоз [6] и болезнь Альцгеймера [7], могут быть вызваны манипулированием геномом мыши и окружающей ее средой. К привлекательности мыши как модели для биомедицинских исследований добавляется еще и относительно низкая стоимость содержания животного и его способность быстро размножаться (рис. 2) [5].
Рисунок 2. Мыши являются самым часто используемыми модельными организмами
Мышей использовали в биомедицинских исследованиях начиная с XVI века, когда Уильям Гарвей изучал на них процессы репродукции и кровообращения, а Роберт Гук использовал их для изучения биологических последствий повышения давления воздуха. В XVIII веке Джозеф Пристли и Антуан Лавуазье изучали дыхание мышей. В XIX веке Грегор Мендель проводил свои ранние исследования наследования цвета шерсти у мышей, но монастырское начальство потребовало прекратить разводить в келье «вонючих существ». После этого Мендель переключил свои исследования на горох, но, поскольку его наблюдения были опубликованы не в крупном научном журнале, а в «Трудах общества естественной истории» города Брно, они фактически игнорировались в течение более 35 лет, пока не были вновь открыты в начале XX века. В 1902 году Люсьен Куэнот опубликовал результаты своих экспериментов на мышах, которые показали, что законы наследования Менделя также действительны для животных — результаты, которые вскоре были подтверждены и распространены на другие виды. В начале XX века студент Гарвардского университета Кларенс Кук Литтл проводил исследования по генетике мышей в лаборатории Уильяма Эрнеста Касла. Литтл и Касл тесно сотрудничали с Эбби Латроп, которая выращивала декоративных мышей и крыс и продавала их любителям грызунов и экзотических животных, а затем начала продавать в больших количествах научным исследователям. С тех пор мышь стала широко использоваться в качестве модельного организма и оказалась связана со многими важными биологическими открытиями XX и XXI веков.
В наши дни самое крупное в мире учреждение, занимающееся исследованиями в области генетики млекопитающих и поставками лабораторных животных в университеты, медицинские школы и научно-исследовательские лаборатории всего мира — некоммерческий институт Джексоновская лаборатория (The Jackson Laboratory, или JAX), основанная в 1929 году. Лаборатория не только главный поставщик практически любых генетических ресурсов, но и крупнейший центр обучения ученых. Миссия Джексоновской лаборатории — найти точные геномные решения для лечения болезней и расширить возможности мирового биомедицинского сообщества в общем стремлении улучшить здоровье людей. Сегодня JAX объединяет генетику мыши и геномику человека для расшифровки генетических и молекулярных основ здоровья и болезней человека. Джексоновская лаборатория предлагает самое большое разнообразие инбредных, гибридных и мутантных мышей для исследований. JAX стала пионером в использовании мышей в исследованиях заболеваний, и с тех пор мыши и исследовательские программы JAX внесли большой вклад в медицину. Джексоновских мышей содержат в условиях чистой комнаты. Самочувствие каждой мыши проверяется, по крайней мере, один раз в день, за каждой мышью следят, чтобы животное было здорово, получало достаточное количество пищи и воды, а подстилка была сухой и чистой. Обученные специалисты по защите животных уделяют самое пристальное внимание мышам, о которых они заботятся каждый день. Международная ассоциация по оценке и аккредитации лабораторных животных (AAALAC) направляет специалистов для регулярного осмотра качества содержания и ухода за животными [8].
Другая частная биотехнологическая компания, один из крупнейших поставщиков лабораторных грызунов, заслужившая доброе имя качеством своих животных и услуг, — Taconic Biosciences. Уже более 65 лет компания занимается поставкой исследовательских моделей. Их миссия — ускорить прогресс в области здоровья человека, предоставляя клиентам лучшие животные модели. Зачем? Потому что сочетание лучших моделей, эксклюзивных технологий, передового опыта и индивидуальных программ позволяет лучше понять заболевания и найти способы их лечения. Предложение наилучшего решения также означает, что для достижения биологического понимания требуется меньше животных. Taconic Biosciences хоть и является поставщиком исследовательских моделей, но поддерживает усилия научного сообщества по сокращению использования лабораторных животных. Компания придерживается высоких этических стандартов использования животных в исследованиях и гарантирует, что ее животные получают высочайший уровень заботы и ухода.
Американская корпорация Charles River Laboratories специализируется на разнообразных доклинических и клинических лабораторных услугах для фармацевтической, медицинской и биотехнологической промышленности. Компания также поставляет различные биомедицинские продукты и услуги аутсорсинга исследований и разработок для использования в фармацевтической промышленности. Согласно веб-сайту компании, клиентами Charles River Laboratories являются ведущие фармацевтические, биотехнологические, агрохимические, государственные и академические организации по всему миру. Вместе создавать здоровую жизнь — цель Charles River. Имея более 20 питомников по всему миру, Charles River является одним из ведущих мировых поставщиков стандартных мышей для биомедицинских исследований.
Теперь перейдем к обзору исследований, где используются мышиные модели инфекционных заболеваний, рака и болезни Альцгеймера.
Мыши и инфекционные заболевания
Инфекционные заболевания — группа заболеваний, вызываемых проникновением в организм болезнетворных микроорганизмов. Чтобы патогенный микроорганизм вызвал заболевание, он должен обладать вирулентностью, способностями преодолевать сопротивляемость организма и оказывать на него токсическое воздействие. Одной из особенностей инфекционных заболеваний является наличие инкубационного периода. Длительность инкубационного периода зависит от способа заражения и вида возбудителя и может длиться от нескольких часов до нескольких лет. Для каждого вида заболевания имеются свои входные ворота — места проникновения инфекции. Так, например, слизистые оболочки дыхательных путей являются входными воротами для возбудителей гриппа, кори [9], скарлатины и других, кожные покровы — для возбудителей малярии [10], сыпного тифа и т.д.
В зависимости от природы возбудителей инфекционные заболевания делятся на разные типы, например, бактериальные, вирусные, грибковые и др. Далее представлено по одному исследованию, направленному на изучение некоторых типов инфекционных заболеваний в зависимости от возбудителя (микобактерии, бактерии, вирусы и круглые черви), в которых, конечно же, используются мыши как модельные организмы.
Микобактерии
Туберкулез входит в десятку ведущих причин смерти (по данным Всемирной организации здравоохранения (WHO), 1,3 млн смертельных случаев от туберкулеза в 2016 году) [2]. Большую обеспокоенность вызывает растущая распространенность устойчивых к лекарственным средствам микобактерий, вызывающих эту болезнь. Также туберкулез — основная причина смерти людей, живущих с ВИЧ [11]. Существует острая необходимость в разработке и тестировании новых вакцин и лекарственных препаратов для профилактики и лечения туберкулеза. Поэтому необходима и разработка животных моделей для изучения приобретения резистентности возбудителями и тестирования новых методов лечения заболевания. Существует несколько превосходных моделей, используемых для изучения туберкулеза, но у многих есть ограничения для воспроизведения человеческой патологии, и ни одна из моделей не поддается непосредственному изучению коинфекции ВИЧ / возбудитель туберкулеза.
В одном исследовании, посвященном созданию мышиной модели туберкулеза, мышей интраназально (капельным способом) заражали Mycobacterium tuberculosis [12]. При этом, животным были изначально привиты ткани печени и тимуса, а также CD34+ гематопоэтические стволовые клетки плода человека. Это было сделано для того, чтобы проследить, как человеческие иммунные клетки будут бороться с микобактериями.
У зараженных мышей была прогрессирующая бактериальная инфекция в легких, которая распространялась в селезенку и печень через 2–8 недель после заражения. Места инфекции в легких были поражены разными недугами с пугающими названиями, а именно: казеозным некрозом (формой гибели клеток, при которой ткань приобретает сыроподобную структуру), бронхиальной обструкцией (синдромом, возникающим в результате нарушенной проходимости бронхиального дерева и приводящим к неадекватной легочной вентиляции и затруднению отхождения слизи из бронхов), гранулематозными поражениями (образованием гранулем — узелков) и кристаллизацией холестерина. В ответ на атаку патогенов и заражение внутренних органов и тканей у мышей активировался клеточный иммунный ответ. Человеческие Т-клетки (следует напомнить о пересаженной ткани тимуса, так как именно этот орган играет решающую роль в развитии Т-лимфоцитов) вышли в бой. Они распределились по легкому, печени, селезенке в местах воспаления и роста бактерий. Исследование показало, что у BLT-гуманизированной мыши (bone marrow — костный мозг; liver — печень; thymus — тимус), которая была моделью туберкулеза в этом исследовании, развивается туберкулез, и видна патология, аналогичная той, которая наблюдается у инфицированных людей. Иммунная система гуманизированных мышей успешно справлялась с заболеванием, благодаря лейкоцитам человека (включая Т-клетки, макрофаги, естественные клетки-киллеры и антигенпрезентирующие клетки). Т-клетки человека (CD4+ и CD8+) и моноциты/макрофаги нормально распределяются в ткани. Важно, что человеческие Т-клетки в мышиной модели делились в ответ на активацию, экспрессировали эффекторные молекулы (например гранулизин) и организовывались в местах инфекции. Исследование подтверждает замечательную возможность использования BLT-гуманизированной мыши для понимания иммунного ответа человека на M. tuberculosis. Такая модель позволит в дальнейшем расширить уже имеющиеся знания о биологии коинфекции ВИЧ / возбудитель туберкулеза, разработать и тестировать вакцины и лекарства.
Бактерии
Salmonella enterica серотип Typhi (S. Typhi) — возбудитель опасного для жизни человека заболевания, брюшного тифа [13]. По оценкам, каждый год от него страдает около 22 миллионов человек. В Соединенных Штатах Америки приблизительно у 350 человек ежегодно диагностируется брюшной тиф, чаще всего после поездок за пределы США в такие страны, как Индия, Бангладеш и Пакистан. Люди являются единственным переносчиком этих бактерий. Брюшным тифом можно заразиться через воду или пищу, загрязненные фекалиями остро инфицированного или выздоравливающего человека или бессимптомного носителя бактерий-возбудителей. Риск заражения высок в странах с низким и средним уровнями доходов, страдающих эндемическими заболеваниями, антисанитарией и недостаточным доступом к безопасной пище и воде [14].
В следующем исследовании ученые стремились изучить способность Rag2–/–γc–/– мышей с гуманизированной иммунной системой поддерживать инфекцию, вызванную S. Typhi [15]. Исследователи вживили CD34+ гемопоэтические стволовые клетки [16], [17] плода человека в печень иммунодефицитных мышей, после чего внутрибрюшинно инфицировали животных S. Typhi дикого типа. Далее ученые обнаружили, что эти мыши способны поддерживать репликацию S. Typhi и непрерывно возобновляющуюся (персистирующую) инфекцию. S. Typhi с мутацией в гене, необходимом для вирулентности у людей, не могли реплицироваться у этих мышей. Другой мутант, не способный продуцировать тифоидный токсин, проявлял повышенную репликацию, что указывает на роль этого токсина в возникновении персистирующей инфекции. Более того, инфицированные животные выработали врожденный и адаптивный иммунный ответ на S. Typhi, что привело к выработке цитокинов и патоген-специфических антител. Таким образом, эти результаты показывают, что такая мышиная модель может быть использована для изучения патогенеза S. Typhi и оценки потенциальных вакцин-кандидатов против брюшного тифа.
Вирусы
Лихорадка Зика — острое инфекционное заболевание, характерными симптомами которого являются сыпь, утомление, головная и суставная боль, лихорадка, опухание суставов. Заболевание вызывает вирус Зика (ВЗ) — вид вирусов рода Flavivirus, переносимый комарами рода Aedes [18]. Вирус привлек к себе всеобщее внимание благодаря своим необычным эпидемиологическим и клиническим характеристикам, включая персистирующую инфекцию в мужском репродуктивном тракте и передачу половым путем, способность проникать через плаценту во время беременности и заражать развивающийся плод, вызывая врожденные аномалии развития, и его связь с синдромом Гийена—Барре у взрослых. В настоящее время нет вакцины против ВЗ, хотя несколько уже проходит клинические испытания, и единственной защитой от вируса являются профилактические меры, такие как репелленты от насекомых, пребывание в защищенном помещении и использование одежды с длинными рукавами и штанинами.
Существуют животные модели для изучения механизмов распространения, патогенеза и иммунного ответа на ВЗ у взрослых, беременных матерей и развивающихся плодов. Эти модели используются для оценки новых терапевтических средств и вакцин для возможной защиты и контроля инфекции ВЗ. Далее мы рассмотрим исследование, опубликованное в августе 2018 года в журнале Nature Communications, посвященное как раз разработке вакцины против ВЗ [19].
Команда исследователей из Университета штата Огайо разработала и протестировала вакцину, в которой используется уникальный подход к борьбе с вирусом Зика. Согласно исследованию, вакцина, несущая гены для двух-трех белков ВЗ, включая белок NS1, оказалась эффективной в запуске иммунного ответа, который предотвращал последующее заражение вирусом. В качестве средства передачи белков ВЗ исследователи использовали вирус везикулярного стоматита (ВВС), который вызывает ящур у крупного рогатого скота, характеризующийся поражением слизистых оболочек ротовой и носовой полостей. Ослабленная форма ВВС безвредна для людей и мышей. В целом, вакцины работают, доставляя безопасные количества целевых вирусных белков в кровоток и позволяя организму запускать иммунные реакции, которые обеспечат защиту в случае последующего воздействия вируса. Исследователям необходимо было ослабить ВВС, чтобы он не вызывал никаких побочных реакций, а затем произвести вставку генов из других вирусов для создания мощных вакцин. Исследователи проверяли вакцину на мышах с нарушенной иммунной системой. Когда вакцинированные мыши подвергались воздействию ВЗ, их ослабленные иммунные системы быстро и эффективно боролись с ним. Исследование показало, что белок NS1 играет регуляторную роль в ВЗ-специфическом Т-клеточном ответе, и что только этот белок может обеспечивать частичную защиту от ВЗ. Разработанная вакцина доказала свою эффективность на мышах и может быть перспективным кандидатом для создания вакцины против ВЗ для людей [19], [20].
Круглые черви, нематоды
Нематода Brugia malayi является одним из трех возбудителей лимфатического филяриоза у людей. Лимфатический филяриоз («слоновость», или элефантиаз) — заболевание человека, характеризующееся увеличением какой-либо части тела (например конечностей) за счет болезненного разрастания кожи и подкожной клетчатки (рис. 3). Это происходит из-за постоянного застоя лимфы с образованием отека. В исследовании далекого 1991 года ученые заражали scid-мышей личинками человеческого паразита, нематоды Brugia malayi [21]. Scid-мыши (от англ. severe combined immunodeficiency — тяжелый комбинированный иммунодефицит) не могут генерировать функциональные B- или T-лимфоциты и поэтому имеют тяжелый иммунодефицит. В течение 6–10 недель после подкожной инъекции инфекционных личинок нематоды самцы и самки червей были найдены у 90% мышей, а уже через 8 недель и более после заражения у 52% обследованных мышей были обнаружены микрофилярии (личинки) в крови и брюшной полости. Взрослые черви наблюдались в лимфатических узлах инфицированных мышей, где их присутствие было связано с лимфангитом (воспалением лимфатических сосудов) и лимфангиэктазией (патологическим расширением лимфатических сосудов). Результаты этого исследования позволяют предположить, что модель лимфатического филяриоза у scid-мышей может иметь важное значение при исследовании взаимодействия мышиной и, возможно, человеческой иммунной системы с филяриями, круглыми червями-паразитами.
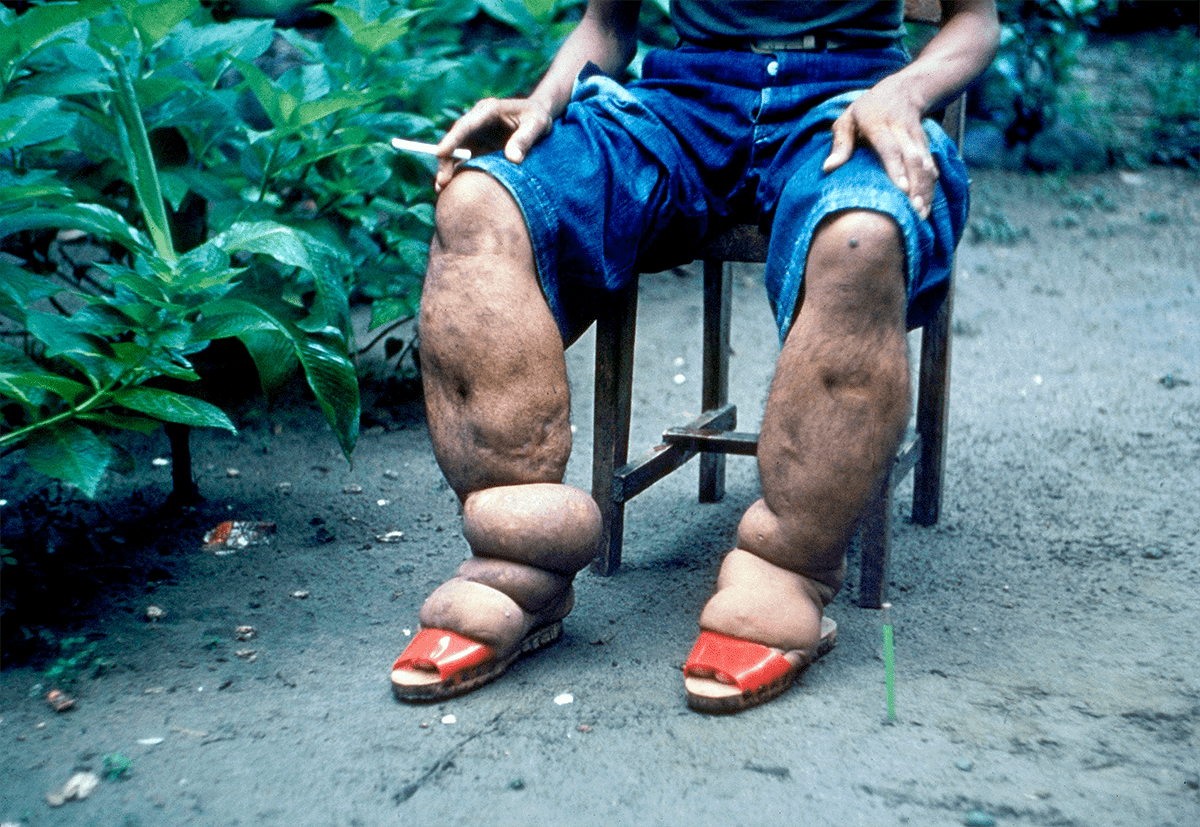
Рисунок 3. Элефантиаз ног из-за филяриоза. Филиппины.
Мыши и опухоли
Рак — это группа заболеваний, связанных с аномальным ростом клеток, которые могут распространяться в другие части тела (метастазировать) [22], [23]. Рак может начать развиваться практически в любом месте организма. Обычно клетки растут и делятся, образуя новые клетки по мере необходимости. Когда клетки стареют или повреждаются, они умирают, и их место занимают новые клетки. Однако когда развивается рак, этот упорядоченный процесс нарушается. Поскольку клетки становятся все более и более генетически «ненормальными», старые или поврежденные выживают, когда они должны умереть, а новые образуются, когда они не нужны. Эти дополнительные клетки могут делиться без остановки и тем самым образовывать опухоли. Опухоли являются злокачественными, если они могут распространяться и проникать в близлежащие ткани. Кроме того, по мере роста злокачественных опухолей некоторые раковые клетки могут перемещаться в отдаленные места тела через кровь или лимфатическую систему и образовывать новые опухолевые очаги вдали от исходной опухоли. Процесс распространения рака из одной части тела в другую называется метастазированием [24].
В отличие от злокачественных опухолей, доброкачественные не распространяются и не проникают в близлежащие ткани. При удалении они обычно не появляются заново, тогда как злокачественные опухоли способны возвращаться [25]. Лечение опухолей может включать в себя хирургическое вмешательство, радиотерапию и/или химиотерапию. Также могут быть применены трансплантация стволовых клеток, гормональная терапия, иммунотерапия или другие виды биологической терапии.
Давайте рассмотрим примеры исследований, изучающих влияние среды и питания на вероятность возникновения опухолей, а также различные подходы к иммунотерапии опухолей.
Влияние среды на вероятность возникновения опухолей
Перед вами — исследование, посвященное изучению влияния среды на организм и на вероятность возникновения и развития опухолей [26]. Известно, что токсичные остатки сигаретного дыма, оседающие на поверхностях в помещениях и в пыли, — это угроза здоровью. Особенно подвержены этим токсинам маленькие дети, так как они вступают в контакт с загрязненными поверхностями, например, во время ползания по полу. Исследователи из Национальной лаборатории им. Лоуренса в Беркли определили, что раннее воздействие табачного дыма связано с увеличением частоты и тяжести рака легких у мышей. Ученые поместили A/J-мышей в клетки, где находились клочки ткани, пропитанные сигаретным дымом. A/J-мыши широко используются для моделирования рака и тестирования канцерогенов, учитывая их высокую восприимчивость к канцероген-индуцированным опухолям. По оценкам, доза, полученная мышами, составляла около 77 микрограммов на килограмм массы тела в день, что сравнимо с воздухом, вдыхаемым несчастным ребенком, живущим в доме с курильщиками. Через сорок недель после последнего воздействия прокуренными кусками ткани у мышей обнаружилась повышенная частота возникновения аденокарциномы легкого. Результаты исследования показывают, что осевшие частички сигаретного дыма, токсичные остатки, которые задерживаются на поверхностях и в пыли после курения сигареты, увеличивают риск рака легких у мышей и, естественно, представляют опасность и для здоровья людей (рис. 4) [27].
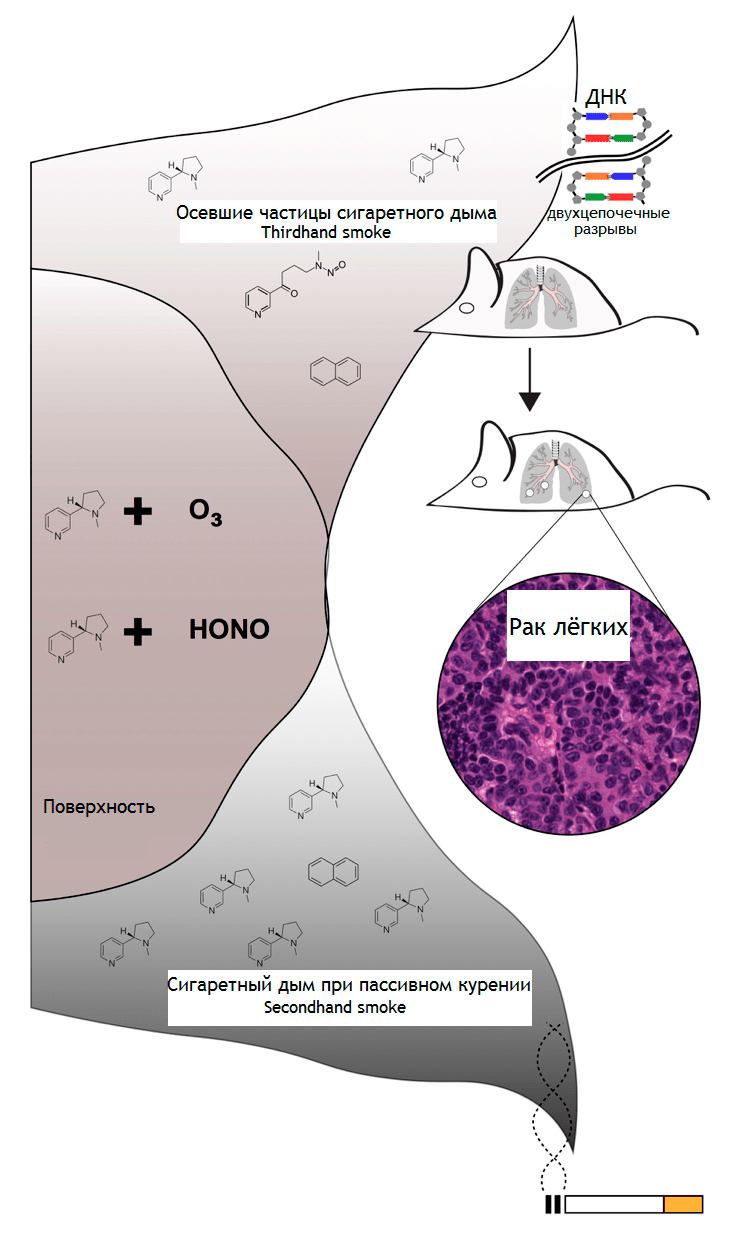
Рисунок 4. Частицы сигаретного дыма, оседающие на поверхностях помещений, содержат химические вещества, которые вдыхают люди при пассивном курении. Некоторые из этих веществ взаимодействуют с молекулами воздуха, создавая токсичную смесь, которая включает потенциально канцерогенные соединения. Эти соединения вызывают двухцепочечные разрывы в ДНК, которые, если их не исправить должным образом, могут привести к онкогенезу у мышей.
Thirdhand Smoke Found to Increase Lung Cancer Risk in Mice, рисунок адаптирован
Влияние питания на развитие рака
Одни ученые «травят» мышей сигаретным дымом, другие «угощают» грызунов жареным маслом. Ученые из Университета Иллинойса обнаружили, что растительное масло, которое неоднократно нагревалось до высоких температур, может выступать в качестве токсикологического триггера, способствующего разрастанию опухолевых клеток, метастазированию и изменениям в метаболизме липидов [28].
Как они это выяснили? После недельной диеты с низким содержанием жиров одну группу мышей в течение 16 недель кормили не нагретым свежим соевым маслом, а другую группу — неоднократно сильно нагретым маслом. Далее исследователи симулировали рак молочной железы поздней стадии, вводя клетки опухоли в голень каждой мыши. Были использованы 4T1-клетки, которые способны эффективно метастазировать в некоторые участки тела, включая легкие, печень, мозг, лимфатические узлы и кости [29]. Спустя 20 дней после прививки опухолевых клеток, первичные опухоли большеберцовой кости мышей, употреблявших «пережаренное» масло, показали метастатический рост больший чем в четыре раза по сравнению с мышами, которые потребляли свежее соевое масло (рис. 5). Исследовав легкие обеих групп животных, ученые обнаружили больше метастазов среди тех, кто употреблял «пережаренное» масло. Происходило это потому, что при повторном использовании масла распадаются триглицериды, окисляя свободные жирные кислоты и выделяя акролеин — токсичный химикат, обладающий канцерогенными свойствами [30].
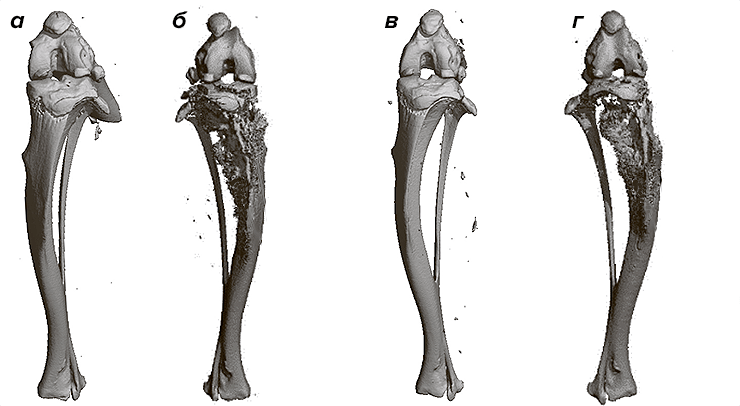
Рисунок 5. Кости использованных в исследовании мышей. Мыши, употреблявшие свежее соевое масло: а — не инокулированные раковыми клетками; б — инокулированные раковыми клетками. Мыши, получавшие «пережаренное» масло: в — не инокулированные раковыми клетками; г — инокулированные раковыми клетками. Заметно, что наибольшие повреждения кости имели мыши, получавшие «пережаренное» масло.
Иммунотерапия опухолей
Иммунотерапия рака — это искусственная стимуляция иммунной системы для лечения рака, способствующая улучшению естественной способности иммунной системы бороться с раком [31], [32]. До недавнего времени врачи располагали лишь тремя инструментами для борьбы с раком — операция, облучение ионизирующей радиацией и химиотерапия. Нобелевская премия 2018 года по физиологии или медицине дана за важнейшие шаги в разработке четвертого способа борьбы — иммунотерапии [33]. В связи с этим рассмотрим два исследования на тему иммунотерапии.
Исследователи из Колумбийского университета разработали непатогенный штамм бактерий Escherichia coli, который способен колонизировать сóлидные опухоли у мышей и действовать как троянский конь, который лечит опухоли изнутри. Дело в том, что терапевтическая мишень этих бактерий — белок CD47, находящийся внутри опухолей. CD47, сигнал «не ешь меня», защищает раковые клетки от поедания клетками врожденного иммунитета, такими как макрофаги и дендритные клетки. Лечение мышей искусственно сконструированными бактериями привело к усиленному фагоцитозу опухолевых клеток и усилению активации и деления Т-клеток в обработанных опухолях. Исследователи обнаружили, что лечение с помощью сконструированных ими бактерий не только привело к уменьшению обработанных опухолей, но и снизило частоту возникновения метастазов в нескольких моделях. Сейчас команда проводит дальнейшие тестирования данной концепции, а также исследования в области безопасности разработанных ими иммунотерапевтических бактерий на широком спектре сóлидных опухолей с применением мышиных моделей. Положительные результаты этих тестов могут привести к клиническим испытаниям такого подхода на пациентах [34], [35].
Следующее исследование также посвящено иммунотерапии. Ученые из Университета штата Северная Каролина разработали метод иммунотерапии меланомы, применяющийся через трансдермальный пластырь и усиливающий меланин. Лизат — «пюре» из клеток меланомы — используется для заполнения микроигл, встроенных в полимерный трансдермальный пластырь. Поскольку клетки меланомы содержат высокий уровень пигмента меланина, заполненные лизатом микроиглы имеют темный цвет и поглощают свет. Исследователи используют это в своей новой технике, направляя ближний инфракрасный свет (ИК-свет) на трансдермальный пластырь. Свет поглощается меланином в микроиглах, что повышает температуру кожи, на которую наносится пластырь. Локальное тепло способствует выделению лизата из микроигл, привлекая и активируя иммунные клетки. Также повышенная местная температура способствует локальному увеличению кровотока и лимфатического потока, облегчая миграцию иммунных клеток. Так пластырь помогает иммунной системе запомнить антигены меланомы и увеличивает скорость реакции и эффективность иммунного ответа, что может пригодится в будущем, если наступит рецидив — возвращение опухоли.
Чтобы проверить потенциал пластыря в качестве вакцины, исследователи использовали три группы мышей:
- одна группа получила пластырь и подвергалась воздействию ИК-света;
- другая группа получила пластырь, но не подвергалась воздействию ИК-света;
- последняя группа получила пустой пластырь, без лизата.
Пластырь был нанесен мышам на пять дней. Через десять дней после нанесения пластыря мышам вводили активные клетки меланомы. В течение одного месяца все мыши, получившие пустой пластырь, умерли от меланомы. Сам по себе пластырь с лизатом, без воздействия ИК-света, обеспечивал слабую защиту: выжило только 13% мышей. Между тем, 100% мышей, которые получили пластырь с лизатом при облучении ИК-светом, выжили через два месяца, а у 87% из этих ста вообще не было обнаружено опухолей.
Чтобы дополнительно проверить терапевтические свойства пластыря, исследователи провели аналогичный эксперимент. Они взяли мышей, у которых уже развились две опухоли — по одной на каждой стороне тела. Пластырь был нанесен только на одну опухоль с левой стороны тела. Результат оказался предсказуем: мыши, которые получили пластырь с лизатом и ИК-свет, имели значительное уменьшение объема обеих опухолей, хотя опухоль слева, на которую был нанесен пластырь, уменьшилась больше правой. Пластырь сам по себе, без ИК-света, ограничивал рост опухоли, особенно слева, но не уничтожал ее. Результаты обнадеживают, но пока данная методика находится лишь на начальных этапах разработки. Необходимо обширное исследование на животных для дальнейшей оценки безопасности и эффективности техники [36], [37].
Изучение рака на людях ограничивается аналитическими и наблюдательными исследованиями по очевидным этическим причинам, при этом мышиные модели служат незаменимой промежуточной доклинической модельной системой, соединяющей исследования in vitro (в пробирке) с клиническими исследованиями на людях. Мыши являются мощными и незаменимыми инструментами в фундаментальных, а также трансляционных исследованиях биологии опухолей. Новые модели разрабатываются с беспрецедентной скоростью и постоянно расширяют набор инструментов исследователей рака [38].
Мыши и болезнь Альцгеймера
Болезнь Альцгеймера (БА) — нейродегенеративное заболевание, проявляющееся, в основном, у людей старше 65 лет (рис. 6) [7]. БА характеризуется ранним дефицитом памяти, за которым следует постепенная дегенерация других когнитивных функций. В мозге у больного БА в определенных местах происходит массивная потеря нервных клеток и синапсов (мест контакта между двумя нейронами), формируются бета-амилоидные (β-amyloid) бляшки и нейрофибриллярные клубки [39]. Со временем разрушаются даже те нейроны, которые отвечают за основные функции организма, такие как ходьба и глотание. На последних стадиях этого заболевания люди оказываются прикованными к постели и нуждаются в постоянном уходе. В конечном итоге БА приводит к смерти [40].

Рисунок 6. Алоис Альцгеймер с белой мышкой
коллаж автора статьи по Alzheimer’s и PicsArt
В одном исследовании на мышах ученые экзогенно ввели бета-амилоид в мозг здоровых грызунов, основываясь на том, что БА начинается с едва заметных изменений в синаптической пластичности, доходя до обширной дегенерации нейронов, и что синаптическая дисфункция может быть вызвана диффузными олигомерными комплексами бета-амилоида [41]. Оказалось, что диффузная форма бета-амилоида оказывает быстрое прямое влияние на синаптическую пластичность и обучение, а в агрегированной форме также запускает вторичные, долговременные процессы, которые влияют на синаптическую функцию и память. Наблюдение, что есть по крайней мере два различных процесса, которые связаны с патогенным амилоидным путем и приводят к ухудшению памяти, делает модель инъекции амилоида особенно ценным инструментом для изучения связанных с БА проблем с памятью и для скрининга новых терапевтических стратегий [41].
Исследователи из Лундского университета в Швеции, изучая как здоровых, так и больных мышей, обнаружили, что мыши, страдающие БА, имеют другой состав кишечных бактерий по сравнению со здоровыми. Они также изучали БА у мышей с полным отсутствием бактерий и выяснили, что в их мозге было меньше бета-амилоидных бляшек. Для прояснения связи между кишечной флорой и возникновение БА исследователи перенесли кишечные бактерии больных БА мышей к «свободным от микробов» мышам, и у этих мышей появилось больше бета-амилоидных бляшек. Это должно «намекнуть» ученым на то, что необходимо продолжать изучать роль бактерий в развитии БА и тестировать совершенно новые типы профилактических и терапевтических стратегий, основанных на модуляции кишечной микробиоты с помощью диеты и новых типов пробиотиков [42].
Исследователи из Чикагского университета изучили влияние антибиотиков на больных БА мышей [43]. Длительное лечение антибиотиками уменьшало количество амилоидных бляшек у мышей-самцов, но не оказывало влияния на самок. Употребление антибиотиков также, по-видимому, изменяло активацию микроглии у самцов, превращая их из формы, которая, как считается, способствует нейродегенерации, в форму, которая помогает поддерживать здоровый мозг. Чтобы доказать, что эти улучшения симптомов БА были вызваны изменениями в микробиоме кишечника, исследователи пересадили фекалии от мышей, которые не употребляли антибиотики, мышам, получившим антибиотики. Эта процедура восстановила микробиом кишечника и вызвала увеличение образования амилоидных бляшек и активации микроглии.
Но почему изменения в микробиоме кишечника повлияли только на самцов мышей? Исследователи обнаружили, что длительное лечение антибиотиками по-разному изменяет сообщество кишечных бактерий мышей мужского и женского полов и что вызванные антибиотиками нарушения кишечного микробиома оказывают избирательное, специфичное для пола, влияние на формирование амилоидных бляшек и активность микроглии в мозге. Изменения в микробиоме мышей-самок заставили их иммунную систему увеличить выработку нескольких провоспалительных факторов, которые могут влиять на активацию микроглии. Исследование показало, что тип бактерий, живущих в кишечнике, может влиять на развитие симптомов БА у мышей, изменение микробиома кишечника и длительное лечение антибиотиками уменьшает воспаление и замедляет рост амилоидных бляшек в мозге мышей-самцов [44].
Известно, что энергичные тренировки приводят к потоку эндорфинов и других гормонов, повышающих настроение. Несколько лет назад обнаружили гормон под названием иризин, который выделяется во время физических нагрузок. Иризин играет роль в энергетическом обмене и способствует росту нейронов в гиппокампе (рис. 7) [45]. Гиппокамп является областью, необходимой для обучения и памяти, генерирует новые нейроны на протяжении всей жизни. При БА именно гиппокамп и кора больших полушарий разрушаются в первую очередь.
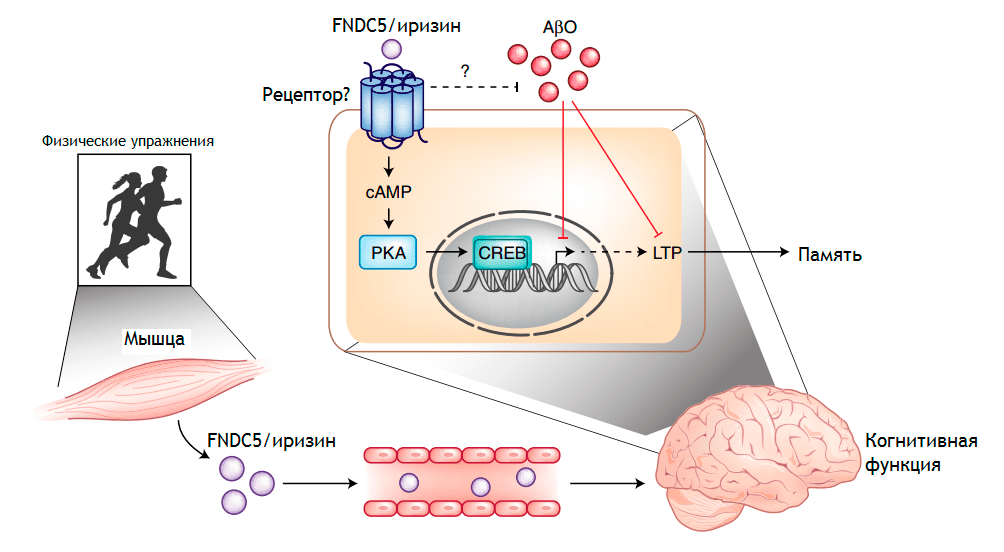
Рисунок 7. FNDC5, или иризин, выделяемый во время физических упражнений, предотвращает снижение когнитивной функции. Физические упражнения способствуют высвобождению иризина из мышц, далее иризин транспортируется через кровообращение в мозг и препятствует потери памяти и улучшает синаптическую пластичность. Механизм, с помощью которого это происходит, еще не изучен полностью.
[45], рисунок адаптирован
Команда ученых из разных стран исследовала, что делает иризин в мозге мышей [46]. Проведенные ими эксперименты показывают, что иризин у мышей защищает синапсы мозга и память животных: когда иризин был отключен в гиппокампе здоровых мышей, синапсы и память ослабевали. Точно также повышение уровня иризина в мозге улучшало оба показателя здоровья мозга (синапсы или «контакты» нейронов и память). Плавание, то есть физическая нагрузка, повысило уровень иризина и защитило память мышей. Исследователи обнаружили, что у мышей, которые плавали почти каждый день в течение пяти недель, не развивалось ухудшение памяти, несмотря на то, что они получали инфузии вовлеченного в БА бета-амилоида. Исследователи также обнаружили, что блокирование иризина препаратом полностью исключает преимущества плавания. Мыши, которые плавали и получали лечение блокирующими иризин веществами, показали результаты в тестах на память не лучше, чем сидячие животные после инфузий бета-амилоида. Вместе результаты показывают, что иризин можно использовать для профилактики или лечения деменции у людей. Команда сейчас ищет фармацевтические соединения, которые могут повысить уровень гормона в мозге или имитировать его действие. Исследователи призывают заниматься физическими упражнениями, чтобы улучшить работу мозга и общее состояние здоровья. Но для многих людей это невозможно, особенно для людей с такими возрастными состояниями, как сердечные заболевания, артрит или деменция. Для этих людей существует особая потребность в лекарствах, которые могут имитировать действие иризина и защищать синапсы и предотвращать снижение когнитивных функций [47].
Как и в случае со всеми другими заболеваниями, доклинические исследования необходимы для расширения уже имеющихся знаний о БА, разработки, валидации и тестирования лекарств. Данные о безопасности, дозировке, фармакокинетическом и фармакодинамическом профилях животных всегда необходимы для клинических испытаний и утверждения новых лекарств на людях. Таким образом, модельные животные являются незаменимыми инструментами для исследования болезни Альцгеймера [48].
Заключение
С появляющимися и уже изобретенными технологиями разрабатываются новые варианты исследований на модельных организмах, в частности, мышах. Так, CRISPR-технологии [49], технологии геномного редактирования, могут быть применены для лечения генетических заболеваний и борьбы с хроническими заболевания, такими как гепатиты и ВИЧ-инфекция, и мышь может быть одной из доклинических моделей тестирования современных технологий коррекции генома. Также заманчивой перспективой является использование трансгенных мышей для производства антител, например, в молоке. В настоящее время такой способ получения антител активно исследуется, однако пока он далек от реального использования в медицине [50].
Наука не стоит на месте, каждый день появляется что-то новое, и можно еще долго размышлять о достижениях, которые могут быть полезны для проведения исследований на мышиных и других животных моделях. Однако если быть честным, по мере разработки дополнительных альтернатив в науке также уменьшается и потребность в модельных животных. Однако полный отказ от них случится очень нескоро, и поэтому мышь как модельный организм будет, скорее всего, так же важна, как сегодня, еще 10–15 и больше лет.
Литература
- Кох и все его палочки;
- Болезнь, не думавшая сдаваться;
- João Pedro Magalhães. (2015). The big, the bad and the ugly. EMBO Rep. 16, 771-776;
- What's more effective: human or animal studies? JAX;
- Background on mouse as a model organism. NIH;
- Муковисцидоз — первые надежды;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Our mice, our hope. JAX;
- Корь: война с детской чумой продолжается;
- Как понравиться вампиру, или За что комары так любят больных малярией?;
- СПИД: как ВИЧ разрушает нашу иммунную систему;
- Veronica E. Calderon, Gustavo Valbuena, Yenny Goez, Barbara M. Judy, Matthew B. Huante, et. al.. (2013). A Humanized Mouse Model of Tuberculosis. PLoS ONE. 8, e63331;
- Секретное оружие конкисты;
- Appiah G.D., Hughes M.J., Chatham-Stephens K. (2020). Typhoid & paratyphoid fever. CDC;
- Jeongmin Song, Tim Willinger, Anthony Rongvaux, Elizabeth E. Eynon, Sean Stevens, et. al.. (2010). A Mouse Model for the Human Pathogen Salmonella Typhi. Cell Host & Microbe. 8, 369-376;
- Ствол и ветки: стволовые клетки;
- Такие разные стволовые клетки;
- Вирус Зика — глобальная угроза?;
- Anzhong Li, Jingyou Yu, Mijia Lu, Yuanmei Ma, Zayed Attia, et. al.. (2018). A Zika virus vaccine expressing premembrane-envelope-NS1 polyprotein. Nat Commun. 9;
- Novel vaccine approach proves powerful against Zika virus. (2018). ScienceDaily;
- F. K. Nelson. (1991). The immunodeficient scid mouse as a model for human lymphatic filariasis. Journal of Experimental Medicine. 173, 659-663;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Страшней клешней на свете нет...;
- Метастазирование опухолей;
- What is cancer? (2015). NIH;
- Bo Hang, Yunshan Wang, Yurong Huang, Pin Wang, Sasha A. Langley, et. al.. (2018). Short-term early exposure to thirdhand cigarette smoke increases lung cancer incidence in mice. Clin. Sci.. 132, 475-488;
- Third-hand smoke found to increase lung cancer risk in mice. (2018). ScienceDaily;
- Anthony Cam, Ashley B. Oyirifi, Yunxian Liu, Wanda M. Haschek, Urszula T. Iwaniec, et. al.. (2019). Thermally Abused Frying Oil Potentiates Metastasis to Lung in a Murine Model of Late-Stage Breast Cancer. Cancer Prev Res. 12, 201-210;
- Kai Tao, Min Fang, Joseph Alroy, G Gary Sahagian. (2008). Imagable 4T1 model for the study of late stage breast cancer. BMC Cancer. 8;
- Study in mice examines impact of reused cooking oil on breast cancer progression. (2019). ScienceDaily;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Иммуностимулирующие вакцины;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Bacteria engineered as Trojan horse for cancer immunotherapy. (2019). ScienceDaily;
- Sreyan Chowdhury, Samuel Castro, Courtney Coker, Taylor E. Hinchliffe, Nicholas Arpaia, Tal Danino. (2019). Programmable bacteria induce durable tumor regression and systemic antitumor immunity. Nat Med. 25, 1057-1063;
- Cancer immunotherapy uses melanin against melanoma. (2017). ScienceDaily;
- Yanqi Ye, Chao Wang, Xudong Zhang, Quanyin Hu, Yuqi Zhang, et. al.. (2017). A melanin-mediated cancer immunotherapy patch. Sci. Immunol.. 2, eaan5692;
- Nicolas Gengenbacher, Mahak Singhal, Hellmut G. Augustin. (2017). Preclinical mouse solid tumour models: status quo, challenges and perspectives. Nat Rev Cancer. 17, 751-765;
- Jürgen Götz, Lars M. Ittner. (2008). Animal models of Alzheimer's disease and frontotemporal dementia. Nat Rev Neurosci. 9, 532-544;
- . (2018). 2018 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 14, 367-429;
- A. Stephan, A. G. Phillips. (2005). A case for a non-transgenic animal model of Alzheimer's disease. Genes Brain Behav. 4, 157-172;
- Gut bacteria may play a role in Alzheimer’s disease. (2017). ScienceDaily;
- Hemraj B. Dodiya, Thomas Kuntz, Shabana M. Shaik, Caroline Baufeld, Jeffrey Leibowitz, et. al.. (2019). Sex-specific effects of microbiome perturbations on cerebral Aβ amyloidosis and microglia phenotypes. J. Exp. Med.. 216, 1542-1560;
- Antibiotic treatment alleviates Alzheimer's disease symptoms in male mice. (2019). ScienceDaily;
- Xu Chen, Li Gan. (2019). An exercise-induced messenger boosts memory in Alzheimer’s disease. Nat Med. 25, 20-21;
- Mychael V. Lourenco, Rudimar L. Frozza, Guilherme B. de Freitas, Hong Zhang, Grasielle C. Kincheski, et. al.. (2019). Exercise-linked FNDC5/irisin rescues synaptic plasticity and memory defects in Alzheimer’s models. Nat Med. 25, 165-175;
- How exercise may protect against Alzheimer's. (2019). ScienceDaily;
- Jürgen Götz, Liviu-Gabriel Bodea, Michel Goedert. (2018). Rodent models for Alzheimer disease. Nat Rev Neurosci. 19, 583-598;
- Просто о сложном: CRISPR/Cas;
- 12 методов в картинках: иммунологические технологии;
- Грызун особого назначения.






