В борьбе с раком: как люди корпускулы приручили
22 сентября 2020
В борьбе с раком: как люди корпускулы приручили
- 671
- 0
- 4
Оборудование для проведения протонной терапии. Онкологический центр Резерфорда в Южном Уэльсе.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Онкологические заболевания — одна из проблем современности. И человечество активно борется с этой проблемой. На помощь ему приходят лекарства и различные технологии. Одним из решений является использование ионизирующих излучений. Каким образом? Об этом расскажет данная статья.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Несколько слов о насущном
Эту статью хочется начать следующей фразой русского минералога, кристаллографа и геохимика Александра Евгеньевича Ферсмана: «Нет пределов фантазии, нет границ проникновению разума, нет пределов технической мощи, побеждающей природу». Когда читаешь этот афоризм, сразу появляется надежда, что однажды человек победит страшную болезнь — рак. А пока... А пока мы из года в год слышим из новостей, что какой-либо известный человек скончался от онкозаболевания. Естественно, в зоне риска оказываются не только артисты, но и любой из нас. Статистика подсказывает, что каждый год в мире выявляется более 14 млн онкологических больных. Она также говорит, что, к примеру, в 2010 году в России заболевших было 505 тысяч человек, а в 2012 году — 526 тысяч. В США в 2012 году рак поразил 1639 тысяч человек, а в 2013 г. 1660 тысяч [1]. Помимо того, совсем недавно было опубликовано исследование [2], результаты которого сообщают нам следующее:
- всего в мире за 2017 год заболело раком 24,5 млн человек, а умерло от него — 9,6 млн человек (что больше, чем в другие годы);
- в период с 2007 по 2017 число заболевших раком увеличилось на 33%;
- наиболее часто встречающиеся в мире на сегодняшний день виды рака — это немеланомный рак кожи; рак трахеи, бронхов и легких; рак кожи; рак толстой и прямой кишок; рак простаты.
Впрочем, статистика смертности от онкологических болезней и динамика заболеваемости известна и для периода с 1990 по 2017 годы.
Приведенные выше числа выглядят, мягко говоря, неприятно. Не внушает оптимизма и то, что рак на сегодняшний день — это вторая причина смерти в мире после сердечно-сосудистых заболеваний, и каждый шестой человек погибает именно по этой причине. Такая распространенность болезни стала возможна из-за развития факторов риска: увеличения продолжительности жизни (рак часто наблюдается именно у пожилых людей), ухудшения экологической обстановки, постоянного стресса. Это может показаться странным, но фактором риска является и успех медицины в лечении прочих заболеваний: заболеваемость и смертность от этих болезней падает и, таким образом, повышается заболеваемость и смертность от других, в частности, от онкологических [1].
От проблемы к ее решению: атака лучами
Сейчас уже сформировался широкий спектр видов лечения онкологических заболеваний, в который в первую очередь включены такие традиционные методы, как хирургия, химиотерапия и лучевая терапия. Кроме того, в последнее время предлагаются и высокотехнологичные методы: таргетная терапия, иммунотерапия, генная терапия [3], [4]. Казалось бы, с таким набором медицинского «оружия» как не победить такого злобного врага, как рак? Но каждый метод в той или иной степени имеет свои ограничения. Положительная сторона в том, что постоянно ведутся исследования в области лечения онкологических заболеваний, а значит, находятся решения, позволяющие обойти существующие ограничения.
В этой статье мы рассмотрим лучевую терапию. Под ней подразумевают такой вид онкотерапии, при котором на опухоль воздействуют потоками определенных частиц. Это могут быть фотоны или электроны. Лучевую терапию потоками этих частиц можно считать «классикой жанра». Однако эту самую «классику» все больше хочет потеснить более прогрессивный вид лучевой терапии — адронная. И частицы, которыми этот метод лечения оперирует, это протоны, нейтроны и ионы (иногда упоминаются и π-мезоны). Традиционная терапия фотонами и электронами вместе с адронной терапией осуществляются дистанционным путем. При этом особняком в сфере дистанционной лучевой терапии стоит так называемая стереотаксическая радиохирургия. Помимо того, раз есть терапия дистанционная, значит, есть и контактная (ее еще называют брахитерапией).
Брахитерапия — самый ранний вариант лучевой терапии, он зародился еще в начале XX века благодаря работам таких ученых, как Д. Пасто, П. Дэгрэ и Б. Барринджер. Осуществляется лечение следующим образом: капсула с источником радиоизлучения помещается внутрь организма вблизи опухоли. Таким образом зона, которая требует лечения, облучается, а здоровые ткани не затрагиваются (либо получают низкую дозу облучения), поскольку радиоактивное вещество не выходит за пределы капсулы. В качестве источников излучения используются радионуклиды: 192Ir, 60Co, 125I, 103Pd. Частицы, которыми облучается в итоге опухоль, это фотоны с низкой энергией, а сами радионуклиды имеют сравнительно небольшой период полураспада: 74 дня для 192Ir, около 5 лет для 60Co, 59,6 суток для 125I и всего 17 суток для 103Pd [5], [6].
Стереотаксическая радиохирургия, как уже сказано, тоже относится к лучевой терапии, поэтому этот метод не является хирургией в строгом смысле. Опухоль и здесь облучается фотонами, однако источник излучения — 60Co — уже находится вне тела человека. Идея в том, чтоб подвести к опухоли пучки от множества источников излучения. Соответственно в этой точке, куда подводятся пучки, доза радиации оказывается велика и, таким образом, достигается самое желанное: опухоль поражена, а здоровые ткани получают минимум дозы радиации.
Стереотаксическая радиохирургия существует уже около 70 лет: она появилась в 50-х годах XX века. Основоположником этого метода лечения был Ларс Лекселл, шведский нейрохирург (рис. 1). Хотя, конечно, метод не возник из ниоткуда: ему предшествовали работы Виктора Хорсли — Роберта Кларка и Генри Вайсиса — Эрнеста Шпигеля в области инвазивной (в данном случае — с внедрением в череп) стереотаксической нейрохирургии. Но, к сожалению, порой следствием такой нейрохирургии становилась смерть пациентов. Поэтому Лекселл хотел изобрести метод, который был бы малоинвазивным. И вот, в 1951 г. совместно со шведским радиобиологом Бьорном Ларрсоном был разработан метод стереотаксической радиохирургии. Реальное воплощение этот метод получил в 1968 году, когда был создан аппарат «Гамма-нож» (Gamma Knife).
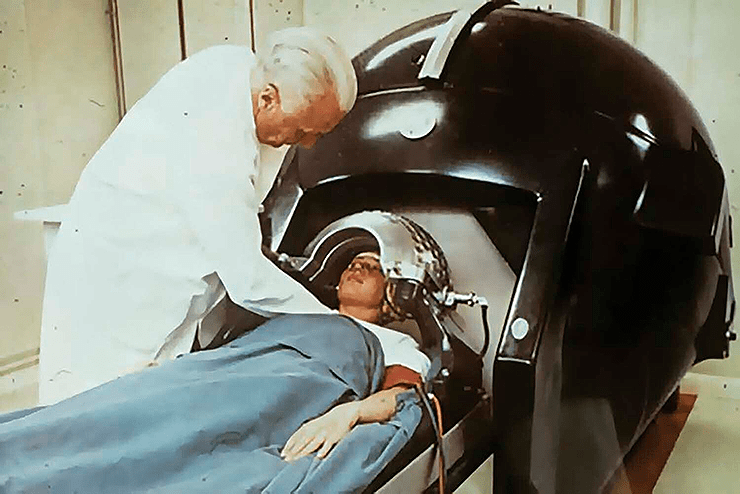
Рисунок 1. Профессор Ларс Лекселл с пациентом и аппарат «Гамма-нож»
Изначально «Гамма-нож» был предназначен для нужд функциональной нейрохирургии, то есть для лечения пациентов с двигательными расстройствами. Однако несколько позже оказалось, что эта технология способна вылечить и опухоли, которые возникают в мозге. Сегодня «Гамма-нож» используется для лечения аденомы гипофиза, краниофарингиомы, метастазов в головном мозге, различных опухолей основания черепа, акустической невриномы. Также при помощи этого устройства могут быть вылечены невралгия тройничного нерва и, как задумывалось с самого начала, некоторые двигательные расстройства.
Как же проводят процедуру лечения при помощи аппарата «Гамма-нож»?
Сперва к голове пациента с помощью винтов прикрепляют стереотаксическую рамку. Такая рамка фиксирует голову пациента, что позволяет лучам попасть строго в одну точку внутри головного мозга. Второй этап — это визуализация: проводят магнитно-резонансную или компьютерную томографию. С ее помощью выясняется, где точно расположена опухоль, каковы ее размеры и форма. На основании этих данных составляется план лечения. Дальнейший путь включает удаление опухоли. К слову, приятным моментом при лечении на подобной установке является возможность послушать музыку [5], [7], [8]!
Чтобы дать полное представление о том, как выглядит процедура лечения на аппарате «Гамма-нож», можно воспользоваться ресурсом YouTube, и посмотреть следующее видео на английском языке.
Лечение «Гамма-ножом» — это отличный метод, однако и он не идеален. Так, использование рамки имеет свой недостаток: во время процедуры пациент может испытывать дискомфорт от нее. Более того, могут возникать постоянные головные боли после снятия рамки, и даже возможно занесение инфекции.
Возможна ли радиохирургия без использования стереотаксической рамки? Определенно да! Уже существует усовершенствованная установка «Гамма-нож» — Leksell Gamma KnifeⓇ IconTM, а также установка «Кибернож» (CyberKnife).
При лечении с помощью Leksell Gamma KnifeⓇ IconTM (рис. 2) все еще нужно фиксировать голову, но для этого применяют специальную термопластичную маску, которую натягивают на лицо. В маске пациент чувствует себя более комфортно. Также использование маски позволяет проводить лечение в несколько этапов, иными словами, фракционно. При применении рамки возможен только разовый сеанс (как раз из-за дискомфорта, причиняемого рамкой), эффект от которого появляется спустя некоторое время [7], [9], [10].
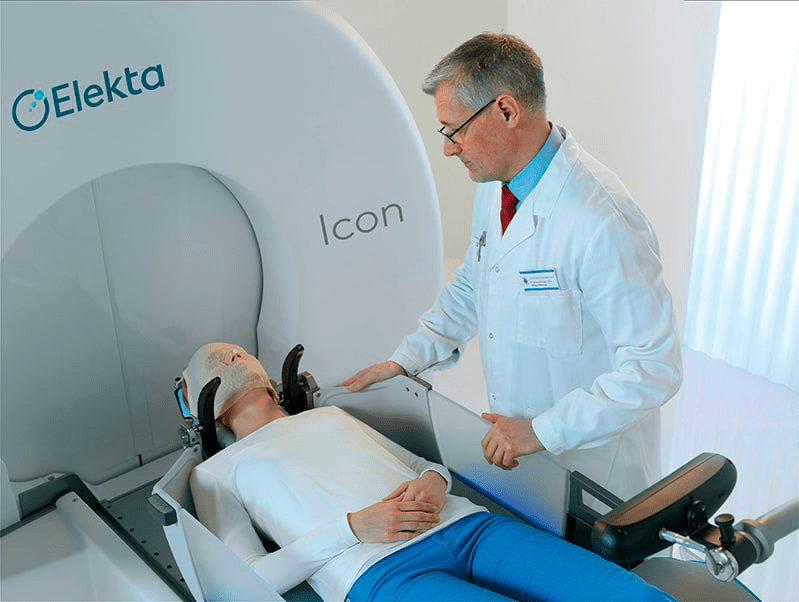
Рисунок 2. Leksell Gamma KnifeⓇ IconTM и пациент в термопластичной маске
Аппарат «Кибернож» (рис. 3) был представлен нейрохирургом из Стэндфорского университета Джоном Адлером в 1997 году на 12-ом съезде Всемирного общества стереотаксической и функциональной нейрохирургии [7].

Рисунок 3. Установка CyberKnife
Система CyberKnife состоит из линейного ускорителя, который установлен на роботизированном манипуляторе (рис. 4). Кроме того, на конце ускорителя имеется так называемый многолепестковый коллиматор (МЛК). МЛК формирует луч в точности по форме опухоли. Манипулятор в свою очередь позволяет направить луч в нужную точку тела под нужным углом. Таким образом, CyberKnife — это установка для прицельного, c субмиллиметровой точностью, лечения опухолей, причем не только в головном мозге, но и, в отличие от «Гамма-ножа», в других органах: легких, печени, почках и т.д.

Рисунок 4. Компоненты установки «Кибернож»: linear accelerator — линейный ускоритель; robotic manipulator — роботизированный манипулятор; collimator changer — стол смены коллиматоров; robotic couch — роботизированный терапевтический стол; optical camera — оптическая камера; X-ray imaging sources — источники рентгеновского излучения; X-ray imaging detectors — детекторы изображения.
При лечении опухолей мозга для фиксирования головы применяют так же, как и на Leksell Gamma KnifeⓇ IconTM, термопластичную маску. Однако при лечении опухоли, расположенной в легком, возникает проблема: человек дышит, легкие сокращаются, и опухоль, соответственно, движется. Как быть в таком случае? Для этой ситуации предназначена целая система визуализации, состоящая из оптической камеры, пары источников рентгеновского излучения и детекторов изображения. Пациенту заранее вводят специальные маркеры — небольшие объекты, как правило, из золота — прямо в опухоль либо около нее, чтоб была возможность отслеживать ее расположение. Достаточно трех маркеров, однако на практике вводят до пяти. Также на груди пациента устанавливают внешние светодиодные маркеры. Источники рентгеновского излучения позволяют сделать рентгеновские снимки легких за весь дыхательный цикл, а оптическая камера дает возможность отследить движения внешних маркеров, траектория которых соответствует дыхательному циклу пациента. На основе полученных изображений строится корреляционная модель между координатами внутренних маркеров и различными частями дыхательного цикла. Модель определяет положение центра масс внутренних маркеров, что позволяет в дальнейшем направить луч в нужную точку в любой выбранный момент времени [11].
Об адронной терапии и ее преимуществах
Фотоны — это главный инструмент установок CyberKnife и Gamma Knife и брахитерапии. Но, как уже было сказано ранее, прогресс стоит за терапией пучками протонов, ионов (протоны можно тоже считать за ионы H+, но здесь и далее будут иметься в виду ионы более тяжелые, чем H+, в частности, ионы углерода) и нейтронов. А почему так, нам поможет разобраться физика.
Сперва надо сказать, что при действии какого-либо излучения на клетку в ней происходит процесс ионизации. Этот процесс разрушает всяческие молекулы, которые находятся внутри клетки: происходит разрыв одной или обеих нитей ДНК, повреждение внутриклеточных мембран, возникновение свободных и активных частиц с неспаренным электроном — радикалов, которые потом образуют вредные для клетки соединения (примером является образующийся из внутриклеточной воды радикал ОН–, из которого в свою очередь образуется пероксид водорода H2O2, агрессивный в отношении ДНК). Соответственно, клетка после таких нарушений в процессе ее жизнедеятельности самовосстанавливается или гибнет [1], [12].
Любое излучение характеризуется особой величиной, которая называется линейной передачей энергии (ЛПЭ). ЛПЭ показывает, какую энергию передает то или иное излучение веществу на участках пути одинаковой длины, а измеряется эта величина в килоэлектронвольтах на микрометр. И, конечно, у некоторых видов излучения величина ЛПЭ высокая (сюда относят пучки нейтронов, ионов), а у некоторых (потоки фотонов, электронов, протонов, рентгеновское излучение) — низкая. Чем выше означенный показатель, тем больше возможно актов ионизации при прохождении луча через вещество. Отсюда становится ясно, что при большем количестве поражений клетка справляется с ними хуже, ей труднее восстанавливаться. Вероятность гибели клетки при этом увеличивается. Этот факт очень важен в борьбе с радиорезистентными опухолями, то есть с теми опухолями, в которых «ремонт» радиационных поражений протекает куда активнее, чем в здоровых клетках. Поэтому и возникает такое пристальное внимание к частицам с высокой ЛПЭ.
Однако, как быть с протонами? Величина ЛПЭ у них низкая, но они имеют и свое преимущество. Рассмотрим график на рисунке 5.
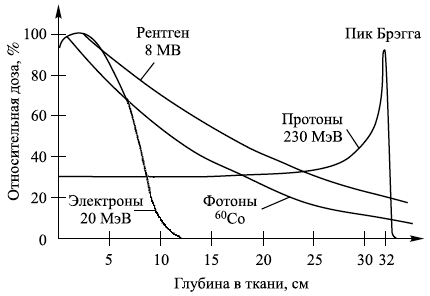
Рисунок 5. Зависимость относительной дозы от глубины в ткани
Как мы видим из графика, с глубиной проникновения в ткани доза разных излучений распределяется неодинаково. Для фотонов, электронов, рентгена доза оказывается максимальной в поверхностных слоях. То ли дело протоны: максимум дозы приходится на место, где останавливается пучок частиц (пик Брэгга). Это можно использовать для прицельной терапии: можно придавать протонам необходимую энергию, чтоб протоны попали строго в зону опухоли, а дальше этой зоны здоровые ткани не облучались. Примечательно и то, что ткани, которые находятся на пути пучка протонов к мишени, получают сравнительно малую дозу облучения, также почти не облучаются ткани, расположенные сбоку от мишени и от траектории пучка. Это значительные преимущества по сравнению с использованием фотонов в онкотерапии. Впрочем, то же самое преимущество — наличие пика Брэгга в месте остановки частицы в веществе — имеют и ионы, наряду с высоким значением ЛПЭ, что тем более увеличивает к ним интерес в качестве оружия против злокачественных опухолей [1], [13].
Казалось бы, применение протонов, более тяжелых ионов, нейтронов — это какой-то новый виток в медицине, веяние XXI века. Однако это не совсем так. Предпосылки использования этих частиц в радиотерапии онкологических заболеваний появились еще в XX веке, а методы лечения развивались с переменным успехом параллельно с развитием брахитерапии и стереотаксической радиохирургии. Так, например, быстрые нейтроны были использованы для лечения онкобольных уже в 1938 году американскими учеными во главе с Робертом Стоуном, однако следствием такого эксперимента стало возникновение осложнений у пациентов, были даже летальные исходы. При этом работы в области нейтронной терапии в достаточной мере быстро возобновились: в 1970-е гг. в Хаммерсмитской больнице (Лондон) провели лечение 800 онкобольных, преимущественно с опухолями в районе головы и шеи, при этом были достигнуты хорошие результаты. Полная регрессия опухоли наступала в 66–82% случаев в зависимости от локализации очага поражения. Находит применение нейтронная терапия и сейчас в самых различных формах: здесь и терапия быстрыми нейтронами, и нейтронно-фотонная терапия, и бор-нейтронзахватная терапия [1], [14] (о последней замечательно рассказано в одной из статей «Биомолекулы» — «Ядерный взрыв в пределах клетки: лечение рака в ногу с биофизикой» [15]).
История же протонной терапии началась где-то в середине XX века. Причем началась с работы американского физика Роберта Ратбуна Уилсона в журнале Radilogy в 1946 г. [16], в которой ученый выразил мысль о возможном применении протонов в терапии рака. Далее медленно, но верно начали проводить исследования в этом направлении, начиная с 1954 г., когда в Беркли, в Национальной лаборатории имени Лоуренса впервые облучили пациента пучком протонов.
В последующие 35 лет лечение пациентов проводили на базе физических институтов. Но в 1990 г., когда методика лечения протонами была в достаточной мере отработана, была создана специальная техника для больниц, впервые построили клинический центр протонной лучевой терапии (ПЛТ) на базе госпиталя г. Лома-Линда в США. Сейчас во всем мире уже действуют около 60 центров ПЛТ.
Ионная терапия — это совсем молодая ветвь адронной терапии. Попытки облучать пациентов пучками тяжелых ионов также предпринимали в Национальной лаборатории им. Лоуренса в 50-х годах XX века. Клинические испытания и внедрение ионной терапии в клиническую практику начались после 1994 года, когда был создан ускоритель HIMAC, позволивший генерировать пучки ионов разной энергии. На данный момент существует мало центров, где возможно облучения пучками ионов углерода: всего восемь во всем мире.
Главная трудность для внедрения адронной терапии в общемировую клиническую практику — дороговизна оборудования, и это основной недостаток. Однако наука продвигается, и ученые ищут все более и более компактные, удобные и дешевые технологии. Поэтому можно надеяться, что в будущем адронная терапия станет основным методом лечения онкологических заболеваний, а центров адронной терапии будет, соответственно, гораздо больше [1], [17].
Литература
- Кленов Г.И. и Хорошков В.И. (2016). Адронная лучевая терапия: история, статус, перспективы. «Успехи физических наук». 186 (8), 891–911;
- Global Burden of Disease Cancer Collaboration, Christina Fitzmaurice, Degu Abate, Naghmeh Abbasi, Hedayat Abbastabar, et. al.. (2019). Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2017. JAMA Oncol. 5, 1749;
- Генная терапия против рака;
- Таргетная терапия — прицельный удар по болезни;
- Черняев А.П., Борщеговская П.Ю., Николаева А.А., Вразарь С.М., Самосадный В.Т., Крусанов Г.А. (2016). Радиационные технологии. Часть 2. Применение изотопов в ядерной медицине. «Вестник Московского университета, серия 3: физика и астрономия». 4, 3–12;
- Cyrus Chargari, Eric Deutsch, Pierre Blanchard, Sebastien Gouy, Hélène Martelli, et. al.. (2019). Brachytherapy: An overview for clinicians. CA A Cancer J Clin. 69, 386-401;
- John M. Lasak, John P. Gorecki. (2009). The History of Stereotactic Radiosurgery and Radiotherapy. Otolaryngologic Clinics of North America. 42, 593-599;
- Gamma Knife: history and technical overview. University of Virginia;
- Horia Vulpe, Akshay V Save, Yuanguang Xu, Carl D Elliston, Matthew D Garrett, et. al.. (2019). Frameless Stereotactic Radiosurgery on the Gamma Knife Icon: Early Experience From 100 Patients. Neurosurgery;
- Gamma Knife Icon: enhancing treatment for brain metastasis and benign tumours. (2018). University of Toronto;
- Iris C. Gibbs, Billy W. Loo. (2010). CyberKnife Stereotactic Ablative Radiotherapy for Lung Tumors. Technol Cancer Res Treat. 9, 589-596;
- Omar Desouky, Nan Ding, Guangming Zhou. (2015). Targeted and non-targeted effects of ionizing radiation. Journal of Radiation Research and Applied Sciences. 8, 247-254;
- Dieter Schardt, Thilo Elsässer, Daniela Schulz-Ertner. (2010). Heavy-ion tumor therapy: Physical and radiobiological benefits. Rev. Mod. Phys.. 82, 383-425;
- Мусабаева Л.И. и Головков В.М. (2015). Терапия быстрыми нейтронами в онкологии. «Сибирский онкологический журнал». 2, 88–94;
- Ядерный взрыв в пределах клетки: лечение рака в ногу с биофизикой;
- Robert R. Wilson. (1946). Radiological Use of Fast Protons. Radiology. 47, 487-491;
- Данилова Т. (2016). Тяжелая ионная артиллерия. «Атомный эксперт». 1, 26–33.