
Вижу цель: новые технологии для незрячих
26 ноября 2019
Вижу цель: новые технологии для незрячих
- 2527
- 1
- 5
Фантасты видят глаз будущего примерно так
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Многие из нас воспринимают зрение как должное — мы с легкостью можем найти нужный носок в шкафу и любоваться красками осени. А между тем, по данным ВОЗ, около 2,2 млрд человек в мире имеют нарушения зрения, около 39 млн — тотально незрячие, а более 1 млн из них — это необратимо слепые дети. В России около 100 тысяч незрячих, при этом примерно 20% инвалидов по зрению — молодежь. Незрячим приходится несладко, а потому ничего удивительного, что ученые активно ищут технологию для восстановления зрения. За последние годы создано многое: и бионические глаза, и генетическое восстановление зрения. Но почему до сих пор все слепые не прозрели?
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Почему вообще люди теряют зрение?
За восприятие света и зрительной информации в наших глазах отвечают так называемые палочки и колбочки — зрительные клетки, расположенные на сетчатке глаза. Совершенно поразительные факты о них можно почерпнуть из статьи «Разные глаза — разные возможности» [1]. Эти клетки содержат фоторецепторы, которые принимают световую энергию, такие как, например, белок родопсин — светочувствительный пигмент палочек [2].
Световая энергия по каскаду химических превращений преобразуется в нервный импульс, и при помощи специальных ганглионарных клеток этот сигнал передается в мозг. Если хотя бы один из элементов этой цепочки нарушен, человек слепнет. Во многих случаях слепота появляется потому, что атрофируются палочки или колбочки. Это может произойти из-за физической травмы глаза или вследствие какого-либо заболевания, влияющего на сетчатку. Яркий пример — пигментный ретинит (retinitis pigmentosa, RP), от которого страдает более полутора миллионов человек в мире [3].
Гаджетозависимость для слепых
Оказывается, даже школьник из Магадана может помочь спуститься по лестнице незрячему из Уфы благодаря проекту Be my eyes — мобильному приложению, которое с камеры в телефоне или со специальных очков на лице незрячего передает изображение волонтеру, который может общаться со своим незрячим подопечным через онлайн-видео-звонок (рис. 1). Так волонтеры становятся «чужими глазами», помогая слепому отыскать дорогу или подобрать галстук к рубашке по цвету. В 2015 году, когда проект только запустили, в нем было чуть более 12 000 волонтеров, а сейчас уже 8 миллионов. Приложение доступно в более чем 150 странах и работает на более чем 180 языках, в том числе и на русском. Приложение бесплатно для использования как на iOS, так и на «Андроиде», и по сей день помогает незрячим. Пользователи говорят, что с приложением жизнь действительно становится легче. Но со своим зрением было бы все же лучше, да и звездное небо увидеть оно не позволяет.
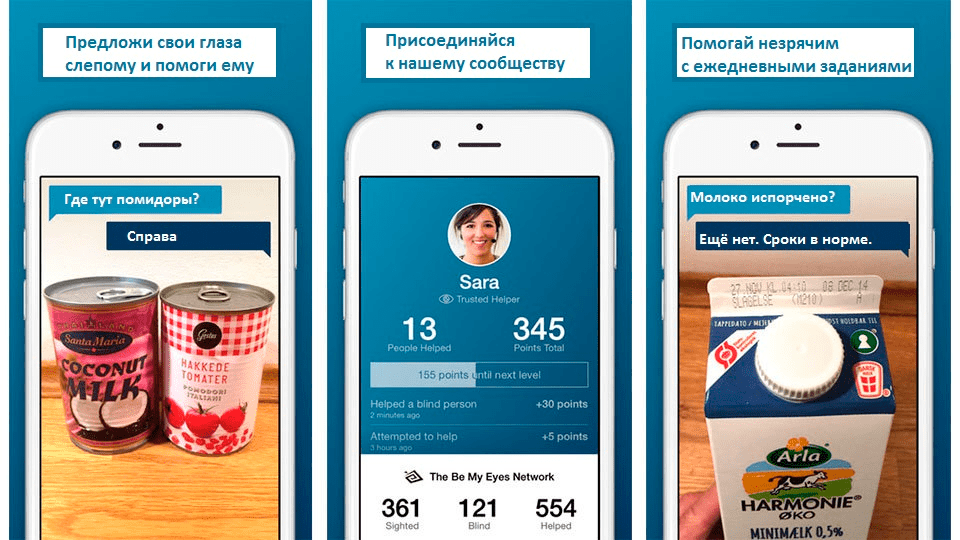
Рисунок 1. Как работает приложение Be my eyes
Ученые спешат на помощь
Позволить людям видеть своими глазами пытаются самые разные области науки. Методы зависят от причины слепоты, с которой они работают, и от имеющихся у науки ресурсов. Как уже писала «Биомолекула» [4], вернуть зрение больным возрастной макулодистрофией могут препараты на основе моноклональных антител — ранибизумаб (Lucentis) или афлиберцепт (Eylea). А британские ученые для той же цели предлагают использовать стволовые клетки [4], [5].
Также в разработке находится технология стимуляции зрительного нерва с помощью нового типа интраневрального электрода под названием OpticSELINE (рис. 2) [6]. Это позволяет посылать зрительные сообщения прямо в мозг, полностью минуя глазное яблоко.
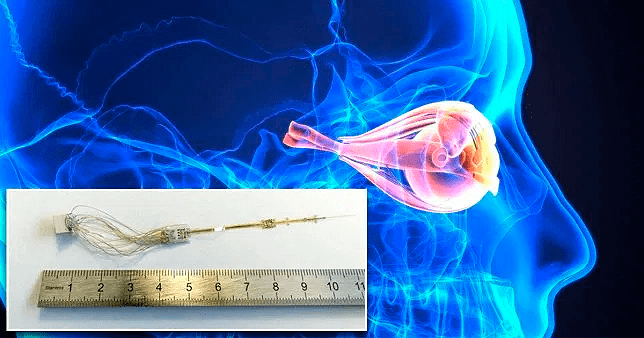
Рисунок 2. Электрод стимулирует зрительный нерв, посылая импульсы в мозг
А может, поправим гены?
Ели слепота вызвана нарушениями в генах, то очевидный выход — генетическая терапия [4]. Например, мутация в гене RPE65 становится причиной амавроза — редкого наследственного заболевания, которое вызывает частичную или полную потерю зрения в раннем возрасте — нередко в детстве. На такой случай компания Spark Therapeutics разработала генетический препарат oretigene neparvovec (Luxturna). За последние годы он не только успешно прошел доклинические и клинические испытания, но и был одобрен к использованию в США и Европе (рис. 3) [7].
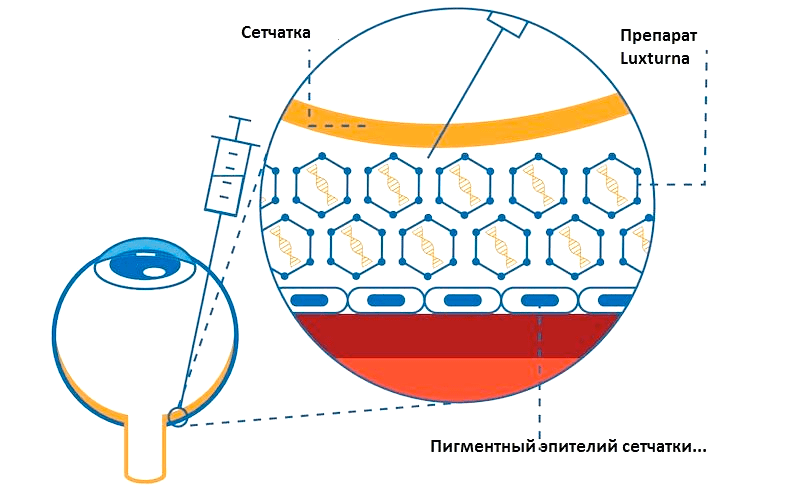
Рисунок 3. Схема работы генетической терапии при помощи препарата Luxturna
Здорово, когда ребенок восьми лет впервые видит звезды и спрашивает маму: «Что за светлые штуки на небе?», — ведь без терапии он мог бы не увидеть звезд вообще. Но и здесь есть нюанс: уже ослепшим на 100% пациентам этот метод никак не поможет. Генетическая терапия работает лишь у пациентов с относительно сохраненными на момент лечения фоторецепторами [8].
Ученые Калифорнийского университета пошли дальше и с помощью инактивированного вируса «вставили» ген для рецептора зеленого света в глаза слепых мышей. Через месяц подопытные обходили препятствия так же легко, как и мыши без проблем со зрением. Они могли видеть движение, изменения яркости в тысячу раз и мелкие детали. В ближайшие три года исследователи планируют провести эксперимент и на людях, потерявших зрение из-за дегенерации сетчатки. По мнению генетиков этого может быть достаточно для восстановления способности читать или смотреть видео [9].
Импланты в мозг и в глаз
На «Биомолекуле» уже была описана бионическая система Argus, которая передает сигналы с камеры на имплантат в сетчатке и далее в мозг [10]. Чтобы получить такое «бионическое зрение», пациенту необходимо заплатить $150 000. При этом полученное зрение не становится нормальным в нашем понимании — это вспышки света и искры, иногда силуэты людей и предметов. Первый бионический глаз Argus II (рис. 4) имплантировали пациенту в 2009 году врачи Манчестерского университета. Теперь, 10 лет спустя, создатели Argus II тестируют более эффективную систему искусственного зрения Orion, которая вживляется прямо в мозг пациента.
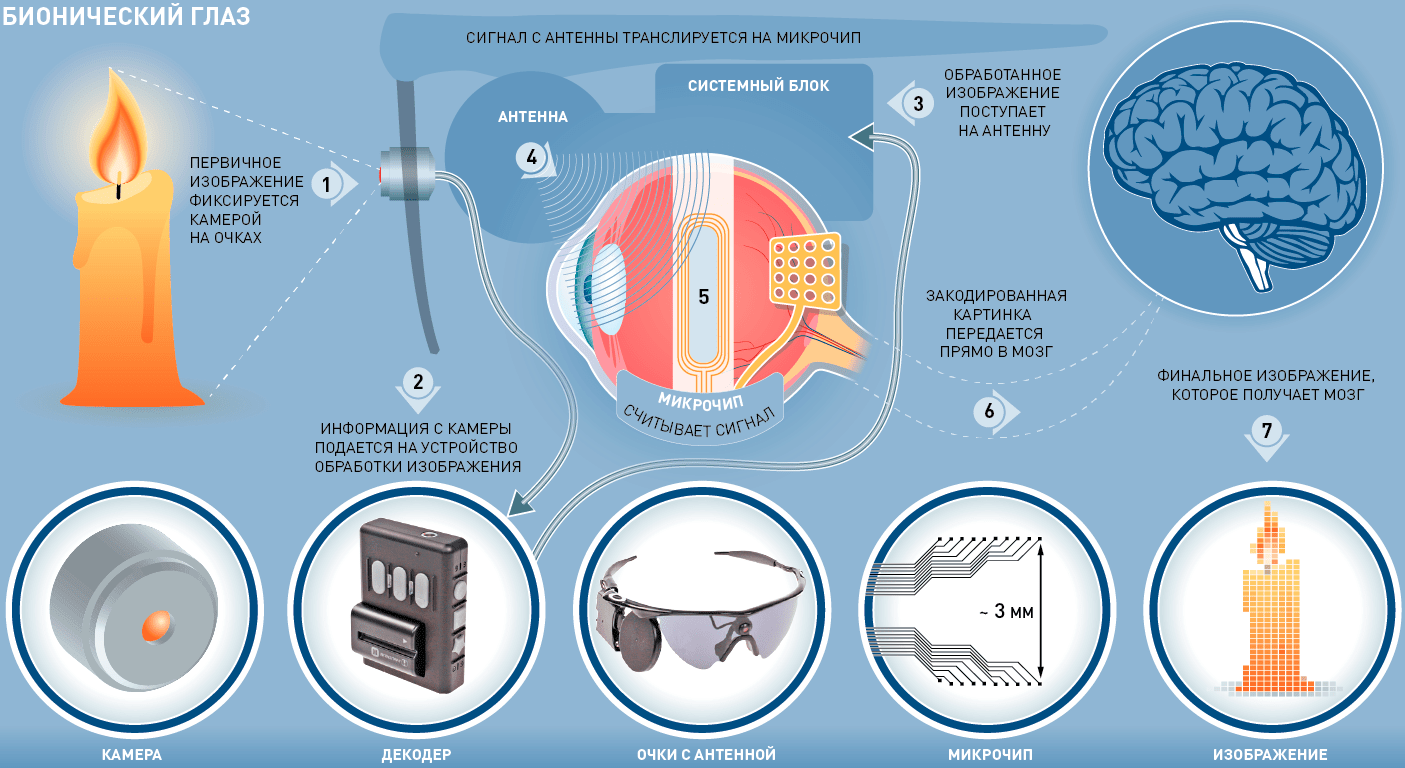
Рисунок 4. Бионическое зрение: схема работы системы системы Argus II
Как и Argus II до этого, система Orion состоит из небольшой камеры, установленной на очках, для захвата изображения, блока преобразования видео в электрические импульсы, которые пользователь может интерпретировать, и имплантата, который стимулирует мозг пользователя. Однако, в отличие от Argus II, в котором использовались имплантаты, зажатые на зрительных нервах пациента, имплантат Orion находится непосредственно в мозге. Основной недостаток новинки по сравнению с предшественником — это необходимость удалить небольшую часть черепа, чтобы обнажить область мозга, где располагают массив электродов, а это дополнительные клинические риски.
В планах разработчиков улучшить точность изображения, добавив большее количество электродов, а также поэкспериментировать с тепловизорами — они позволят слепому видеть горячую плиту и людей в комнате. Так или иначе, технология требует доработки и одобрения FDA, а вот стоимость лечения вряд ли изменится в меньшую сторону.
У этих систем есть аналоги: Boston Retinal Implant и IRIS, работающие по схожему принципу. Существенно отличается от конкурентов лишь Retina Implant AG — эта система не имеет внешней камеры, но улавливает фотоны и активирует зрительный нерв.
Вся надежда на оптогенетику
Сейчас одним из самых перспективных методов «пробуждения» спящего зрения считают оптогенетику, и о ней написано немало [10]. Это фантастический способ управления живым организмом с помощью света, который заключается во «встраивании» в нервные клетки светочувствительных белков. Подробнее об истории и основах оптогенетики написано в статье «Светлая голова» [11].
Изначально это направление придумали для исследования нейродегенеративных заболеваний мозга: так изменяли ДНК нейронов с помощью вируса, после чего нейрон можно было активировать светом (рис. 5). И тут возник вопрос: а почему бы таким же образом не активировать ганглионарные клетки — те самые, которые в ответе за передачу зрительного сигнала мозгу?
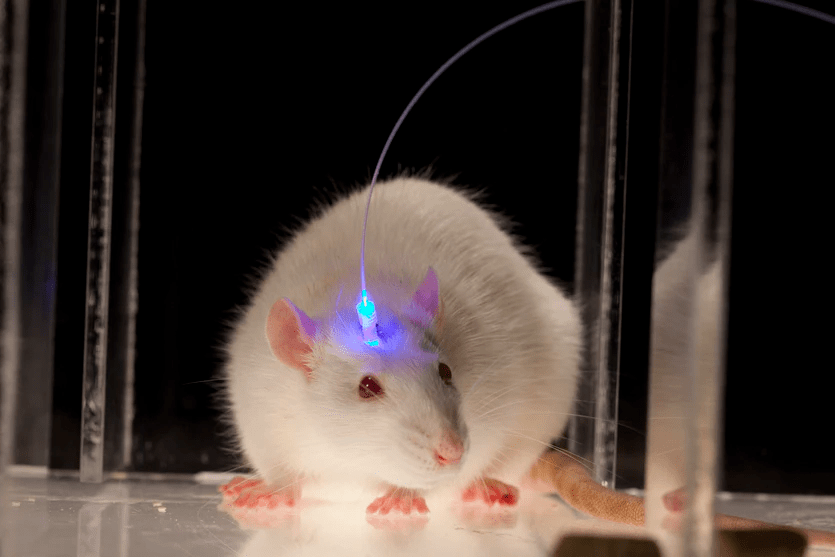
Рисунок 5. Изначально оптогенетику придумали для исследования болезней мозга
Сейчас возвращением зрения при помощи оптогенетики занимаются и российские ученые. В 2021–2022 годах они планируют провести первые клинические испытания генетических исследований по проекту «ВЗОР» («Восстановление зрения оптогенетическими решениями»). Вот только каким будет это новое зрение, ведь ганглионарные клетки находятся внутри головы и достаточно изолированы от внешних источников света? Да и перенос такого метода лечения на человека — непростой шаг, поскольку в нем используются вирусы. Требуется много дополнительных контрольных экспериментов, чтобы показать полную безвредность этой технологии для людей [12].
Все не так просто
И почему же все слепые еще не прозрели? Дело в том, что технологии двигают нас в сторону комфорта не так быстро, как хотелось бы. Требуется время, чтобы бионический глаз видел не только искры света, а полноценную цветную картинку. Требуется время, чтобы онтогенетические методы не только полностью восстанавливали зрение, но и были одобрены FDA и Минздравом. А пока что многие новые технологии, такие как OpticSELINE, еще находятся на стадии испытаний, а уже проверенные временем Argus II и Orion имеют ряд медицинских противопоказаний, не говоря уже о том, что такие установки сильно бьют по карману. Обратим свой взор в будущее — чтобы узреть те времена, когда ослепшие прозреют.
Литература
- Разные глаза — разные возможности;
- Зрительный родопсин — рецептор, реагирующий на свет;
- New gene-editing technology partially restores vision in blind animals. (2016). ScienceDaily;
- Когда ослепшие прозреют?;
- Ajay E. Kuriyan, Thomas A. Albini, Justin H. Townsend, Marianeli Rodriguez, Hemang K. Pandya, et. al.. (2017). Vision Loss after Intravitreal Injection of Autologous “Stem Cells” for AMD. N Engl J Med. 376, 1047-1053;
- Vivien Gaillet, Annarita Cutrone, Fiorenzo Artoni, Paola Vagni, Ariastity Mega Pratiwi, et. al.. (2019). Spatially selective activation of the visual cortex via intraneural stimulation of the optic nerve. Nat Biomed Eng;
- Virginia Miraldi Utz, Razek Georges Coussa, Fares Antaki, Elias I. Traboulsi. (2018). Gene therapy for RPE65-related retinal disease. Ophthalmic Genetics. 39, 671-677;
- Kristin L. Gardiner, Artur V. Cideciyan, Malgorzata Swider, Valérie L. Dufour, Alexander Sumaroka, et. al.. (2019). Long-Term Structural Outcomes of Late-Stage RPE65 Gene Therapy. Molecular Therapy;
- Michael H. Berry, Amy Holt, Autoosa Salari, Julia Veit, Meike Visel, et. al.. (2019). Restoration of high-sensitivity and adapting vision with a cone opsin. Nat Commun. 10;
- Оптогенетика + голография = прозрение?;
- Светлая голова;
- Simon Makin. (2019). Four technologies that could transform the treatment of blindness. Nature.







