Вослед Варбургу — последние достижения в изучении биоэнергетики рака
22 сентября 2017
Вослед Варбургу — последние достижения в изучении биоэнергетики рака
- 3488
- 1
- 12
рисунок Елены Беловой, модифицирован с использованием фото с сайта www.volkskrant.nl
-
Автор
-
Редактор
-
Иллюстратор
Современные технологии изучения биоэнергетики клеток, такие как метод анализа внеклеточных потоков (extracellular flux analyzer, XF), открывают новую страницу в молекулярной онкологии, демонстрируя связь метаболических процессов с ключевыми признаками злокачественной опухоли: гетерогенностью, метастазированием, перепрограммированием клеточного окружения. На основании этих данных исследователи разрабатывают новые, метаболически ориентированные типы антираковой терапии.
Биоэнергетика

Спецпроект о клеточном энергетическом метаболизме, работе митохондрий и АТФ, а также о заболеваниях, связанных с нарушениями функций клеточных «батареек».
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Хорошо забытое старое
Развитие науки редко похоже на прямую линию, но чаще на спираль — с повторением уже пройденного пути на новом уровне. В начале 20 века, когда ученый Отто Варбург описал для раковых клеток эффект, названный позднее его именем [1], биохимия была «на взлете», и изучение механизмов клеточного энергообмена велось очень интенсивно. Обнаружение такого факта, что опухолевые клетки используют гликолиз (более древний и менее эффективный путь «сжигания глюкозы»), а не митохондриальное окисление, гармонично легло в череду других биохимических открытий тех лет, породив кратковременную надежду на то, что рак есть ни что иное, как болезнь нарушенного метаболизма (рис. 1) [2].
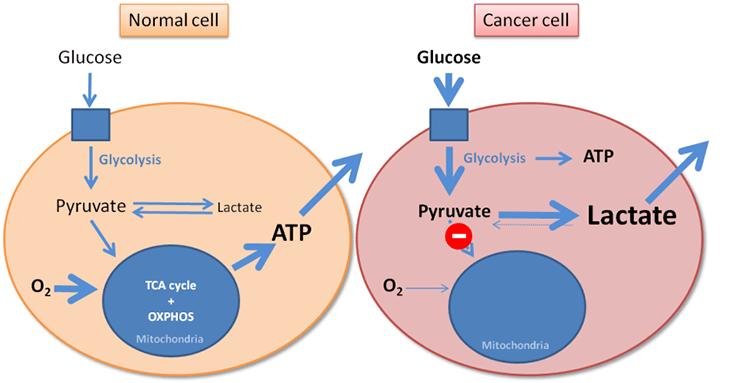
Рисунок 1. Эффект Варбурга в опухолевых клетках. Нормальные клетки в присутствии кислорода используют преимущественно митохондриальное окисление, в то время как раковые клетки — гликолиз.
сайт metabiolab.com
Позднее, после открытия структуры и функций молекулярных носителей генетической информации (ДНК и РНК), когда стало ясно, что первопричиной рака являются мутации и перестройки генома, изучение метаболизма раковых клеток ушло на второй план в свете блестящих молекулярно-биологических открытий — описания сигнальных путей, определяющих скорость деления клетки, связи злокачественной трансформации и нарушения путей репарации ДНК и так далее. Однако в последние годы мы наблюдаем уверенное «второе рождение» биохимии как науки о клеточном метаболизме. Усиленная новыми мощными методами, она «в связке» со своей «младшей сестрой» — молекулярной биологией — открывает нам новые грани бытия раковых клеток и новые перспективы борьбы с болезнью.
Как выяснилось в последние годы, большинство ключевых процессов, протекающих в опухоли, так или иначе оказывают влияние на ее метаболизм и, в свою очередь, находятся под влиянием метаболизма. Именно осознание этого факта, по-видимому, побудило «ракового гуру» Роберта Вайнберга назвать «нарушение регуляции клеточной энергетики» (deregulating cellular energetics) одним из ключевых признаков (hallmarks) в статье 2011 года [3]. Любопытно, что в первом перечне hallmarks, в статье 2000 года [4], данный признак отсутствовал, хотя, разумеется, «эффект Варбурга» был уже тогда известен исследователям. Этот маленький факт подчеркивает, как изменились представления о важности опухолевой биоэнергетики всего за каких-то десять лет.
Методы анализа состояния клеточного метаболизма находят свое применение в самых разных направлениях онкологической науки. Приведенный ниже перечень решаемых ими задач наверняка не является исчерпывающим, однако позволяет составить некоторое представление о потенциале метаболического подхода.
Метаболический обмен и гетерогенность опухоли
Современная онкология далеко ушла от представления об опухоли как о целостной и, в общем, однородной структуре. Да, действительно, большинство опухолей начинается, по-видимому, с одной-единственной трансформировавшейся клетки (или с небольшого их числа — в случае опухолей поликлонального происхождения). Однако дальше потомки этой прораковой клетки накапливают мутации и повреждения независимо, формируя различные субпопуляции клеток, среди которых в полном соответствии с дарвиновской теорией естественного отбора преимущество получают наиболее приспособленные. И хотя влияние первичных мутаций, повернувших здоровую клетку на путь злокачественного перерождения (их еще называют драйверными мутациями), нельзя недооценивать, чем дальше, тем более очевидным становится понимание, что для эффективного лечения опухоли необходимо учитывать присущую ее клеткам разнородность.
Анализировать опухоль можно на самых разных уровнях — генетическом (проводя секвенирование образцов), экспрессионном и так далее. Но это весьма дорогие и непростые методы, в то время как анализ метаболического типа представляет собой достаточно простой и информативный метод, сообщающий существенную информацию о физиологии раковой клетки. Вот, например, статья в Nature, посвященная исследованию мышиной модели рака поджелудочной железы (pancreatic ductal adenocarcinoma, PDAC) — Oncogene ablation-resistant pancreatic cancer cells depend on mitochondrial function [5]. Характерной драйверной мутацией этой формы рака является мутация гена KRAS, однако тагретная терапия, направленая на снижение патологической активности этого онкогена, которая, по идее, должна приводить к гибели опухоли, оказывается не всегда эффективна, и частота опухолевых рецидивов указывает на то, что, хотя все клетки опухоли несут эту мутацию, среди них есть такие, которые способны компенсировать таргетную терапию, — типичный пример гетерогенности.
В данном исследовании таргетную терапию моделировали «выключением» онкогена в трансгенных мышах, после которого (как и в случаях пациентов-людей, подвергшихся лекарственной терапии) у многих животных все равно происходил рецидив болезни.
Используя разные методы, в том числе и анализ биоэнергетических параметров опухоли, ученые показали, что «спящие» опухолевые клетки, обеспечивающие рецидив опухоли (даже в случае «выключения» гена KRAS), отличаются от чувствительных к выключению онкогена клеток особенностями своего метаболизма. Хотя, как мы говорили выше, для раковых клеток «в среднем» характерно преобладание гликолиза над окислительным фосфорилированием, данные клетки, напротив, демонстрировали бóльшую активацию митохондриальных путей и ослабленный гликолиз — такой своеобразный «Анти-Варбург». Применение вместе и таргетной терапии, и ингибиторов митохондриального окисления значительно уменьшало частоту рецидивов у модельных животных — полностью подтверждая тезис, сформулированнный в начале этой главы о необходимости учета гетерогенности опухоли для подбора эффективного лечения.
Микроокружение опухоли
Не только сами раковые клетки могут быть объектом интереса ученых, занимающихся молекулярной онкологией. В последние годы все больше внимания исследователей привлекает ближайшее опухолевое окружение (tumor microenvironment) [6]. Составляющие его иммунные и неиммунные клетки оказывают значительное влияние на скорость развития опухоли, вероятность метастазирования, прогноз выживания пациента. Связь метаболизма с состоянием микроокружения двояка. С одной стороны, метаболиты, выделяемые опухолевой клеткой, оказывают влияние на клетки рядом. Так, например, лактат является одним из факторов, угнетающих антиопухолевую функцию макрофагов [7].
С другой стороны, «перепрограммирование» клеток окружения с борьбы с опухолью на ее обслуживание — характерная черта опухолевого окружения, и также отражается на их метаболических путях. Например, перевод макрофагов из активированного состояния M1 в «обслуживающее опухоль» состояние М2 характеризуется переключением метаболических путей с активации гликолиза на активацию окислительного фосфорилирования в митохондриях. Измеряя соотношение «активность гликолиза/активность митохондриального окисления» в опухолевых макрофагах, мы можем получить довольно точное представление об иммунном статусе опухоли [8].
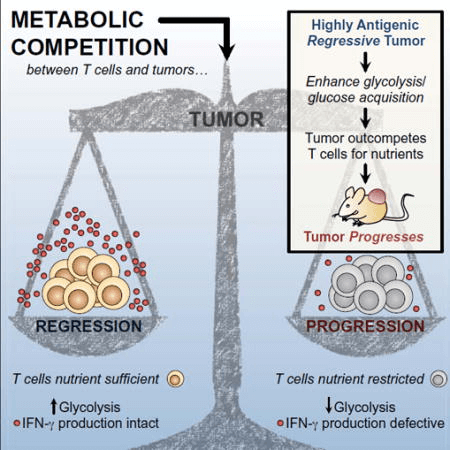
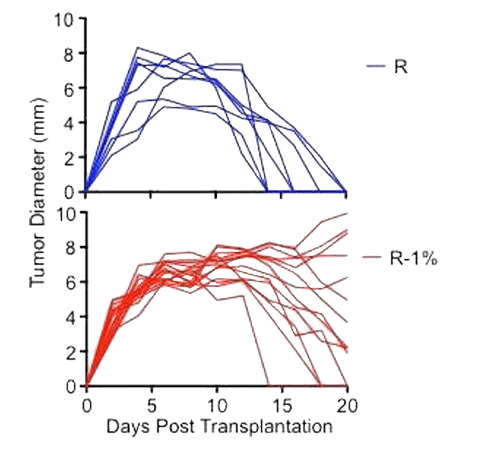
Интересным примером исследования роли метаболических процессов в опухолевом окружении может служить работа американских ученых [9], в которой показано, что «метаболическая конкуренция» служит одним из двигателей опухолевого прогресса. Oграничивая доступ Т-клеток к глюкозе, опухоль не только изменяет их метаболизм в сторону более активного использования окислительного фосфорилирования, но и блокирует их иммунную активность. Чем выше активность гликолитических путей в опухоли и активней захват глюкозы ею, тем более угнетенным оказывается местный иммунитет (в том числе и путем ингибирования макрофагов, о котором мы писали выше), и быстрее прогрессирует болезнь (рис. 2).
О том, как опухоли «прячутся» и защищаются от иммунной системы, и о перспективах иммунотерапии рассказывают статьи: «Расследования в поджелудочной: чем питаются раковые клетки» [10], «Антиген-невидимка» [11] и «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль» [12]. — Ред.
Связь с метастазированием
Критический момент в развитии злокачественной опухоли — появление дистантных вторичных опухолей (метастазов), которое сразу затрудняет лечение больного и снижает его шансы на благоприятный исход болезни [13]. Вопрос предупреждения развития метастазов, таким образом, является одним из важнейших для практической онкологии. Оказывается, анализ метаболических путей в перспективе может помочь нам и в решении этой задачи [14]. Метаболический анализ клеточной линии из рака простаты и сравнение его с нормальными клетками простаты ожидаемо показал, что раковые клетки сильно «закисляют» среду вокруг себя. Из других исследований известно, что кислая среда способствует разрушению межклеточного матрикса [15], который в норме удерживает клетки на месте, и таким образом может облегчать распространение раковых клеток по организму. Используя щелочной лизиновый буфер в мышиной модели рака простаты для уменьшения ацидоза, ученые добились значительного снижения числа метастазов у модельных животных [14].
Фармакология
Разумеется, «дальним прицелом» всех перечисленных выше (и многих оставшихся «за кадром») работ является выход на разработку новых методов лечения болезни, опирающихся на разницу в метаболизме между опухолевыми и нормальными клетками. Конечно, едва ли можно надеяться, что «метаболические» лекарства смогут победить рак сами по себе, но, как свидетельствует приведенный выше пример о модели рака простаты, они могут значительно усилить действие других типов лекарств. Основным направлением является поиск эффективных ингибиторов гликолитического пути. Хотя, как показывает все тот же пример с раком простаты, эффект Варбурга — не догма, но лишь один из возможных ориентиров.
Пример с аспирином, который оказался не только эффективным противовоспалительным препаратом, но также мощным профилактическим средством для предотвращения инфарктов и инсультов [16], побуждает исследователей не только искать новые лекарства, но и проверять и перепроверять давно известные препараты на предмет не выявленных ранее эффектов.
Примером использования анализа основных метаболических путей для скрининга потенциальных лекарств, модулирующих метаболизм, хотя и не связанного напрямую с раком, но демонстрирующего общие принципы подхода, может служить исследование, в котором авторы сравнили эффект более 3500 малых молекул на рост и деление фибробластов в средах с глюкозой и галактозой [17]. Как и ожидалось, известные хемотерапевтические агенты сильнее угнетали рост клеток в среде с глюкозой, в то время как агенты, известные своим влиянием на митохондриальную дыхательную цепь, подавляли рост и деление клеток в галактозной среде. Однако наряду с наблюдением ожидаемых эффектов в ходе этого скрининга обнаружили, что такое вещество как меклизин (meclizine), входящее в состав безрецептурных препаратов от тошноты и головокружения, способно эффективно перенаправлять метаболизм клеток на гликолитический путь, что, возможно, в будущем обеспечит этому препарату новые пути применения.
Разные работы — один метод
Наука и технология идут рука об руку, и появление новых методов часто стимулирует развитие целых научных направлений. Возможно, прорыв, происходящий в клеточной биоэнергетике рака, свидетелями которого мы является, также может быть отнесен (по крайней мере, частично) на счет развития новых экспериментальных техник.
Традиционные экспериментальные подходы в биоэнергетике включали в себя целый ряд сложный и трудоемких методов, таких как последовательное и независимое измерение клеточного дыхания, поглощения глюкозы, выработки лактата и анализ функции митохондрий, которые требовали много времени, подразумевали использование меченых радиоизотопом агентов, а главное, как правило, не предоставляли данные в режиме реального времени. Однако с появлением нового поколения метаболических анализаторов ситуация изменилась.
Все экспериментальные работы, описанные выше, кроме объекта исследования (то есть тех или иных аспектов клеточного энергетического/метаболического обмена), объединяет еще и то, что «метаболическую» часть исследований в них выполняли с помощью метода анализа внеклеточных потоков (extracellular flux analyzer, XF). В его основе лежит прагматичное допущение, что вся сложность и многообразие энергетических путей в клетке, в конечном счете, может быть осмыслена как соотношение двух параметров: скорости потребления кислорода (oxygen consumption rate, OCR) и скорости «закисления» окружающей среды, связанной преимущественно с производством молочной кислоты — лактата (extracellular acidification rate, ECAR). Первый параметр дает представление об интенсивности митохондриального (аэробного) метаболизма, второй служит индикатором интенсивности анаэробного окисления — гликолиза (рис. 3). Революционность метода XF заключается в том, что благодаря специальной системе высокочувствительных сенсоров-анализаторов, оба эти параметра можно измерять одновременно, а, дополнив ХF-анализ данными о синтезе АТФ (из аликвот), можно получить полный энергетический портрет клетки в данный момент времени. Таким образом, этот метод позволяет оценить параметры гликолиза и митохондриального дыхания без необходимости последовательного отбора проб и спектрофотометрических измерений молочной кислоты.
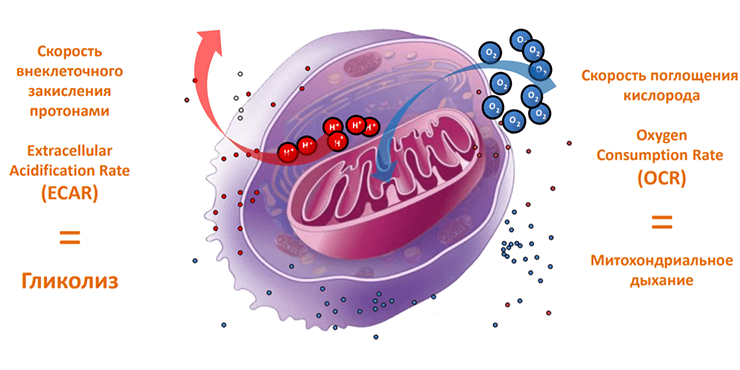
Рисунок 3. Основные параметры, характеризующие гликолитический и митохондриальный пути в клетке.
На мировом научном рынке (в том числе и в России) автоматические анализаторы, использующие технологию XF, представлены маркой Seahorse (Agilent Technologies, США). Автоматические анализаторы Seahorse — это компактные высокопроизводительные приборы, способные анализировать одновременно до 96 клеточных проб. Использование этой технологии не требует добавления красителей или радиоактивно меченых изотопов.
Схему прибора и образец графика соотношений ECAR/OCR можно увидеть на рисунке 4.
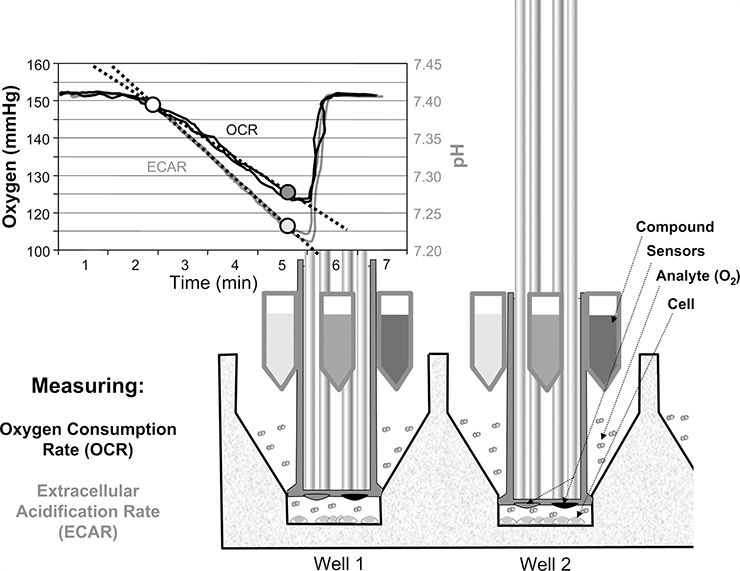
Рисунок 4. Схема устройства автоматического анализатора Seahorse. Клетки (Сell) помещают в пластиковые ячейки. На рабочей поверхности анализатора присутствуют два типа сенсоров (Sensors): черные измеряют скорость потребления кислорода (OCR), серые — скорость закисления среды (ECAR). Четыре инъектора (Compound) позволяют вводить в систему лекарства, ингибиторы и другие активные вещества. График показывает соотношение OCR/ECAR в экспериментальной системе через 5 мин после начала эксперимента.
Измерение анализаторами Seahorse требует в 10–20 раз меньшего количества клеток и объема реагентов, чем традиционные методы анализа клеточного метаболизма, что обусловливает более низкую себестоимость анализа одного образца. При этом в случае необходимости в систему может автоматически инъецироваться до четырех препаратов (ингибиторов или стимуляторов метаболизма, тестируемых лекарств, токсинов и др.). Для тестирования можно использовать и выделенные митохондрии, и целые живые клетки различного происхождения (как ресуспендированные, так и в клеточном монослое), и даже целые инсулярные островки поджелудочной железы. Метод — неинвазивный и недеструктивный; клетки остаются жизнеспособными и могут быть использованы для последующих экспериментов. Кроме того, как большинство современных приборов, анализаторы метаболизма нового поколения имеют собственное программное обеспечение для анализа полученных данных, которое позволяет экспортировать информацию в файл программы MS Excel для возможной последующей обработки с использованием других программ.
Не удивительно, что многие научные группы и в России, и в мире делают выбор в пользу этой гибкой, быстрой и простой в обращении технологии. И значит, можно надеяться, что «второе рождение» биоэнергетики, которое мы наблюдаем сейчас, не остановится. Для онкологии это открывает перспективы объединения «двух научных картин мира»: молекулярно-биологической и биохимической (сейчас пока существующих в научном сообществе несколько параллельно). Воссоздав целостную картину болезни, ученые наверняка смогут предложить новые более эффективные и одновременно более безопасные методы ее лечения.
Победа над раком несомненно продлит срок человеческой жизни, однако для того чтобы эта жизнь была не только долгой, но и полноценной, науке предстоит победить не менее грозного врага, а именно нейродегенеративные заболевания. О том, какой вклад в изучения болезней Альцгеймера, Паркинсона и похожих нарушений может внести современная биоэнергетика, мы поговорим в заключительной статье нашего миницикла.
Литература
- O. Warburg. (1956). On the Origin of Cancer Cells. Science. 123, 309-314;
- Страшней клешней на свете нет...;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Andrea Viale, Piergiorgio Pettazzoni, Costas A. Lyssiotis, Haoqiang Ying, Nora Sánchez, et. al.. (2014). Oncogene ablation-resistant pancreatic cancer cells depend on mitochondrial function. Nature. 514, 628-632;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Oscar R. Colegio, Ngoc-Quynh Chu, Alison L. Szabo, Thach Chu, Anne Marie Rhebergen, et. al.. (2014). Functional polarization of tumour-associated macrophages by tumour-derived lactic acid. Nature. 513, 559-563;
- Philip A. Kramer, Saranya Ravi, Balu Chacko, Michelle S. Johnson, Victor M. Darley-Usmar. (2014). A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: Implications for their use as bioenergetic biomarkers. Redox Biology. 2, 206-210;
- Chih-Hao Chang, Jing Qiu, David O’Sullivan, Michael D. Buck, Takuro Noguchi, et. al.. (2015). Metabolic Competition in the Tumor Microenvironment Is a Driver of Cancer Progression. Cell. 162, 1229-1241;
- Расследования в поджелудочной: чем питаются раковые клетки;
- Антиген — невидимка;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Chih-Hao Chang, Jing Qiu, David O’Sullivan, Michael D. Buck, Takuro Noguchi, et. al.. (2015). Metabolic Competition in the Tumor Microenvironment Is a Driver of Cancer Progression. Cell. 162, 1229-1241;
- Метастазирование опухолей;
- Arig Ibrahim- Hashim, Jonathan W. W ojtkowiak, Maria de Lourdes Coelho Ribeiro. (2011). Free Base Lysine Increases Survival and Reduces Metastasis in Prostate Cancer Model. J Cancer Sci Ther. 01;
- C. Cuvier, A. Jang, R. P. Hill. (1996). Unknown title.. Unknown journal title.. 15, 19-25;
- S. V. Ittaman, J. J. VanWormer, S. H. Rezkalla. (2014). The Role of Aspirin in the Prevention of Cardiovascular Disease. Clinical Medicine & Research. 12, 147-154;
- Vishal M Gohil, Sunil A Sheth, Roland Nilsson, Andrew P Wojtovich, Jeong Hyun Lee, et. al.. (2010). Nutrient-sensitized screening for drugs that shift energy metabolism from mitochondrial respiration to glycolysis. Nat Biotechnol;
- M. Wu, A. Neilson, A. L. Swift, R. Moran, J. Tamagnine, et. al.. (2006). Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. AJP: Cell Physiology. 292, C125-C136.