Заразный рак: правило или исключение?
07 августа 2018
Заразный рак: правило или исключение?
- 8189
- 0
- 8
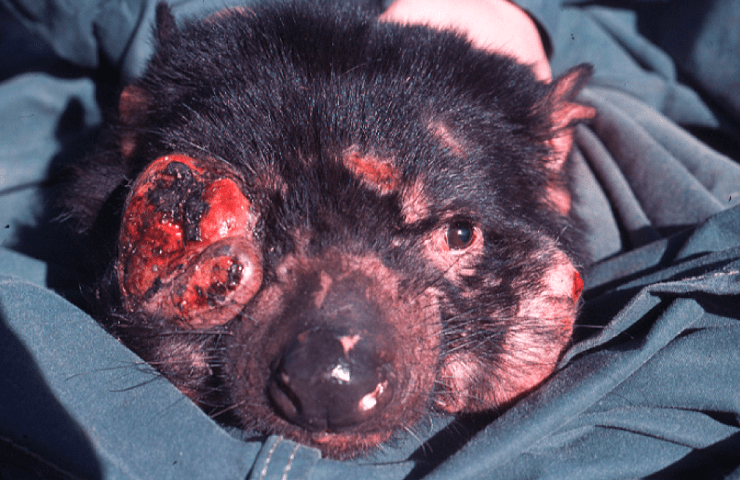
Тасманийский дьявол с лицевой опухолью
-
Автор
-
Редакторы
Давно известно, что некоторые виды рака могут вызываться онкогенными вирусами, например, человеческим папилломавирусом, T-лимфотропным вирусом человека, вирусом Эпштейна—Барр и вирусом саркомы Капоши. А могут ли сами раковые клетки выступать в роли инфекционных агентов и передаваться от одной особи к другой, вызывая онкологические заболевания? Оказывается, могут, хотя пока нам известно лишь несколько примеров: лицевые опухоли тасманийского дьявола, трансмиссивная венерическая опухоль собак и лейкемия двустворчатых моллюсков. Каковы же механизмы заразного рака и почему подавляющее большинство раковых клеток не может передаваться от одной особи к другой? Ответам на эти вопросы и посвящена наша статья.
Вирусная природа некоторых видов рака установлена довольно давно и сейчас ни у кого не вызывает удивления (подробнее про открытие онкогенных вирусов можно прочитать на «Биомолекуле»: "Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования«[1] и «Увидевший вирусы в раке. Харальд цур Хаузен» [2]). В то же время идея о существовании заразных форм рака на первый взгляд может показаться абсурдной. Даже если раковые клетки попадут в одну особь от другой, иммунная система второй особи распознает раковые клетки как чужеродные и быстро расправится с ними. Действительно, иммунная система активно отторгает трансплантаты органов и тканей, взятые даже от генетически близкой особи. Можно предположить, что чужеродные раковые клетки могут не отторгаться организмом с ослабленной иммунной системой, и такие случаи действительно известны. Однако иногда опухолевые клетки могут передаваться между совершенно нормальными особями. Так происходит, например, у тасманийских дьяволов и собак. В нашей статье собраны последние данные о биологии заразного рака. Сначала мы рассмотрим известные частные случаи заразного рака, а потом попытаемся вывести общие свойства, которыми должны обладать все раковые клетки, способные передаваться от одной особи к другой.
Трансмиссивная венерическая опухоль собак
Первым известным случаем заразного рака стала трансмиссивная венерическая опухоль собак (canine transmissible venereal tumor, CTVT). Помимо собак, заболевание обнаружено у волков, койотов и шакалов. Возможность передачи этой опухоли от одной особи к другой экспериментально продемонстрировали в 1876 году. Однако это не доказывает, что передающаяся опухоль представлена клетками единственной однажды возникшей линии, а не развивается каждый раз заново у разных собак. Идентичность клеток CTVT стала очевидной после выявления одинаковых хромосомных перестроек, а также обнаружения интеграции ретротранспозона LINE1 перед геном c-myc у всех клеток опухоли. Стоит отметить, что вообще-то почти все клетки любого многоклеточного организма немного отличаются друг от друга [3], и наличие одинаковых мутаций свидетельствует об общности происхождения двух клеток. Передача опухоли (плотного образования до 10 см в диаметре) происходит при половом контакте, и у новой особи опухоль, как правило, развивается на гениталиях. Любопытно, что клетки CTVT постоянно заимствуют митохондриальные геномы своих хозяев. Вероятно, митохондриальные геномы опухолевых клеток быстро приходят в негодность из-за многочисленных мутаций. Как правило, CTVT в течение нескольких месяцев после активного роста регрессирует, не приводя к гибели собаки, однако в некоторых случаях регрессии опухоли не происходит. Описаны даже случаи метастазирования CTVT. Орган или ткань, от которых произошли клетки CTVT, неизвестны [4–6].
По оценкам, CTVT появилась очень давно — от 10 тысяч до 12 тысяч лет назад, что делает ее самой древней самоподдерживающейся линией клеток (первой искусственной самоподдерживающейся линией стала HeLa, произошедшая от клеток рака шейки матки [7]). Она обнаружена на всех континентах, кроме Антарктиды [5]. Предполагают, что CTVT привела к гибели древнейших американских домашних собак, прибывших на континент вместе с первыми поселенцами около 15 тысяч лет назад. Судя по анализу древних геномов, клетки CTVT генетически гораздо ближе к первым американским собакам, чем к современным животным, из-за чего иммунная система первых не была в состоянии эффективно отторгать опухоль [8].
Лицевые опухоли тасманийского дьявола
Впервые лицевая опухоль тасманийского дьявола (devil facial tumor disease 1, DFTD1) была описана в 1996 году на северо-востоке Тасмании. Передача этой крайне агрессивной опухоли происходит при укусах, которые служат важным средством социального общения животных. Трансмиссивный характер опухоли стал очевиден после обнаружения уникальных хромосомных перестроек во всех опухолевых клетках (рис. 1), а также после полного секвенирования геномов клеток двух различных опухолей [9].
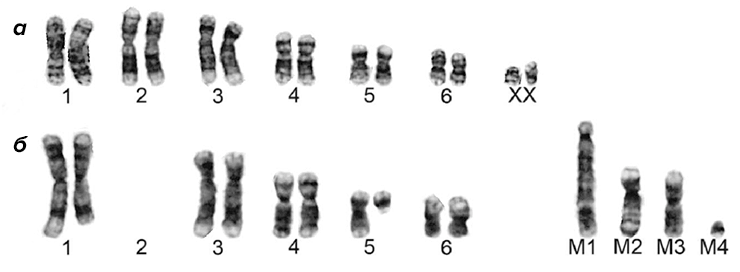
Рисунок 1. Кариотипы нормальных клеток самки тасманийского дьявола (а) и клеток лицевой опухоли (б). Кариотип нормального дьявола включает 14 хромосом, из которых 12 — аутосомы. В клетках лицевой опухоли утрачены хромосомы второй пары и половые хромосомы. Хромосома 5 подверглась перестройке, сопровождающейся полной делецией длинного плеча, причем делетированный фрагмент переместился в одну из новых (маркерных) хромосом. В длинном плече хромосомы 1 произошло несколько делеций, а к хромосоме 6, наоборот, добавился новый материал. Также имеются 4 неидентифицируемые маркерные хромосомы.
[9], рисунок с изменениями
В 2014 году на юго-востоке Тасмании обнаружили другую линию раковых клеток лицевых опухолей тасманийского дьявола (DFTD2). Пока выявлено 5 особей с DFTD2, причем все они самцы. Родоначальником DFTD1 была самка, в то время как DFTD2 появилась у самца. Возможно, самки каким-то образом распознают клетки DFTD2 как чужеродные и избавляются от них, однако делать какие-либо заключения преждевременно в силу недостатка данных. Эпидемиология DFTD2 еще не изучена, но проявления DFTD1 и DFTD2 очень схожи: оба заболевания сопровождаются ростом опухолей до 10 см в диаметре на лице и шее животных. Со временем опухоли подвергаются некрозу и воспаляются, приводя к значительным изменениям анатомии челюсти животного. Кроме того, в 65% случаев лицевая опухоль метастазирует.
Генетические маркеры и кариотипы указывают, что DFTD1 и DFTD2 возникли у разных особей. Клетки DFTD1 произошли от шванновских клеток, образующих миелиновую оболочку периферических нервов, а происхождение клеток DFTD2 еще неизвестно. В отличие от опухоли собак, DFTD всегда приводит к летальному исходу, что представляет серьезную угрозу для тасманийского дьявола как вида. Описаны только 6 животных, у которых развился иммунный ответ на клетки опухоли [4–6].
Трансмиссивная лейкемия двустворчатых моллюсков
По меньшей мере 15 видов двустворчатых моллюсков подвержены смертельной трансмиссивной лейкемии. Опухолевые клетки при этом заболевании происходят от гемоцитов — клеток, циркулирующих в гемолимфе. Первые случаи заболевания описаны в 1970-х годах, и с тех пор болезнь начала быстро распространяться по восточному побережью Северной Америки. Иногда происходят вспышки заболевания, когда более 90% популяции оказываются зараженными. Клетки разных видов трансмиссивной лейкемии характеризуются значительным увеличением числа копий ретротранспозонов в одних и тех же участках генома.
Возможно, перемещение ретроэлементов запускается факторами внешней среды, такими как перенаселенность, загрязнение, изменение температуры воды. К настоящему времени трансмиссивная лейкемия детально изучена у песчаной мии (Mya arenaria), мидий (Mytilis trossulus), съедобной сердцевидки (Cerastoderma edule) и полититапеса золотистого (Polititapes aureus), и у каждого вида имеется своя независимая линия трансмиссивной лейкемии. У сердцевидки обнаружены две независимые трансмиссивные лейкемии, как у тасманийского дьявола (рис. 2).
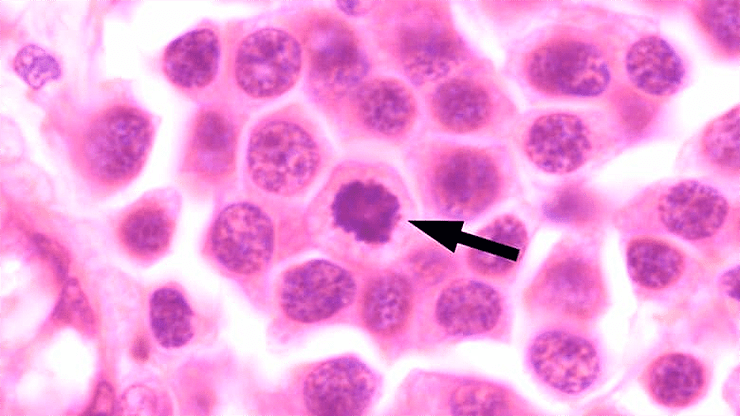
Рисунок 2. Препарат гемолимфы сердцевидки. Стрелка указывает на клетку лейкемии.
Интересно, что лейкемия Polititapes aureus была получена им от другого вида двустворчатых моллюсков — Venerupis corrugate, — который в настоящее время лейкемии не подвержен, несмотря на общность местообитания с P. aureus. Вероятно, ему удалось приобрести резистентность к этому заболеванию. Передача раковых клеток происходит через морскую воду, которая проникает в организм моллюска при фильтрации. Со временем раковые клетки распространяются по всем органам и тканям зараженного животного [4–6].
Есть ли заразный рак у человека?
Передача раковых клеток от одного человека к другому — чрезвычайно редкое явление. Как правило, она происходит при пересадке органов, так как иммунная система реципиента искусственно угнетается с целью предотвратить отторжение трансплантата. Другие случаи относятся к передаче раковых клеток от матери плоду, перемещению лейкемийных клеток между близнецами в утробе матери, а также передаче клеток внеплодной хориокарциномы от плода матери [10]. Недавно описали заражение пациента со СПИДом раковыми клетками обитающего в его кишечнике карликового цепня. Во всех этих случаях целостность физических и иммунных барьеров организма была нарушена.
Известно всего лишь несколько случаев передачи чужеродных раковых клеток людям с нормальным иммунитетом. Один хирург случайно занес себе в руку раковые клетки во время операции. Другой случай произошел с исследователем, который по неосторожности занес себе иглой клетки из линии аденокарциномы, что привело к образованию небольшой опухоли. В этих двух случаях опухоли успешно удалили без дальнейших рецидивов [5].
Как клетки заразного рака противостоят иммунной системе
Клетки любой раковой опухоли, как заразной, так и незаразной, вынуждены постоянно обманывать иммунную систему хозяина, чтобы избежать уничтожения. Один из современных способов лечения рака основан на том, чтобы вернуть раковые клетки под надзор иммуннитета (подробнее об этом методе лечения можно почитать на «Биомолекуле»: «Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак» [11]). Перед клетками заразного рака стоит еще более трудная задача. Чтобы заразить другую особь, им необходимо каким-то образом увернуться от иммунной системы, для которой они являются чужеродными клетками и, следовательно, подлежат уничтожению. У челюстноротых позвоночных животных ключевую роль в распознавании своего и чужого играют молекулы главного комплекса гистосовместимости (main histocompatibility complex, MHC). В клетках CTVT наблюдается пониженная экспрессия генов MHC, а также генов, связанных с презентацией антигенов и апоптозом.
Предполагают, что тасманийские дьяволы не развивают эффективного иммунного ответа против опухоли в силу низкого разнообразия MHC. Дело в том, что в начале XX века численность популяции дьяволов резко сократилась, что привело к снижению генетического разнообразия. Впрочем, в экспериментах по трансплантации кожи одного дьявола другому отторжение трансплантата все-таки происходило. Оказалось также, что клетки DFTD тоже понижают экспрессию MHC, как и клетки опухоли собак. У людей перенос раковых клеток от матери к плоду возможен, потому что эмбрион имеет одну аллель MHC от матери, и, если опухолевые клетки потеряют ту аллель, которой у эмбриона нет, они не будут распознаны плодом как чужеродные. У двустворчатых моллюсков, как и у всех беспозвоночных, MHC нет. Однако какой-то механизм распознавания своего и чужого у них все-таки существует, так как их лейкемии, как правило, связаны с одним конкретным видом. Возможно, это достигается при помощи того же механизма, что препятствует слиянию колоний оболочников разных видов [4], [5].
Стоит отметить, что клетки CTVT и DFTD сохраняют способность к экспрессии генов MHC, а не утрачивают ее необратимо. Например, если обработать клетки DFTD1 интерфероном γ, экспрессия генов MHC резко возрастет, а также восстановится способность к процессингу и презентации антигенов. Вышеупомянутые шесть тасманийских дьяволов, развившие иммунный ответ против опухоли, имеют антитела к опухолевым клеткам, синтезирующим MHC, и у двух животных даже произошла спонтанная регрессия опухоли. У одного из дьяволов в опухоль проникли CD4+ и CD8+ T-лимфоциты. Неизвестно, сформировалась ли у этих животных иммунологическая память к опухолевым клеткам [4], [5].
Регрессия CTVT, которая наблюдается у большинства собак, начинается с увеличения доли опухолевых клеток, экспрессирующих MHC. Вместе с этим CD4+ и CD8+ T-лимфоциты начинают проникать в опухоль и оказывают на ее клетки цитотоксическое действие. Вероятно, интерлейкин 6 и интерферон γ, вырабатываемые Т-лимфоцитами в опухоли, запускают образование MHC в раковых клетках [5].
Опухолевые клетки, не экспрессирующие MHC, могут стать жертвами других клеток иммунной системы — натуральных киллеров. Чтобы избежать этого, клетки CTVT выделяют цитокины, подавляющие иммунный ответ, такие как TGF-β (tumor growth factor β, фактор роста опухоли β). Секреция TGF-β наблюдается в фазе роста опухоли и на первых этапах стационарной фазы. Когда T-лимфоциты начинают синтезировть интерлейкин 6 и интерферон γ, развивается более мощная воспалительная реакция, нивелирующая эффект TGF-β. Рост DFTD, по всей видимости, от TGF-β не зависит [5].
Эволюция линий клеток заразных опухолей
Генетически клетки заразных опухолей, да и многих раковых опухолей вообще, отличаются от своих хозяев. Если жизнь «обычных» раковых клеток обрывается вместе со смертью хозяина, то время существования линии заразных раковых клеток существенно превышает время жизни одной особи за счет передачи от одного организма к другому. В случае CTVT линия заразных раковых клеток существует более 10 тысяч лет. Поскольку эволюция и размножение таких клеток совершенно независимы от хозяина, возникает соблазн даже рассматривать линии заразных раковых клеток как самостоятельные виды [4].
В принципе, процесс метастазирования, то есть смены местообитания раковых клеток в пределах одного организма, схож с передачей раковых клеток от одной особи к другой. В обоих случаях раковые клетки эволюционируют по Дарвину, приобретая мутации, которые потом отбраковываются естественным отбором сообразно условиям окружающей среды. Кроме того, и те, и другие клетки вынуждены изобретать разнообразные ухищрения, чтобы избежать уничтожения иммунной системой хозяина [5].
Клетки CTVT характеризуются уникальной для опухолевых клеток стабильностью. В них почти не происходят мутации и хромосомные перестройки, и клетки в пределах опухолей удивительно однородны. На основании этого ученые заключили, что эволюция клеток CTVT, вначале сопровождавшаяся многочисленными мутациями и перестройками, в данный момент вышла на плато. Клетки CTVT достигли тонкого равновесия со своим хозяином: с одной стороны, они не убивают его, однако долгое время, вплоть до полной регрессии опухоли, собака-хозяин служит в роли переносчика опухолевых клеток. Клетки DFTD, напротив, находятся на ранних этапах эволюции и еще далеки от равновесия со своим хозяином [6].
Активация ретротранспозонов в клетках, ставших впоследствии клетками лейкемии двустворчатых моллюсков, вероятно, стала следствием чрезвычайной геномной нестабильности. Эти клетки содержат больше ДНК, чем нормальные клетки, и нередко являются анеуплоидными или тетраплоидными. Более того, клетки лейкемии в пределах одного организма могут различаться числом некоторых микросателлитов и заменами в митохондриальной ДНК [6].
К сожалению, наши знания о заразных раковых опухолях очень скудны и ограничиваются лишь отдельными примерами, кажущимися результатом роковой случайности. Поэтому и создать общую концепцию заразного рака на данном этапе невозможно. Нам остается лишь с нетерпением ждать новых данных, которые прольют свет на механизмы, лежащие в основе этого заболевания.Литература
- Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования;
- Увидевший вирусы в раке. Харальд цур Хаузен;
- Геномная головоломка: открой в себе мозаика;
- Michael J. Metzger, Stephen P. Goff. (2016). A Sixth Modality of Infectious Disease: Contagious Cancer from Devils to Clams and Beyond. PLoS Pathog. 12, e1005904;
- H. V. Siddle. (2017). Cancer as a contagious disease. HLA. 89, 209-214;
- Beata Ujvari, Anthony T. Papenfuss, Katherine Belov. (2016). Transmissible cancers in an evolutionary context. BioEssays. 38, S14-S23;
- Бессмертные клетки Генриетты Лакс;
- Máire Ní Leathlobhair, Angela R. Perri, Evan K. Irving-Pease, Kelsey E. Witt, Anna Linderholm, et. al.. (2018). The evolutionary history of dogs in the Americas. Science. 361, 81-85;
- A. Kreiss, C. Tovar, D. L. Obendorf, K. Dun, G. M. Woods. (2011). A Murine Xenograft Model for a Transmissible Cancer in Tasmanian Devils. Vet Pathol. 48, 475-481;
- Mel Greaves, William Hughes. (2018). Cancer cell transmission via the placenta. Evolution, Medicine, and Public Health. 2018, 106-115;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак.