
Геномная головоломка: открой в себе мозаика
23 марта 2018
Геномная головоломка: открой в себе мозаика
- 9674
- 0
- 16
Хотя жизнь многоклеточного организма и начинается с одной клетки, с самых первых делений в ДНК закрадываются мутации. Даже при рождении младенец уже является генетическим мозаиком — не говоря уж про взрослого человека. Израиль, Национальный парк Циппори, мозаика с изображением охотника.
сайт flickr.com, by Alex Brey
-
Автор
-
Редакторы
-
Рецензент
Если вы до сих думаете, что у всех клеток вашего организма одинаковый геном, то спешим вас разочаровать. Есть вероятность, что у индивидуума не найти и двух клеток с полностью идентичной ДНК. Грозит ли это чем-то, почему ученые с энтузиазмом изучают мозаицизм, и как видит будущее этой области известный исследователь геномных вариаций Алексей Абызов из лаборатории при Клинике Мэйо (Mayo Clinic), чья группа недавно опубликовала новую статью по этой теме?
В организме взрослого человека примерно 1014 клеток двухсот разных типов [1]. С давних пор считалось, что геномы всех клеток одинаковы, а различия в их облике и функциях определяются набором «работающих» генов. Однако даже на первый взгляд всё не так просто. В половых клетках набор хромосом половинчатый, а геном иммунных клеток меняется после V(D)J-рекомбинации, чтобы закодировать великое множество вариабельных участков иммуноглобулинов В-лимфоцитов и Т-клеточных рецепторов на Т-лимфоцитах.
Сейчас же ученые выступают с еще более радикальным заявлением. Возможно, из ста триллионов клеток не найдется и двух с полностью одинаковым геномом — из-за мутаций , накапливающихся в эмбриогенезе и в течение жизни организма [2].
Хотя, в целом, ДНК реплицируется с довольно высокой точностью, полимераза иногда ошибается и вставляет или неправильный нуклеотид, или неправильное их количество. Частота таких ошибок — примерно одна на каждые 100 000 нуклеотидов. Вроде бы число не кажется большим, но вы только подумайте, сколько это ошибок на наш огромный геном! К счастью, подавляющее число таких дефектов исправляется благодаря неустанному труду систем репарации ДНК. Но некоторые ошибки репликации всё же ускользают от этого надзора и становятся постоянными мутациями [3].
По самым минимальным оценкам, только однонуклеотидных замен на весь геном здорового индивидуума окажется более 1016. Кроме того, вариабельность генома затрагивает и крупные его участки — бóльшие, чем одно нуклеотидное основание, — например, вставки или делеции (indels) либо вариации количества копий генов (CNV) [4]. Сколько же тогда всех мутаций в одном человеке? Похоже, эта цифра просто огромна.
Что же, генетический материал всех клеток организма различается, и каждая клетка как будто играет роль отдельного пазла в общей картинке генома? И каждый человек генетически «мозаичен»? Получается, что да, и это нормальное явление, а само слово «мозаицизм» — устоявшийся научный термин. Традиционно под ним понимают сосуществование внутри одного организма как минимум двух линий клеток с различающимся геномом, встречающихся и среди соматических, и среди зародышевых клеток (рис. 1) [5].
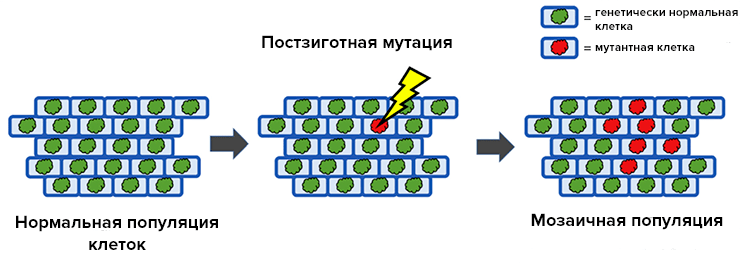
Рисунок 1. Что же такое мозаицизм? В популяции нормальных клеток (с зелеными ядрами) происходит что-то, ведущее к мутации в одной клетке, — теперь у нее схематически красное ядро. Спустя некоторое количество циклов деления популяция состоит из потомков мутировавшей клетки и нормальных клеток, что выглядит действительно как мозаика.
Хотя жизнь многоклеточного организма и начинается с одной клетки, с самых первых делений в ДНК закрадываются мутации. Даже при появлении на свет младенец уже является генетическим мозаиком — не говоря уж про взрослого человека.
«Уже при рождении мутаций в каждой клетке очень много — причем это как новые мутации, появившиеся в процессе преимплантации и эмбриогенеза, так и унаследованные от родителей, — рассказывает „Биомолекуле“ Алексей Абызов, специалист по геномным вариациям из Клиники Мэйо. — Изучение индивидуального „мозаикóма“ — совокупности всех мозаичных изменений генома отдельного человека — это не простой научный интерес, а насущная необходимость. Такая информация поможет лучше понять и состояние здоровья отдельного индивидуума, и, возможно, даже найдет применение в клинической практике».
Мозаичность уникальна для каждого — причем часто и отследить ее трудно, не то что предугадать исход. Ее клинические проявления зависят от множества факторов, некоторые из которых мы и рассмотрим ниже, внимательнее остановившись на мозаицизме в эмбриогенезе и немного поговорив о мозаицизме во взрослом организме [6].
Мозаицизм обнаружен и у многих других видов животных, помимо человека [7]. Наглядный же пример мозаицизма — некоторые случаи гетерохромии радужки глаз (рис. 2).

Рисунок 2. Гетерохромия радужки в некоторых случаях возникает именно из-за мозаицизма. Бывает она и у людей, и у животных. На рисунке представлен случай полной гетерохромии, когда цвет глаз полностью различается.
сайт cat-world.com.au
Истоки изучения мозаицизма: рождение концепции
Эпоха исследований этого явления началась более 120 лет назад — задолго до открытия ДНК. Саму концепцию мозаицизма (без введения термина) в 1895 году предложил Альфред Блашко при обсуждении происхождения линейного эпидермального невуса (врожденного окрашенного пигментного пятна, немного выступающего над кожей и вытянутого в линию) и т.н. линий Блашко, которые, как нетрудно догадаться, назвали в его честь. То, что он был дерматологом, не удивительно: кожа — наглядный и легкодоступный для исследования орган, — и его будущие коллеги впоследствии активно изучали вариации генома кожных клеток.
Сам термин предложил немецкий зоолог Валентин Хайкер в 1904 году при описании «мозаично-подобного распределения» характеристик разных частей тела. Генетики растений и зоологи в последующие годы использовали взаимозаменяемые термины «мозаичности» и «секторального химеризма» [8].
Альфред Стертевант в 1929 году при работе с дрозофилами намеренно создал первых генетических мозаиков — с клетками X/O и X/X внутри одной мухи [7]. Название «соматический мозаицизм» именно как вариативность генома у клеток одного индивидуума ввел Чарльз Коттерман в 1956 году, а в 60-х уже охарактеризовали соматический мозаицизм у животных (Элоф Карлсон и Джон Соутин / Elof Carlson and John Southin) и растений (Сэстри с коллегами / Sastry G.R.K.) [9].
Дерматологи же работу Альфреда Блашко благополучно позабыли на полвека: упоминания появились лишь в двух голландских учебниках, один из которых впоследствии перевели на немецкий. Об исследователе вновь вспомнили лишь в 70-х годах. Роберт Джексон и Рудольф Хэппл независимо друг от друга в 1976 году обнаружили его работу и линии Блашко, и второй предложил связать идею с инактивацией X-хромосомы в эмбриогенезе [10]. Вскоре после этого концепция мозаицизма прочно вошла в профессиональную жизнь дерматологов.
В 1983 году, с развитием технологий, Хуан Хемке (Juan Chemke) с коллегами увидел мозаичную форму трисомии 18, при которой часть клеток содержат по две 18-х хромосомы, а часть — по три. Позже мозаицизм был зафиксирован при различных кожных заболеваниях [8].
Сейчас мозаицизм изучается очень активно, причем учеными руководит не только прикладной интерес. «Давно было понятно, что мозаичность может иметь фундаментальное значение для понимания того, как работает наш организм. Но изучение этого процесса, помимо очевидного отношения к здоровью, представляет эстетический научный интерес. Изучать мозаицизм клетки, этой минимальной единицы жизни, еще и необычайно увлекательно», — делится Алексей Абызов.
Мозаицизм в эмбриогенезе — что нам известно?
Серьезные хромосомные аномалии на ранних стадиях эмбриогенеза у человека встречаются очень часто. Однако понимание того, как и с какой скоростью это происходит, довольно ограничено. Проводили исследования на здоровых эмбрионах мышей, где ученые оценивали накопление мутаций и вклад эмбриональных клеток в дифференцированные ткани взрослого животного [12]. Однако, к сожалению, просто взять и перенести эти данные на человека оказалось нельзя: они не совпадают. Так, скорости как мутаций зародышевой линии, так и соматических мутаций значительно выше у мышей, чем у людей [13].
К счастью, с появлением новых технологий изучать эти события становится все проще. Например, британские ученые исследуют буквально первые дни развития человеческого эмбриона с привлечением CRISPR—Cas9 [14]. Возможно, в ближайшем будущем проявятся более точные данные и по скорости накопления мутаций в эмбриогенезе человека. Нельзя забывать, что младенцу передаются несколько десятков (50–100) мутаций половых клеток его родителей (рис. 4). Как было показано при анализе геномов 78 семей из двух родителей и ребенка, в одном поколении средняя скорость мутаций de novo составляет 1,20 × 10–8 на нуклеотид, а этих нуклеотидов в каждой клетке, на секундочку, 3 миллиарда [15].
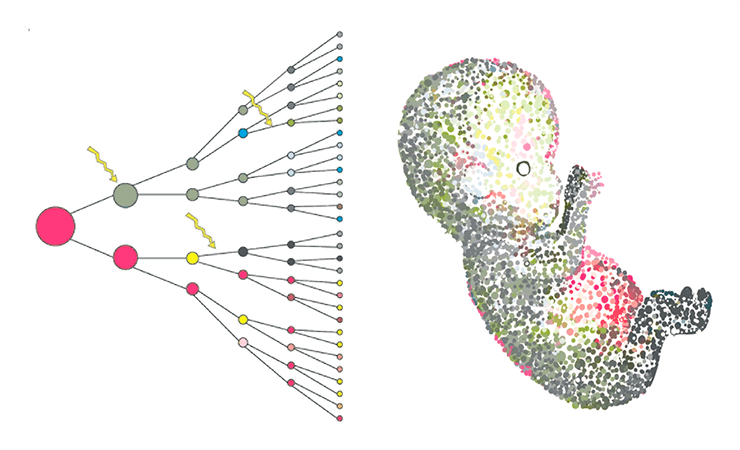
Рисунок 4. Мозаицизм в эмбриогенезе — частое явление, и мутации могут остаться с организмом на всю жизнь.
сайт sangerinstitute.files.wordpress.com. Сredit: Tarryn Porter.
Что же мы сейчас знаем? Мозаицизм — нередкое явление на стадии преимплантации. В этом случае любая мутация способна оказать значительное влияние на весь организм: определенный мозаичный генотип потенциально может в итоге оказаться во многих клетках. Кроме того, на стадии преимплантации частота мозаичности колеблется — по крайней мере, так показывают исследования эмбрионов, созданных при помощи искусственного оплодотворения (возможно, при естественном зачатии процессы идут несколько иначе). Есть предположения, что это объясняется естественным отбором против мозаичного эмбриона в зависимости от количества анеуплоидных клеток в нем [16]. (Эта и другие модели — на рисунке 5.)
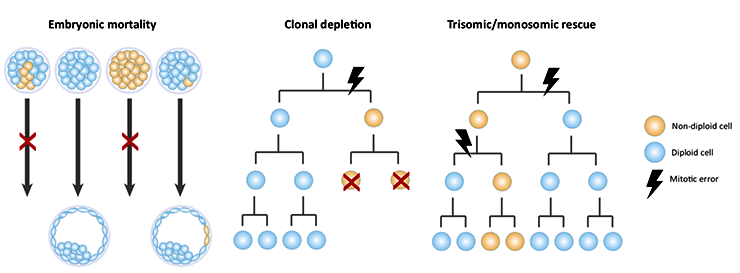
Рисунок 5. Согласно исследованиям эмбрионов, созданных при помощи искусственного оплодотворения, частота мозаичности снижается от стадии дробления к стадии бластоцисты, и несколько моделей объясняют, почему это так. Слева. Естественный отбор против мозаичных эмбрионов может вызывать смерть плода на основании доли анеуплоидных клеток в нем. В центре. Модель «клонального истощения» включает апоптоз или уменьшение распространения доли анеуплоидных клеток у мозаичных эмбрионов. Справа. Наконец, третья модель описывает механизмы, с помощью которых при моносомии и трисомии анеуплоидные клетки могут при делении давать и клетки с нормальным количеством хромосом.
В первые дни эмбрионального развития, по некоторым оценкам, на каждое деление на одну клетку приходится три мутации с заменой нуклеотидных оснований. При этом клетки на этом этапе часто делятся асимметрично и, соответственно, вносят разный вклад в клеточный состав в более взрослом организме [17].
Появление геномных вариантов на более поздних стадиях ведет к мозаицизму, ограниченному определенной областью тела [6]. Как показывают многие исследования, частота соматических мутаций значительно выше, чем в клетках зародышевой линии [13].
Клинические последствия после рождения: мозаицизм — это хорошо или плохо?
Мы уже разобрались, что мозаицизм — естественное и крайне распространенное явление в человеческом организме. Но каковы же его последствия?
Как уже было упомянуто, это зависит от множества факторов. Многие клинические последствия мозаичности трудно «поймать» и объяснить. Кроме того, важно учитывать распространенность и количество клеток с определенной вариацией генома [6].
Есть предположения, что в некоторых случаях соматический мозаицизм может играть на руку организму. К примеру, частота мозаичности в нейронах крайне высока [18]. Существует теория, что это специальный эволюционный механизм для того, чтобы создать многообразие нейронов и, собственно, разнообразить количество выполняемых ими функций (подробнее о мозаичности в головном мозге читайте ниже) [2].
Другой пример — это полиплоидия гепатоцитов в печени у взрослых людей. Хотя у животных это явление более редкое, чем у растений, но все же и у них встречаются клетки с увеличенным количеством хромосом [19]. Некоторое количество полиплоидных клеток печени образуется при развитии печени в эмбриогенезе [20]. Однако с возрастом и при наличии некоторых заболеваний, приводящих к повреждению и регенерации печени, распространенность полиплоидных гепатоцитов увеличивается — преимущественно в перицентральных зонах печеночных долек. Исследователи предполагают, что такой генотип может оказаться полезным, поскольку способен задержать повреждение ДНК, а дополнительные копии генов помогут нивелировать последствия мутаций потери функции [4].
Однако в большинстве случаев мозаицизм ассоциируют с очевидно негативными последствиями. Его тесно связывают со случаями выкидышей, появлением врожденных дефектов, задержками и расстройствами развития [5]. В частности, на мозаичную трисомию 21 приходится 2–4% случаев синдрома Дауна. В отличие от полной трисомии, проявления синдрома, связанные с общим развитием организма и интеллектуальными способностями, в случае мозаицизма могут быть выражены мягче. Мозаичный синдром Шерешевского—Тернера, или же мозаичная моносомия по X-хромосоме, может тоже проявляться менее тяжело, чем его полная форма. Еще один пример нарушения мозаичной формы — это синдром Маккьюна—Олбрайта, связанный с эмбриональной потенциально летальной мутацией в гене GNAS1. Синдром Протея может быть вызван ранними мозаичными мутациями в онкогене AKT1, которые вовлечены в формирование солидных опухолей.
Эмбриональные мозаичные мутации в генах IDH1 и IDH2 связывают с болезнью Олье и синдромом Маффуччи. Ранние мозаичные мутации в генах HRAS, KRAS и NRAS оказались ассоциированы с синдромом невуса сальных желез (nevus sebaceous), синдромом Шиммельпеннинга и синдромом кератиноцитарного эпидермального невуса [21].
Опасность того, что вредоносная мутация произойдет в клетках с большим потенциалом к делению, существует не только в эмбриогенезе. Соматические вариации генома накапливаются в течение всей жизни человека. Мозаицизм отдельных органов человека, например, мозга и кожи, уже изучают несколько групп исследователей (подробнее об этом пойдет речь ниже). Скорости накопления мутаций, как уже было сказано выше, измерены у мышей и некоторых типов клеток человека. Однако технические методы пока не совершенны, и ответить на вопрос, насколько же взрослый человек — мозаик, пока трудно [22].
Тем не менее, уже удалось связать некоторые типы клеточного мозаицизма и состояние здоровья взрослого человека. В частности, ученые проследили, как дочерние клетки стволовых клеток взрослого человека наследуют опасные изменения генома своей предшественницы. Постепенное же накопление генетических мутаций в этих клетках связывают с процессами старения, различными возрастными и онкологическими заболеваниями [5], [23], [24]. Информации о связи учащения мозаицизма в пожилом возрасте уже собрано немало. Недавнее исследование, включавшее в себя анализ генома почти 130 000 человек, в очередной раз подтвердило, что частота мозаицизма увеличивается со старением — особенно у мужчин [25] (про гендерное неравенство читайте во врезке ниже).
Пожалуй, еще одно из самых изучаемых клинических последствий мозаицизма — это его связь с развитием рака. Информации по этой теме уже накоплено немало, хотя всё еще недостаточно. Так до конца и не ясно: рак — это следствие мозаичности, или же у больных раком больше мозаичных клеток или больше мутаций на клетку.
В одном из исследований ученые проанализировали материал от 31 717 пациентов с раком и 26 136 здоровых людей без него. Они набрали такое огромное количество из 13 других работ с использованием полногеномного поиска ассоциаций — GWAS (genome-wide association studies). Этот метод помогает установить связи между различными вариантами генов и их фенотипическими проявлениями. Мозаичные аномалии встречались чаще у пациентов с сóлидными опухолями, причем связь была сильнее, если образец для анализа брали до постановки диагноза и начала лечения. Клональный мозаицизм оказался обычным явлением для тех, чью ДНК собирали по меньшей мере за год до постановки диагноза «лейкемия» — по сравнению с людьми без рака [5]. Соматический мозаицизм по мутациям в гене HRAS у человека связан с уротелиальными раками [5].
Мозаицизм отдельных органов
Клетки всех органов взрослого человека без исключения должны обладать мозаичным геномом. Некоторые из них ученые изучают более пристально — например, клетки головного мозга и кожи. О том, что нам стало известно из таких работ, мы и поговорим ниже.
Мозаичный мозг
Для изучения мозаичности мозг — один из самых интересных органов, поскольку нейроны живут долго по сравнению со многими другими типами клеток. По-видимому, их мозаичность — это очень частое событие, и, скорее всего, геном отдельно взятого нейрона отличается от окружающих его клеток [1] (на «Биомолекуле» даже выходила специальная статья по этой теме [18]). Исследованы уже и накопление мутаций с возрастом, и в развивающемся мозге до рождения [28], [29]. Для этого ученые используют метод изучения одиночных нейронов.
Среди факторов развития мутаций ученые называют, например, и присутствие свободных радикалов, и электромагнитное излучение, и миграцию транспозонов [30]. Частота анеуплоидии и ретротранспозиции в нейронах даже выше, чем в других исследованных тканях.
Как было упомянуто выше, высокая частота мозаичности в нервных клетках приводит к их большому разнообразию и, возможно, даже выполняет эволюционную функцию [2]. Мозаицизм нейронов может влиять на предрасположенность человека к некоторым болезням в дальнейшей жизни. В частности, исследователи называют онкологические заболевания, пороки развития мозга, эпилепсию [30]. Результат всего лишь одного измененного нуклеотида — это конститутивная активация гена AKT2 и последующее развитие тяжелой формы мегалэнцефалии с эпилепсией [31].
Сейчас активно исследуют связь мозаицизма нейронов и психиатрических расстройств [1]. Это довольно сложная задача: многое остается неизвестно и о самих болезнях, и об их генетической составляющей. По этой причине по инициативе Национального института психического здоровья (NIMH) США был создан специальный проект Brain Somatic Mosaicism Network, чтобы как можно быстрее получить информацию по этой теме (рис. 6).
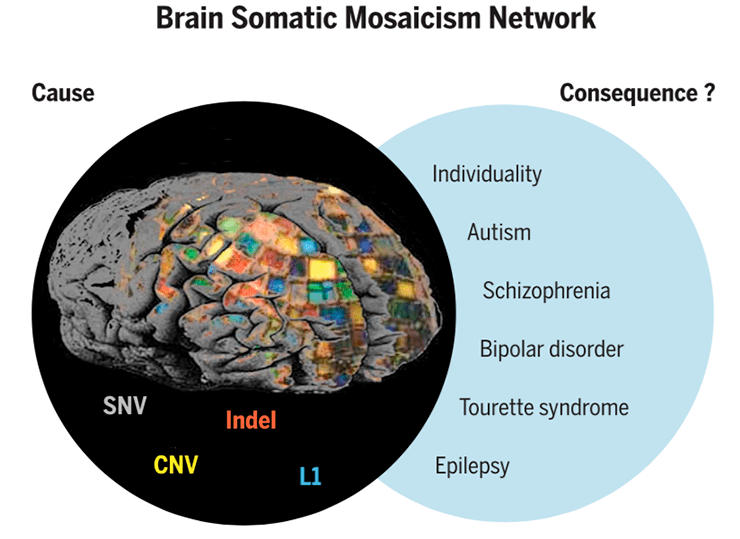
Рисунок 6. Конечный геном одного нейрона формируют все те изменения, которые мы обсуждали во врезке «Откуда берется соматический мозаицизм»: в частности, это однонуклетотидные варианты (SNV), вставки-делеции (indel), структурные варианты CNV, ретроэлементы типа L1. Цель проекта Brain Somatic Mosaicism Network — связать эти вариации с их многочисленными потенциальными последствиями, как находящимися в пределах нормы, так и ассоциированными с заболеваниями.
Мы изучали геномные мутации в клетках мозга эмбриона. Для этой цели мы вырастили клональные колонии из одиночных нейронных предшественников. Так, мутации, присутствующие у клетки-предшественницы, будут во всех клетках выращенной из нее колонии, и, следовательно, могут быть легко обнаружены секвенированием колонии.
Однако секвенирование определяет и все унаследованные вариации. Чтобы разделить их и приобретенные мутации, мы провели сравнение геномов колоний, выращенных из клеток одного и того же эмбриона. В результате мы определили, что уже в середине беременности в одной-единственной клетке мозга эмбриона присутствует около 400 однонуклеотидных вариантов SNV. Хотя такой результат в какой-то мере был ожидаем, при этом он крайне важен: ранее это не было продемонстрировано в опыте.
Далее, по общим мутациям в разных клетках одного мозга мы установили родственность этих клеток (то есть выяснили, у каких были общие клетки-прародители) и восстановили дерево первых пяти дроблений зиготы. Наша лаборатория — первая, подробно воссоздавшая картину дроблений у человека. Ранее это проделывали только на мышах. При этом анализе мутации использовали как метки дробления. При дроблении в каждой новой клетке появляется в среднем по одной новой мутации-метке. В совокупности с другими данными эти метки позволяют очень точно определить историю на ранней стадии развития эмбриона.
Наконец, мы показали, что скорость мутагенеза и типы накапливаемых мутаций отличаются при дроблении и нейрогенезе. Хоть это тоже не стало сюрпризом для нас, это новое крайне важное наблюдение.
Лоскутное одеяло кожного мозаицизма
Как уже было упомянуто в исторической сводке, ученые давно занимаются изучением мозаицизма в кожных покровах. «Главное преимущество исследований кожи в том, что её образец легко получить, — рассказывает Алексей Абызов о других работах своей лаборатории. — Мы работали с кожными фибробластами, поскольку они легко доступны, и существуют отработанные методы их извлечения, выращивания и перепрограммирования. Опять же, методы разработали из-за лёгкой доступности фибробластов». Соматические вариации числа копий генов (CNV) обнаружили почти у каждого третьего фибробласта [32]. В одном-единственном же кожном фибробласте при рождении можно обнаружить тысячу однонуклеотидных замен! Интересно, однако, что паттерн мозаичности кардинально отличается от, например, наблюдаемого в нейронах [31].
Неудивительно, что в клетках кожи, подверженных воздействию ультрафиолетового излучения, мутаций обнаруживается больше, чем в клетках покрытых одеждой зон [22]. Оказывается, что даже нормальная здоровая кожа, отлично выполняющая свои функции, но попавшая под солнечные лучи, вообще напоминает лоскутное одеяло из тысяч клеточных клонов. Больше четверти из них несут мутации, повышающие риск развития рака.
Мозаицизм сегодня — зачем пациентам о нем знать?
Многим может показаться, что пока изучение мозаичности генома — удел только ученых в лаборатории, — и что на клиническую практику он еще не повлиял. Конечно, где-то в будущем маячит призрак того, что человеку будут считывать его собственный мозаикóм и, опираясь на эту информацию, улучшать его здоровье (про персонализированную медицину «Биомолекула» уже писала: «От медицины для всех — к медицине для каждого!» [36]). Но как вовлечь это знание в клиническую практику сегодня, в 2018 году?
На самом деле, уже сейчас исследователи активно пытаются присовокупить исследования мозаицизма эмбрионов к преимплантационному генетическому скринингу и диагностике (ПГД), выявлению некоторых генетических аномалий у эмбриона, — например, при проведении экстракорпорального оплодотворения (ЭКО) до «подсадки» эмбриона матери [37]. Для получения результатов обычно используют, например, полярное тельце, клетку эмбриона на стадии третьего дня дробления либо несколько клеток из трофобласта бластоцисты. Как уже говорилось выше, мозаицизм хромосом присутствует даже на этих ранних стадиях развития, так что этот материал можно было бы использовать [6].
Обычно для «подсадки» предпочитают эуплоидных эмбрионов, но иногда таких просто не оказывается в текущем цикле. Сейчас проводят работы по отслеживанию результатов беременностей при переносе анеуплоидных и мозаичных эмбрионов: закончилось ли это выкидышем, нарушением развития ребенка или рождением живого и здорового младенца [16].
Клинический результат мозаицизма бывает очень разным, и из некоторых эмбрионов-мозаиков вырастают абсолютно здоровые дети. Возможности или желания пойти на следующий цикл ЭКО у пациента может не быть — это недешевая процедура, изматывающая физически и эмоционально. В таких случаях можно обсудить с доктором перенос мозаичного эмбриона, который уже есть.
Какие же эмбрионы точно нельзя выбирать? Больше всего риск при наличии мозаичных трисомий 2, 7, 13, 14, 15, 16, 18 и 21 — у ребенка с высокой вероятностью разовьется соответствующий синдром. Однако риски большие и при обнаружении мозаичных моносомий и других трисомий. При некоторых видах мозаичности, как уже обсуждалось, повышается риск ранней потери беременности.
Уже сейчас появляются рекомендации о том, как должны проводиться консультации врача с пациентами относительно мозаичности эмбриона. Приходится учитывать и то, что, несмотря на потенциальную клиническую пользу от такого анализа, некоторые пациенты могут не хотеть ее получить [38].
Поскольку ЭКО, сопутствующие анализы и неуспешные беременности и так сопровождаются эмоциональной и финансовой нагрузкой для пациента [16], новые данные о клинической значимости мозаицизма для рождения живых и здоровых детей необходимы — как и стандартизация отчетов о мозаицизме в ПГД [39].
Заключение
Хотя наука уже прошла долгий путь в расследовании мозаицизма, самая захватывающая часть ждет впереди. Нам повезло жить на заре эпохи изучения мозаицизма, когда еще столько аспектов этого явления остаются неизученными. Пока что не хватает масштабных когортных исследований [21], и все еще мало данных по динамике и частоте мозаицизма во многих тканях организма даже у здорового человека — что уж тут говорить о взаимосвязи мозаицизма и рисков развития определенных заболеваний.
«Мы хотели бы разобраться, если будет финансирование, как и какая мозаичность образуется в разных органах до рождения, как она меняется при жизни, — делится планами на будущую работу лаборатории Алексей Абызов. — Используя мутации как метки, хочется понять, как происходит специализация клеток. Например, сколько и каких клеток образуют внутреннюю и внешнюю (трофобласт) массу клеток в бластомере, сколько и каких клеток образуют зародышевые листки и каждый орган».
Возможно, благодаря усовершенствованию и развитию технологий мы сможем создавать индивидуальные карты генома для каждого и использовать генетический мозаицизм в качестве биомаркера риска некоторых болезней [4], но пока что это дело будущего. «Есть мечта довести экспериментальную и аналитическую технологии до такого уровня, — продолжает Алексей, — чтобы можно было относительно дешево получить картину раннего развития и общие параметры мозаичности для каждого человека. Возможно, это поможет лучше спрогнозировать здоровье каждого человека и в таком случае будет частью личной медицинской карточки».
К счастью, серьезных научных групп по изучению мозаицизма уже немало. Особое внимание Алексей Абызов уделяет работам британской лаборатории в Сэнгеровском институте (Wellcome Sanger Institute) под руководством Майкла Стрэттона, а из соотечественников — Дмитрию Горденину из американского Национального института наук об экологии и здоровье (NIEHS).
«Очевидно, что мы никогда не сможем измерить все процессы и мутации во всех клетках даже одного человека. Это связано не с развитием технологий, а с фундаментальными физико-биологическими изменениями, — завершает разговор с „Биомолекулой“ Алексей Абызов. — При исследованиях одиночных клеток мы сталкиваемся с тем, что я называю „принцип неопределённости“ — по аналогии с принципом неопределённости Гейзенберга в квантовой физике. То есть невозможно узнать всё о микрочастице (читай — клетке) без применения воздействия на нее. При текущем уровне развития технологий для изучения клеток мы их должны разрушить. Возможно, в будущем мы сможем изучать их, не разрушая, но в любом случае воздействие на клетку будет сильным.
С другой стороны, в изучении всех клеток нет смысла. Задача науки — находить природные закономерности и улучшать окружающую среду и человеческое общество на их основе. Это, я считаю, нам вполне по силам. Я думаю, что персональный мозаикóм и связанные с ним вещи найдут свое применение в медицине уже на нашем веку».
Литература
- Michael J. McConnell, John V. Moran, Alexej Abyzov, Schahram Akbarian, Taejeong Bae, et. al.. (2017). Intersection of diverse neuronal genomes and neuropsychiatric disease: The Brain Somatic Mosaicism Network. Science. 356, eaal1641;
- Gilad D. Evrony, Xuyu Cai, Eunjung Lee, L. Benjamin Hills, Princess C. Elhosary, et. al.. (2012). Single-Neuron Sequencing Analysis of L1 Retrotransposition and Somatic Mutation in the Human Brain. Cell. 151, 483-496;
- Pray L. (2008). DNA replication and causes of mutation. Nat. Education. 1, 214;
- Lars A. Forsberg, David Gisselsson, Jan P. Dumanski. (2017). Mosaicism in health and disease — clones picking up speed. Nat Rev Genet. 18, 128-142;
- Kevin B Jacobs, Meredith Yeager, Weiyin Zhou, Sholom Wacholder, Zhaoming Wang, et. al.. (2012). Detectable clonal mosaicism and its relationship to aging and cancer. Nat Genet. 44, 651-658;
- Tyl H. Taylor, Susan A. Gitlin, Jennifer L. Patrick, Jack L. Crain, J. Michael Wilson, Darren K. Griffin. (2014). The origin, mechanisms, incidence and clinical consequences of chromosomal mosaicism in humans. Human Reproduction Update. 20, 571-581;
- T. Xu, G. M. Rubin. (2012). The effort to make mosaic analysis a household tool. Development. 139, 4501-4503;
- Rudolf Happle. (2017). The Molecular Revolution in Cutaneous Biology: Era of Mosaicism. Journal of Investigative Dermatology. 137, e73-e77;
- David Mittelman Stress-Induced Mutagenesis — Springer New York, 2013;
- Загадочное путешествие некодирующей РНК Xist по X-хромосоме;
- Alu: история одной последовательности;
- Sam Behjati, Meritxell Huch, Ruben van Boxtel, Wouter Karthaus, David C. Wedge, et. al.. (2014). Genome sequencing of normal cells reveals developmental lineages and mutational processes. Nature. 513, 422-425;
- Brandon Milholland, Xiao Dong, Lei Zhang, Xiaoxiao Hao, Yousin Suh, Jan Vijg. (2017). Differences between germline and somatic mutation rates in humans and mice. Nat Comms. 8, 15183;
- Heidi Ledford. (2017). CRISPR used to peer into human embryos' first days. Nature;
- Augustine Kong, Michael L. Frigge, Gisli Masson, Soren Besenbacher, Patrick Sulem, et. al.. (2012). Rate of de novo mutations and the importance of father’s age to disease risk. Nature. 488, 471-475;
- Rajiv C. McCoy. (2017). Mosaicism in Preimplantation Human Embryos: When Chromosomal Abnormalities Are the Norm. Trends in Genetics. 33, 448-463;
- Young Seok Ju, Inigo Martincorena, Moritz Gerstung, Mia Petljak, Ludmil B. Alexandrov, et. al.. (2017). Somatic mutations reveal asymmetric cellular dynamics in the early human embryo. Nature. 543, 714-718;
- Родословная нейронов: как носить в себе множество мутаций и выглядеть совершенно здоровым;
- Luca Comai. (2005). The advantages and disadvantages of being polyploid. Nat Rev Genet. 6, 836-846;
- Géraldine Gentric, Chantal Desdouets. (2014). Polyploidization in Liver Tissue. The American Journal of Pathology. 184, 322-331;
- Mitchell J Machiela, Stephen J Chanock. (2017). The ageing genome, clonal mosaicism and chronic disease. Current Opinion in Genetics & Development. 42, 8-13;
- Natalie Saini, Steven A. Roberts, Leszek J. Klimczak, Kin Chan, Sara A. Grimm, et. al.. (2016). The Impact of Environmental and Endogenous Damage on Somatic Mutation Load in Human Skin Fibroblasts. PLoS Genet. 12, e1006385;
- Старение — плата за подавление раковых опухолей?;
- Francis Blokzijl, Joep de Ligt, Myrthe Jager, Valentina Sasselli, Sophie Roerink, et. al.. (2016). Tissue-specific mutation accumulation in human adult stem cells during life. Nature. 538, 260-264;
- Mitchell J. Machiela, Weiyin Zhou, Joshua N. Sampson, Michael C. Dean, Kevin B. Jacobs, et. al.. (2015). Characterization of Large Structural Genetic Mosaicism in Human Autosomes. The American Journal of Human Genetics. 96, 487-497;
- Курить – Y-хромосоме вредить;
- J. P. Dumanski, C. Rasi, M. Lonn, H. Davies, M. Ingelsson, et. al.. (2015). Smoking is associated with mosaic loss of chromosome Y. Science. 347, 81-83;
- Je H. Lee. (2018). Tracing single-cell histories. Science. 359, 521-522;
- Taejeong Bae, Livia Tomasini, Jessica Mariani, Bo Zhou, Tanmoy Roychowdhury, et. al.. (2018). Different mutational rates and mechanisms in human cells at pregastrulation and neurogenesis. Science. 359, 550-555;
- M. A. Lodato, M. B. Woodworth, S. Lee, G. D. Evrony, B. K. Mehta, et. al.. (2015). Somatic mutation in single human neurons tracks developmental and transcriptional history. Science. 350, 94-98;
- Alexej Abyzov, Livia Tomasini, Bo Zhou, Nikolaos Vasmatzis, Gianfilippo Coppola, et. al.. (2017). One thousand somatic SNVs per skin fibroblast cell set baseline of mosaic mutational load with patterns that suggest proliferative origin. Genome Res.. 27, 512-523;
- Alexej Abyzov, Jessica Mariani, Dean Palejev, Ying Zhang, Michael Seamus Haney, et. al.. (2012). Somatic copy number mosaicism in human skin revealed by induced pluripotent stem cells. Nature. 492, 438-442;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: полимеразная цепная реакция;
- Xiao Dong, Lei Zhang, Brandon Milholland, Moonsook Lee, Alexander Y Maslov, et. al.. (2017). Accurate identification of single-nucleotide variants in whole-genome-amplified single cells. Nat Meth. 14, 491-493;
- От медицины для всех — к медицине для каждого!;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- Nidhee M. Sachdev, Susan M. Maxwell, Andria G. Besser, James A. Grifo. (2017). Diagnosis and clinical management of embryonic mosaicism. Fertility and Sterility. 107, 6-11;
- Ariel Weissman, Gon Shoham, Zeev Shoham, Simon Fishel, Milton Leong, Yuval Yaron. (2017). Chromosomal mosaicism detected during preimplantation genetic screening: results of a worldwide Web-based survey. Fertility and Sterility. 107, 1092-1097.






