
Перевалило за тысячу: третья фаза геномики человека
29 октября 2010
Перевалило за тысячу: третья фаза геномики человека
- 2959
- 6
- 5
Генетическое секвенирование — самый что ни на есть передний край биотехнологий и прибыльная область для производителей соответствующего оборудования. Кстати, США — лидер по числу приборов для высокопроизводительного секвенирования: их там около 600 (для сравнения: в России — уже девятнадцать).
Ricardipus @ Flickr (картинка прибора Applied Biosystems SOLiD) и [7]
-
Автор
-
Редакторы
Лишь десять лет назад всего двух пальцев было достаточно, чтобы сосчитать отсеквенированные человеческие геномы. В прошлом году для этого нужны были уже пальцы двух рук. Однако сейчас уже непонятно, найдётся ли нужное количество пальцев в роте солдат, чтобы продолжать вести такой подсчёт. Исследовательский консорциум «1000 геномов» сообщает о завершении «пилотной» фазы проекта, в которой получено 179 полных генетических последовательностей, ещё для почти 700 индивидуумов «прочли» только кодирующие участки ДНК, а для двух групп родители–ребёнок (получается, ещё шесть геномов) секвенирование выполнили с особенной тщательностью, чтобы изучить скорость возникновения мутаций. Персональная генетическая медицина всё продолжает приближаться.
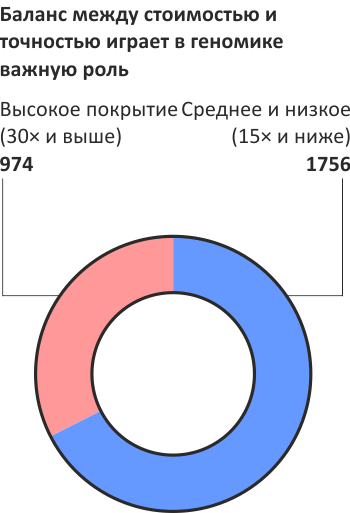
Рисунок 1. Зачем учёным тысячи геномов? Для понимания различий между популяциями. Сравнение тысяч геномов между собой позволяет найти действительно значимые различия, которые важны в медицине и других областях. В этом случае достаточно и «невысокой» точности прочтения: около 900 геномов, прочтённых к настоящему моменту в проекте «1000 геномов», имеют «уровень покрытия» около 3×.
Для выявления генетической подоплёки заболеваний. Исследования по ассоциации конкретных мутаций с риском возникновения заболеваний требуют от генетической информации высокой точности — уровня покрытия 30× и выше. В частности, ведутся проекты по секвенированию геномов больных раком [4], диабетом, болезнью Крона и других. Разумеется, анализ полученных данных — сложнейшая проблема, но интерес подогревает то, что результаты найдут немедленное применение в медицине.
Десять лет назад публике объявили о начале постгеномной эры: была прочтена полная (ну, почти полная) последовательность ДНК человека. Этот «эталонный» геном не принадлежал кому-то конкретно: в него вошли образцы ДНК множества разных людей, а в работу над проектом были вовлечены исследовательские группы из нескольких стран [1]. Вскоре после этого по формальным признакам настало время персональной геномики: два первых прочитанных и опубликованных «персональных» генома принадлежат суперзвёздам молекулярной биологии Джеймсу Уотсону [2] и Крейгу Вентеру. Позже (в 2008 году), когда прочтение очередного генома в связи с развитием технологий высокопроизводительного секвенирования ДНК [3] перестало быть новинкой [4], было объявлено о начале работы консорциума, чья цель следует из названия — «1000 геномов». До 2012 года (срок окончания работы консорциума) альянс ставит своей целью определить и сделать доступным для общественности минимум 1000 полных последовательностей ДНК людей из разных стран и разных национальностей (сейчас речь идёт уже о цифрах 2500 полных геномов из 27 разных популяций).
Одна из практических целей консорциума — исследовать пределы вариабельности человеческой ДНК, которая, как известно, не только более чем на 95% кодирует неизвестно что (так называемый «генетический мусор» [5]), но и идентична у всех человеческих особей более чем на 99%. Очевидно, что оставшийся процент и определяет различия — такие как склонность к определённым заболеваниям или даже личностные характеристики [6]. Однако каким образом это происходит — в большинстве случаев совершенно неизвестно: понятно лишь, что эффект этот крайне сложный и основан не на одном-двух, а на сотнях или даже тысячах признаков, действующих в совокупности.
Проект «1000 геномов» выполняется в примерно 80 исследовательских центрах по всему миру, а инициирован он британским Сенгеровским Институтом (одной из «колыбелей» проекта «Геном человека»), Национальным институтом геномики человека США (NHGRI) и Пекинским геномным институтом (BGI). (Географию геномных проектов можно посмотреть на диаграмме, опубликованной на сайте Nature [7] или на интерактивной карте (рис. 2), показывающей распределение секвенаторов по лабораториям мира [сейчас уже не существует].) Одна из заявленных целей проекта — картировать вариабельные участки генома, встречающиеся в популяции с частотой минимум 1%. (Достижение предыдущего проекта по вариабельности генома человека — HapMap — это 10%-частота, соответствующая 3,5 млн. однонуклеотидных полиморфизмов («снипов», от английской аббревиатуры SNP), — однобуквенных замен в ДНК-тексте.)
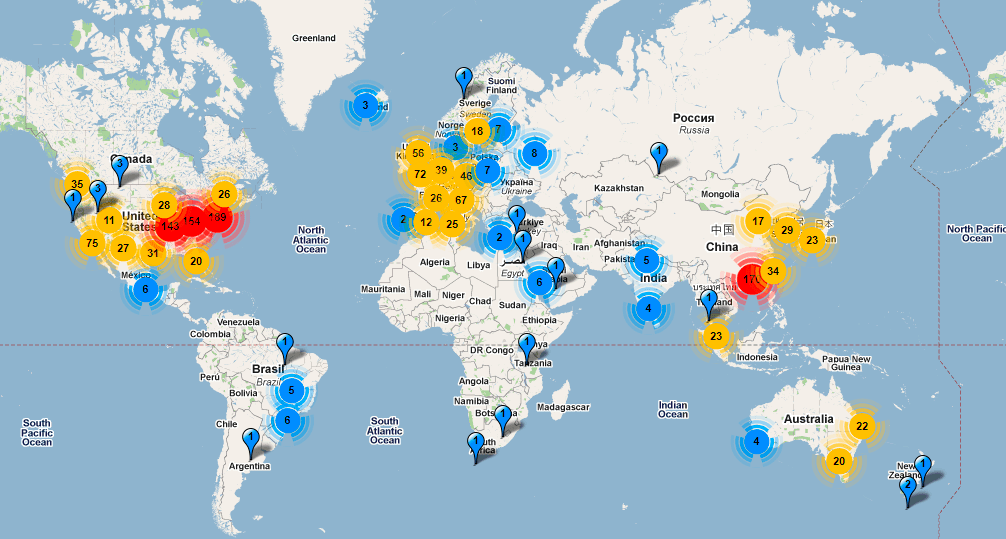
Рисунок 2. Интерактивная карта географического положения оборудования для высокопроизводительного секвенирования позволяет оценить темп работ. На долю России согласно этой карте приходится девять приборов: восемь в Курчатовском институте (месте выполнения проекта «Геном русского человека») и один — в Институте химической биологии и фундаментальной медицины в Академгородке. (На самом деле, по информации, поступившей от специалистов из Курчатовского института, приборов 19: карта неполная.)
Однонуклеотидные полиморфизмы (ОНП) в настоящее время активно используются для выявления генетической предрасположенности к различным заболеваниям (такие исследования с применением технологии высокоплотных олигонуклеотидных микрочипов получили название GWAS — genome wide association studies); правда, даже в самых лучших исследованиях найденные полиморфизмы зачастую не способны объяснить (или предсказать) заболевания с приемлемой для практической медицины точностью (см., например, «Загадочная генетика „загадочной болезни кожи“ — витилиго» [8]). У медицинских генетиков есть надежды, что, знай они не только самые распространённые полиморфизмы в геноме, но и более редкие «снипы» (например, встречающиеся в уже упомянутом 1% случаев), они смогли бы точнее определять риск развития заболевания. Однако, разумеется, не может быть полной уверенности в искренности этого утверждения, даже если предположить, что геном каждого человека будет записан, выражаясь фигурально, на персональной «флэшке».
Как бы то ни было, проект «1000 геномов» отчитывается на страницах Nature в завершении «пилотной» стадии выполнения проекта [9], состоящей из трёх частей:
- полного прочтения геномов 179 индивидуумов европейского, африканского и восточно-азиатского происхождения (тут секвенирование проведено с невысокой «точностью», которая прямо пропорциональна количеству повторных прочтений одной последовательности);
- секвенирования только экзонов (так называемых неполных «экзомов») генома (8140 белок-кодирующих фрагментов ДНК, составляющих 906 различных генов) для 697 людей;
- высокоточного (с большим «покрытием») установления полных генетических последовательностей двух «триад», состоящих из двух родителей и их ребёнка (что позволяет оценить скорость накопления мутаций между двумя поколениями).
Статья консорциума опубликована в открытом доступе (также как и сами последовательности), чтобы результаты смогли получить как можно более широкое распространение.
В результате пилотной фазы проекта «1000 геномов» обнаружилось, что в каждом поколении человек приобретает около 60 новых мутаций (которых не было у родителей), а среднее число «дефектных» аллелей у каждого из нас — 250–300, что соответствует болезнетворным мутациям в более чем 1% всех генов. К счастью, существование двух экземпляров ДНК (отцовской и материнской) позволяет реализоваться механизму активности доминантных генов: в большинстве случаев эти опасные мутации «молчат», хотя и продолжают передаваться по наследству.
Кроме того, было идентифицировано около 15 миллионов однонуклеотидных полиморфизмов, более половины из которых не были известны ранее (это те самые «редкие» аллели), около миллиона коротких вставок/делеций и в районе 20000 других структурных вариантов. Эта работа вскоре повлечёт за собой и практические выгоды: уже проектируют микрочипы для генотипирования по 5 миллионам «снипов», в то время как нынешнее поколение микрочипов позволяет определять примерно 1 миллион аллельных различий.
Параллельно с этим (в один день) в журнале Science опубликовали исследование другого аспекта генетической вариабельности — числа копий (дубликатов) одних и те же генов, содержащихся в геноме (а это издавна считается методологически сложной задачей) [10]. Число копий генов также считается очень важным моментом, определяющим черты организма и его эволюцию.
Авторы предложили оригинальную методику подсчёта числа копий генов, в результате чего открылись неожиданно большие различия по этому параметру между людьми различных рас. Кстати, сравнение участков ДНК с повторяющимися генами выявляет у людей (по сравнению с другими приматами) намного большее число экземпляров некоторых генов, участвующих в развитии мозга.
Технологически прочтение генома остаётся очень сложной задачей, в которой исследователям приходится виртуозно балансировать между стоимостью процедуры и точностью, с которой производится прочтение. С частотой раз в год появляется новое поколение приборов для высокопроизводительного секвенирования (о технологиях «нового поколения», пришедших на смену уже ставшим классикой [3], «биомолекула» как-нибудь обязательно расскажет). Результаты проходят через сложнейшую статистическую обработку, учитывающую уже известные последовательности ДНК, что позволяет повысить точность расшифровки до приемлемого уровня (иначе процент ошибок был бы всё-таки слишком высок). [Без подробностей — методика «коррекции ошибок» получила название imputation.]
В совокупности, эти результаты показывают, насколько же мы всё-таки различны [11] — и это при том, что разница в ДНК не превышает какого-то одного процента. Если считать, что первой фазой геномики человека стал «первый геном» [1], а во время второй исследователи со всего мира изучили вариабельность генома «с высоты птичьего полёта», то наступающая третья фаза обещает стать фазой действительно персональной геномики. Готовьте флэшки под геномы! ;-)
Написано по материалам новостей Science [12] и Nature [13], [14].
Литература
- Геном человека: как это было и как это будет;
- Геном Нобелевского лауреата Джеймса Уотсона скоро будет расшифрован;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
Скверный анекдот: негр, китаец и Крейг Вентер...;- «Мусорная» ДНК управляет эволюцией млекопитающих?;
- Слово о генетике поведения;
- Human genome: Genomes by the thousand. (2010). Nature. 467, 1026-1027;
- Загадочная генетика «загадочной болезни кожи» — витилиго;
- Richard M. Durbin, David L. Altshuler, Richard M. Durbin, Gonçalo R. Abecasis, David R. Bentley, et. al.. (2010). A map of human genome variation from population-scale sequencing. Nature. 467, 1061-1073;
- Peter H. Sudmant, Jacob O. Kitzman, Francesca Antonacci, Can Alkan, Maika Malig, et. al.. (2010). Diversity of Human Copy Number Variation and Multicopy Genes. Science. 330, 641-646;
- Мы все такие разные;
- Elizabeth Pennisi. (2010). 1000 Genomes Project Gives New Map of Genetic Diversity. Science. 330, 574-575;
- Rasmus Nielsen. (2010). Genomics: In search of rare human variants. Nature. 467, 1050-1051;
- Alla Katsnelson. (2010). 1000 Genomes Project reveals human variation. Nature.






