2D-почтальон: системы доставки лекарств на основе графена
17 ноября 2018
2D-почтальон: системы доставки лекарств на основе графена
- 2104
- 0
- 4
Графен — двумерный материал из одноатомного слоя углерода, легкий и прочный. Благодаря своим уникальным свойствам он стал любимчиком во многих отраслях науки, в том числе и в биофармацевтике.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Адресная доставка — популярный тренд в фармакологии. Ученые всего мира несколько десятилетий искали идеальный переносчик для лекарственных препаратов: безопасный и эффективный. Перепробовали все: магнитные частицы и углеродные нанотрубки, липосомы и биополимеры. И, кажется, наконец нашли самый безопасный и эффективный способ попасть точно в цель.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
От левитирующих лягушек к Нобелевской премии
Крохотный переулок академгородка в Манчестере, факультет физики — место, где всё началось. В 2004 году, в один из пятничных вечеров двое физиков, выходцев из России — Андрей Гейм и Константин Новоселов — почти случайно совершили важнейшее открытие. Они смогли выделить графен — двумерный материал, состоящий из одноатомного слоя углерода. Более полувека назад теоретические расчеты предсказали его существование, но получить графен удалось только спустя десятилетия.
В тот вечер физики в своей лаборатории просто баловались со скотчем — не шотландским, а канцелярским. Они приклеивали клейкую ленту на кусок графита (как тот, что используется в простых карандашах) и пытались отшелушить тончайшие слои углерода. В лаборатории была традиция — каждую пятницу по вечерам сотрудники откладывали в сторону свои основные проекты и занимались «пятничной наукой» — диковинными экспериментами, которые вряд ли могли рассчитывать на успех или финансирование. За всё время существования пятничного клуба удача улыбнулась физикам лишь трижды. В первый раз Андрей Гейм сумел провести успешный эксперимент по левитации живой лягушки, за что, кстати, в 2000 году получил Шнобелевскую премию. Второй успех — создание gecko tape: клейкой ленты с крошечными волосками вроде тех, которыми покрыты лапы гекконов. Ну а последним и самым важным пятничным открытием стал графен. В 2010 году за «новаторские эксперименты по исследованию графена» Гейм и Новоселов удостоились Нобелевской премии по физике. Андрей Гейм при этом стал первым человеком, получившим и Нобелевскую, и Шнобелевскую премии [1].
Удержать слона
С графеном сталкивался каждый, кто хоть раз пользовался простым карандашом. След, который грифель оставляет на бумаге — не что иное, как несколько слоев графена, наложенных друг на друга. Связи между ними достаточно слабые, поэтому слои так легко отделяются друг от друга и остаются на бумаге. Между углеродами внутри плоскости, наоборот, взаимодействия очень сильные. Настолько, что два слоя графена, наложенные друг на друга, могут выдержать выстрел из огнестрельного оружия, а стопка толщиной с обычный полиэтиленовый пакет удержала бы целого слона [2].
По сути графен — это тонкий одноатомный слой графита. Его атомы образуют шестигранные кольца, похожие на пчелиные соты. Он напоминает множество ароматических молекул (таких как бензол), связанных между собой в одной плоскости (рис. 1). Графен очень химически и механически устойчив, поэтому его часто используют в биомедицине.
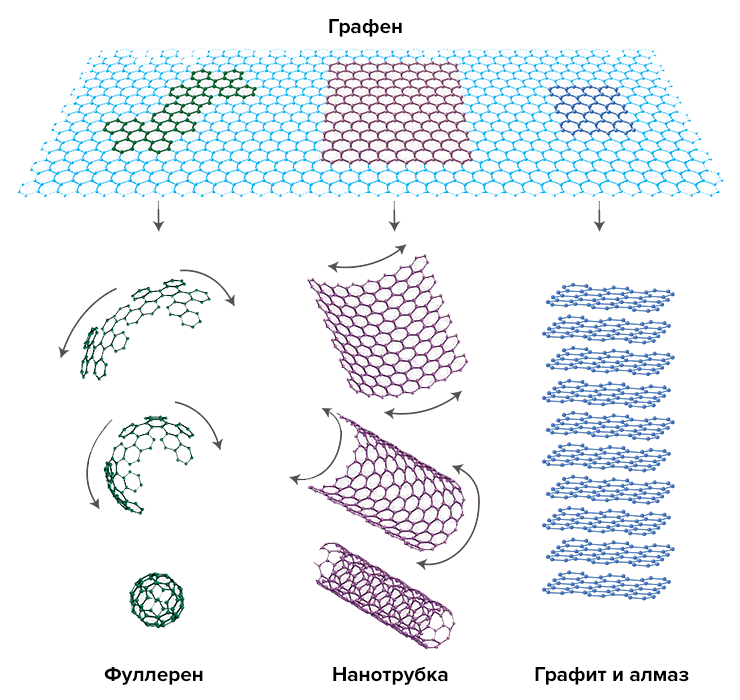
Рисунок 1. У углерода есть несколько аллотропных модификаций, которые кардинально отличаются друг от друга по свойствам
А еще он очень легкий — в 2017 году китайские ученые разработали графеновый аэрогель, который на 99% состоит из воздуха. При этом материал выдерживает вес в 4000 раз больше своего собственного [3].
Самое удивительное свойство графена — он сам может создавать энергию. Графен хоть и двумерен, но никогда не бывает совершенно плоским. Его структура напоминает скорее рябь на воде — случайные колебания атомов создают на поверхности «волны», которые выгибаются попеременно то в одну, то в другую сторону, генерируя энергию [4].
Гибридные технологии
В последние годы популярной стала идея применить графен в биомедицине. Вариантов использования масса — это и биосенсоры на основе графеновых транзисторов, и графеновые носители для биологической визуализации, и, что особенно интересно, системы доставки лекарственных препаратов [5] . Мы же подробно остановимся на том, почему графен — идеальный кандидат на роль переносчика и какие перспективы в биомедицине его ждут.
«Биомолекула» уже писала про важность и нужность целевой доставки и ее роли в наномедицине будущего: «Наночастицы — инструмент адресной доставки лекарств» [6], «Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза» [7] и «Наномедицина будущего: трансдермальная доставка с использованием наночастиц» [8].
Самое первое исследование в этой области провели в Стэнфордском университете (Калифорния, США) в 2008 году. Авторы впечатлились успехами углеродных нанотрубок в биомедицине и задались вопросом: «А можно ли в доставке лекарств использовать графен?» [9]. Наряду с очевидными преимуществами у материала были и существенные недостатки.
С одной стороны, большая площадь поверхности позволяет разместить на одном слое графена множество молекул — масса лекарства может быть в два раза больше, чем масса самого носителя [10].
Но для медицинских применений графен нужно растворить в биологических жидкостях, при этом не дав чешуйкам слипнуться друг с другом. В своем первозданном виде материал гидрофобен , поэтому растворить его можно только с помощью неполярного растворителя или поверхностно-активных веществ (ПАВ) [11]. Главная проблема в том, что молекулы ПАВ и растворителя остаются на поверхности графена и делают препарат токсичным. Более того, в 2011 году исследователи из Пекинского университета обнаружили, что даже чистый графен сам по себе может быть ядовит — он вызывал смерть мышиных макрофагов. Причина — высокая концентрация активных форм кислорода внутри клетки [12].
Про гидрофобность «Биомолекула» подробно писала в статье «Физическая водобоязнь» [13].
Поэтому в биомедицине предпочитают использовать альтернативные формы графена. Сейчас самый распространенный препарат — оксид графена. Он содержит множество гидрофильных групп (например карбоксильные). Это повышает биосовместимость материала и предотвращает слипание чешуек друг с другом.
Другой способ модифицировать графен — покрыть его полиэтиленгликолем (ПЭГ), декстраном или альгинатом. Эти вещества увеличивают время циркуляции, биосовместимость и растворимость графена. Что, в свою очередь, уменьшает его токсичность и негативные последствия для организма [14].
Модифицированные формы графена стали широко изучать в последние несколько лет как новый переносчик лекарственных средств: противоопухолевых препаратов, антибиотиков, антител и даже генетического материала. В отличие от традиционной химиотерапии, при которой препараты свободно путешествуют по кровотоку и равномерно распределяются по всему организму, использование специальных носителей делает процесс точечным и направленным. Такой себе почтальон от медицины.
Контролировать доставку можно через внешние (температура, ультразвук, магнитные, световые и электрические поля) или внутренние (рН, концентрация ферментов, окислительно-восстановительные реакции) стимулы (рис. 2) [14].
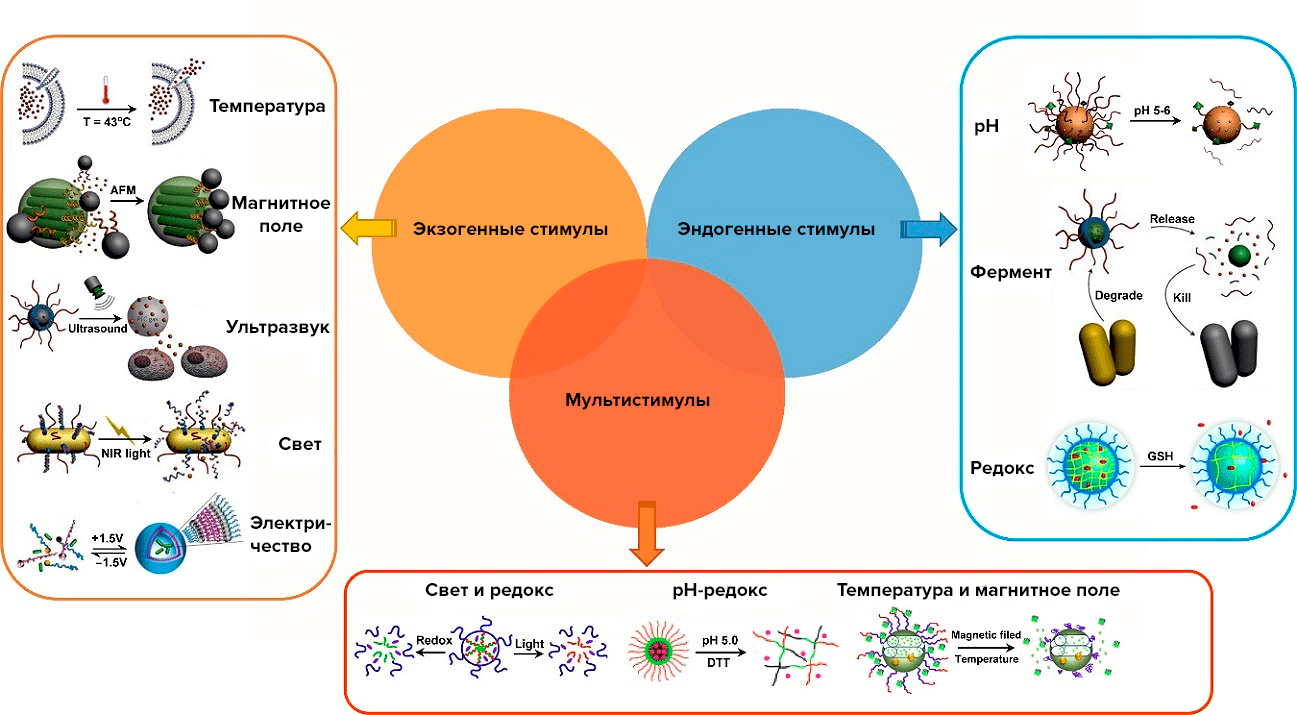
Рисунок 2. Способы контроля доставки лекарств. Условные обозначения: AMF — переменное магнитное поле; NIR — ближнее инфракрасное излучение; DTT — дитиотреитол; GSH — глутатион.
Из-за сложного строения человеческого тела и труднодоступного расположения опухолей используют несколько разных стимулов одновременно. Согласно исследованиям, гибридная везикула на основе оксида графена не только вмещает большую дозу противоопухолевого препарата доксорубицина (DOX), но также может последовательно высвобождать его при инфракрасном облучении и под действием кислой внутриклеточной среды (рис. 3). При лазерном облучении везикула «лопается», и в полость клетки выходят молекулы DOX, закрепленные на чешуйках оксида графена. Затем в дело вступает кислотная среда — за счет понижения pH DOX высвобождается и направляется в ядро клетки [15].
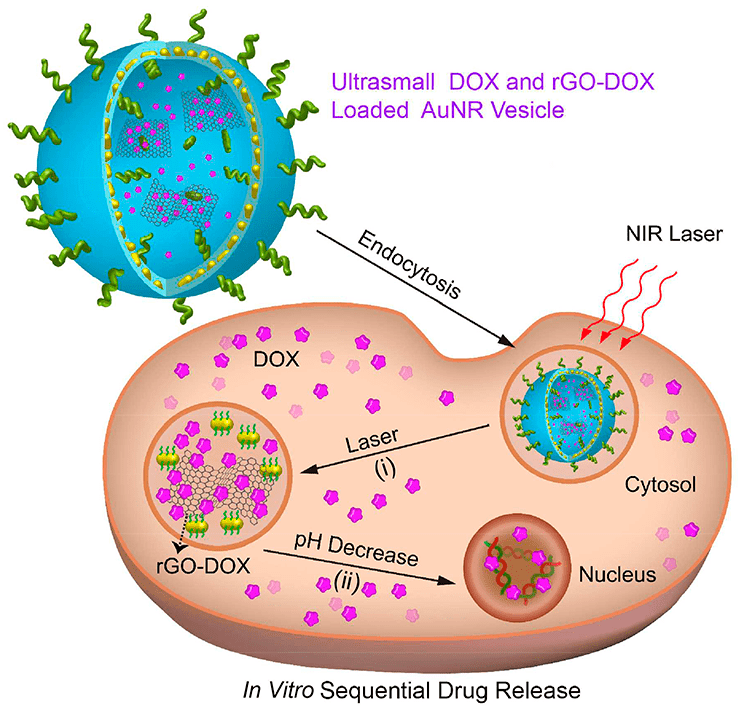
Рисунок 3. Схема последовательного высвобождения DOX, вызванного излучением NIR-лазера (i) и кислой средой раковой клетки (ii)
Такие гибридные подходы повышают эффективность доставки лекарства и позволят снизить его дозировку. А следовательно, уменьшить побочные эффекты [10], [14].
Доставить по адресу
Системы доставки на основе графена развиваются в двух направлениях: доставка лекарств и доставка генетического материала.
Доставка лекарств
Для адресной доставки лекарств есть несколько подходов.
Первый, наиболее простой — прикрепление препарата на поверхность носителя напрямую. Например, как упомянутый выше доксорубицин, прочно связанный с поверхностью оксида графена и высвобождающийся только в кислотной среде опухоли.
Более сложный способ — прикрепить к поверхности носителя не только действующее вещество, но и направляющие молекулы — лиганды. Это могут быть, например, поликлональные антитела, фолиевая кислота или трансферрин. Они распознают клетки-мишени и связываются с ними [16].
Иногда лиганд может быть одновременно и лекарством.
К примеру, международная группа ученых из Университета Северной Каролины и Китайского фармацевтического университета показали, что противоопухолевый белок TRAIL может связываться с поверхностью раковых клеток. В своем исследовании авторы прикрепили два препарата — TRAIL и DOX — к полоскам графена (рис. 4). TRAIL эффективен при доставке к наружной мембране раковой клетки, а DOX — при доставке к ее ядру. Когда конструкция контактирует с раковой клеткой, рецепторы на ее поверхности связываются с белком TRAIL, что позволяет клетке поглотить загруженный доксорубицином графен и оставляет TRAIL на поверхности, где он запускает процесс гибели клеток. Графен с доксорубицином попадают внутрь клетки, кислая среда отделяет DOX от графена и дает ему возможность атаковать ядро [17].
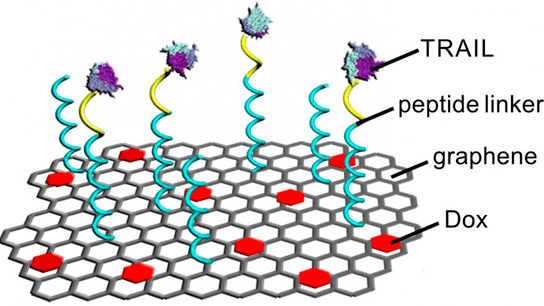
Рисунок 4. Схема конструкции на основе графена для одновременной доставки TRAIL и DOX
Доставка генетического материала
Генная терапия для лечения таких заболеваний, как болезнь Паркинсона, кистозный фиброз (он же — муковисцидоз [18]) и различные виды рака, требует наличия транспортера для защиты целевого гена от разрушения. Сейчас в 70% случаев для этого исследователи используют вирусные векторы. Но учитывая их непредсказуемость, многие пытаются создать синтетические аналоги на основе липосом или производных графена. Гибридные молекулы на основе графена вмещают больший объем ДНК или РНК, защищают их от деградации и облегчают поглощение клеткой [19]. «Загрузить» нуклеиновые кислоты на графеновые чешуйки можно благодаря гидрофобным и характерным для аромамолекул π-π взаимодействиям. Последние образуются между кольцевыми структурами нуклеотидов и шестиугольной решеткой углерода в оксиде графена (рис. 5). Предполагают, что участие также принимают и силы Ван-дер-Ваальса. А некоторые исследования показывают, что двойная спираль лучше связывается с оксидом графена при высокой концентрации соли и низком уровне рH [19], [20].
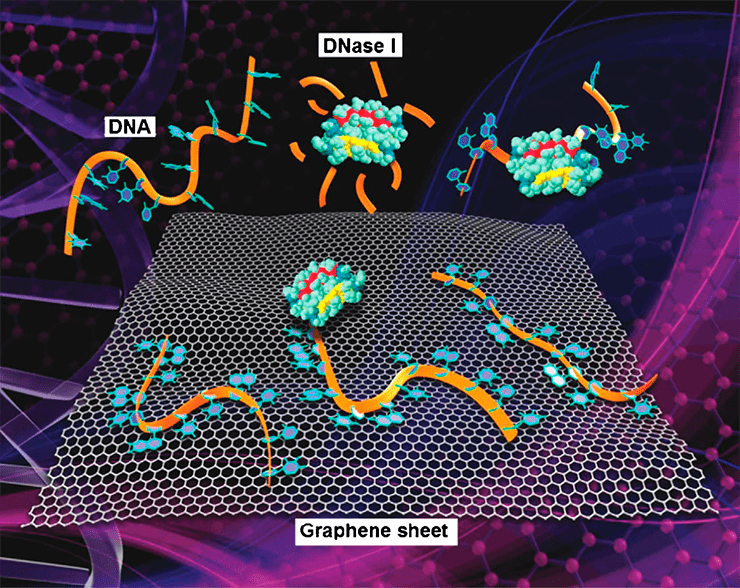
Рисунок 5. Схематическое изображение связывания одноцепочечной ДНК с листом функционализированного графена. Находящаяся поблизости ДНКаза легко разрушает свободную цепь, но не вредит связанной с графеном.
Как именно графен с генетическим материалом попадает в клетку — пока остается загадкой. Из возможных вариантов — фагоцитоз и опосредованный белком клатрином эндоцитоз [7]. Кроме того, в некоторых экспериментах используют инфракрасное излучение — оно нарушает структуру мембраны и облегчает проникновение внутрь клетки [19].
В 2017 году исследователи из Китая показали, что графен можно применять в лечении рака поджелудочной железы. Авторы работы использовали оксид графена с фолиевой кислотой и ПЭГ в качестве носителя для коротких интерферирующих РНК (киРНК). Они «выключают» гены HDAC1 и K-Ras, ответственные за рост злокачественных опухолей, и вызывают смерть раковых клеток. Комбинация такой генной терапии и терапии инфракрасным излучением подавляет рост опухоли in vivo более чем на 80% [21].
Вместо послесловия
Применение графена в медицине не ограничивается только системами доставки. У графена обнаружена способность ускорять дифференцировку стволовых клеток [22] и селективно связывать антитела [23], он используется в клеточной инженерии [24], и из него делают даже вживляемые в организм электроды [25]. Этот материал используют как контрастное вещество при МРТ и КТ [26]. А при добавлении графена в смесь ПЦР увеличивается выход ДНК!
На основе графена создают самые разные медицинские девайсы — биосенсоры, микрочипы, пластыри для контроля уровня глюкозы [27] и даже импланты [28] . В 2014 году были анонсированы прозрачные (по инфракрасным и ультрафиолетовым частотам) графены, гибкие имплантируемые медицинские микрочипы медицинских датчиков, которые позволяют просматривать ткани мозга, скрытые имплантатами [29].
Подобным устройствам, используемым в медицине, на «Биомолекуле» посвящена целая тема: «Носимые технологии». — Ред.
Скорость, с которой графен ворвался во многие сферы науки, включая биомедицину, доказывает, что для великого открытия иногда нужны лишь пятничный вечер и немного скотча.
Литература
- A. K. Geim, K. S. Novoselov. (2007). The rise of graphene. Nature Mater. 6, 183-191;
- Mirsky S. (2011). Elephant illustrates important point. Scientific American;
- Han Hu, Zongbin Zhao, Wubo Wan, Yury Gogotsi, Jieshan Qiu. (2013). Ultralight and Highly Compressible Graphene Aerogels. Adv. Mater.. 25, 2219-2223;
- D. Li, R. B. Kaner. (2008). MATERIALS SCIENCE: Graphene-Based Materials. Science. 320, 1170-1171;
- Martin Pumera. (2011). Graphene in biosensing. Materials Today. 14, 308-315;
- Наночастицы — инструмент адресной доставки лекарств;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Наномедицина будущего: трансдермальная доставка с использованием наночастиц;
- Liangzhu Feng, Zhuang Liu. (2011). Graphene in biomedicine: opportunities and challenges. Nanomedicine. 6, 317-324;
- Zhuqing Wang, Lucio Colombi Ciacchi, Gang Wei. (2017). Recent Advances in the Synthesis of Graphene-Based Nanomaterials for Controlled Drug Delivery. Applied Sciences. 7, 1175;
- Hongqian Bao, Yongzheng Pan, Yuan Ping, Nanda Gopal Sahoo, Tongfei Wu, et. al.. (2011). Chitosan-Functionalized Graphene Oxide as a Nanocarrier for Drug and Gene Delivery. Small. 7, 1569-1578;
- Yang Li, Ying Liu, Yujian Fu, Taotao Wei, Laurent Le Guyader, et. al.. (2012). The triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathways. Biomaterials. 33, 402-411;
- Физическая водобоязнь;
- Jingquan Liu, Liang Cui, Dusan Losic. (2013). Graphene and graphene oxide as new nanocarriers for drug delivery applications. Acta Biomaterialia. 9, 9243-9257;
- Jibin Song, Xiangyu Yang, Orit Jacobson, Lisen Lin, Peng Huang, et. al.. (2015). Sequential Drug Release and Enhanced Photothermal and Photoacoustic Effect of Hybrid Reduced Graphene Oxide-Loaded Ultrasmall Gold Nanorod Vesicles for Cancer Therapy. ACS Nano. 9, 9199-9209;
- Seong Soo An, Si-Ying Wu, John Hulme. (2015). Current applications of graphene oxide in nanomedicine. IJN. 9;
- Tianyue Jiang, Wujin Sun, Qiuwen Zhu, Nancy A. Burns, Saad A. Khan, et. al.. (2015). Furin-Mediated Sequential Delivery of Anticancer Cytokine and Small-Molecule Drug Shuttled by Graphene. Adv. Mater.. 27, 1021-1028;
- Муковисцидоз — первые надежды;
- M Vincent, I de Lázaro, K Kostarelos. (2017). Graphene materials as 2D non-viral gene transfer vector platforms. Gene Ther. 24, 123-132;
- Yuqi Yang, Abdullah Mohamed Asiri, Zhiwen Tang, Dan Du, Yuehe Lin. (2013). Graphene based materials for biomedical applications. Materials Today. 16, 365-373;
- Feng Yin, Kuan Hu, Yangzi Chen, Mengying Yu, Dongyuan Wang, et. al.. (2017). SiRNA Delivery with PEGylated Graphene Oxide Nanosheets for Combined Photothermal and Genetherapy for Pancreatic Cancer. Theranostics. 7, 1133-1148;
- Tapas R. Nayak, Henrik Andersen, Venkata S. Makam, Clement Khaw, Sukang Bae, et. al.. (2011). Graphene for Controlled and Accelerated Osteogenic Differentiation of Human Mesenchymal Stem Cells. ACS Nano. 5, 4670-4678;
- Z Tehrani, G Burwell, M A Mohd Azmi, A Castaing, R Rickman, et. al.. (2014). Generic epitaxial graphene biosensors for ultrasensitive detection of cancer risk biomarker. 2D Mater.. 1, 025004;
- Gaurav Lalwani, Allan M. Henslee, Behzad Farshid, Liangjun Lin, F. Kurtis Kasper, et. al.. (2013). Two-Dimensional Nanostructure-Reinforced Biodegradable Polymeric Nanocomposites for Bone Tissue Engineering. Biomacromolecules. 14, 900-909;
- Alessandra Fabbro, Denis Scaini, Verónica León, Ester Vázquez, Giada Cellot, et. al.. (2016). Graphene-Based Interfaces Do Not Alter Target Nerve Cells. ACS Nano. 10, 615-623;
- Balaji Sitharaman, Shruti Kanakia, Jimmy Toussaint, Sayan Mullick Chowdhury, Gaurav Lalwani, et. al.. (2013). Physicochemical characterization of a novel graphene-based magnetic resonance imaging contrast agent. IJN. 2821;
- Hyunjae Lee, Tae Kyu Choi, Young Bum Lee, Hye Rim Cho, Roozbeh Ghaffari, et. al.. (2016). A graphene-based electrochemical device with thermoresponsive microneedles for diabetes monitoring and therapy. Nature Nanotech. 11, 566-572;
- Dibyendu Chakravarty, Chandra Sekhar Tiwary, Cristano F. Woellner, Sruthi Radhakrishnan, Soumya Vinod, et. al.. (2016). 3D Porous Graphene by Low-Temperature Plasma Welding for Bone Implants. Adv. Mater.. 28, 8959-8967;
- Dong-Wook Park, Amelia A. Schendel, Solomon Mikael, Sarah K. Brodnick, Thomas J. Richner, et. al.. (2014). Graphene-based carbon-layered electrode array technology for neural imaging and optogenetic applications. Nat Commun. 5.