Наночастицы — инструмент адресной доставки лекарств
16 ноября 2018
Наночастицы — инструмент адресной доставки лекарств
- 8066
- 0
- 16
Опухоль в момент атаки наночастицами
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Химиотерапия рака основывается на приеме пациентом противоопухолевых антибиотиков, уничтожающих раковые клетки или останавливающих их рост. Химиотерапия не всегда достаточно эффективна и может наносить ощутимый вред организму. Из-за неселективного действия антибиотиков на здоровые клетки возникают побочные эффекты. Как сделать удар по раковым клеткам точечным, не задев при этом здоровые? Свойства опухолевой ткани существенно отличаются от нормальных. Можно добавить к нашему лекарству «систему наведения», которая распознает отличие и направит лекарство в нужное место. Эта концепция получила название адресной доставки.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Зачем нужна адресная доставка лекарств?
Начиная с 1980-х годов активно разрабатывается доставка противоопухолевых антибиотиков с помощью наночастиц . Наночастицы проникают в опухоль благодаря так называемому эффекту «повышенной проницаемости и удержания» (enhanced permeability and retention, EPR). EPR-эффект возникает из-за чрезмерного разрастания сосудов (ангиогенеза), вызванного потребностью опухоли в кислороде и питании [1]. При патологическом ангиогенезе в стенках сосудов появляются поры до 200 нм в диаметре. Также разрастание опухоли вызывает сдавливание лимфатических сосудов и препятствует нормальному оттоку межклеточной жидкости. Наночастицы проникают в опухоль сквозь поры и не могут покинуть ее из-за нарушенного дренажа. Путь попадания в сами раковые клетки определяется материалом наночастицы.
Взаимодействие биологических и наноразмерных систем подробно рассмотрено в статье «Невидимая граница: где сталкиваются “нано” и “био”» [2]. — Ред.
В этой статье рассмотрены основные типы применяемых сегодня наночастиц — липосомы, полиплексы, наночастицы золота, магнитные наночастицы и наночастицы графеновых полимеров . Сейчас активно разрабатывают многофункциональные наночастицы из разных комбинаций перечисленных материалов. По данным за 2017 год наибольшую долю (56%) среди «нанолекарств», одобренных для терапии, составляют липосомы [3].
На «Биомолекуле» уже была серия материалов, посвященная вопросам адресной доставки и применению нанотехнологий в медицине [4–11]. — Ред.
Липосомы: все дело в волшебных пузырьках
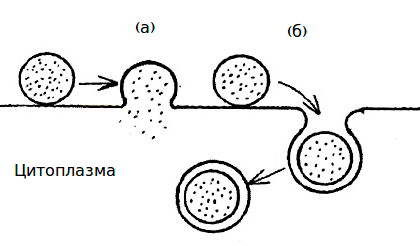
Рисунок 1. Типы взаимодействия липосом с клеточной мембраной: слияние (а) и эндоцитоз (б)
Липосомы — это сферические пузырьки из двойного слоя липидов размером 25–100 нм, заполненные жидкостью. Липосомы эффективны, потому что состоят из нативных липидов и обладают высоким сродством к клеточным мембранам. После контакта с плазматической мембраной, содержимое липосом проникает в клетку при слиянии мембран, или по пути эндоцитоза (рис. 1).
Противоопухолевый антибиотик доксорубицин был открыт в 1960-х годах и широко применяется в химиотерапии метастазирующих опухолей и рака молочный железы [12], [13]. Однако применение доксорубицина было ограничено из-за его побочного действия на сердце. Адресная доставка этого вещества к опухоли может решить эту проблему, снизив системную токсичность и эффекты на сердце. Первый внедренный в терапию препарат доксорубицина на основе липосом — «Миоцет» — представляет собой соль доксорубицина (10–15 тыс. молекул), заключенную в бислойный липидный пузырек. Бислой сформирован фосфатидилхолином и холестерином, которые содержатся в клеточных мембранах. Преимущества «Миоцета» перед свободным доксорубицином — более медленное выведение из организма и иное распределение препарата в организме. При этом значительно снижается опасное накопление антибиотика в сердечной мышце [14].
Липосомы другого препарата доксорубицина — «Доксила» — содержат положительно заряженный липид дистеароилфосфатидилэтаноламин, ковалентно сшитый с полимером метоксиполиэтиленгликолем (МПЭГ) (рис. 2). Дополнительный слой оболочки из производного полиэтиленгликоля позволяет «обмануть» иммунные клетки (фагоциты), препятствуя поглощению липосом и увеличивая время циркуляции таких «стелс-липосом» в организме. «Доксил» был одобрен FDA для лечения рака молочной железы и яичников в 1995 году [14].
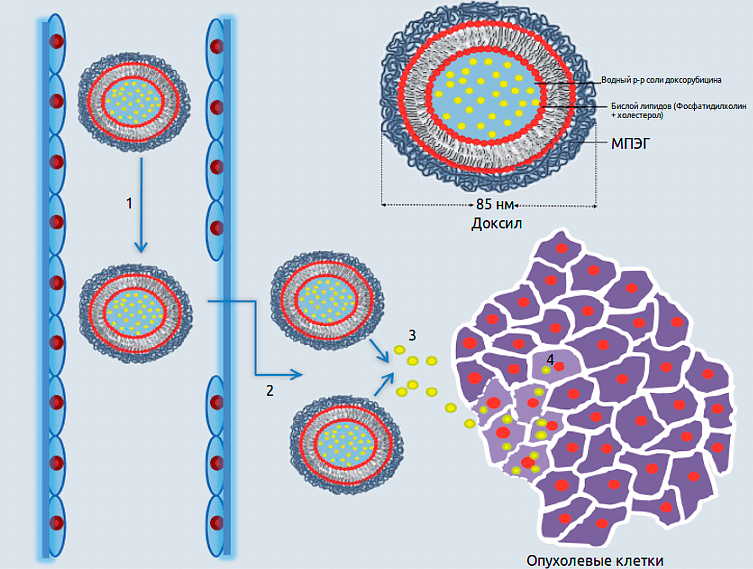
Рисунок 2. Строение липосом «Доксила» и путь транспорта липосом в опухоль. Дополнительная оболочка из МПЭГ позволяет «обмануть» фагоциты иммунной системы.
В препарате нового поколения — «Термодоксе» — селективность действия дополнительно увеличена за счет инновационного подхода «контролируемого высвобождения». Липосомы «Термодокса» термочувствительны: они разрушаются и высвобождают доксорубицин при нагревании опухоли до 43 °С. «Термодокс» применяют для лечения твердых опухолей. Прием лекарства проводят в сочетании с прогреванием опухоли ультразвуком (рис. 3).
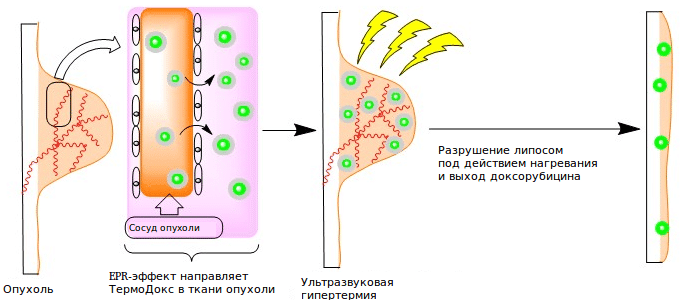
Рисунок 3. Доксорубицин высвобождается из липосом «Термодокса» под действием ультразвуковой гипертермии
На примере доксорубицина и ряда других антибиотиков с опасными побочными эффектами была доказана эффективность и безопасность липосомальной доставки. EPR-эффект — основная движущая сила, направляющая наночастицы в опухоль. Однако чрезмерная плотность слоев раковых клеток препятствует доставке препарата вглубь опухоли. Также не все опухоли демонстрируют EPR-эффект: например, поры отсутствуют в сосудах опухолей головного мозга. Поэтому для повышения эффективности доставки могут использоваться некоторые клеточные механизмы транспорта. В настоящее время исследуют наночастицы, проникающие в опухоль за счет взаимодействия рецепторов на мембранах раковых клеток с лигандами на поверхности наночастиц [6].
Одним из них является рецептор трансферрина — TfR, — необходимый для импорта железа в клетку. Трансферрин — это белок, образующий комплексы с ионами железа [15]. Свободное железо токсично для организма, поэтому в организме оно связано в комплекс с трансферрином. В свою очередь, комплекс взаимодействует с рецептором TfR на поверхности клеток и проникает внутрь по механизму эндоцитоза (рис. 4). Такие липосомы активно захватываются из сосудов опухоли мозга клетками эндотелия.
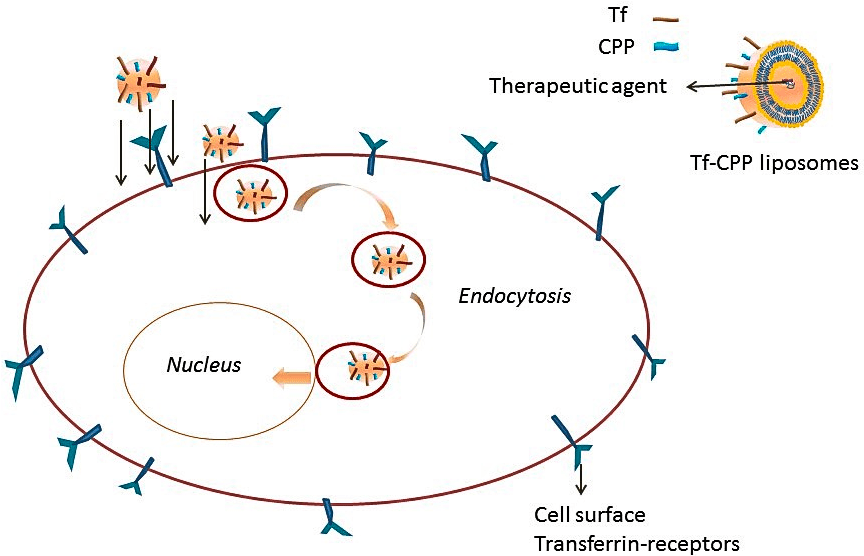
Рисунок 4. Трансферриновые липосомы активно проникают в клетку за счет взаимодействия с рецептором TfR. Молекулы трансферрина пришиваются к липосоме за свободные концы ПЭГ.
Липоплексы: способ доставки нуклеиновых кислот
Одна из разновидностей липосом — липоплекс — применяется для доставки в раковые клетки коротких интерферерующих РНК (киРНК) (рис. 5). Открытие РНК-интерференции [16] и ее внедрение в терапию опухолей потребовало разработки новых носителей и модификации уже существующих — из-за наличия отрицательного заряда у молекул РНК. В основе РНК-интерференции лежит взаимодействие киРНК длиной 20–25 нуклеотидов и комплементарной ей мРНК-мишени, приводящее к разрушению последней. С помощью нее можно подавить аномально высокую транскрипцию или транскрипцию гена с мутацией, характерную для раковых клеток [16]. Такие «целебные» киРНК часто называют антисенсами [17].
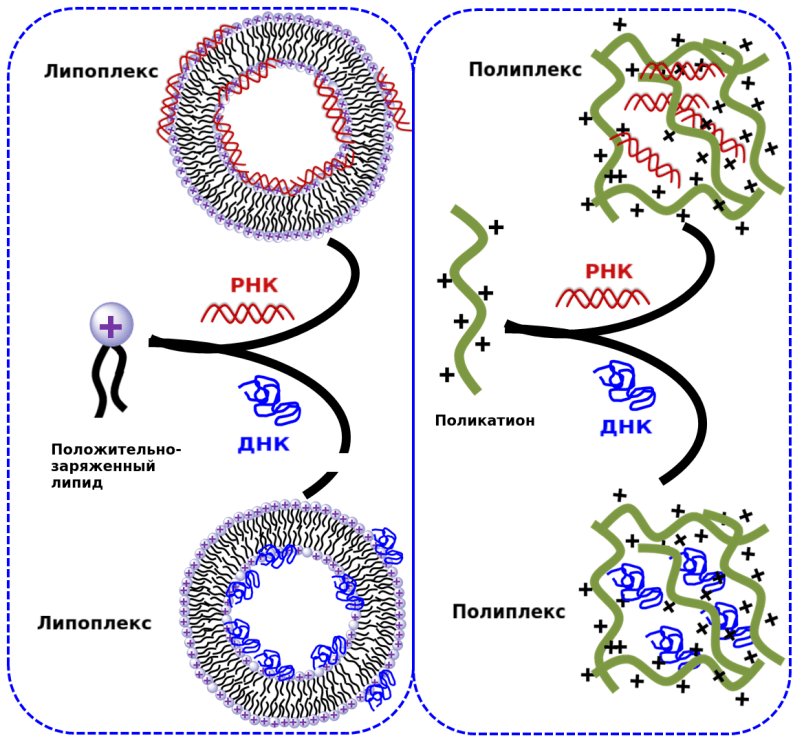
Рисунок 5. Схема строения липоплекса и полиплекса
Данный вид терапии невозможен без адресной доставки, поскольку время жизни свободной РНК в крови исчисляется минутами, а распознавание свободной нуклеиновой кислоты иммунной системой дает аллергические реакции. Для доставки РНК могут использоваться липоплексы. Липоплекс — это липосома, содержащая липиды с положительно заряженными аминогруппами: с ними и взаимодействуют фосфатные группы РНК (рис. 6) [18].
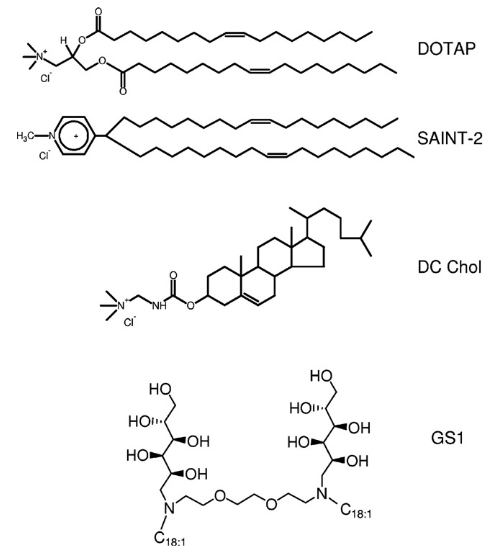
Рисунок 6. Структурные формулы некоторых положительно заряженных липидов
В отличие от незаряженных липосом, липоплексы проникают в клетку по механизму эндоцитоза. При этом вокруг липоплекса формируется эндосома. Аминогруппы липоплекса нарушают кислотно-щелочной баланс (рН) внутри эндосомы, что приводит к ее разрушению и выходу РНК в цитоплазму. Разработан ряд липосомных препаратов киРНК, некоторые из которых проходят клинические испытания (табл. 1) [19], [20].
| Препарат | Гены-мишени | Функция генов | Заболевания |
|---|---|---|---|
| ALN-VSP02 | KSP и VEGF | Моторный тубулин-зависимый белок, осуществляющий расхождение хромосом при митозе. Сигнальный белок для стимуляции роста сосудов |
Рак печени |
| Atu027 | PKN3 | Регуляторный белок, сверхэкспрессирующийся в опухолевых клетках | Рак легких |
| TK080301 | PLK1 | Нейроэндокринные опухоли, адренокортикальный рак | |
| DCR MYC | MYC | Твердые опухоли, меланолма, лимфома |
Полиплексы: плюс на минус дает плюс?
Полиэлектролиты
Другие носители киРНК — поликатионы — высокомолекулярные соединения из положительно заряженных органических мономеров. В растворе они самопроизвольно образуют комплексы-наночастицы с отрицательно заряженными нуклеиновыми кислотами — полиплексы. Наиболее часто используемые поликатионы — полиэтиленимин, поли-L-лизин, полиамидоамин и хитозан (рис. 5) [21]. Полиплекс также проникает в клетку по пути эндоцитоза, где разрушает мембрану лизосом за счет сдвига pH внутри органоида [21], [22].
Эффективность поликатионов зависит от их молекулярной массы. Полиэтиленимин (ПЭИ) и полиамидоамин с высокой молекулярной массой отлично проникают в клетку, однако сами полимеры способны повреждать плазматическую мембрану, вызывая гибель клеток. Полимеры малой длины обладают минимальной токсичностью, но их эффективность невелика. Сополимеризация с гидрофобными молекулами, такими как ПЭГ, улучшает свойства носителя. Препарат ICS-283 компании Intradigm представляет собой сополимер ПЭИ, ПЭГ и пептида Арг—Гли—Асп, несущий киРНК к фактору ангиогенеза VEGF. В доклинических испытаниях показана высокая эффективность препарата [21].
Один из первых «натуральных» поликатионов — пептид поли-L-лизин — малоэффективен в немодифицированном виде, поскольку расщепляется лизосомальными протеазами, не разрушая оболочку эндосомы.
Другой широко используемый поликатион — хитозан (производное натурального полимера хитина) — слишком сильно взаимодействует с РНК и плохо диссоциирует внутри клеток. Модификация полимера по гидроксильной группе (С-3) и аминогруппе (С-2) гидрофобными молекулами жирных или жёлчных кислот повышает сродство полимера к клеточной мембране и одновременно ослабляет взаимодействие с киРНК [22].
Наномицеллы: совместить несовместимое
Таким образом, перспективнее всего использовать комбинированные полимеры, содержащие и гидрофобные, и заряженные группы. Такие молекулы получили название амфифильных (от греч. amphi — «двойственный») полимеров .
Подробнее о таких явлениях, как гидрофобность и амфифильнось, читайте в статье «Физическая водобоязнь» [23].
В водном растворе они самоорганизуются в наномицеллы, состоящие из гидрофобного «ядра» и заряженной «оболочки» из свободных хвостов полиэлектролита. Помимо преимущества наномицелл по основным характеристикам, они обладают и качественно новым свойством носителей. В оболочке могут располагаться молекулы РНК, а в гидрофобном ядре — нерастворимые соединения, например, некоторые антибиотики. РНК-интерференция рассматривается как вспомогательный элемент терапии рака, в дополнение к уже имеющимся методам. В частности, она способна подавить механизмы резистентности опухоли, повысив эффективность химиотерапии [22].
Активность транспортеров из группы белков множественной лекарственной устойчивости (multi-drug resistance, MDR) является одним из главных механизмов резистентности. Сверхэкспрессия гена белка P-gp (MDR1) из данного семейства колеблется от 30% до 70% в разных типах опухолей. Снижение экспрессии MDR1 возвращает чувствительность клеток к антибиотику. Однако для достижения кооперативного действия важно одновременное попадание обеих молекул в опухолевую клетку. При введении киРНК и антибиотика «по отдельности» вероятность того, что обе молекулы синхронно проникнут в одну и ту же клетку, слишком низка. Для проверки данной концепции были созданы трехслойные наночастицы.
В водном растворе полимер N-сукцинилхитозан–поли-L-лизин–пальмитат (NSC-PLL-PA) образует наномицеллы. Они доставляют в клетки доксорубицин и киРНК MDR1 одновременно (рис. 7) [24].
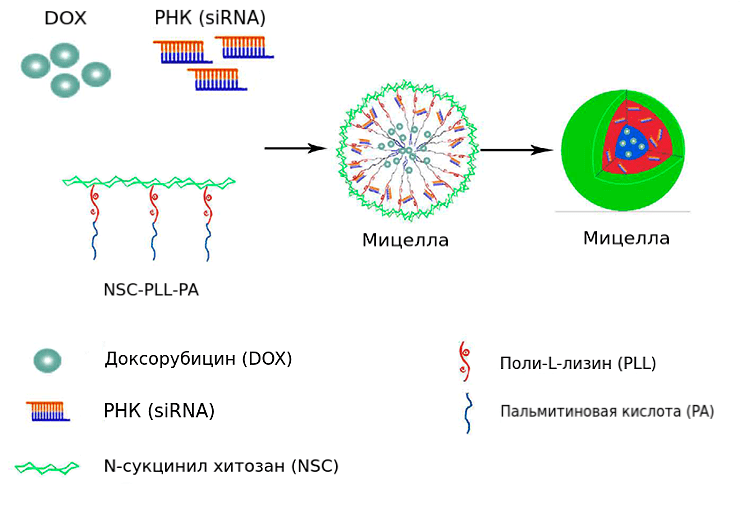
Рисунок 7. Строение амфифильной мицеллы для совместного транспорта киРНК и доксорубицина. В ядре находится пальмитат, в промежуточном слое — поли-L-лизин, а оболочка образована N-сукцинилхитозаном. При смешивании полимера с гидрохлоридом доксорубицина и киРНК MDR1 они распределяются в ядре и промежуточном слое соответственно.
Противоопухолевая активность комбинированного препарата в два раза выше, чем у мицелл с доксорубицином. Количество всевозможных комбинаций полимеров практически не ограничено и открывает широкий простор для исследователей.
Циклодекстриновые наночастицы: «бублик» для доставки лекарств
Очень высоким потенциалом для адресной доставки обладает сополимер поликатиона и циклодекстрина. Циклодекстрины — кольцевые олигомеры глюкозы с гидрофобной полостью [25]. В природе циклодекстрины встречаются как продукты неполного ферментативного гидролиза крахмала. Шестичленный α-циклодекстрин и семичленный β-циклодекстрин одобрены FDA для медицинского применения. Сополимеры циклодекстрина и поликатионов могут «сворачиваться» с образованием наночастиц в присутствии отрицательно заряженных молекул РНК. Находящиеся на поверхности циклодекстрины представляют собой ячейки, в которые могут помещаться гидрофобные молекулы. Ранее было обнаружено, что гидрофобная полость β-циклодекстрина вмещает в себя трициклический углеводород адамантан, образуя стабильный комплекс. К молекуле адамантана могут «довешиваться» те или иные молекулы, при этом он выступает в роли адаптера. В качестве производных адамантана могут использоваться адамантан-ПЭГ или адамантантрансферрин.
Первый препарат киРНК на основе циклодекстриновых наночастиц — CALAA-01 с киРНК к гену RRM2 (рис. 8) — проходит клинические испытания.
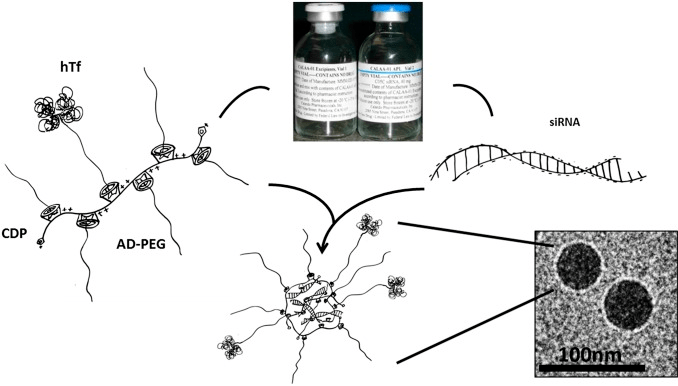
Рисунок 8. Структура препарата CALAA-01 на основе циклодекстриновых наночастиц. CALAA-01 состоит из четырех компонентов, входящих в состав двух растворов. В первом растворе содержится сополимер поликатиона и β-циклодекстрина (CDP), ячейки которого служат матрицей для адамантан-ПЭГ (AD-PEG) и адамантантрансферрина (hTf). Второй раствор содержит сайленсинг киРНК к гену рибонуклеотидредуктазы RRM2. При смешивании растворов происходит конденсация поликатиона и нуклеиновой кислоты с образованием 75-нанометровых наночастиц.
В ходе испытаний была показана высокая безопасность и эффективность доставки киРНК, а также снижение экспрессии RRM2 на 50% [26].
Белковые наночастицы
Некоторые белки (например, альбумин) способны образовывать наночастицы. Препарат на основе альбуминовых наночастиц называется «Абраксан» и содержит действующее вещество — паклитаксел. Это алкалоид с противоопухолевым эффектом, открытый примерно в то же время, что и доксорубицин. Однако он имеет серьезный недостаток, ограничивающий его применение. Молекулы паклитаксела гидрофобны, и чистый антибиотик нерастворим в воде. Ранее для введения использовался раствор препарата в кремофоре (производном касторового масла). Инъекции кремофора сами по себе вызывают тяжелые аллергические реакции, поэтому требовался прием пациентом иммуносупрессоров. В «Абраксане» паклитаксел помещен внутрь 130-нанометровой наночастицы альбумина (рис. 9). Использование «Абраксана» позволяет отказаться от применения кремофора. Также он обладает более высокой биодоступностью и активно проникает в клетку, в отличие от свободного паклитаксела. Транспорт «Абраксана» через мембрану происходит за счет взаимодействия альбумина с рецептором альбондином (gp60).
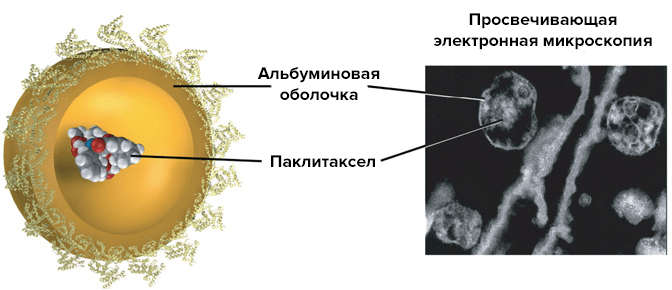
Рисунок 9. Строение наночастиц «Абраксана»
Наночастицы золота
Помимо органических наночастиц, для адресной доставки активно применяют наночастицы металлов и оксидов — наночастицы золота и магнитные наночастицы (рис. 10). Металлы и их оксиды токсичны для организма, поэтому применяемые в медицине наночастицы несут защитную оболочку из полимера. Транспортируемые молекулы содержатся либо в составе оболочки, либо закреплены на поверхности через молекулу-линкер. Подробно ознакомиться с применением наночастиц золота можно в статье «Мал золотник, да дорог, или об использовании золотых наночастиц в бионанотехнологиях» [27].
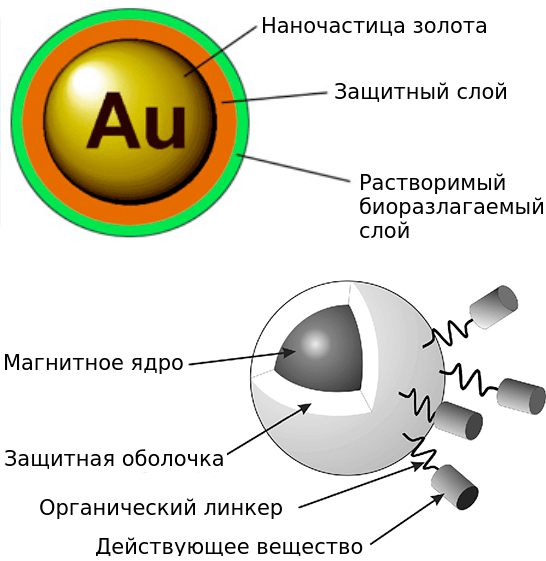
Рисунок 10. Строение наночастиц золота, применяемых в медицине
В инновационном препарате «Ауримун» (Aurimune) 27-нанометровые наночастицы золота использованы в качестве носителя для белка фактора некроза опухоли (tumour necrosis factor, TNF). Препарат существенно расширяет возможности TNF в лечении рака. Свободный TNF был получен еще в 1980-х годах и продемонстрировал высокую противоопухолевую активность: считается, что он разрушает сосуды опухоли. Это нарушает питание раковых клеток и увеличивает проницаемость опухоли для антибиотиков. Однако избыточный TNF вызывает ряд побочных эффектов, таких как гипотония, гепатотоксичность и физическое недомогание. Доставка с помощью наночастиц снимает эти эффекты. Фармакологи сравнивают Aurimune с троянским конем, который преодолевает границы крепости опухоли и «тащит» за собой химиотерапевтические препараты. Развивая данный подход, разработчики добавили на поверхность «Ауримуна» упомянутый ранее паклитаксел. Полученный препарат второго поколения проходит доклинические испытания.
В отличие от органических наночастиц, наночастицы металлов и их соединений могут преобразовывать оптическое излучение в тепло за счет эффекта поверхностного плазмонного резонанса. На основании этого разработали две терапии — фототермическую и фотодинамическую. Первая основана на нагревании клеток, «поглотивших» наночастицу под действием БИК-излучения (БИК — ближняя инфракрасная область). Вторая терапия заключается во введении молекул-фотосенсибилизаторов, химически связанных с наночастицей. При активации светом, они реагируют с кислородом внутри клетки с образованием активных форм кислорода, которые запускают апоптоз (программируемую клеточную смерть). Обе активности наночастиц стимулируются электромагнитным излучением, поэтому перспективным подходом является комбинация указанных методов в единую терапию [27].
Препарат «Ауролаз» (Aurolase) — это комбинированные наночастицы из кремния и золота раковинообразной формы, обернутые в оболочку из ПЭГ. Препарат прошел клинические испытания для фототермической терапии опухолей легких, головы и шеи. В настоящее время препарат проходит испытания для терапии рака простаты. Поскольку «голые» частицы не несут действующего вещества, «Ауролаз» не обладает токсичностью, а направленное воздействие исключает повреждение здоровых тканей.
Магнитные наночастицы
Идея использовать магнитные наночастицы для доставки биоактивных молекул была предложена в 1970-х годах. С помощью магнитного поля частицы собираются в нужной точке в организме. Для этого разработали модифицированные аппараты МРТ. В качестве магнитного материала могут использоваться магнетит (Fe3O4), маггемит (Fe2O3), смешанные оксиды железа и других переходных металлов [28].
Магнитные наночастицы применяли в клинике много лет в основном как контрастирующие агенты для магнитно-резонансной томографии. Чтобы использовать их в качестве носителя для нуклеиновых кислот и лекарств, требуется создание подходящей защитной оболочки.
В настоящее время проведено всего несколько клинических испытаний с применением магнитных наночастиц. В 1996 году они были использованы для транспорта эпирубицина. Наночастицы были стабилизированы оболочкой из полимера глюкозы, на который сорбировался эпирубицин. Коллоидный раствор наночастиц представлял собой ферромагнитную жидкость, которая вводилась мышам в виде инъекций и направлялась в опухоль под действием магнитного поля (рис. 11) [29]. Магнитные наночастицы способны генерировать тепло в изменяющемся магнитным поле или БИК (так же, как и наночастицы золота). Терапия Nano-Cancer заключается во введении в опухоль 12-нанометровых наночастиц Fe3O4 с защитной оболочкой из полимера аминосилана. Установлено, что комбинированное воздействие магнитного поля и БИК создает исключительно высокое нагревание и эффективно подавляет рост опухоли [30].
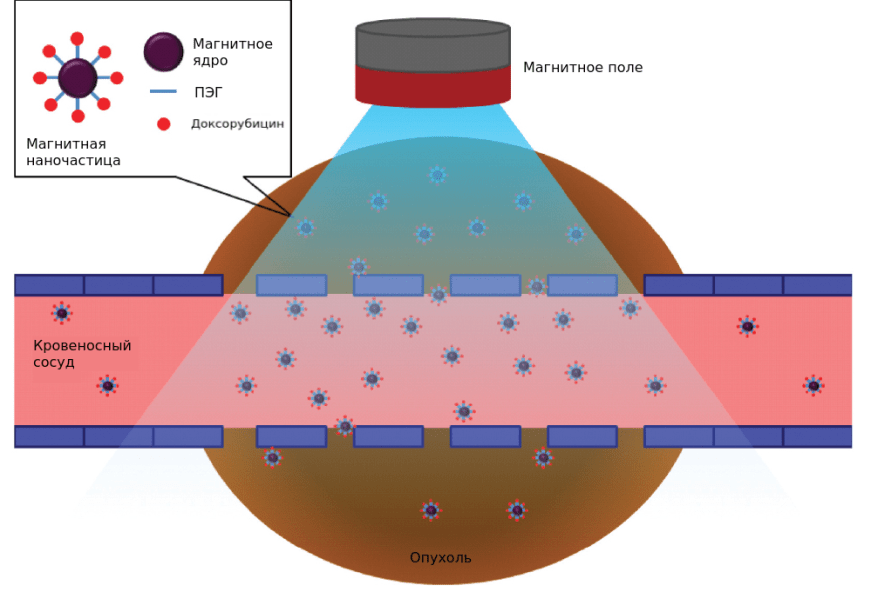
Рисунок 11. Магнитное поле направляет магнитные наночастицы в опухоль
Наночастицы на основе графена
Графен — одномерный «лист» из атомов углерода. Начиная с 2008 года, производные графена — оксид графена (GO) и восстановленный оксид графена (RGO) — тестируются в качестве носителей для доставки лекарств. Они обладают исключительными физико-химическими свойствами: высокой площадью поверхности и делокализованными «ароматическими» электронами. Связывание препарата с носителем может осуществляться ковалентно через линкеры и/или через π-π стэкинг. Стэкинг позволяет взаимодействовать с гидрофобными молекулами, такими как доксорубицин, а также нуклеиновыми кислотами [31].
Наличие в составе полимеров большого количество ОН- и эпокси-групп открывает широкие возможности для модификации полимера. На основе оксида графена был описан примечательный препарат с контролируемым высвобождением доксорубицина (рис. 12). Его структура напоминает сэндвич из двух слоев оксида графена. Между слоями располагаются молекулы доксорубицина. К поверхностям «сэндвича» присоединены одноцепочечные молекулы ДНК, свободные концы которых сцеплены через АТФ-аптамер, играющий роль «застежки». В присутствии АТФ он меняет свою конформацию, и «застежка» расцепляется, выпуская доксорубицин [32].
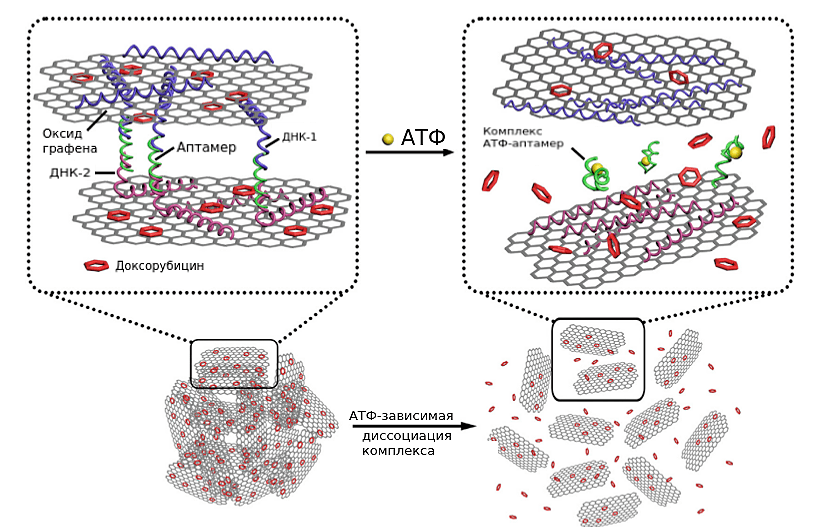
Рисунок 12. Наночастицы оксида графена с АТФ-зависимым высвобождением доксорубицина. Свободные концы ДНК-1 и ДНК-2 комплементарно взаимодействуют с АТФ-аптамером. Таким образом образуется двухслойная структура из оксида графена. На слои оксида графена адсорбированы молекулы доксорубицина.
Для транспорта киРНК могут использоваться комбинированные полимеры оксида графена и полиэлектролитов. На поверхность оксида графена нанесли цепочки полилизина, на свободном конце которых был транспортный пептид RGDS, стимулирующий активный транспорт внутрь клеток за счет взаимодействия с рецептором. Комбинация электростатических и стэкинг-взаимодействий с нуклеиновыми кислотами создало высокую «емкость» этих наночастиц для киРНК. С помощью такой трехслойной структуры в опухоль была доставлена киРНК к гену ангиогенеза VEGF (рис. 13) [33].
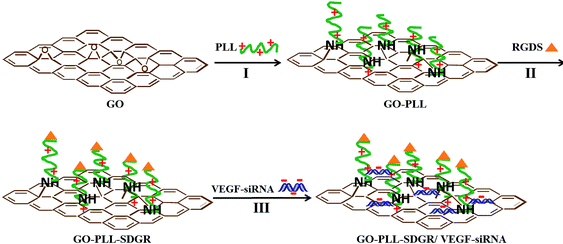
Рисунок 13. Комбинированные наночастицы оксида графена и поли-L-лизина для транспорта сайленсинг РНК
Способность связываться как с нуклеиновыми кислотами, так и с антибиотиками делает графеновые материалы перспективными для комбинированной терапии по аналогии с наномицеллами.
Рынок адресной доставки
Не обойдем вниманием и экономический аспект внедрения наночастиц в терапию рака. Число публикаций по теме targeted drug delivery постоянно растет. В 2017 году вышло более двух тысяч таких публикаций, и было проведено 17 клинических испытаний. На сегодняшний день в авангарде разработки нанолекарств остаются небольшие стартапы, в то время как крупные фармацевтические компании обходят данную тематику. Причина —высокая стоимость производства препаратов. Однако более аккуратный расчет стоимости лечения, включающий госпитализацию и уход за больным в процессе химиотерапии, показал, что использование препаратов на основе наночастиц приводит к значительной экономии. Видимо, число таких исследований пока что недостаточно велико, чтобы побудить фармацевтических гигантов к выходу на этот рынок. Однако ситуация меняется уже сейчас, и к 2021 году ожидается рост рынка технологий лекарственной доставки на 24% по сравнению с состоянием на 2018 год [34–36].
Заключение
Сегодня мы регулярно слышим о новых возможностях, которые нам открывают нанотехнологии. Но как полноценно применить полученный опыт в лечении раковых заболеваний? Улучшить терапию можно путем совершенствования «системы наведения» и механизмов ликвидации раковой клетки.
Полагаю, что наночастицы будут иметь в составе несколько модулей и станут полноценными нанороботами [37]. Можно представить, как модули «системы наведения» такого наноробота будут ингибировать модуль ликвидации и диссоциировать от него по мере получения тревожного сигнала от клетки. Им может быть концентрация какого-нибудь внутриклеточного вещества-маркера опухолевых клеток. Для этих целей пригодятся антитела или аптамеры [38], [39]. Несколько «узнающих» модулей совместно контролируют модуль ликвидации по принципу логических операторов «И»/«ИЛИ» [40].
Управлять уничтожением клетки можно, либо используя описанное контролируемое высвобождение антибиотика, либо какой-нибудь ингибируемый фермент, производящий, к примеру, свободные радикалы [32], [41].
Таким образом, наноробот, попав внутрь клетки, сможет самостоятельно принимать решение о ее дальнейшей судьбе.
Литература
- Нанотехнологии — новый союзник в войне с болезнями;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Ventola C.L. (2017). Progress in nanomedicine: approved and investigational nanodrugs. P. T. 42, 742–755;
- Наномеханика для адресной доставки лекарств – насколько это реально?;
- Наномедицина будущего: трансдермальная доставка с использованием наночастиц;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Вакцинация в контексте «нано»;
- «Мал золотник, да дорог», или об использовании золотых наночастиц в бионанотехнологиях;
- Волшебные пузырьки — липосомы цифелина;
- Нанотехнологии — новый союзник в войне с болезнями;
- Вирусы-платформы: яд во благо;
- Рак молочной железы с семейной историей;
- Порочный цикл: от рака молочной железы до костных метастазов;
- Juan Lao, Julia Madani, Teresa Puértolas, María Álvarez, Alba Hernández, et. al.. (2013). Liposomal Doxorubicin in the Treatment of Breast Cancer Patients: A Review. Journal of Drug Delivery. 2013, 1-12;
- Alexandre Yersin, Toshiya Osada, Atsushi Ikai. (2008). Exploring Transferrin-Receptor Interactions at the Single-Molecule Level. Biophysical Journal. 94, 230-240;
- Обо всех РНК на свете, больших и малых;
- Есть ли смысл в антисенсах?;
- Luc Wasungu, Dick Hoekstra. (2006). Cationic lipids, lipoplexes and intracellular delivery of genes. Journal of Controlled Release. 116, 255-264;
- John C. Burnett, John J. Rossi. (2012). RNA-Based Therapeutics: Current Progress and Future Prospects. Chemistry & Biology. 19, 60-71;
- Gollob J.A. (2011). ALN-VSP02 phase 1 trial update. Demonstrating RNAi in man. Dana-Farber Cancer Institute;
- Лаборатория инженерии биополимеров: симбиоз длиною в десятилетия;
- Gemma Navarro, Jiayi Pan, Vladimir P. Torchilin. (2015). Micelle-like Nanoparticles as Carriers for DNA and siRNA. Mol. Pharmaceutics. 12, 301-313;
- Физическая водобоязнь;
- Chun-ge Zhang, Wen-jing Zhu, Yang Liu, Zhi-qiang Yuan, Shu-di Yang, et. al.. (2016). Novel polymer micelle mediated co-delivery of doxorubicin and P-glycoprotein siRNA for reversal of multidrug resistance and synergistic tumor therapy. Sci Rep. 6;
- Циклодекстрины — уникальные молекулы для создания современных лекарств и не только...;
- J. E. Zuckerman, I. Gritli, A. Tolcher, J. D. Heidel, D. Lim, et. al.. (2014). Correlating animal and human phase Ia/Ib clinical data with CALAA-01, a targeted, polymer-based nanoparticle containing siRNA. Proceedings of the National Academy of Sciences. 111, 11449-11454;
- «Мал золотник, да дорог», или об использовании золотых наночастиц в бионанотехнологиях;
- Живые магниты: применение бактериальных магнетосом;
- Dobson. (2008). Magnetic nanoparticles for gene and drug delivery. IJN. 169;
- Ana Espinosa, Riccardo Di Corato, Jelena Kolosnjaj-Tabi, Patrice Flaud, Teresa Pellegrino, Claire Wilhelm. (2016). Duality of Iron Oxide Nanoparticles in Cancer Therapy: Amplification of Heating Efficiency by Magnetic Hyperthermia and Photothermal Bimodal Treatment. ACS Nano. 10, 2436-2446;
- Thabitha P. Dasari Shareena, Danielle McShan, Asok K. Dasmahapatra, Paul B. Tchounwou. (2018). A Review on Graphene-Based Nanomaterials in Biomedical Applications and Risks in Environment and Health. Nano-Micro Lett.. 10;
- Ran Mo, Tianyue Jiang, Wujin Sun, Zhen Gu. (2015). ATP-responsive DNA-graphene hybrid nanoaggregates for anticancer drug delivery. Biomaterials. 50, 67-74;
- Lulu Ren, Yifan Zhang, Chunying Cui, Yanzhao Bi, Xu Ge. (2017). Functionalized graphene oxide for anti-VEGF siRNA delivery: preparation, characterization and evaluation in vitro and in vivo. RSC Adv.. 7, 20553-20566;
- Omid C. Farokhzad, Robert Langer. (2009). Impact of Nanotechnology on Drug Delivery. ACS Nano. 3, 16-20;
- Rita Bosetti. (2015). Cost–effectiveness of nanomedicine: the path to a future successful and dominant market?. Nanomedicine. 10, 1851-1853;
- Rita Bosetti, Gabriella Ferrandina, Wim Marneffe, Giovanni Scambia, Lode Vereeck. (2014). Cost–effectiveness of gemcitabine versus PEGylated liposomal doxorubicin for recurrent or progressive ovarian cancer: comparing chemotherapy with nanotherapy. Nanomedicine. 9, 2175-2186;
- «Врачи-нанороботы» — миф или реальность?;
- Краткая история открытия и применения антител;
- Антитело: лучший способ распознать чужого;
- Язык программирования: «ДНК»;
- Сказка-комикс о великой битве между радикалами и антиоксидантами.