Аутоиммунные заболевания нервной системы: как сдержать нечаянное зло?
26 июля 2024
Аутоиммунные заболевания нервной системы: как сдержать нечаянное зло?
- 4198
- 0
- 14
«Тому, кто сражается с монстрами, следует остерегаться, чтобы самому при этом не стать монстром!»
Фридрих Ницше
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
История знает немало примеров, когда доблестные солдаты и воины, стоявшие на страже государства, вовлекались в смуту, мятежи и бунты. Междоусобицы разрушали всю структуру общества, их жертвами становились молодые, сильные, инициативные люди. Догадывались ли вы, что похожая история иногда происходит даже внутри человека? Вооруженные и дисциплинированные популяции иммунных клеток защищают организм от инфекций и опухолей, но способны совершить атаку против него самого, в том числе против нервной системы. В отличие от нейродегенеративных заболеваний, аутоиммунные заболевания нервной системы обычно развиваются остро и подостро у молодых людей — они лишаются счастливых дней детства и юности, работоспособности и самореализации. Этот факт, как минимум из экономических соображений, способствовал уникальному для неврологии прорыву в разработке методов лечения аутоиммунных заболеваний нервной системы.
Нейрофармакология

Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Партнер спецпроекта — биотехнологическая компания LEENERS. Современные исследовательские лаборатории LEENERS — это место, где совершаются научные открытия и рождаются лекарственные препараты нового поколения.
Причины развития иммунной агрессии в отношении нервной системы
Иммунная система — это вооруженные силы организма в борьбе с инородными и опасными объектами. История ее эволюции насчитывает миллиард лет; внутри человека 1,5-килограммовая армия из почти 2 триллионов стремительных иммунных клеток потребляет около 15–30% от всей энергии в организме, использует около 1600 генов человеческой ДНК (рис. 1, подробнее об иммунной системе читайте в этой статье [1]). История подсказывает, что иногда такая военная мощь придает импульс мятежам, революциям, переворотам...
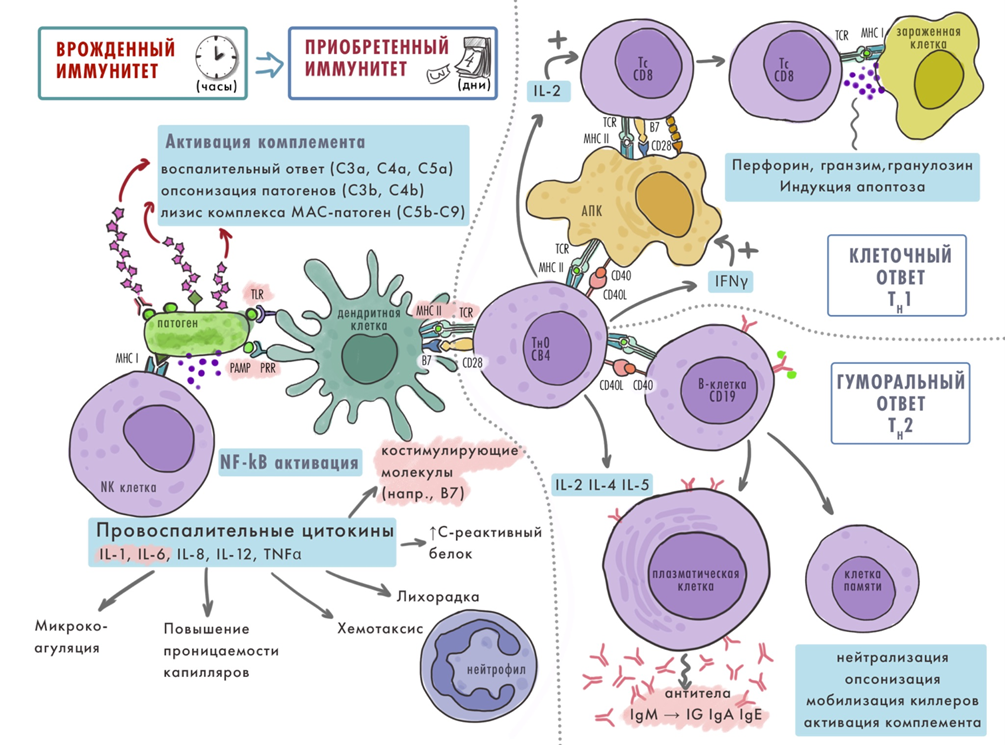
Рисунок 1. Краткая схема врожденного и приобретенного иммунного ответа в человеческом организме, на которой представлены основные клеточные и гуморальные факторы.
CD — кластер дифференцировки; IFN — интерферон; IG — иммуноглобулины; IL — интерлейкин; МАC — комплекс, атакующий мембрану; MHC — главный комплекс гистосовместимости; NK — натуральная клетка-киллер; PAMP — патоген-ассоциированный молекулярный паттерн; PRR — рецептор опознавания паттерна; TCR — Т-клеточный рецептор; TLR — толл-подобный рецептор; АПК — антиген-презентирующая клетка; СРБ — C-реактивный белок.
Geeky medics, с изменениями
Изначально считалось, что иммунная система лишь помогает нервной ткани в борьбе с инфекциями и опухолями, но не приносит ей вреда. С открытием аутоиммунных заболеваний нервной системы, поражающих своей стремительностью и силой клинических проявлений, стало ясно, что контакт нервной и иммунной систем носит неоднозначный характер. Дело в том, что нервная ткань на генетическом уровне заплатила низким потенциалом к регенерации за свою уникальную клеточную архитектуру, способность к созданию и проведению электричества. Нервные клетки иногда восстанавливаются, вопреки старой поговорке; но восстанавливаются редко, не все и не в полном объеме. Иммунная система же исполняет свой долг с сопутствующим ущербом в виде разрушения скомпрометированных тканей. Несмотря на разный «характер», обе системы являются регуляторными, то есть координируют работу других систем, в том числе друг друга. Поэтому у них есть схожие сигнальные молекулы и пути, а полное устранение контактов между ними приводит к патологии ([2], подробнее об этом читайте здесь [3]). Но когда взаимодействуют две системы, одна из которых не может полноценно восстанавливаться, а вторая — создана, чтобы разрушать, любая осечка ведет к тяжелым последствиям.
От «нечаянного зла» иммунных клеток, циркулирующих в периферической крови, хрупкую нервную систему защищает гематоэнцефалический барьер (ГЭБ), состоящий из эндотелиальных клеток капилляров и астроцитов, соприкасающихся своими базальными мембранами. Между кровью и периферическими нервами функционирует гематоневральный барьер (ГНБ): эндотелий сосудов нерва окружен снаружи перицитами (о строении и функциях ГЭБ можно прочитать в предыдущих статьях нашего спецпроекта: «Ликбез по ЦНС» [4] и Сквозь тернии к нервам: особенности доставки лекарств в нервную систему [5]). Современные исследования позволили приоткрыть этот «железный занавес» (рис. 2) [6]. Выяснилось, что во время сна между базальными мембранами эндотелия и астроцита появляются свободные пространства Вирхова–Робина — основа глимфатической системы [7], по которой цереброспинальная жидкость, омывающая мозг снаружи, проникает в его глубокие отделы, омывает нервную ткань и далее направляется в венозный кровоток, менингеальные и глубокие шейные лимфатические сосуды. Выявлены области повышенной проницаемости ГЭБ и ГНБ — здесь присутствуют участки фенестрированного «продырявленного» эндотелия без астроцитов (например, вокруг третьего желудочка мозга — в циркумвентрикулярной зоне, вокруг четвертого желудочка мозга — в зоне area postrema, вокруг корешков спинного мозга, из которых формируются нервы). Ученые научились управлять проницаемостью гематоэнцефалического барьера (например, с помощью фокусированного ультразвука [8) и выяснили, что транзит иммунных клеток между нервной системой и периферическим кровотоком происходит в норме даже при отсутствии нейровоспаления [2].
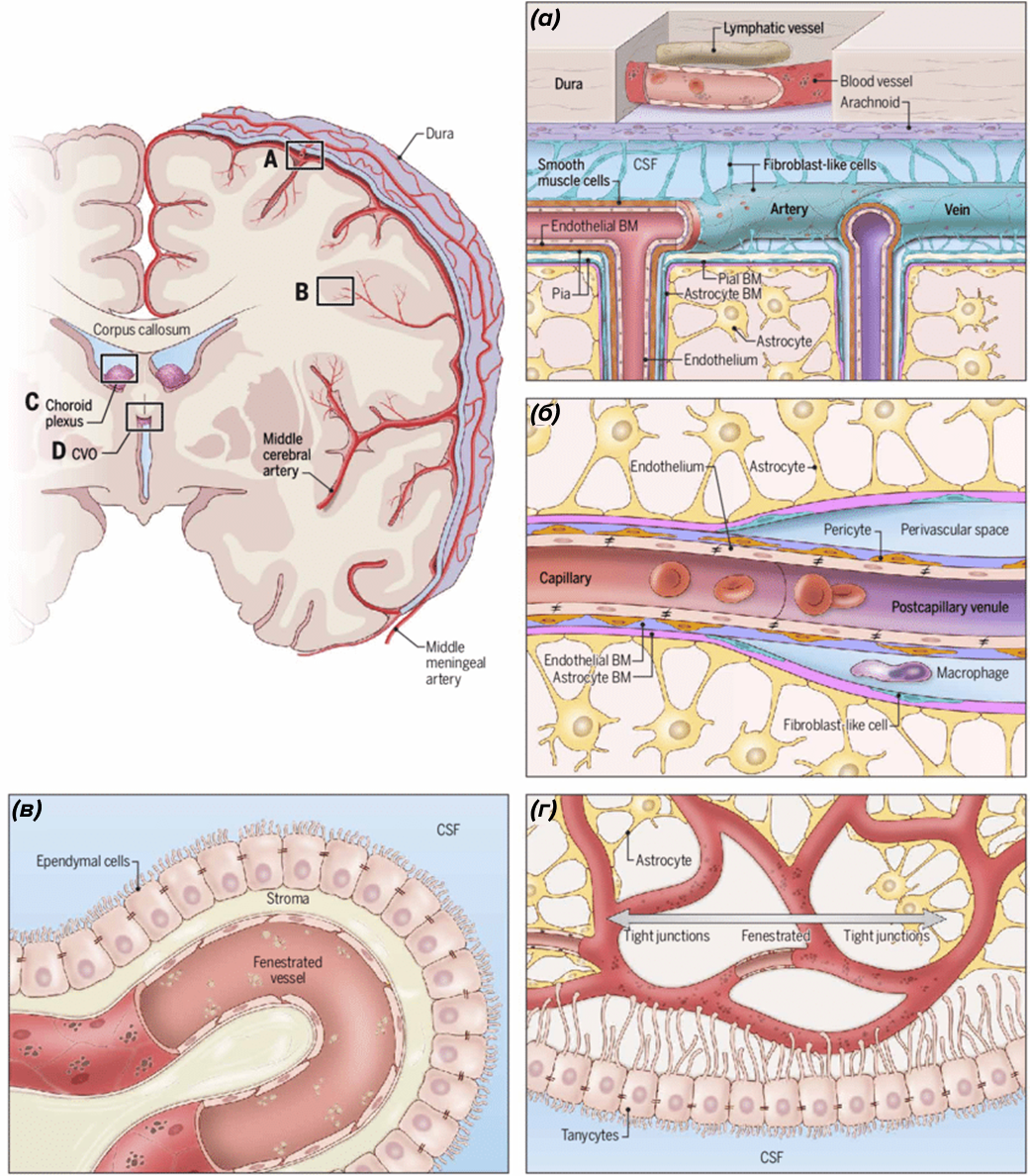
Рисунок 2. Структурные особенности взаимодействия крови, лимфы, цереброспинальной жидкости и нервной ткани в обход гематоэнцефалического барьера:
(а): в твердой мозговой оболочке (белая) расположены менингеальные лимфатические сосуды, которые имеют контакт с цереброспинальной жидкостью (через венозные синусы) и мозговой тканью (через глимфатическую систему) — отсюда иммунные клетки шейных лимфоузлов получают «наводку» по подозрительным антигенам в нервной системе;
(б): через глимфатическую систему внутримозговых венул (голубая) активированные иммунные клетки периферической крови могут попытаться проникнуть в нервную ткань или хотя бы выделить в нее свои цитокины и антитела С. Через сосудистые сплетения желудочков иммунные факторы могут попытаться проникнуть из периферического кровотока в желудочки мозга (голубой);
(г): в циркумвентрикулярной зоне и area postrema есть капилляры, не покрытые астроцитами — возникает прямой контакт периферической крови и нервной ткани, удобный для проникновения иммунных факторов.
Эти открытия способствовали развитию теории «периферического многофакторного программирования иммунитета», согласно которой различные стрессовые факторы на уровне периферической крови влияют на деление, созревание и уровень активности провоспалительных, противовоспалительных и регуляторных иммунных клеток, прежде чем они смогут избирательно проникнуть через гистологические барьеры и установить прямой контакт с нервной системой. Иными словами, если «многоликая армия» клеток-защитников переживает «травмирующий опыт» в виде инфекции, опухоли, гормонального скачка, она может «переходить на темную сторону» и нападать на ни в чем не повинную нервную систему.
Для большинства аутоиммунных заболеваний ЦНС доказана роль предшествующей вирусной или бактериальной инфекции либо кишечной микрофлоры в запуске «несанкционированной иммунной атаки». Дело в том, что микроорганизмы используют различные стратегии эвазии, то есть избегания иммунного ответа — они управляют делением и созреванием иммунных клеток, выделяя сигнальные молекулы, а также маскируют компоненты своих оболочек под молекулы организма-хозяина (такая мимикрия приводит к последующей перекрестной активации иммунитета собственными антигенами). Опухолевые клетки из-за нестабильности своего генома при бесконтрольном делении также могут синтезировать компоненты нервной ткани, сбивая иммунную систему с правильного пути.
Судьба аутоиммунного ответа определяется и на генетическом уровне. В геноме созревающих лимфоцитов, как в карточной колоде, происходит случайная V(D)J-перестройка кластеров генов [9], контролирующих иммунитет, — в результате организм насыщается миллионами клеток с уникальными по строению MHC-комплексами, Т- и В-клеточными рецепторами, ответственными за распознавание не только «чужих», но и «своих» антигенов. Хотя существуют способы «отстрела» клеток, имеющих аутоиммунный потенциал, иногда эта система дает осечку.
Наконец, иммунный ответ способен поддерживаться по механизму положительной обратной связи — первичная иммунная атака разрушает клетки, обнажая внутриклеточные, обычно скрытые от «глаз» иммунитета компоненты, что вызывает еще большую активацию и хроническую трансформацию иммунного ответа. Неудивительно, что большинство аутоиммунных заболеваний нервной системы носят хронический и интенсивный характер [10].
Современная классификация аутоиммунных заболеваний нервной системы
Начиная с 19 века, эпохи «отца неврологии» Жана Мартена Шарко и его блистательной плеяды учеников, не угасает живой интерес к аутоиммунным заболеваниям нервной системы — описано более 30 различных нозологий, и список продолжает пополняться в 21 веке (рис. 3) [10]. Врачам очень важно различать аутоиммунные заболевания ЦНС, несмотря на их сходство (так же, как опытный грибник должен отличать истинные грибы от ложных), основываясь на клинических наблюдениях, методах нейровизуализации и лабораторной диагностики, так как лечение этих заболеваний различается и при неверном диагнозе может серьезно навредить пациенту.
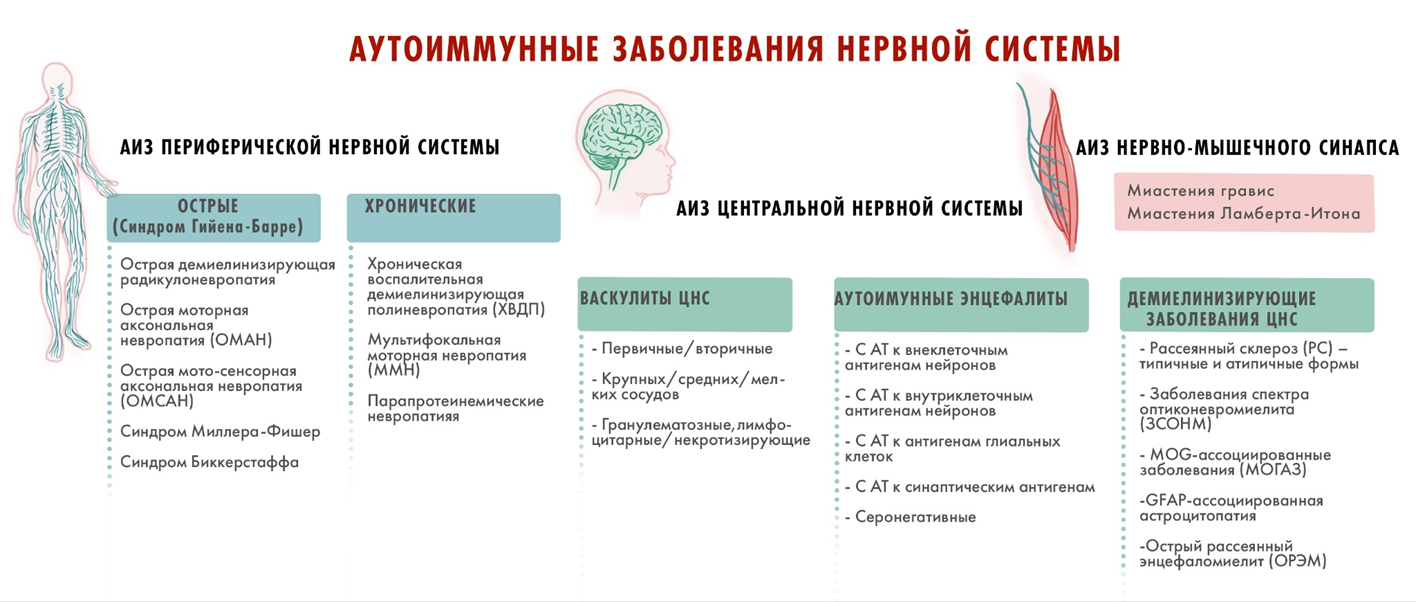
Рисунок 3. Классификация аутоиммунных заболеваний нервной системы.
Чаще всего иммунные клетки пытаются «раздеть» нейроны головного или спинного мозга, разрушая их миелиновую оболочку или нападая на их «слуг» — глиальные клетки, регулирующие синтез и созревание миелина. Самым распространенным демиелинизирующим заболеванием ЦНС, рассеянным склерозом (РС), болеют более 3 млн человек в мире (в самом расцвете сил: средний возраст — 29–33 года). Термин «рассеянный» означает появление небольших очагов демиелинизации, т.е. «раздевания» нейронов, в разных участках головного и спинного мозга в разное время (свежие очаги отличаются от старых накоплением контрастного вещества на МРТ). В результате пациент страдает от совокупности чувствительных, двигательных, психоэмоциональных нарушений, варьирующих по тяжести в течение дней, месяцев, лет. Вокруг миелиновых оболочек нейронов обнаруживаются «прожорливые» Т-лимфоциты и макрофаги. В мягкой мозговой оболочке формируются скопления активированных В-лимфоцитов, чьи антитела к компонентам миелина выделяются изолированно в цереброспинальную жидкость. Показано влияние семейств герпес-вирусов, ретровирусов, полиморфизмов в более чем 200 генах, недостатка витамина Д на программирование иммунного ответа при РС. Заболевание чаще всего протекает как чередование обострений и ремиссий (ремиттирующая форма), когда пациент практически полностью восстанавливается, особенно при своевременном лечении, что указывает на восстановление миелиновой оболочки при живом нейроне. Однако по достижении критической точки до 90% случаев ремиттирующего РС принимает форму нейродегенеративного заболевания (вторично-прогрессирующая форма). Обострения при этом могут отступать, но полного восстановления между ними уже не происходит. Реже РС изначально протекает по типу нейродегенеративного заболевания (первично-прогрессирующая форма). Прогрессирующее течение вызвано отмиранием нейронов и олигодендроцитов, которые в норме отвечают за восстановление миелиновых оболочек нейронов. Это приводит к тяжелой инвалидизации, которая трудно поддается лечению, как и при классических нейродегенеративных заболеваниях. Менее чем в 7% случаев течение РС принимает атипичный «злокачественный» характер: из-за одновременной атаки Т-клеток и аутоантител в короткие сроки происходит масштабная демиелинизация с неуклонным быстрым прогрессированием. Лечение форм РС отличается, поэтому для оценки динамики симптомов до и после обострений, на фоне проводимой терапии, используют шкалу EDSS (Расширенная шкала нарушений жизнедеятельности Куртцке) [11].
Если все очаги демиелинизации в головном и спинном мозге возникают единовременно, как и клинические проявления, то диагностируется другое заболевание — острый рассеянный энцефаломиелит (ОРЭМ). Он чаще поражает детей (у взрослых он протекает реже, но тяжелее) после перенесенной вакцинации или инфекции (корь, краснуха, паротит, герпес-вирусы, вирусы гепатитов и гриппа, стрептококки, микоплазмы и т.д.). В периферической крови происходит «всеобщая мобилизация» провоспалительных компонентов иммунной системы из-за «крайне вызывающей» химической структуры антигенов микроорганизмов. Развивается цитокиновый шторм, повреждающий защитные барьеры ЦНС, поэтому воспалительный процесс и демиелинизация при ОРЭМ протекают тяжелее, чем при РС: симптомы нарастают за несколько дней, проявляются лихорадкой, выраженными головными болями; возможно угнетение сознания, развитие психозов и эпилептических приступов. Из-за глубокого повреждения компонентов ГЭБ, ОРЭМ может осложняться массивной гибелью нервной ткани и сосудов с кровоизлияниями в зоны демиелинизации — например, при тяжелой летальной форме ОРЭМ, энцефалите Херста. Некоторые препараты, такие как противопаразитарный левамизол, способны стимулировать масштабную активацию Т-клеточного и В-клеточного иммунитета — несмотря на то, что этот препарат может вызывать тяжелые случаи ОРЭМ, он до сих пор свободно продается на территории нашей страны [12]!
Вторая по частоте форма демиелинизации (20–30%) — заболевания спектра оптиконевромиелита (ЗСОНМ), со средним возрастом начала 35–41 лет. В крови пациентов определяются антитела к аквапорину-4 — астроцитарному белку, регулирующему транспорт жидкости через глимфатическую систему. Каким образом это приводит к «раздеванию» нейронов, до конца не известно. В отличие от РС, это коварное заболевание протекает с немногочисленными, но более выраженными обострениями и последующим медленным неполным восстановлением, что указывает на раннее развитие нейродегенерации. Обострения могут провоцироваться вирусными инфекциями (вирусы простого герпеса, Эпштейна-Барр, эпидемического паротита). Вначале чаще происходит двустороннее повреждение зрительных нервов — тускнеет цветность картинки, потом быстро развивается слепота. Вторым частым проявлением ЗСОНМ является острый миелит — демиелинизация захватывает несколько сегментов шейного отдела спинного мозга, поэтому развивается выраженный паралич рук и ног, онемение всего туловища, нарушение мочеиспускания (симптомы сопоставимы с «травмой ныряльщика» — переломом шейного отдела позвоночника). Реже при ЗСОНМ повреждается головной мозг в зонах повышенной проницаемости ГЭБ — в area postrema — с развитием тошноты и неукротимой рвоты, либо в циркумвентрикулярной зоне, с нарушениями сна или эндокринными нарушениями [13].
Еще один пример антитело-опосредованного механизма демиелинизации — заболевания, ассоциированные с антителами к миелин-олигодендроцитарному гликопротеину (МОГАЗ). В отличие от ЗСОНМ, повреждаются не астроциты, а олигодендроциты, а спектр клинических проявлений очень широк — у детей они принимают ОРЭМ-подобную форму, у молодых людей (средний возраст: 25–35 лет) течет по типу РС или коркового воспаления с эпилептическими приступами (FLAMES-синдром), а у пожилых пациентов — по типу оптиконевромиелита, как при ЗСОНМ. У пациентов в сыворотке крови обнаруживаются МОГ-антитела. Интересно, что иногда дополнительно обнаруживаются антитела к нейронам, как при аутоиммунных энцефалитах (особенно против глутаматных NMDA-рецепторов, см. ниже). Как при монофазном, так и при ремиттирующем течении заболевания пациенты хорошо восстанавливаются после обострений — прогрессирующее течение нехарактерно для МОГАЗ, что указывает на сохранные механизмы восстановления миелина [14].
Иногда иммунные клетки «не церемонятся» и напрямую атакуют нейроны — развиваются аутоиммунные энцефалиты (АИЭ). Их систематическим изучением занимаются не более двух десятилетий, но уже сейчас известно, что по частоте и симптомам они сопоставимы с вирусными энцефалитами. АИЭ развиваются остро-подостро (до 3 месяцев) в виде гриппоподобного синдрома, далее присоединяется головная боль, угнетение сознания, эпилептические приступы и психическое расстройство (из-за которого пациенты нередко оказываются на учете у психиатра). Обострения сменяются ремиссиями, но постепенно присоединяются умственные, чувствительные, двигательные нарушения. В крови или цереброспинальной жидкости обнаруживаются антитела к различным компонентам нейронов и глиальных клеток. Выделяют АИЭ с антинейрональными антителами к поверхностным мишеням (NMDAR, AMPAR, GABAR, GlyR, mGluR и др.) — данные формы чаще возникают у молодых людей после вирусных инфекций, они хорошо отвечают на лечение. Очаги антитело-опосредованного повреждения в больших полушариях головного мозга проявляются эпилептическими приступами и психозами, нарушением сна и поведения. АИЭ с антинейрональными антителами к внутриклеточным мишеням (Ri, Yo-1, Yu, Hu, Ma и др.) или компонентам синапса (GAD, амфифизин) являются истинно паранеопластическими — где-то в организме у пациента зреет опухоль (рак легкого, молочной железы, яичников, лимфома Ходжкина и др.) и «легкомысленно» продуцирует антигены, напоминающие иммунным клеткам нейроны. Очаги воспаления формируются из-за прямой цитотоксической атаки Т-клеток преимущественно в стволе и мозжечке головного мозга. Симптоматика постепенно прогрессирует и плохо реагирует на лечение, поэтому таких пациентов направляют на онкопоиск, и лучшим лечением может быть удаление новообразования. Но вот «загвоздка» — долгое время у пациента могут не находить опухоль, а энцефалит с внутриклеточными антителами есть!
Больше 50% случаев АИЭ являются серонегативными, то есть имеют типичную клиническую, лабораторную инструментальную картину, но известные аутоантитела к нейронам и глии не обнаруживаются! Аутоиммунные энцефалиты стали в последнее время очень «модными» для изучения — многообразие их проявлений пересекается с демиелинизирующими заболеваниями ЦНС, эпилепсиями, органическими психическими расстройствами, даже с нейродегенеративными заболеваниями ЦНС, например, с атипичным паркинсонизмом. Хочется «привязать» такие нозологии к наличию антител, чтобы излечить пациентов иммунотерапией [15], [16].
При аутоиммунных васкулитах иммунные клетки повреждают нервную систему «обходным путем», т.е. опосредованно через атаку на стенки сосудов (чаще всего — артерий) разного калибра в головном и спинном мозге. Неадекватный иммунный ответ может быть «запрограммирован» хроническими инфекциями (герпес-вирусы, особенно вирус ветрянки, вирусы гепатитов, сифилис, туберкулез и др.), системными аутоиммунными заболеваниями (системная красная волчанка, болезнь Шегрена, ревматоидный артрит и др.), опухолевым процессом, приемом наркотиков, антибиотиков, лучевой и химиотерапией. Васкулиты ЦНС — одна из самых малоизученных групп аутоиммунных заболеваний нервной системы, так как современные методы диагностики (КТ-ангиография, МР-ангиография) не дают четких доказательств «иммунного преступления» в стенке сосудов, особенно мелких. Изучить процесс «напрямую», через микроскоп, затруднительно — для этого необходимо проводить забор кусочка ткани из головного или спинного мозга. На такое могут решиться только очень отчаянные пациенты и врачи, поэтому почти вся информация собрана патологоанатомами при изучении летальных исходов.
Клинические проявления зависят от калибра сосуда: васкулит крупных и средних сосудов ЦНС развивается чаще у людей после 50 лет и приводит к развитию острых инсультов и нарушению сознания из за прогрессирующего сужения просвета или тромбоза сосудов, а при васкулите мелких сосудов ЦНС (который еще называется ангиографически негативным) чаще страдают люди моложе 50 лет от прогрессирующих и рецидивирующих умственных, психоэмоциональных, двигательных нарушений, реже — эпилептических приступов. Для агрессивных форм васкулита ЦНС, плохо поддающихся лечению, характерно двустороннее поражение сосудов головного мозга с множественными кровоизлияниями, повторными инсультами, быстрым угнетением сознания. На основании микроскопического анализа выделяют гранулематозный васкулит ЦНС — до 60% случаев, чаще обусловленных хроническим иммунным ответом на отложение в стенке сосуда бета-амилоида (того самого, что накапливается в мозге и при болезни Альцгеймера). При лимфоцитарном васкулите ЦНС (до 30% случаев, чаще у детей) предшествующее воздействие вирусных агентов приводит к перекрестной активации лимфоцитов, реагирующих на компоненты стенок сосудов. Наконец, некротизирующие васкулиты ЦНС приводят к разрушению стенки сосуда по всей толщине, что становится причиной аневризм, кровоизлияний и нарушения кровообращения чаще на уровне мелких сосудов. Описание сотен пациентов с васкулитами ЦНС способствовало расширению представлений о смешанных энцефалопатиях — ученые стали активно изучать роль иммунных и сосудистых факторов для нейродегенеративных заболеваний с умственными, психическими и двигательными нарушениями, таких как болезнь Альцгеймера и болезнь Паркинсона [17], [18].
Периферическая нервная система, представленная нервами, сплетениями и корешками, также подвержена аутоиммунным атакам. Нарушение проницаемости гематоневрального барьера для аутоантител является основой для развития большой группы дизиммунных невропатий. Выделяют демиелинизирующие невропатии, когда из-за повреждения компонентов миелиновой оболочки и формирующих ее шванновских клеток происходит удлинение времени или затухание (блок) проведения электрического сигнала по нерву, а также аксональные невропатии, когда повреждается аксон нейрона, по которому проходит электрический импульс. Аксональные дизиммунные невропатии встречаются реже, но имеют худшее течение и прогноз, подобно вторичному дегенеративному процессу при аутоиммунном повреждении ЦНС.
При острых дизиммунных невропатиях заболевание манифестирует так резко, что пациенты называют точный день появления симптомов. Симптомы развиваются монофазно, менее чем за четыре недели, и проявляются синдромом Гийена–Барре (СГБ) — симметричным восходящим параличом (от ног через туловище к рукам), сопровождающимся иногда нарушением глотания и дыхания (каждый пятый переходит на искусственную вентиляцию легких). В крови пациентов выявляются антитела к сложным липидным компонентам миелина (ганглиозидам), а в цереброспинальной жидкости — значительно увеличенное количество белка, что указывает на ключевую повреждающую роль антител и белков комплемента. При гистологическом исследовании нервов обнаруживаются макрофаги, поедающие поврежденный миелин или аксоны, а также активированные Т-лимфоциты. Симптомам предшествует перенесенный иммунный стресс (инфекция с кишечной кампилобактерией, цитомегаловирусом, коронавирусом, вирусом Эпштейна-Барр; травма, операция, трансплантация костного мозга, вакцинация). В европейско-американской популяции преобладает классическая демиелинизирующая форма (90% случаев) с более мягким, контролируемым течением и хорошим восстановлением. В Азии выше частота аксональных форм (моторная и мотосенсорная) с более тяжелым течением и менее полным восстановлением. Редко встречаются тяжелые формы СГБ с дополнительным вовлечением ЦНС (синдром Миллера–Фишера, энцефалит Биккерстаффа).
При хронических дизиммунных невропатиях симптоматика прогрессирует более двух месяцев. Самой частой формой является хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) — в отличие от СГБ, она имеет характер более мягкой, но прогрессирующей демиелинизации, с чередованием обострений и ремиссий, восходящая слабость в конечностях (от ног к рукам) сочетается с чувствительными нарушениями. Из-за хронического повреждения миелина антителами и нарушенного восстановления миелина нервы становятся утолщенными и напоминают «луковицы». В отличие от СГБ, специфической связи с инфекциями или циркулирующими антителами для ХВДП пока не выявлено.
Хронические парапротеинемические полинейропатии напоминают ХВДП, но могут проявляться чисто аксональным поражением. Причиной является бесконтрольное деление одного активированного клона В-лимфоцитов или плазмоцитов, продуцирующего моноклональные антитела (парапротеины). При этом выраженного воспалительного процесса нет, просто антител становится слишком много, и они откладываются в тканях. Это может быть проявлением опухолевого процесса в костном мозге (неправильные клетки синтезируют много неправильных антител), криоглобулинемии (при хронической вирусной инфекции лимфоциты «устают» и синтезируют извращенные антитела, выпадающие в осадок) или гаммапатии неясного происхождения (если исключены вышеуказанные причины).
При мультифокальной моторной невропатии симптоматика развивается от 1 до 6 месяцев в виде асимметричной слабости конечностей, в крови выявляются антитела к ганглиозиду GM1. Он расположен в области перехватов Ранвье (небольших естественных участков «голого» аксона между миелинизированными сегментами). При действии GM1-антител происходит краевая демиелинизация — перехват Ранвье удлиняется, изменяется состав ионных каналов на клеточной мембране аксона, что приводит к формированию блоков проведения, то есть полному затуханию электрических импульсов на данном участке аксона [19].
Формы аутоиммунного поражения нервно-мышечного синапса тоже хорошо изучены. Самая частая из них — миастения гравис (МГ) — развивается при антитело-опосредованном повреждении компонентов постсинаптической мембраны (мышечной мембраны, принимающей сигнал от двигательного нейрона для запуска мышечного сокращения). Характерное проявление МГ — феномен патологической мышечной утомляемости, проявляющийся к концу дня и при выполнении физической нагрузки. Чаще всего утомляемость начинается с глазных мышц (глазная форма МГ), постепенно распространяясь на все поперечнополосатые мышцы, в том числе дыхательные (генерализованная форма МГ). Впервые это заболевание было описано еще в 17 веке, и в настоящий момент около 80% случаев ассоциированы с антителами к никотиновым рецепторам ацетилхолина (nAChR) — эти формы имеют контролируемое течение с хорошим ответом на лечение. Остальные случаи более агрессивны, хуже отвечают на лечение и ассоциированы с антителами к белкам, участвующим в размещении ацетилхолиновых рецепторов на постсинаптической мембране (MuSK, LRP4). Иногда миастения гравис может развиваться на фоне опухолевого образования тимуса (места созревания Т-лимфоцитов) — тимомы. Несмотря на устоявшиеся критерии диагностики и контролируемое лечение ингибиторами ацетилхолинэстеразы, увеличивающими содержание ацетилхолина в синапсах, случаются жизнеугрожающие обострения в виде миастенических кризов, требующих наблюдения в условиях отделения реанимации на «лекарственных каникулах», то есть с полной отменой терапии (потому что концентрация ацетилхолина становится неуправляемо низкой или высокой), с подключением к аппарату искусственной вентиляции легких [20]. Существует также паранеопластическая форма — миастения Ламберта–Итона, развивающаяся вторично на фоне злокачественного процесса (чаще рака легкого). Опухолевые клетки продуцируют антигены, похожие по строению на компоненты пресинаптической мембраны нервно-мышечного синапса (в частности, на потенциал-зависимые кальциевые каналы на аксональной мембране двигательного нейрона). Если МГ чаще развивается у молодых женщин со слабости глазных мышц, то миастения Ламберта–Итона проявляется чаще у мужчин после 40 лет со слабости в ногах и характерной «утиной походки». Необходимо проводить онкопоиск и устранять первичную причину миастении [21].
Коалиция наносит ответный удар: как врачи и фармацевты сражаются с аутоиммунными заболеваниями нервной системы
Чтобы укротить мятежную иммунную систему, врачи используют широкий арсенал средств иммунотерапии. Можно представить иммунную систему как густо ветвящееся дерево, где каждая ветвь — популяция иммунных клеток с их «продуктами» (антитела, цитокины), отвечающих за ту или иную функцию. У пациента с аутоиммунным заболеванием некоторые ветви будут избыточно разросшимися или лишними, мешать другим ветвям и нарушать «живописную красоту» кроны дерева. Традиционные методы иммунотерапии (неспецифическая иммуносупрессия), влияют на общий ствол «иммунного древа» или на крупные ветви, чтобы восстановить крону «с основания», но дереву для этого потребуется больше времени и сил. Более аккуратная таргетная иммуносупрессия влияет только на отдельные «неправильные» веточки — в этом случае не затрагиваются остальные здоровые ветви, и крона дерева быстрее восстанавливает свой полноценный вид. Подобно искусному садовнику, формирующему крону деревьев, ученые используют таргетную иммунотерапию только при наличии идентифицированных мишеней, по которым можно определить, какую ветвь «иммунного древа» нужно исправить.
Для препаратов таргетной иммунотерапии необходимо помнить о «феномене айсберга» — специфическое удаление антител или иммунных клеток может не покрывать других малоизученных патогенетических звеньев процесса, то есть не останавливать развитие заболевания. Например, более половины пациентов с РС, получающих современные препараты моноклональных антител, сохраняют признаки активности заболевания [22].
Иммунотерапия может значительно повлиять на структуру иммунной системы. Поэтому все основные нежелательные побочные эффекты связаны с развитием вторичного иммунодефицита. Быстрая инактивация популяций иммунных клеток приводит к пробуждению их «естественных противников» — микроорганизмов и опухолевых клеток. И если до иммунотерапии микроорганизмы не могли проникнуть во внутреннюю среду через барьеры организма или находились в подавленном, латентном состоянии, то с развитием иммунодефицита они дают развитие оппортунистическим инфекциям (туберкулез, менингококковый менингит, гепатит В, кандидоз, токсоплазмоз, листериоз, пневмоцистная пневмония и др.). Поэтому если у пациента имеются хронические инфекционные заболевания — необходимо проконсультироваться с инфекционистом, пройти дообследование и профилактическое лечение. При некоторых видах таргетной терапии рекомендуют предварительно делать вакцинацию (например, против менингококка) и назначать профилактическую антибиотикотерапию или противовирусную терапию. В таких случаях за большинством оппортунистических инфекций возможно установить контроль. Но иногда возникают тяжелейшие летальные инфекции.
Для лечения аутоиммунных заболеваний нервной системы было позаимствовано из общей практики много препаратов для иммунотерапии. Примечательно, что они не проникают через гематоэнцефалический барьер, а действуют на уровне иммунных клеток периферической крови или лимфоузлов. Для иммунотерапии отдельным пунктом оценивается риск вторичного повреждения нервной системы — препараты могут вмешиваться в тесные гомеостатические взаимодействия между иммунной системой и нервной тканью (см. ниже).
В терапии обострений наиболее часто используются глюкокортикостероиды (преднизолон и метилпреднизолон) — синтетические структурно-функциональные аналоги гормонов надпочечников, в целом угнетающие воспаление и иммунитет (причем в несколько раз более эффективно, чем их природные предшественники): уменьшается продукция цитокинов, хемокинов, проницаемость сосудов в зоне воспаления, тормозится деление клеток врожденного и приобретенного иммунитета, фагоцитоз. Из-за разнонаправленного гормонального эффекта глюкокортикостероиды вызывают ряд нежелательных явлений, особенно при длительном использовании (повышение артериального давления, повышение сахара крови, остеопороз, абдоминальное ожирение, мышечная атрофия и др.), поэтому их используют в качестве стартовой индукционной пульс-терапии (внутривенное капельное введение ГКС в большой дозе 0,5–1 г/сут в течение 5 дней), то есть для быстрого неспецифического подавления иммунного ответа во избежание его вторичной активации и трансформации по механизму положительной обратной связи. После переходят на поддерживающую терапию в таблетках в десятикратно меньших дозах и с очень плавной отменой (недели–месяцы). Некоторые виды аутоиммунных заболеваний крайне негативно реагируют на подобную терапию (например, при синдроме Гийена–Барре глюкокортикостероиды противопоказаны, так как уменьшают потенциал восстановления функций нервной системы в период выздоровления).
При особо агрессивных формах заболевания (например, злокачественная форма Марбурга при РС, тяжелое обострение при ЗСОНМ, агрессивные формы ОРЭМ), остром течении заболевания с жизнеугрожающими состояниями (например, при синдроме Гийена–Барре) или неэффективности пульс-терапии глюкокортикостероидами назначают 5–7 сеансов плазмафереза — с помощью вращательного ускорения из цельной крови пациента отделяют от форменных элементов крови жидкую плазму, содержащую цитокины и аутоантитела. Далее эту плазму извлекают и заменяют на плазму здорового донора или искусственные кровезаменители. Это позволяет «заново переустановить» гуморальные параметры иммунитета. Данная процедура также имеет ряд нежелательных побочных эффектов (аллергия на кровезаменители, тромбозы и кровотечения, падение артериального давления), однако в тех случаях, когда плазмаферез показан, польза для пациента значительно превышает риски.
Для дизиммунных полиневропатий и миастении, а также аутоиммунных энцефалитов и васкулитов к терапии обострений первой линии относятся внутривенные человеческие иммуноглобулины (IVIG). Еще их рекомендуют при РС детям, кормящим матерям, при планировании беременности. Каждый флакон для внутривенного введения содержит поликлональные антитела, которые извлекают из плазмы по меньшей мере 1000 здоровых доноров и тщательно очищают. При попадании в кровоток такая «боевая смесь» эффективно захватывает и выводит из организма циркулирующие аутоантитела, а также массово блокирует рецепторы воинственно настроенных иммунных клеток. Получается битва «хороших» антител против «плохих» антител. Препарат назначают в высоких дозах — 1–2 г на килограмм веса в течение 3–5 дней — пациенты выделяются в больнице по наличию большого «груза», состоящего из десятков флаконов с лекарством.
После терапии обострения для большинства аутоиммунных заболеваний нервной системы на длительной основе назначается профилактическая терапия, направленная на уменьшение частоты и интенсивности обострений, замедление прогрессирования заболевания и его инвалидизирующих проявлений.
Так как от рассеянного склероза страдают граждане в самом расцвете сил, в том числе планирующие создание семьи, для него за прошедшие несколько десятилетий была разработана многоуровневая и гибкая система лечения на основе препаратов, изменяющих течение рассеянного склероза (ПИТРС). Подробнее о рассеянном склерозе и его лечении смотрите посвященную ему статью: «Рассеянный склероз: иммунная система против мозга» [23].
К ПИТРС-терапии 1 линии относятся «старые и добрые» препараты из 90-х, которые на протяжении многих лет доказывали свою эффективность и ограниченный спектр нежелательных явлений. Интерфероны бета, подавляющие избыточную продукцию провоспалительных цитокинов, повышенную проницаемость ГЭБ, активацию провоспалительных макрофагов и лимфоцитов, вводят внутримышечно, чаще детям или работоспособным мужчинам при наличии нетяжелых обострений и стойких ремиссий. Глатирамера ацетат (копаксон) считается самым безопасным, «женским» препаратом — его рекомендуют женщинам, планирующим в будущем создание семьи, при наличии стойких ремиссий и хорошем восстановлении после обострений. Препарат состоит из смеси синтетических полипептидов, имитирующих основной белок миелина. После подкожного введения он стимулирует рост и активацию противовоспалительных клонов Т-лимфоцитов (Th2), способствующих восстановлению нервной ткани. К таблетированным (а значит, и более удобным для длительного применения) ПИТРС 1-ой линии относят терифлуномид, блокирующий биохимический путь синтеза нуклеотидов в активированных быстро делящихся лимфоцитах, а также диметилфумарат, который активирует антиоксидантные и противовоспалительные пути. Удивительно, как это средство, разработанное для чистки мебели от плесени, «получило повышение» до 1-й линии ПИТРС! Необходимо помнить, что таблетированные ПИТРС могут негативно влиять на печень и противопоказаны женщинам детородного возраста при планировании беременности и лактации.
К ПИТРС-терапии 2 линии обращаются при тяжелых частых обострениях (нередко со вторичным прогрессированием из-за включения механизмов нейродегенерации) и неэффективности 1 линии препаратов. Сюда относятся «препараты 21 века», которые обладают более избирательным механизмом подавления иммунитета, преимущественно Т- и В-клеточного (селективная иммуносупрессия) — это гуманизированные моноклональные антитела (см. далее) и ингибиторы сфингозин-1-фосфатных рецепторов (см. далее). Самым популярным препаратом из этой группы стал натализумаб — препарат из группы моноклональных антител, который избирательно блокирует интегрин альфа-4 на поверхности Т-лимфоцитов, препятствуя их миграции из периферического кровотока через ГЭБ. Препарат удобно использовать (внутривенно один раз в месяц), однако это сопряжено с риском развития оппортунистических инфекций из-за иммуносупрессии, особенно тяжелейшей ПМЛ-инфекции (см. далее). Поэтому если натализумаб противопоказан, назначают алемтузумаб — препарат из той же группы моноклональных антител, который способствует длительной (на несколько лет) реконституции иммунитета, вызывая CD52-опосредованный апоптоз и Т-, и В-лимфоцитов, но не их стволовых клеток (проводят восемь инфузий в течение двух лет). Еще один препарат моноклональных антител — окрелизумаб, атакующий CD20-мишень на поверхности В-лимфоцитов разной степени зрелости, уникален тем, что доказал свою эффективность в отношении первично-прогрессирующего рассеянного склероза, когда изначально преобладают механизмы нейродегенерации. К таблетированной ПИТРС-терапии 2 линии относят модуляторы S1P-рецепторов (финголимод, сипонимод, озанимод, понесимод) — они не только блокируют выход активированных провоспалительных Т-лимфоцитов из лимфоузлов в периферический кровоток, но и проникают через ГЭБ, оказывая нейропротективный и ремиелинизирующий эффект, поэтому их назначают при вторично прогрессирующих формах РС. Побочные эффекты модуляторов рецепторов сфингозин-1-фосфата связаны с множественным воздействием на разные типы рецепторов S1P. В частности, они могут вызывать нарушение сократимости и проводимости миокарда, токсическое действие на печень, отек сетчатки. Поэтому пациенты нуждаются в проведении мониторинга частоты пульса, артериального давления, ЭКГ, биохимического анализа крови и осмотре глазного дна на старте лечения.
Каждый врач, назначающий пациенту ПИТРС, хочет услышать «4 главных буквы» — NEDA (no evidence of disease activity), когда у пациента на фоне профилактического лечения нет признаков демиелинизации (не возникает новых обострений, новых очагов на МРТ) и нейродегенерации (не уменьшается МРТ-объем мозговой ткани, не повышается уровень нейрофиламентов в цереброспинальной жидкости, не прогрессирует симптоматика по шкале EDSS между обострениями, не развиваются когнитивные нарушения).
Если заболевания протекают с затяжными частыми обострениями или носят быстропрогрессирующий характер, не отвечая на лечение глюкокортикостероидами, назначается «терапия отчаяния», входящая и в ПИТРС в качестве 3-ей линии — агрессивные таблетированные цитостатики, неселективно угнетающие пролиферацию активно делящихся клеток (в том числе всех активированных иммунных клеток) путем нарушения синтеза и репарации ДНК. При этом развивается множество нежелательных явлений (диарея из-за повреждения эпителия ЖКТ, выпадение волос, анемия, кардиомиопатия и др.) Для лечения вторично-прогрессирующих и злокачественных атипичных форм РС используют митоксантрон. Для ЗСОНМ и МОГАЗ противопоказано применение ПИТРС 1–2 линии (они могут усугубить течение заболевания!) — это связано с тем, что патогенез этих заболеваний, в отличие от РС, имеет преимущественно антитело-опосредованный механизм. Зато хорошо зарекомендовали себя цитостатики азатиоприн и микофенолата мофетил. Хотя более современным методом профилактики обострений при ЗСОНМ и МОГАЗ является ритуксимаб (препарат моноклональных антител к CD20-мишеням В-лимфоцитов, см. ниже), цитостатики не теряют своей актуальности из-за меньшей стоимости и таблетированной формы приема. Более того, цитостатики комбинируют с приемом ритуксимаба, так как эффект последнего проявляется постепенно.
Наконец, существуют еще более «отчаянные» способы реконституции иммунитета, когда лекарственные препараты не помогают установить контроль над агрессивно протекающим заболеванием — например, при миастениях и некоторых аутоиммунных энцефалитах производят тимэктомию, то есть удаление тимуса (место созревания Т-лимфоцитов, здесь они «учатся» отличать свои антигены от чужих). При агрессивных формах рассеянного склероза показана эффективность аутотрансплантации гемопоэтических стволовых клеток (AHSCT) — с помощью гранулоцитарного колониестимулирующего фактора и циклофосфамида стимулируют выход стволовых CD34+ клеток лейкоцитов из красного костного мозга в периферический кровоток, далее эти клетки извлекают и замораживают, после проведения генерализованной иммуносупрессии цитостатиками стволовые клетки обратно вводят внутривенно пациенту и они заново формируют соотношение популяций иммунных клеток. Даже по этому краткому описанию становится понятно, что процедура является очень долгой (недели) и опасной (высокий риск инфекций, пока «с нуля» восстанавливается иммунитет, необходимо наблюдение в стационаре).
Оружие возмездия — новые методы лечения и мишени их действия
Основные прорывы фармацевтического рынка последних десятилетий оказали огромное влияние и на терапию аутоиммунных заболеваний, в том числе — нервной системы. Пожалуй, главный из этих прорывов — моноклональные антитела [24]. Они продуцируются in vitro [25] и селективно связываются с одной мишенью. Разработка первого препарата моноклональных антител в 1975 г. была подобна открытию электричества — произошла революция в лечении аутоиммунных и опухолевых заболеваний, наметился переход от общего неспецифического подавления и перестройки иммунитета к избирательной (таргетной) модуляции иммунного ответа и выведению из организма повреждающих гуморальных факторов (антител, белков комплемента).
Помимо избирательности воздействия, к преимуществам моноклональных антител относится длительный эффект — одной инъекции хватает на месяцы–годы, это очень удобно для людей, которые работают и создают семьи. Существует и обратная сторона медали — высокая стоимость лечения, сохраняющийся риск нежелательных побочных эффектов (аллергические и токсические реакции на вводимый белок, а также избирательные, как и сами препараты, инфекционные осложнения — см. ниже).
Большинство препаратов моноклональных антител вводятся внутривенно — из-за высокого риска аллергических реакций, реакций «отторжения» при попадании инородных белков в кровь, пациенты иногда вынуждены проходить премедикацию с введением глюкокортикостероидов и антигистаминных препаратов перед непосредственным введением антител. Несмотря на это, пациенты нередко жалуются на першение в горле и кашель, крапивницу, покраснение глаз, преходящее повышение температуры. Очень редко развиваются более тяжелые осложнения — отек Квинке, анафилактический шок, токсическое повреждение эпидермиса кожи с его отслаиванием (синдром Лайелла, синдром Стивена–Джонсона). Подделка препарата или неправильные условия его хранения могут обойтись очень дорого не только для кошелька, но и для здоровья пациента.
Но моноклональные антитела бывают коварны. Некоторые их препараты, одобренные для иммуномодуляции и иммуносупрессии за пределами нервной системы, могут, наоборот, спровоцировать аутоиммунное повреждение нервной ткани. Например, неоднократно сообщалось, что этанерцепт, адалимумаб и инфликсимаб (моноклональные антитела к провоспалительному цитокину TNF-alpha) могут спровоцировать РС-подобную демиелинизацию ЦНС [26]. Совсем недавно было описан новый вид аутоиммунного заболевания нервной системы, связанный с иммуномодулирующей терапией опухолей моноклональными антителами — ингибиторами контрольных точек иммунного ответа (атезолизумаб, ипилимумаб, ниволумаб и др.). Эти препараты блокируют маркеры регуляторных Т-клеток, поликлональная популяция которых занимается генерализованной модуляцией иммунного ответа. В результате активируются спящие ранее аутореактивные клоны Т- и В-лимфоцитов — развиваются миастеноподобные синдромы, дизиммунные невропатии, опсоклонус-атаксии и др.
Натализумаб — препарат гуманизированных антител к интегрину альфа-4 на поверхности активированных Т-лимфоцитов, был первым из класса моноклональных антител, доказавшим свою эффективность в лечении аутоиммунных заболеваний ЦНС, в частности, он входит во 2-ю линию ПИТРС. Прежде всего, натализумаб не позволяет аутоагрессивным Т-лимфоцитам проникнуть из кровотока в нервную ткань. В 2005 году препарат был «осужден» за случаи развития тяжелейшего осложнения — прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ), но после был «реабилитирован» из-за своей высокой эффективности. ПМЛ — это неуклонно прогрессирующая демиелинизация головного мозга со смертью в течение 1–9 месяцев после появления первых симптомов. ПМЛ вызывается JC-вирусом из семейства полиомавирусов (по инициалам пациента John Cunningham, у которого он впервые был обнаружен). Носителем JC-вируса является большая часть населения планеты, но при нормальном иммунитете вирус не способен навредить. Для оценки риска развития ПМЛ всем пациентам рекомендуется определение уровня сывороточных антител к JC-вирусу перед началом терапии натализумабом и далее — каждые полгода. Рост титра антител повышает риск ПМЛ и является противопоказанием к использованию натализумаба. В 2023 г. для РС впервые был одобрен биосимиляр натализумаба (аналог оригинальных антител). Это событие позволяет ожидать, что в ближайшем будущем биосимиляры других моноклональных антител снизят стоимость лечения этим классом препаратов.
В качестве избирательной мишени для воздействия моноклональных антител часто используются белковые комплексы на поверхности лейкоцитов — CD (кластеры дифференцировки). По этим белкам ученые могут узнать, как по резюме, какой путь развития выбрал лейкоцит при своем созревании, на каких функциях он специализируется, каков его «характер» (провоспалительный или антивоспалительный), есть ли у него уже «опыт работы» с антигенами.
Наиболее широким спектром действия обладает препарат гуманизированных антител алемтузумаб — его мишенью служит CD52 комплекс на поверхности зрелых Т- и В-лимфоцитов, моноцитов, дендритных клеток, натуральных клеток-киллеров. При терапии им происходит тотальное обновление популяций иммунных клеток (реконституция) за счет стволовых клеток-предшественников, поэтому алемтузумаб показан при высокоактивном течении РС. Однако этот препарат ассоциирован с редкими случаями развития листериоза — через некоторое время после начала симптомов кишечной инфекции и подъема температуры, возбудитель мигрирует и вызывает листериозный менингит с высокой долей летальности.
Ритуксимаб (химерное антитело, одобренное для ЗСОНМ и МОГАЗ) и окрелизумаб (гуманизированное антитело, одобренное при первично-прогрессирующем РС) связываются с CD20 — маркером всех В-лимфоцитов на всех стадиях развития, кроме первой (CD19-предшественники) и последней (плазмоциты). За последние несколько лет одобрены новые анти-CD20-препараты для лечения РС с обострениями. У каждого из них есть свое преимущество: офатумумаб пациент может вводить себе самостоятельно подкожно один раз в месяц, а ублитуксимаб и дивозилимаб за счет модификаций сильнее других анти-СD20-антител привлекают «адекватные» иммунные клетки к уничтожению «неправильных» В-лимфоцитов. Важно понимать, что CD20 большой, и каждый препарат находит свое место для его связывания.
Препарат химерных антител к CD19, инебилизумаб, способен, в отличие от анти-СD20 терапии, связывать все виды В-клеток, включая ранние предшественники и плазмоциты, продуцирующие антитела. Поэтому он одобрен для лечения антитело-опосредованной демиелинизации — ЗСОНМ. Интересно, что кроме инебилизумаба, при ЗСОНМ с тяжелыми и затяжными обострениями одобрен препарат из группы ингибиторов протеасом (бортезомиб), который тоже способствует удалению избытка плазмоцитов — блокируя внутриклеточную систему утилизации белков (протеасомный путь деградации), бортезомиб повышает склонность к запрограммированной клеточной смерти у активно продуцирующих белки плазмоцитов. Данный препарат также одобрен для лечения некоторых парапротеинемических полинейропатий, показал хорошую эффективность в качестве «терапии отчаяния» при тяжелых формах хронических дизиммунных невропатий.
Так как многие аутоиммунные заболевания ЦНС имеют антитело-опосредованный механизм действия (например, миастения гравис, ЗСОНМ, АИЭ), для них разрабатываются антитела к белкам комплемента (тем самым, которые уничтожают меченую антителом клетку путем нарушения целостности ее клеточной мембраны). В частности, одобренные для лечения миастении и ЗСОНМ экулизумаб и равулизумаб блокируют ключевой C5 белок комплемента. Разрабатываются антитела к неонатальным Fc-рецепторам (FcRn) — белкам, захватывающим циркулирующие антитела (IgG, в том числе, аутоантитела) на поверхности сосудистого эндотелия, чтобы защитить их от внутриклеточного разрушения в лизосомах и снова выпустить в кровоток, увеличив продолжительность их действия. Для тяжелых форм миастении гравис из этой группы уже одобрен препарат гуманизированных антител (розаноликсизумаб) и препарат фрагментов антител (эфгартимод). Эти и новые препараты (батоклимаб, ориланолимаб и др.) показали на стадии клинических испытаний снижение количества аутоантител для миастении гравис, ХВДП и в экспериментальных моделях РС.
При развитии аутоиммунных заболеваний нервной системы, устойчивых к индукционной терапии ГКС, цитостатиками, плазмаферезом, ВВИГ, и сопровождающихся выраженной симптоматикой (угнетение сознания, эпилептический статус, дыхательная недостаточность) или частыми затяжными обострениями, рассматривают назначение в качестве «терапии отчаяния» борьбу с цитокиновым штормом. Данное состояние развивается, когда провоспалительный иммунитет, разрушая клетки, активирует сам себя по механизму положительной обратной связи, выделяя огромное количество таких цитокинов, как фактор некроза опухоли альфа (TNF-alpha), интерлейкины 1 и 6. Именно цитокиновый шторм «бушевал» внутри тяжелых пациентов во времена пандемии COVID-19! При тяжелых формах АИЭ и ОРЭМ используют моноклональные антитела к ИЛ-6 тоцилизумаб, а для ЗСОНМ одобрено применение моноклональных антител к ИЛ-6 сартрализумаб, так как при активной стадии в ликворе у пациентов отмечается повышение уровня ИЛ-6.
Многие препараты находятся на стадии доклинических и клинических испытаний [10]. Перспективны разработки моноклональных антител против антител — например, аквапорумаб блокирует антитела к аквапорину-4, играющие ключевую роль в патогенезе ЗСОНМ. Помимо моноклональных антител повышается интерес к разработке других методов лечения. Исследуется влияние новых ингибиторов протеасом («-зомибов»), ингибиторов нейтрофильной эластазы (таких как сивелестат), уменьшающих агрессивность провоспалительного иммунного ответа, на животных моделях аутоиммунных заболеваний ЦНС.
Следом за моноклональными антителами на фармацевтическом рынке случился второй «взрыв сверхновой» — появились методы клеточной терапии с элементами генной инженерии. Большие надежды подает Т-клеточная терапия с химерными рецепторами антигенов (CAR-T-клеточная терапия). Это «живое лекарство», состоящее из Т-клеток, специфически распознающих и уничтожающих мишени. При этом они способны долго циркулировать в крови и не нуждаются в предварительном контакте с антиген-презентирующими клетками — активация происходит в «автономном режиме» с помощью химерного рецептора (фрагмент антитела + сигнальный фрагмент Т-клеточного рецептора TCR). Чтобы получить такую «улучшенную версию» Т-клеток, их забирают в нужном количестве из крови пациента, после чего встраивают в их геном информацию о химерном рецепторе и возвращают обратно в кровь. Описаны успешные случаи лечения тяжелых форм миастении и ХВДП, устойчивым ко всем лекарственным методам лечения, CAR-T-клетками к маркеру созревания В-лимфоцитов (BCMA) и СD19-маркеру всех В-лимфоцитов [26–28]. У 20–70% пациентов, получающих экспериментальную CAR-T-клеточную терапию, развиваются нежелательные явления, такие как синдром высвобождения цитокинов и синдром нейротоксичности, ассоциированный с иммунными эффекторными клетками, особенно у пациентов с РС и ЗСОНМ. Они связаны с выделением незрелыми лимфоцитами интерлейкинов (особенно ИЛ-6), влияющих на проницаемость ГЭБ [29]. На животных моделях решается судьба клеточной терапии на основе Т-регуляторных лимфоцитов. В норме популяция Т-регуляторных лимфоцитов поликлональна и подавляет иммунный ответ генерализованно, поэтому для таргетного воздействия создают моноклональную популяцию клеток, на поверхности которых размещены рецепторы антигена (TCR для узнавания аутоантиген-презентирующих клеток или химерные CAR-рецепторы для узнавания аутореактивных лимфоцитов) [30].
Еще одним способом экспериментальной таргетной иммуносупрессии являются наночастицы, покрытые комплексами «MHCII-аутоантиген». Эти свободно циркулирующие комплексы, изъятые с поверхности антиген-презентирующих клеток и перемещенные на поверхность наночастиц, «обманным путем» связывают лимфоциты с аутоиммунным потенциалом. При связывании не происходит костимуляции лимфоцита другими рецепторами антиген-презентирующих клеток, в результате чего лимфоциты «сходят с ума» от системной ошибки и превращаются в иммуносупрессивные клетки, препятствующие развитию иммунного ответа по механизму положительной обратной связи.
Гонка вооружений: недостатки современного лечения и дальнейшие перспективы
Прогресс в иммунотерапии поражает воображение, но многие вопросы остаются нерешенными. Аутоиммунные заболевания ЦНС и молодеют, и стареют (из-за развития методов диагностики и патоморфоза заболеваний), однако для многих препаратов, особенно таргетных, достоверно не известно соотношение пользы и рисков для людей моложе 18 и старше 55 лет, а также у пациентов со стойкой инвалидизацией (то есть если пациент уже ходит с опорой или передвигается на коляске). Пациенты чрезвычайно огорчаются, когда им сообщают, что для таких, как они, современные лекарства не прошли доказательных клинических испытаний.
Спектр препаратов для лечения прогрессирующих (особенно быстропрогрессирующих, фульминантных) форм аутоиммунных заболеваний ЦНС остается узким и малоэффективным — полностью остановить нейродегенеративные процессы не удается даже современным таргетным препаратам. Поэтому лечение рекомендуется начинать как можно раньше, на стадии первых обострений, чтобы отсрочить или не допустить переход в прогрессирующие формы.
Таким образом, продолжаются попытки «укротить» иммунную систему, чтобы защитить хрупкую нервную ткань от «нечаянного зла». Ведется активный поиск специфических маркеров и антител для серонегативных форм аутоиммунных энцефалитов, демиелинизирующих заболеваний ЦНС, дизиммунных полиневропатий. МРТ высокого разрешения (3–7 Тл) в новых режимах выявляет дополнительные дифференцирующие и прогностические признаки аутоиммунных заболеваний. Открываются новые аутоиммунные заболевания — например, разрабатываются критерии диагностики для атипичной демиелинизации с антителами к GFAP [31]. Уточняются и дополняются показания к назначению терапии обострений, профилактической терапии, а также критерии эффективности лечения (такие как NEDA). В 20 веке считалось, что женщинам с рассеянным склерозом противопоказана беременность — теперь женщины получают ПИТРС до и после беременности, а копаксон одобрен к применению даже во время беременности, показано, что беременность, роды и грудное вскармливание не влияют значимо на течение РС. Повышение осведомленности населения об аутоиммунных заболеваниях нервной системы способствует более раннему старту лечения и лучшему восстановлению после обострений. Активно изучаются нейропротективные эффекты иммунотерапии для лечения прогрессирующих нейродегенеративных форм. Почти каждый год появляются современные таргетные препараты. Усложняются протоколы премедикации и скрининга пациента на скрытые инфекции перед началом терапии. Благодаря подробному описанию паранеопластических форм аутоиммунных заболеваний нервной системы улучшается диагностика опухолей на ранних стадиях. Разрабатываются биоинформатические программы по вычислению болезнь-ассоциированных антигенов, их «провоцирующих свойств» и схожести с инфекционными агентами на основании секвенирования таких генов иммунитета [32–34].
Хочется верить, что в этой бесконечной битве стратегическая инициатива находится в руках врачей и фармацевтов.
Литература
- Иммунитет: борьба с чужими и… своими;
- Antoine Louveau, Tajie H. Harris, Jonathan Kipnis. (2015). Revisiting the Mechanisms of CNS Immune Privilege. Trends in Immunology. 36, 569-577;
- Взаимодействие нервной и иммунной систем: предпосылки новой терапии;
- Ликбез по ЦНС;
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- Panagiotis Mastorakos, Dorian McGavern. (2019). The anatomy and immunology of vasculature in the central nervous system. Sci. Immunol.. 4;
- Промывка мозгов: как работает глимфатическая система;
- Dallan McMahon, Reina Bendayan, Kullervo Hynynen. (2017). Acute effects of focused ultrasound-induced increases in blood-brain barrier permeability on rat microvascular transcriptome. Sci Rep. 7;
- Системная иммунология: секреты Т-клеточного репертуара;
- Satyakam Bhagavati. (2021). Autoimmune Disorders of the Nervous System: Pathophysiology, Clinical Features, and Therapy. Front. Neurol.. 12;
- Захарова М.Н. Рассеянный склероз: вопросы диагностики и лечения: практическое руководство для врачей. М.: «Медиа Менте», 2018. — 240 с.;
- I. S. Bakulin, Yu. E. Korzhova, A. O. Kozlova, R. N. Konovalov, A. V. Vasil'ev, et. al.. (2019). Clinical characteristics and diagnosis of disseminated encephalomyelitis in adults. Z. nevrol. psikhiatr. im. S.S. Korsakova. 119, 36;
- T. O. Simaniv, K. Z. Bakhtiyarova, A. N. Belova, Z. A. Goncharova, S. A. Sivertseva, et. al.. (2023). Diagnostic criteria and treatment of neuromyelitis optica spectrum disorders (NMOSD). RJTAO. 15, 71-75;
- D.D. Eliseeva, A.V. Vasiliev, A.A. Shabalina, T.O. Simaniv, M.N. Zakharova. (2020). Myelin oligodendrocyte glycoprotein immunoglobulin G-associated encephalomyelitis. Z. nevrol. psikhiatr. im. S.S. Korsakova. 120, 13;
- B.P. Kelley, S.C. Patel, H.L. Marin, J.J. Corrigan, P.D. Mitsias, B. Griffith. (2017). Autoimmune Encephalitis: Pathophysiology and Imaging Review of an Overlooked Diagnosis. AJNR Am J Neuroradiol. 38, 1070-1078;
- Christopher E Uy, Sophie Binks, Sarosh R Irani. (2021). Autoimmune encephalitis: clinical spectrum and management. Pract Neurol. 21, 412-423;
- L. A. Kalashnikova, L. A. Dobrynina, M. S. Legenko. (2019). Primary central nervous system vasculitis. Z. nevrol. psikhiatr. im. S.S. Korsakova. 119, 113;
- Carolin Beuker, Daniel Strunk, Rajesh Rawal, Antje Schmidt-Pogoda, Nils Werring, et. al.. (2021). Primary Angiitis of the CNS. Neurol Neuroimmunol Neuroinflamm. 8;
- Пирадов М.А., Супонева Н.А., Гришина Д.А. Полинейропатии: алгоритмы диагностики и лечения. M: «Горячая линия — Телеком», 2019. — 248 с.;
- Miriam L. Fichtner, Ruoyi Jiang, Aoibh Bourke, Richard J. Nowak, Kevin C. O’Connor. (2020). Autoimmune Pathology in Myasthenia Gravis Disease Subtypes Is Governed by Divergent Mechanisms of Immunopathology. Front. Immunol.. 11;
- Benedikt Schoser, Bruno Eymard, Joe Datt, Renato Mantegazza. (2017). Lambert–Eaton myasthenic syndrome (LEMS): a rare autoimmune presynaptic disorder often associated with cancer. J Neurol. 264, 1854-1863;
- Alice Mariottini, Paolo A. Muraro, Jan D. Lünemann. (2022). Antibody-mediated cell depletion therapies in multiple sclerosis. Front. Immunol.. 13;
- Рассеянный склероз: иммунная система против мозга;
- Терапевтические моноклональные антитела;
- Биотехнология антител;
- Miral H. Gharib, Mohamed Awni AlKahlout, Beatriz Garcia Canibano, Dirk Theophiel Deleu, Hani Malallah AlEssa, Samar AlEmadi. (2022). Demyelinating Neurological Adverse Events following the Use of Anti-TNF-α Agents: A Double-Edged Sword. Case Reports in Neurological Medicine. 2022, 1-5;
- Aiden Haghikia, Tobias Hegelmaier, Denise Wolleschak, Martin Böttcher, Christiane Desel, et. al.. (2023). Anti-CD19 CAR T cells for refractory myasthenia gravis. The Lancet Neurology. 22, 1104-1105;
- Volkan Granit, Michael Benatar, Metin Kurtoglu, Miloš D Miljković, Nizar Chahin, et. al.. (2023). Safety and clinical activity of autologous RNA chimeric antigen receptor T-cell therapy in myasthenia gravis (MG-001): a prospective, multicentre, open-label, non-randomised phase 1b/2a study. The Lancet Neurology. 22, 578-590;
- Aiden Haghikia, Georg Schett, Dimitrios Mougiakakos. (2024). B cell-targeting chimeric antigen receptor T cells as an emerging therapy in neuroimmunological diseases. The Lancet Neurology. 23, 615-624;
- Caroline Raffin, Linda T. Vo, Jeffrey A. Bluestone. (2020). Treg cell-based therapies: challenges and perspectives. Nat Rev Immunol. 20, 158-172;
- Fulan Shan, Youming Long, Wei Qiu. (2018). Autoimmune Glial Fibrillary Acidic Protein Astrocytopathy: A Review of the Literature. Front. Immunol.. 9;
- Hongchen Ji, Xiang-Xu Wang, Qiong Zhang, Chengkai Zhang, Hong-Mei Zhang. (2024). Predicting TCR sequences for unseen antigen epitopes using structural and sequence features. Briefings in Bioinformatics. 25;
- Philip Bradley. (2023). Structure-based prediction of T cell receptor:peptide-MHC interactions. eLife. 12;
- William D. Chronister, Austin Crinklaw, Swapnil Mahajan, Randi Vita, Zeynep Koşaloğlu-Yalçın, et. al.. (2021). TCRMatch: Predicting T-Cell Receptor Specificity Based on Sequence Similarity to Previously Characterized Receptors. Front. Immunol.. 12.