Сквозь тернии к нервам: особенности доставки лекарств в нервную систему
29 марта 2024
Сквозь тернии к нервам: особенности доставки лекарств в нервную систему
- 3525
- 0
- 24
Мозг спрятался за надежной «стеной» гематоэнцефалического барьера. Открыть лазейку и помочь мозгу при заболеваниях — непростая задача для исследователей.
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Одна из самых насущных задач современной медицины — научиться точно и эффективно доставлять терапевтические агенты в мозг пациентов. Задача эта архисложная, так как мозг специально отгородился барьером, чтобы почти ничего в себя не пропускать. О том, как этот барьер преодолевается и какие трудности встают перед адресной доставкой лекарств, пойдет речь в очередной статье спецпроекта «Нейрофармакология».
Нейрофармакология

Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Партнер спецпроекта — биотехнологическая компания LEENERS. Современные исследовательские лаборатории LEENERS — это место, где совершаются научные открытия и рождаются лекарственные препараты нового поколения.
То были каменщики, много размышлявшие о стене и не перестававшие размышлять...
Ф. Кафка. «Как строилась Китайская стена»
Вероятно, треть всего населения в мире страдает теми или иными неврологическими или психическими расстройствами — от эпилепсии до болезни Альцгеймера, от мигрени до депрессии — и, что не может не тревожить, за последние тридцать лет смертность от всех этих заболеваний выросла почти на 40% [1]. Доставить лекарство в мозг — чрезвычайно сложная задача, в первую очередь потому, что наша центральная нервная система (ЦНС) за миллионы лет эволюции обзавелась хитроумными системами защиты от непрошенного посягательства инородных тел и веществ. Это «крепкий орешек» в прямом смысле слова. Мозг укрылся под черепными костями и тремя слоями менингеальных оболочек, в которых содержится спинномозговая жидкость (СМЖ), одна из функций которой — амортизация. Уютную микросреду мозгу обеспечивает гематоэнцефалический барьер (ГЭБ) [2], пропускающий внутрь ионы и питательные вещества, но задерживающий патогены и опасные молекулы. «Опасными» по мнению ГЭБ являются и лекарства . Через барьер не проходят 98% (!) лекарственных соединений, вводимых системно (в кровоток). Биопрепараты на основе моноклональных антител тоже бессильны. Например, бевацизумаб и натализумаб, одобренные FDA (Управление по пищевым продуктам и лекарствам США), соответственно, для лечения опухолей мозга и рассеянного склероза, как оказалось, через ГЭБ практически не проходят [3], [4]. Ситуация довольно печальная: скажем, опухоли мозга, являясь наиболее легко диагностируемыми среди сóлидных опухолей у детей и подростков, одновременно становятся причиной наибольшего числа смертельных случаев среди всех онкологических заболеваний [5]. Про нейродегенеративные заболевания и говорить нечего — множество замечательных идей и ни одного эффективного средства лечения [6], попавшего в клиническую практику, — что в немалой степени связано с проблемой доставки препаратов. Доставку лекарств в мозг можно сравнить со штурмом крепостной стены, подступиться к которому можно по-разному — ломиться напролом или же искать лазейки. Аналогия на самом деле не такая уж и плохая, и мы будем пользоваться ею в нашем рассказе. Однако, прежде чем мы разберем способы преодоления нашей «стены», стоит познакомиться с ее устройством.
Зато ГЭБ спокойно пропускает алкоголь и кофеин.
Об антителах как лекарствах мы рассказывали в статье «Терапевтические моноклональные антитела» [7] почти одноименного спецпроекта.
Те опухоли, что не развились из стволовых клеток крови и представляют более-менее оформленное образование.
Посвятим им следующую статью спецпроекта.
Глава 1. Чудесная стена
Because maybe
You’re gonna be the one that saves me
And after all
You’re my wonderwall
Поскольку, вероятно
Ты будешь тем, кто спасет меня
И в конечном итоге
Ты моя чудесная стена.
Вначале нужно сказать, что барьеров на самом деле несколько. Есть, например, гемато-цереброспинальный, гемато-ретинальный , гемато-опухолевый барьеры и еще ряд других. Все они собирательно называются гистогематическими барьерами, то есть отделяющими ткань от крови и тканевой жидкости. Говорить мы будем в основном про ГЭБ, в первую очередь из-за его масштаба (это от 12 до 18 м2 суммарной площади обмена между барьером и тканью мозга).
Про этот барьер можно узнать из замечательной статьи «Свет в конце туннеля: генная терапия болезней зрения» [8], опубликованной «Биомолекулой».
О строении ГЭБ достаточно рассказано в первой статье спецпроекта: «Ликбез по ЦНС» [9]; а потому повторяться здесь не станем, а вместо этого сконцентрируемся на тех особенностях барьера, которые затрудняют проникновение веществ в мозг. В первую очередь обращают на себя внимание плотные контакты (tight junctions) между эндотелиальными клетками — они в 50–100 раз плотнее, чем в периферических тканях . И если в эндотелиальных клетках периферических тканей довольно много секреторных везикул, то в эндотелиоцитах ГЭБ таковых очень мало [10]. Если вы внимательно смотрели на схему строения ГЭБ (рис. 6 из статьи «Ликбез по ЦНС» [9]), то могли заметить там микроглиальные клетки. Здесь они выполняют довольно интересную защитную функцию. Как показывают последние исследования, в активированном состоянии микроглиальные клетки усиливают экспрессию белков, составляющих плотные контакты. Получается, что при повреждении или появлении патогена микроглия как бы старается поплотнее «заткнуть» все щели.
Если развивать аналогию с крепостной стеной, будет уместно вспомнить твердыню инков Саксайуаман, между каменных блоков которой невозможно просунуть даже лезвие.
Ошибочно считается, что все малые молекулы (менее 400 дальтон, Да) могут проскользнуть через ГЭБ — скажем, молекула гистамина весом всего 100 Да этого сделать не может , хотя через периферические сосуды проходит прекрасно [11], [12]. Однако если какой-нибудь пептид и протиснется, его ждет еще и ферментативный барьер, поскольку эндотелиальные клетки ГЭБ имеют «на вооружении» протеолитические ферменты. Для белковой молекулы это может быть столь же фатально, как оказаться в стародавние времена под потоком кипящего масла, изливаемого защитниками крепости на штурмующих.
Большинство химиотерапевтических препаратов имеет массу от 200 до 1200 Да, что автоматически затрудняет их транспортировку через ГЭБ.
Стоит поближе познакомиться с межклеточными контактами в ГЭБ, поскольку многие из них являются потенциальными лазейками для его преодоления. Итак, есть три основных типа контактов: плотные (tight junctions), щелевые (gap junctions) и адгезивные (adherens junction) (рис. 1) [13]. Щелевые контакты очень напоминают по структуре клеточный канал, состоят из паннексинов и коннексинов, соединяющихся с прилежащей эндотелиальной клеткой. Локализованы щелевые контакты в окружении плотных и адгезивных контактов и служат для обмена ионами и сигнальными молекулами между соседними эндотелиоцитами. Благодаря межклеточным контактам очень высоко трансэндотелиальное электрическое сопротивление, составляющее 1500–2000 Ω×см2, что в 50–500 раз больше, чем в обычных тканях, и очень ограничивает межклеточный транспорт веществ.
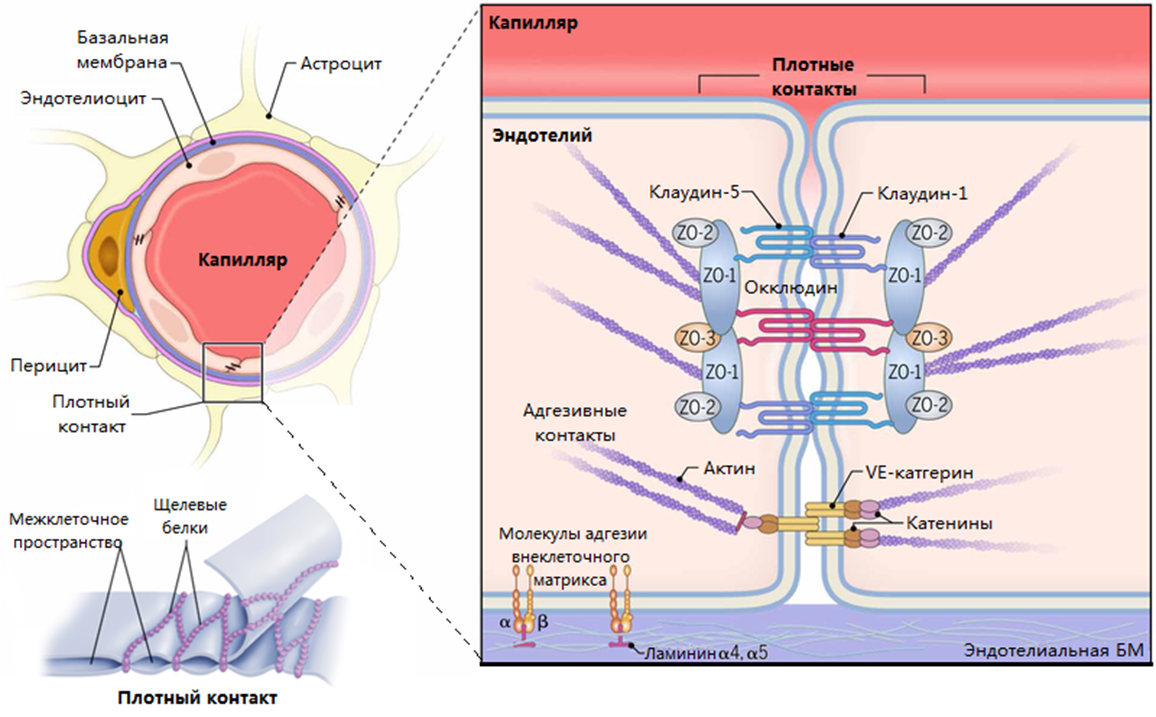
Рисунок 1. Среди трансмембранных белков контактной адгезии на схеме особо отмечены клаудины, поскольку именно они составляют плотные контакты эндотелиальных клеток. В качестве «страховки» выступают еще и белки окклюдины — они есть только в плотных контактах. Благодаря трансмембранным доменам кадгеринов, составляющих адгезивные контакты, эндотелиальные клетки плотнее связываются друг с другом, а внутриклеточные домены еще и стабилизируют цитоскелет.
[13], c изменениями
Стоит оговориться, что не во всех отделах головного мозга ГЭБ представляет собой неприступную крепость: есть и места с ослабленной защитой. В районе гипофиза, например, проницаемость ГЭБ достаточно высока, что и понятно, учитывая его секреторную функцию. Но это сущие мелочи по сравнению с тем, что происходит с барьером при появлении в мозгу опухоли. Гемато-опухолевый барьер (сократим его как ГОБ) похож на крепость, созданную нерадивыми строителями — весь он какой-то кривой и неправильный. В эндотелиальных клетках ГОБ утрачиваются контактные белки, перициты перераспределяются неверно, щелевые контакты открываются и пропускают больше молекул. Размер пропускаемых молекул тоже увеличивается, причем резко, вплоть до 330 кДа (что более чем в два раза превышает массу антитела). Рост сосудов становится беспорядочным, большинство их не покрыто концевыми пластинками астроцитов. Основной тренд ГОБ — усиление проницаемости, дабы беспрепятственно снабжать растущую опухоль всем необходимым. При этом больше всего «плюшек» от усиленной проницаемости получают внутренние участки опухоли, в то время как на внешних участках ГОБ функционирует как полноценный ГЭБ, потому антиопухолевым препаратом и трудно (фактически невозможно) уничтожить опухоль.
Барьерами для проникновения препаратов в опухоль, кроме того, могут быть высокое гидростатическое давление в опухолевой ткани и опухолевая строма (по сути, ее оболочка).
Даже при таком беглом знакомстве с особенностями ГЭБ можно понять, что его преодоление представляет нетривиальную задачу для исследователей и медиков. На сегодняшний день разработано и в разной степени испытано много подходов (рис. 2). Мы попробуем кратко ознакомиться с ними и узнать их достоинства и недостатки.
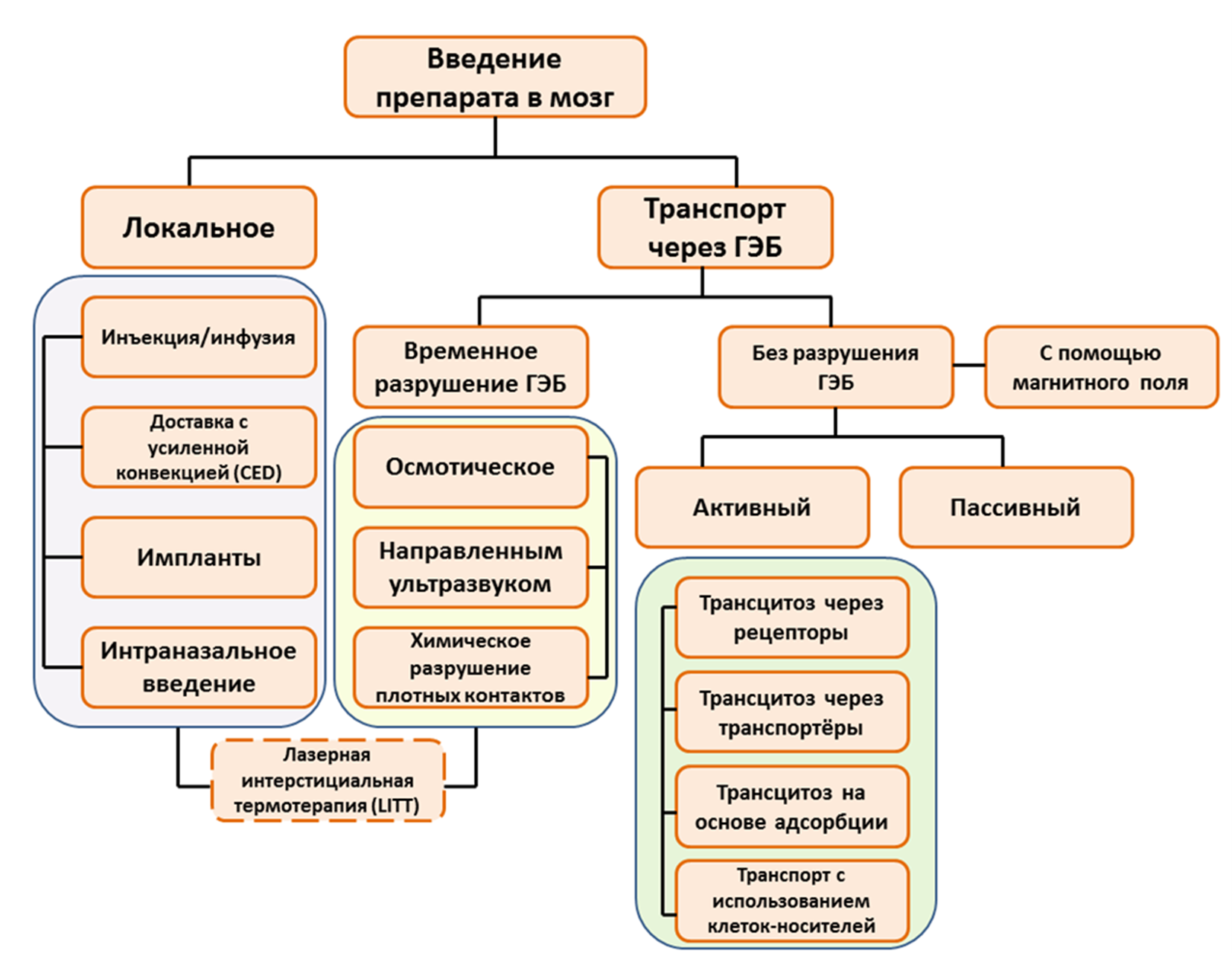
Рисунок 2. Стратегии введения препаратов в головной мозг.
[12], c изменениями
Глава 2. Обходной маневр
Я придумал оригинальный способ отправиться в крепость. Только что выстрелили из самой большой нашей пушки, как я вскочил верхом на ядро и полетел.
Пожалуй, самый очевидный способ миновать ГЭБ — это бесцеремонно вторгнуться в ткани мозга. Хотя условно такую группу методов и можно охарактеризовать как «локальное введение» (рис. 2), эффекты могут быть не ограничены какой-то конкретной областью мозга. Но, допустим, мы знаем, что нужно устранить опухоль или восстановить нарушения в определенной структуре мозга. Оправдает ли локальное введение себя? Давайте посмотрим.
Инфузии
Векторы на основе аденоассоциированных вирусных частиц (AAV) стали «рабочей лошадкой» генной терапии (им посвящена целая статья на «Биомолекуле» [14]). Подобно молекулярным «конвертам», вирусные частицы доставляют копии генов в неисправные клетки. AAV-векторы обладают относительно низкой иммуногенностью, но если вводить их в кровоток в надежде на проникновение через ГЭБ, то нужны просто огромные концентрации — до 1,13 × 1015 вирусных частиц на каждые 10 кг массы пациента. Риски иммунного ответа здесь очень высоки, да и с точностью доставки ждут проблемы — большая часть попадет в печень и вызовет там гепатотоксичность. Неизбежно приходится прибегать к стереотаксическим инъекциям в мозг. На сегодняшний день можно насчитать порядка двадцати пяти завершившихся и продолжающихся клинических испытаний [15], в которых векторы вводились в мозг для терапии моногенных заболеваний (например, болезнь Тея—Сакса и Сандхофа) или нейродегенеративных расстройств, вроде болезни Паркинсона или Альцгеймера . Место инъекции зависит от специфики заболевания. Как правило, это введение в ткань (паренхиму мозга). Но иногда необходимо, чтобы вирусные частицы распространились на большей площади, для чего их вводят в желудочки мозга (интрацеребровентрикулярная инъекция, для краткости — ICV). Так они попадают сразу в СМЖ, что облегчает их проникновение в окружающие ткани, поскольку система желудочков обширна и позволяет частицам попасть почти куда угодно. Таким путем можно добиться в 100 раз большей трансдукции тканей мозга [16]. В настоящее время проходят клинические испытания на добровольцах, страдающих болезнью Канаван и синдромом Хантера (идентификаторы NCT04833907 и NCT04571970). С точки зрения иммуногенности и нейротоксичности AAV частицы могут преподносить неприятные сюрпризы даже при введении в мозг [15], поэтому необходимо хорошо взвесить все выгоды и риски, прежде чем применять такой подход.
Существуют разные серотипы, но в клинических испытаниях чаще всего используют AAV2 и rAAV9. Здесь r — означает «рекомбинантные», т.е. они созданы на основе нескольких серотипов, чтобы эффективно заражать нервные клетки.
Исследователи используют термин «трансдукция» вместо обиходного слова «заражение».
С помощью ICV-инъекции или укола в субарахноидальное пространство (опять-таки прямиком в СМЖ), можно вводить не только вирусы. Например, препарат трастузумаб для лечения опухолей проходит клинические испытания [17], [18], в которых его вводят именно в это самое пространство. Проникает препарат, вероятно, неглубоко, всего на 2–3 мм, поэтому такой подход годится исключительно для терапии метастазов в мозговых оболочках. При этом существует пусть и небольшой, но риск асептического менингита.
Доставка с усиленной конвекцией (Convention-Enhanced Delivery, CED)
Некоторые издержки однократной инъекции препарата решаются с помощью имплантации катетера, подключенного к помпе, позволяющей закачивать в ткань мозга вещество с постоянной скоростью. Небольшой градиент гидростатического давления обеспечивает лучшее проникновение инфузата в межклеточное пространство, а значит, бóльшую площадь распространения вводимого вещества. Обычно соотношение объема препарата к площади составляет 5:1, а иногда и существенно больше. Вот вам такой пример. При введении химиотерапевтического агента через обычный катетер вещество распространяется не более чем на 5 мм от места инъекции, а при использовании CED то же вещество растекается от катетера на 6 см, то есть объем распространения в 4000 раз больше (рис. 3) [19], [20]! С помощью CED можно вводить самые разные вещества, в том числе и макромолекулы , причем неоднократно. Это особенно полезно там, где добиться эффекта однократной инъекцией невозможно.
О том, как CED используется для доставки нейротрофических факторов в мозг пациентов с болезнью Паркинсона, автор уже писал в статье на «Биомолекуле» [21].
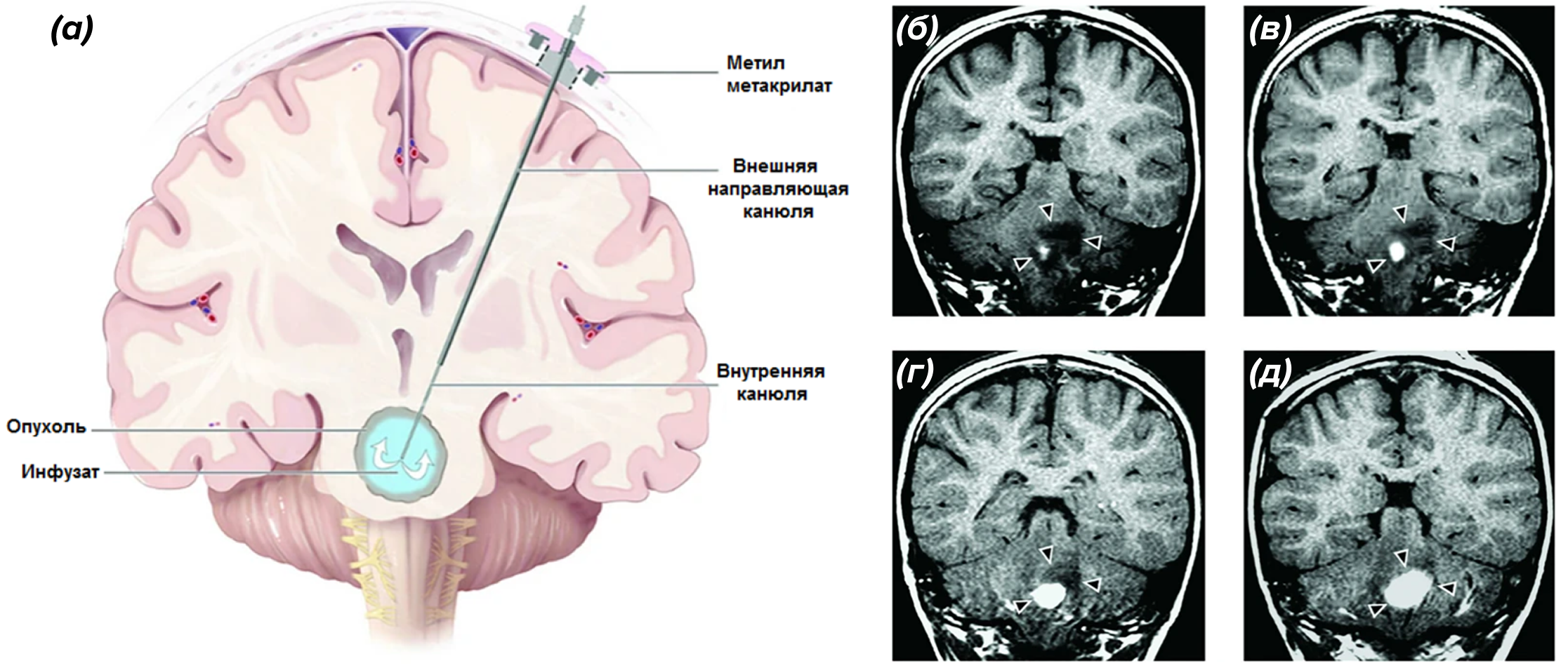
Рисунок 3. Доставка с усиленной конвекцией. На схеме (а) показана конвективная инъекция с помощью канюли системы CED. МРТ-снимки (б—д) показывают в реальном времени, как с помощью CED препарат, введенный совместно с контрастным веществом гадотеридолом, полностью заполняет опухоль (отмечена стрелками).
Неудивительно, что CED привлекла к себе большое внимание нейроонкологов. Проведены уже десятки клинических испытаний, которые показали, что препараты таким образом вводить можно, что это безопасно... но пока ещt не эффективно [20]. Действительно, существенного увеличения выживаемости пациентов с глиомами не наблюдается. Причины могут быть разные и, в основном, чисто технического плана. Например, из-за отсутствия визуального сопровождения перфузии (как на рис. 3). Осложняющим фактором является и гетерогенность опухолей, то есть в какие-то участки препарат все равно попасть не может. Большая площадь распространения препарата также вызывает опасения, поскольку возникает риск «удара» по здоровым тканям. Это же справедливо и в отношении терапии нейродегенеративных расстройств — если вводимый нейротрофический фактор действует еще и далеко за пределами мишени, весь эффект от лечения будет смазан. Вероятно, это одна из причин неудач, коими окончились попытки терапии болезни Паркинсона с помощью нейротрофических факторов GDNF [22], [23] и CDNF [24], вводимых путем CED.
Есть, однако, некоторая надежда, что использование CED в генной терапии будет более успешным. В клиническом испытании, результаты которого были обнародованы в 2019 году, с помощью CED пациентам с болезнью Паркинсона доставили AAV2 вирус с геном GDNF. Одновременно вводили контраст для отслеживания, чтобы заполнить инъекцией только стриатум. Через 6 и 18 месяцев после инъекции в стриатуме испытуемых увеличилось в среднем на 30–50% поглощение меченной изотопом 18F-ДОФА, что говорит о восстановлении дофаминовых нейронов. Остается надеяться, что этот отличный результат выльется еще и в улучшение моторных функций пациентов и не исчезнет в рандомизированном двойном слепом исследовании [25].
Лазерная интерстициальная термотерапия (LITT)
Этот метод был бы уместен в следующей главе, но по причине его высокой инвазивности стоит сказать о нем пару слов здесь. Как следует из названия, тут не обошлось без лазера и нагрева. Если кратко, то с помощью стереотаксической операции непосредственно в опухоль вводится оптоволокно, и с помощью лазерной эмиссии происходит разогрев ткани [19]. Раковые клетки в принципе не любят перегрев , но LITT подразумевает «коагуляционный некроз», то есть опухоль просто варят, как яйцо вкрутую. Звучит жутковато, но процедура строго контролируется магнитно-резонансной термометрией, поэтому риск «поджарить» пациенту мозг сведен к минимуму. Вы скажете, причем здесь введение лекарств? А вот при чем. Гипертермия, вызванная LITT, приводит к разрушению щелевых контактов, и проницаемость ГЭБ существенно усиливается. Это открывает (в прямом смысле) окно возможностей для введения препаратов, которые могли бы помочь добить опухоль. В ряде исследований было показано [26], что у пациентов с глиомой, перенесших процедуру LITT, пик проницаемости ГЭБ наблюдался через одну—две недели после разрушения опухоли, а возвращение проницаемости к базовому уровню происходило только через восемь недель. Кроме того, в это «время чудес» через проницаемый ГЭБ могут проходить крупные молекулы — например, терапевтические антитела, весящие около 150 кДа [27]. В настоящее время проводятся клинические испытания, в которых LITT комбинируется с введением доксорубицина, пембролизумаба или авелумаба [19]. Но по трем клиническим испытаниям, которые еще и не завершились, делать выводы об эффективности и безопасности методики пока рано.
Из-за неработающих белков теплового шока. Чего еще не любят раковые клетки и чем отличаются от здоровых, читайте в статье «От медицинской онкологии к молекулярной биологии рака» [28].
Импланты
Из вышенаписанного можно вычленить определенный тренд — если уж исследователи и клиницисты прибегают к оперативному вмешательству, то стараются «выжать» из этого максимум. А что может быть лучше единожды помещенного импланта, который длительное время секретирует лекарство в поврежденную область? Действительно заманчиво. Носителями лекарства могут быть микросферы, пластинки , гели. Первое такое средство было одобрено FDA еще в 1996 году и сейчас под торговой маркой Gliadel доступно для лечения нейробластомы. Принцип метода в том, что после удаления опухоли остается полость, которая выкладывается пластинками, пропитанными лекарством. Сделана каждая такая пластинка из биоразлагаемого полимера , поэтому со временем она рассасывается. По идее, секретируемый препарат должен предотвратить повторный рост опухоли, но низкая степень диффузии позволяет проникнуть лекарству всего на пару миллиметров от места введения, и в случае с такой инвазивной опухолью, как глиобластома, это плохо работает [12]. А кроме того, препарат утекает в СМЖ и вызывает побочные неврологические осложнения. В общем, хочется сделать процесс более надежным и управляемым. В 2019 году коллектив исследователей из Южной Кореи предложил довольно хитроумную систему, названную ими «биоразлагаемым электронным пластырем». Суть ее в том, что гибкая биоразлагаемая пластинка одновременно является полупроводниковым термодатчиком и при термической активации в переменном магнитном поле высвобождает лекарство (рис. 4) [29].
Из-за схожести с облатками, применяемыми при евхаристии, в английском языке закрепилось wafers, но мы будем называть их пластинками.
Это смесь из поли-[бис-(p-карбоксифенокси)]-пропана и себациновой кислоты.
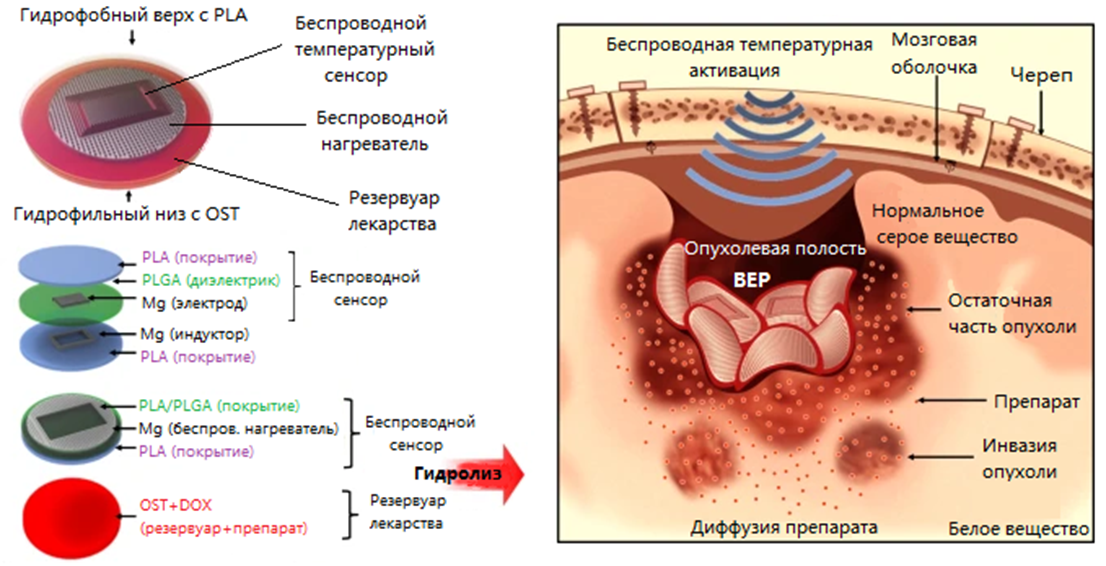
Рисунок 4. Схема биоразлагаемого электронного пластыря: материалы изготовления и принцип беспроводной активации.
PLA — поли(молочная кислота); PLGA — молочная кислота:гликолевая кислота; OST — окисленный крахмал; DOX — доксорубицин
С помощью такого контролируемого высвобождения препарата он не утекает бесконтрольно в СМЖ, но проникает глубже в пораженную ткань. Эта методика хорошо показала себя на мышах и более крупных млекопитающих — собаках, — так что стоит скрестить пальцы и ждать испытаний на пациентах.
Интраназальное введение
Из всех способов обойти ГЭБ этот, пожалуй, наименее инвазивный. На введение препаратов через нос как на способ быстрой и безболезненной доставки лекарства в мозг обратили внимание еще в конце 1980-х. Подход очень привлекательный, и вот почему. Если мы посмотрим на строение носовой полости, то обращает на себя внимание обонятельная область, в которой расположены дендриты обонятельных нейронов. Путь их аксонов пролегает через решетчатую кость прямиком в обонятельную луковицу (рис. 5) [30]. Все, добро пожаловать в головной мозг !
Чтобы быть честным, скажу, что есть еще два пути интраназальной доставки веществ в мозг: тригеминальный и через кровоток. Носовая полость богата кровеносными сосудами, поэтому веществам гораздо легче попасть в кровеносное русло, однако проблема преодоления ГЭБ от этого никуда не исчезает. Тригеминальный путь подразумевает доставку через тройничный нерв, окончания которого можно обнаружить в носовой полости. Хотя даже адепты этого подхода признают, что значимость такой доставки куда меньше, чем через обонятельные нейроны.
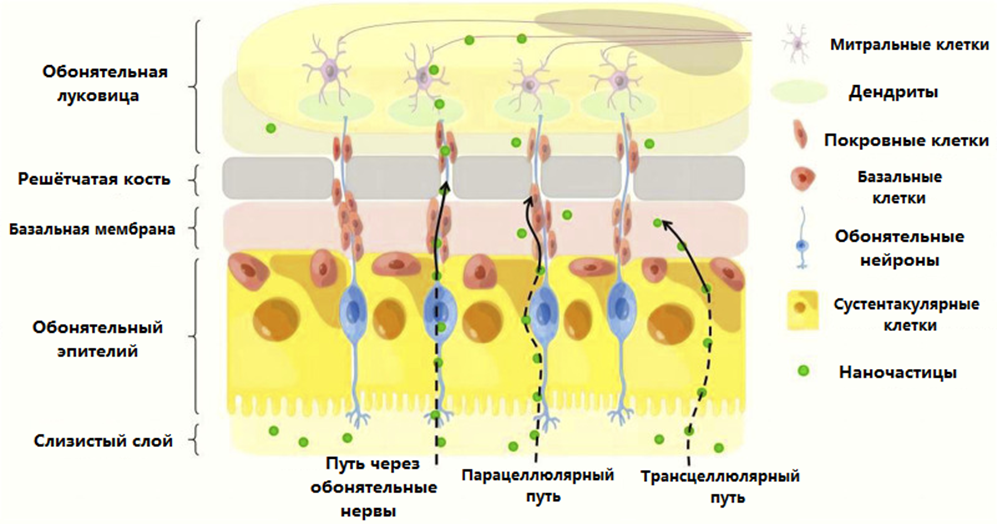
Рисунок 5. Основные пути прямой доставки частиц в мозг через обонятельную область носовой полости. Вводимый агент (вещество или наночастица) может попасть в обонятельную луковицу непосредственно по обонятельным нейронам или парацеллюлярно. В последнем случае движение осуществляется через промежутки сустентакулярных клеток, окружающих каждый обонятельный нейрон и как бы закупоривающих поры в решетчатой кости. Этот способ подходит для маленьких гидрофильных молекул. Есть и третий способ — трансцеллюлярный, — который подразумевает связывание с рецепторами и эндоцитоз через мембрану сустентакулярных клеток, что больше подходит для гидрофобных частиц.
Как только частица попадает в обонятельный тракт, для нее открывается море возможностей, ведь при помощи аксонального транспорта можно проникнуть и в ствол мозга, и в базальные ядра, и даже в важные структуры лимбической системы — например, в миндалину. Но если бы так просто было пробраться в мозг! Все инородное вычищается из носовой полости ресничками, покрытыми слизью (так называемый мукоцилиарный клиренс). «Голому» препарату в носовой полости не выжить в принципе; лучший способ защитить его — спрятать внутрь липосомы. Состоят они из липидного бислоя; размер имеют около 150 нанометров и меньше; могут инкапсулировать и липофильные, и гидрофильные молекулы; а, соединяясь с мембранами клеток, плавно с ними сливаются, высвобождая действующее вещество. В липосомы помещают как препараты — например, донепезил и ривастигмин для лечения болезни Альцгеймера, — так и более экзотичные вещи, вроде нейротрофических факторов GDNF и FGF [31]. Кроме непосредственно липосом, можно создавать коллоидную наноэмульсию из масла и воды. В эмульсии площадь адсорбции для препарата очень велика, и еще эмульсию легко готовить. Также в эмульсию можно добавлять «присадки» вроде хитозана, который увеличивает время удержания эмульсии в носовой полости, и, как следствие, обеспечивает лучшую доставку препарата в мозг. Есть такой препарат — тетрабеназин, — эффективно устраняющий гиперкинезию у больных хореей Хантингтона, но он отличается низкой биодоступностью. В одной из работ удалось существенно улучшить фармакокинетику препарата, смешав его с наноэмульсией и введя интраназально [32].
Аксоны — это настоящие «транспортные магистрали». Различные вещества, белки и целые везикулы движутся не только от тела нейрона к синапсам (антероградный транспорт), но и в обратном направлении (ретроградный транспорт). Именно так — «противоходом» — перемещаются молекулы по обонятельному тракту. Перемещение происходит вдоль актиновых микротрубочек, а белками-транспортерами выступают динеины.
Липидные наночастицы могут быть «твердыми», то есть иметь гидрофобное ядро, снаружи покрытое всего одним слоем липидов (рис. 6). В отличие от эмульсии, которая термодинамически неустойчива, твердые липидные наночастицы отличаются физико-химической стабильностью, что несомненный плюс. Несомненный минус — это коллоидная полимеризация в процессе приготовления наночастиц, из-за чего их размер становится неоднородным. Из-за такого нюанса вместо медленного высвобождения лекарства из частицы может произойти взрывообразный выброс. Ситуация несколько улучшается, если смешать жидкие и твердые липиды, тогда инкапсуляция препарата улучшается, как и его высвобождение. Но желательно, чтобы препарат был гидрофобный. А еще желательно, чтобы он был один — комбинации препаратов плохо поддаются инкапсуляции. Относительно недавно разработанные кубосомы (рис. 6) позволяют преодолеть эти недостатки.
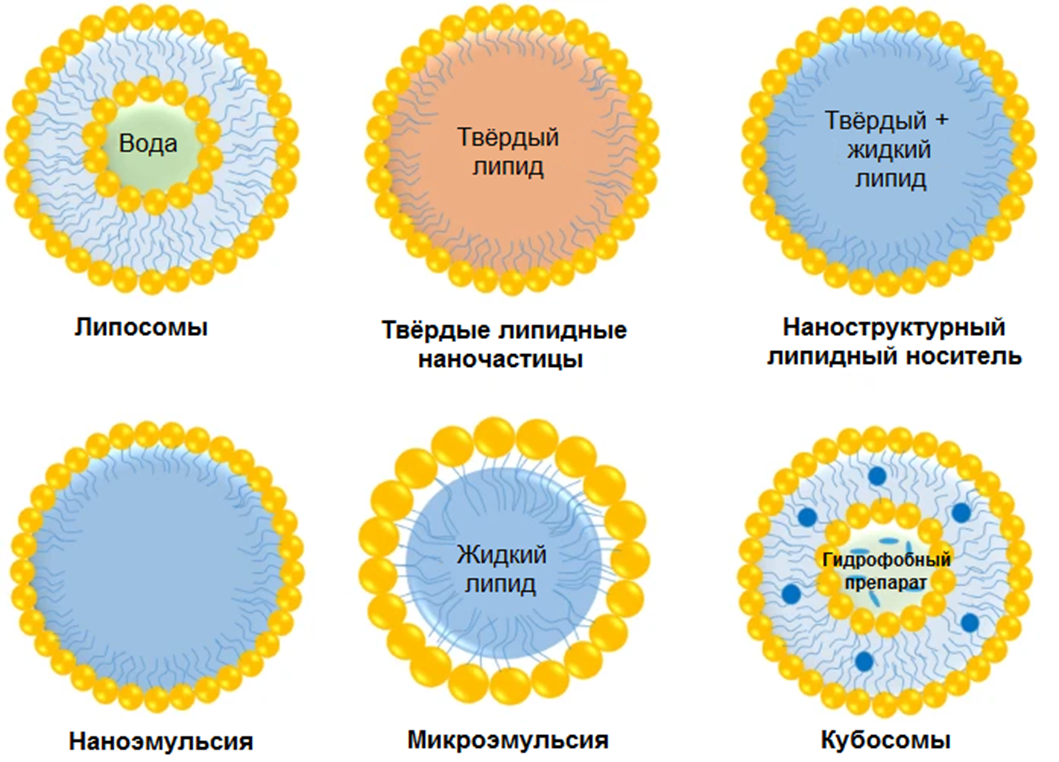
Рисунок 6. Системы липосомальной доставки препаратов. Представленная на схеме кубосома — довольно хитрая система, состоящая из амфифильных липидов и поверхностно-активных веществ, организованных в кубическую наноструктуру (для удобства изображена сферической). Кубосомы содержат жидкокристаллические фазы, которые могут способствовать инкапсулированию гидрофобных, гидрофильных и амфифильных субстратов.
Как это ни удивительно, но при столь очевидной простоте, эффективности и многообещающих перспективах, интраназальная доставка липосом «застряла» на стадии доклинических испытаний. Тормозом здесь является существенная нехватка токсикологических данных. Неясно, как ткани пациента среагируют на ежедневное столкновение с миллионами и миллионами липосом, несущих лекарства. На данный момент зарегистрировано только одно клиническое испытание интраназальной доставки ингибитора α-секретазы АРН-1105 с помощью липосом; завершиться оно должно в декабре 2024 года [33].
Подводя промежуточный итог под всеми описанными методами локальной доставки, стоит признать, что их применение в большинстве случаев встречает существенные трудности. Если импланты идут скорее важным дополнением к уже свершившемуся (и необходимому) хирургическому вмешательству, то доставка вирусов, CED и LITT, наоборот, подразумевают такое вмешательство как неотъемлемую часть методики. Пока что у инвазивных методик есть некоторые перспективы в области нейроонкологии. С другими неврологическими расстройствами уже имеются обоснованные сомнения. Учитывая десятки миллионов пациентов по всему миру, страдающих нейродегенеративными заболеваниями, сложно представить, что созыв бригады нейрохирургов и радиологов станет рутинной практикой терапии деменции или паркинсонизма. Сделать выбор в сторону рискованного хирургического вмешательства можно было бы при наличии убедительных результатов клинических испытаний, а их, к сожалению, нет.
К примеру, сейчас в мире около 70 млн человек с диагностированной болезнью Альцгеймера, а по прогнозам World Alzheimer Report 2020 через 30 лет их будет минимум 150 млн.
Глава 3. Создавая бреши
С грохотом рухнула часть стены. Дым, сноп пламени, клубы пара, рев реки — все смешалось. В зияющий пролом хлынули орки.
Теперь рассмотрим большую группу методик, связанных с доставкой препаратов непосредственно через ГЭБ. Условно их можно разделить на две группы: 1) подразумевающие временное повреждение ГЭБ и 2) использующие физико-химические подходы и свойства мембран эндотелиальных клеток для аккуратного внедрения через ГЭБ. Сейчас пробежимся по тем методикам, что «погрубее».
Химическое разрушение плотных контактов
Учитывая, что плотные контакты — важный конструктивный элемент ГЭБ, вполне логично стремление их ослабить — и «расцепить», подобно вагонам, клетки эндотелия. Есть такой пептид, способный расширять кровеносные сосуды, — брадикинин. Нам он интересен тем, что снижает экспрессию уже упоминавшихся в первой главе окклюдинов и клаудина-5, из которых и состоят в основном плотные контакты. Введение брадикинина и его аналогов усиливает проницаемость ГЭБ, и при совместной инъекции с терапевтическими агентами можно ожидать лучшего их проникновения в мозг. В первую очередь брадикинин заинтересовал нейроонкологов, так как на опухолях особенно велико число рецепторов к брадикинину. Но клинические испытания были остановлены из-за нежелательных явлений, поскольку большое число брадикининовых рецепторов «внезапно» обнаружилось во многих тканях [34]. По этой же причине отказались и от использования антител к клаудину-5 — этот белок также широко экспрессируется в периферических сосудах. Но, кажется, исследователи «нащупали», как можно разъединить плотные контакты в ГЭБ, не разрушив все сосуды пациента. В эндотелиальном слое есть много участков, где контактируют три клетки: там формируются триклеточные плотные контакты. В их строительстве участвует белок ангулин-1 [35], довольно специфичный именно для эндотелиоцитов ГЭБ (рис. 7). Так вот, относительно недавно был создан ингибитор ангулина-1 — ангубиндин-1 [36]. Это вещество позволяет обратимо разъединять триклеточные контакты и проникать действующим веществам в нервные клетки без заметных нежелательных эффектов [37]. Правда, пока дальше экспериментов на мышах дело не продвинулось.
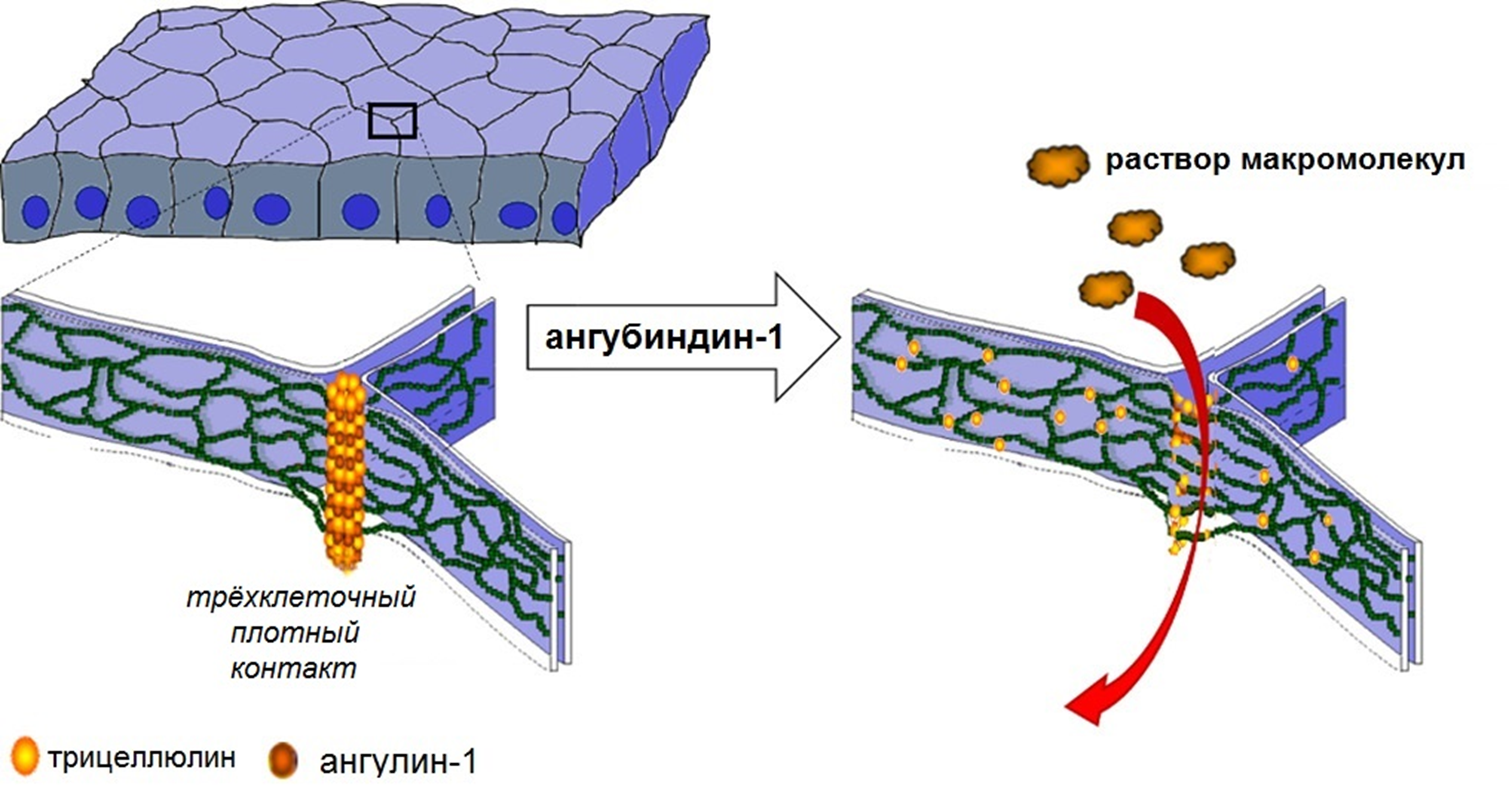
Рисунок 7. Триклеточный плотный контакт и действие ангубиндина-1.
Осмотическое разрушение ГЭБ
Разъединить плотные контакты можно, если сами клетки съежатся. Для этого их достаточно поместить в гипертонический раствор, что приведет к дегидратации эндотелиоцитов и их физическому сжиманию (рис. 8). Для осмотического разрушения ГЭБ использовалось много разных веществ, таких как лактамид, мочевина, соли, но лучше всего подошел маннитол. Он, кстати, широко используется в клинике при отеке мозга, делая ровно то, что и должен делать диуретик — выводит избыточную жидкость. Еще в 1980-х годах был проведен ряд доклинических и клинических испытаний, в которых «концентрированный» гиперосмотический маннитол вместе с противоопухолевыми препаратами вводился через сонную артерию . С тех пор было проведено более 30 различных клинических испытаний [38]. В некоторых были очевидные успехи. Например, при попытке лечить лимфому ЦНС комбинированным введением циклофосфамида и маннитола (плюс радиотерапия) удалось значительно увеличить медианную общую выживаемость пациентов (с 17,8 до 44,5 месяцев!) [39].
Чтобы он попал сразу в кровоток головного мозга и не дестабилизировал работу периферических тканей.
Как вы уже догадались, что-то пошло не так. В последующих испытаниях (правда, уже с другими препаратами) осмотическое разрушение ГЭБ останавливало рост опухоли... но частично лишало слуха [40]. Многие испытания после многообещающих результатов первой фазы застопорились на второй. В целом, как указывают авторы уже процитированного обзора [38], вычленить из этих испытаний полезную информацию не так-то просто. Везде разный дизайн, разные препараты, разные группы пациентов. Просто невозможно понять, насколько эта методика может быть эффективной в клинической практике, а главное — безопасной. Такие проблемы осмотического разрушения ГЭБ, как неизбирательность, нейротоксичность, воспалительные ответы, не решены до сих пор.
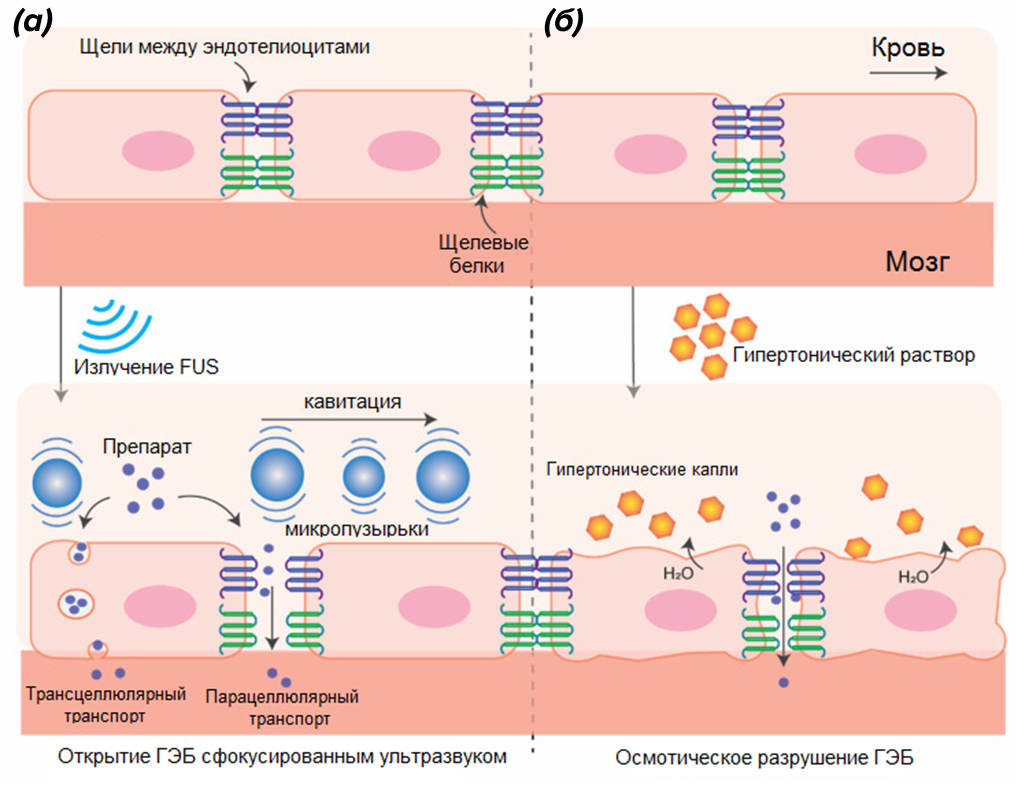
Рисунок 8. Способы разрушения ГЭБ с помощью сфокусированного ультразвука (а) и при добавлении гипертонического раствора (б). В обоих случаях основной путь доставки веществ — парацеллюлярный, то есть через открытые межклеточные контакты.
Разрушение ГЭБ сфокусированным ультразвуком
Проблему специфичности открытия ГЭБ может решить применение ультразвука высокой частоты, который можно сфокусировать в нужном месте (от того и название методики — focused ultrasound, FUS), а кроме того, варьируя частоту и длительность применения, можно контролировать степень открытия барьера. Плюс ко всему, метод неинвазивен и несет меньшие издержки от открытия ГЭБ, поскольку создает довольно короткое «окно» от 6 до 24 часов. Важным дополнением к ультразвуку могут стать вводимые микропузырьки. Их колебания под действием ультразвука вызывают кавитацию, что, в свою очередь, приводит к открытию полостей между эндотелиальными клетками [41]. Пузырьки для FUS коммерчески доступны и, в зависимости от производителя, имеют размер от 1 до 5 мкм, иногда уже продаются покрытыми препаратом. Чем больше размер пузырька, тем сильнее раскрывается ГЭБ и дольше остается открытым; такова же зависимость и от концентрации вводимых пузырьков. С помощью FUS можно пропихнуть через ГЭБ молекулу огромных размеров — до 2000 кДа; но это в целом излишне и сопряжено с рисками инерционной кавитации и кровотечения. Достаточно того, что в присутствии ультразвука молекулы противоопухолевых препаратов и антител (например, герцептин или трастузумаб с молекулой размером 150 кДа) через ГЭБ проходят хорошо. На этот счет имеется достаточно убедительных данных, полученных в том числе и в клинических испытаниях [42].
Сделаю тут оговорку. Есть подход, подразумевающий низкочастотную стимуляцию. Однако для этого в череп должен быть вмонтирован имплант, генерирующий волны низкой интенсивности. Во Франции даже разработали и провели клиническое испытание такого устройства (CarThera, SonoCloud-1) на пациентах с глиобластомой [43]. По сообщениям компании CarTera, сейчас продолжаются клинические испытания улучшенных версий предложенной системы.
Это в прямом смысле пузырьки газа, покрытые слоем фосфолипидов с пришитыми цепочками полиэтиленгликоля, чтобы на них цеплять лекарственные средства. Коммерческая доступность этой диковинки не должна вас смущать. Терапия неврологических расстройств с помощью FUS это, так сказать, верхушка айсберга. На сайте Focused Ultrasound Foundation можно ознакомится с великим множеством направлений, в которых нашел применение FUS. Для целого ряда заболеваний уже получено одобрение на использование метода в клинической практике.
Сфера применения FUS очень широка и год от года расширяется. Объектом нашего интереса является проницаемость ГЭБ для доставки препаратов, но с помощью ультразвука можно осуществлять точечную термоабляцию (дословно — «выжигание») пораженных мозговых структур. Есть примеры успешного устранения эссенциального тремора и хронических болей после таламотомии с помощью FUS. В 2019 году этот подход даже получил высокую оценку и одобрение Американского общества стереотаксической и функциональной нейрохирургии [44]. Интересно, что применение FUS на умеренных режимах, даже без каких-либо препаратов, усиливает выведение белковых агрегатов, например, белка tau или β-амилоида. Пока это показано только на мышах, но наблюдение весьма интересное.
К счастью, на тех мощностях, что используются для разрушения ГЭБ, температура повышается незначительно, поэтому риска для целостности мозговой ткани не возникает.
Любопытно и то, что FUS активирует сигнальный каскад PI3K/Akt, участвующий в нейрогенезе, и таким образом усиливает его в гиппокампе подопытных мышей [45]. Все это еще может найти применение при терапии болезни Альцгеймера. По крайней мере, проведено два пилотных исследования на пациентах, но выборки там очень маленькие (по пять—шесть человек), и судить о результатах трудно [44]. Пока единственное, что могут сказать авторы данных работ, — что методика FUS безопасна. Хотя с этим вряд ли согласились бы авторы обзора 2019 года, проанализировавшие 422 исследования с применением FUS [42]. Они отмечают, что три четверти рассмотренных ими работ, строго говоря, о безопасности ничего толком не сообщают. В нейроонкологии (а в этой области выполнено примерно 40% всех клинических испытаний FUS) порог допустимого ущерба невысок. Кровотечение, воспаление, глиоз, апоптоз, некроз и прочие страшные слова теряют значимость, когда вам нужно справится с глиобластомой. Здесь, к слову, FUS достаточно эффективен и демонстрирует хорошие результаты.
Но когда мы имеем дело с нейродегенеративными заболеваниями, вопрос безопасности становится уже на первое место. Например, осложняющим фактором становится то, что естественные (если можно так сказать) патологические изменения по ходу течения заболевания могут маскировать урон от применения FUS. На самом деле, для отработки метода нужно сделать еще очень многое. Эксперименты на трансгенных мышах, моделирующих болезнь Альцгеймера, показали, что эти животные имеют меньшую проницаемость сосудов, и при обработке ультразвуком вещество проходит через ГЭБ хуже, чем у нормальных животных [46]. А это значит, что с учетом сосудистых особенностей при нейродегенерации нужно оптимизировать размер и число частиц, а также режим обработки ультразвуком. Куда уж там исследованиям на шести пациентах!
Глава 4. Тайные лазейки
Но расскажите же мне, пока мы поджидаем ваших друзей, как вам удалось протащить их сюда? Похоже, на то, чтобы найти нужный способ, у вас ушло немалое время.
К неинвазивным методам проникновения через ГЭБ относится пассивный транспорт по градиенту концентрации: энергетически не затратный, но и неэффективный (помните про 98% лекарств, что не проходят через барьер?). По этой же причине мы не будем рассматривать адсорбцию, так как ни о какой прицельной доставке в данном случае речи не идет. Нас же интересует использование активного транспорта через мембрану эндотелиальных клеток (трансцитоз). Здесь к услугам исследователей рецепторы на клеточной мембране и транспортеры ионов и низкомолекулярных веществ, которые, если продолжить аналогию, похожи на «калитку» в крепостной стене.
Трансцитоз через рецепторы и транспортеры
Люминальная сторона ГЭБ (та, что выходит в просвет сосуда) усеяна рецепторами. Рецепторы трансферрина, инсулина или липопротеинов низкой плотности (ЛНП) могут быть мишенью для веществ или наночастиц, главное — подобрать к этим «замочкам» соответствующие «ключики» (рис. 9). Наиболее предпочтительный способ доставки действующего вещества — именно наночастицы, поскольку их поверхность можно покрыть пептидами для связывания с рецепторами, а кроме того, вещество, заключенное внутри наночастиц, гораздо дольше будет сохраняться в кровотоке, не подвергаясь риску деградации ферментами. Про липосомы мы уже говорили ранее. Кроме них существуют наночастицы на основе металлов (золото, серебро), натуральных (хитозан, полимолочная кислота и ее производные) или синтетических полимеров. Отдельно стоит выделить циклодекстрины (о них можно прочитать отдельную статью на «Биомолекуле» [47]). Это циклические олигосахариды с уникальной структурной геометрией (в виде своеобразной «чаши»), позволяющей им формировать частицы с гидрофильным наружным и внутренним липофильным слоем, благодаря чему они обладают хорошей растворимостью и биодоступностью. На основе модифицированного циклодекстрина каптизола (Captisol) создан ряд средств для лечения психических расстройств, которые уже доступны на фармацевтическом рынке [48]. По сути, это препараты, уже давно зарекомендовавшие себя , но их доставка улучшена с помощью частиц каптизола, которые, правда, не имеют специальных навесок из пептидов для связывания с рецепторами.
Это антипсихотические препараты зипрасидон и арипипразол для лечения биполярного расстройства и шизофрении (под торговыми марками Geodon и Abilify), а также брексанолон для лечения послеродовой депрессии (под торговой маркой Zulresso).
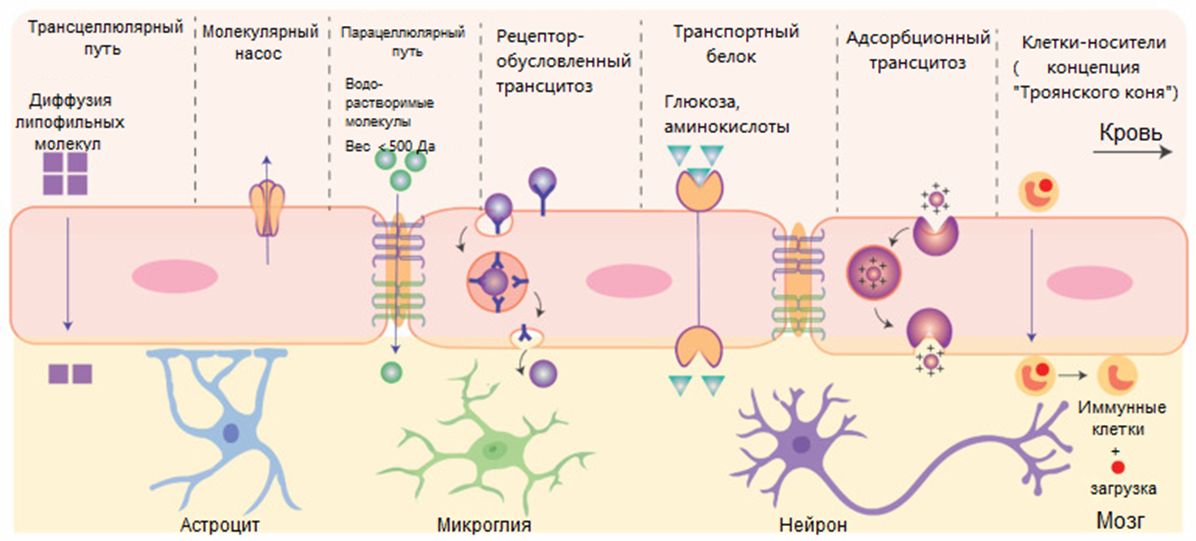
Рисунок 9. Возможные пути доставки лекарственных средств через ГЭБ, не приводящие к его повреждению или разрушению: трансцитоз, адсорбция, пассивный транспорт и клетки-носители.
К наночастицам можно и не прибегать. Например, в Японии проходят клинические испытания идуронат-2 сульфатазы, конъюгированной с антителом к рецептору трансферрина [49]. Этот подход должен помочь пациентам с синдромом Хантера. Однако наибольшее число исследований в области адресной доставки путем трансцитоза сделано в области нейроонкологии. Обусловлено это тем, что рецепторы трансферрина и ЛНП особенно интенсивно экспрессируются в опухолях [50], [51]. Здесь наночастицы остаются наиболее предпочитаемыми носителями. Их покрывают как трансферрином, так и антителами к его рецепторам, что помогает наночастицам выиграть конкуренцию с естественным трансферрином. Подход этот, как бы хорошо ни выглядел внешне, встречает существенные трудности [12]. Во-первых, рецепторы трансферрина подвергаются рециклингу с какой-то невероятной интенсивностью — примерно 90% их деградирует внутри клетки, что сильно снижает шансы наночастицам попасть в паренхиму мозга. Во-вторых, бивалентные антитела к трансферриновым рецепторам переносятся также в лизосомы и утягивают с собой препараты, где препараты деградируют под действием лизосомальных ферментов. В-третьих, у мышей экспрессия рецепторов к трансферрину в мозге в 2,5 раза выше, что затрудняет экстраполяцию результатов на человека. Ну и как «вишенка» на всем этом — трансферриновые рецепторы широко экспрессируются в периферических тканях, создавая угрозу множества нежелательных эффектов. Возможно, из-за указанных причин несколько небольших клинических испытаний наночастиц против опухолей завершились неудачей [50]. О более масштабных испытаниях нигде не сообщается.
Под рециклингом рецепторов подразумевается их круговорот. Обычно рецепторы, связываясь с лигандом, погружаются внутрь клетки, где происходит их рассоединение с лигандом и со вторичными посредниками, а сам рецептор возвращается на мембрану. Но часть рецепторов подвергается деградации.
Наночастицы к рецепторам ЛНП можно покрыть самим аполипопротеином либо интегрировать его в структуру наночастицы. В одной из старых работ применили довольно хитроумный подход, покрыв полисорбатом-80 наночастицы из поли-бутилцианакрилата. Полисорбат собрал на себя аполипопротеин из плазмы и таким образом позволил частицам связаться с рецепторами ЛНП и проникнуть в паренхиму мозга [52]. Также наночастицы можно покрывать пептидами, представляющими собой короткие участки рецепторов ЛНП. Есть здесь и еще одна привлекательная мишень — белки, ассоциированные с рецепторами ЛНП, особенно LRP1 [51]. Оказалось, что этот белок широко экспрессируется в ГЭБ человека. Пептид ангиопеп-2 специфически связывается с LRP1, поэтому конъюгированные с ним препараты хорошо преодолевают ГЭБ и попадают в опухоли. В настоящее время завершилась уже вторая фаза клинических испытаний ANG1005 (паклитаксел + ангиопеп-2) на пациентах с лептоменингиальным карциноматозом , и результаты пока обнадеживающие. Вероятно, подобный подход может найти применение и за пределами нейроонкологии. Так, на модели инсульта у крыс была показана эффективность наночастиц оксида церия (CeO2) покрытых ангиопеп-2 и препаратом эдаравоном [53]. Наночастицы CeO2 и сами по себе могут быть потенциально эффективны. Как показал биоинформатический анализ [54], они могут эффективно связываться с α-синуклеином и предотвращать его агрегацию. Поскольку часто α-синуклеин ассоциируется с патогенезом болезни Паркинсона, у наночастиц CeO2, кажется, есть потенциал для терапии этого заболевания.
В данном случае речь идет о пациентках с раком молочной железы, у которых образовались метастазы в мозге.
Теперь стоит сказать пару слов о транспортерах. В качестве примера таковых можно привести изоформу транспортера глюкозы (GLUT-1) и транспортер крупных аминокислот (LAT). Через них в мозг попадают габапентин и L-DOPA, применяемые, соответственно, для терапии эпилепсии и паркинсонизма. Увы, пропускать макромолекулярные соединения транспортеры не могут. Но задача ведь перехитрить ГЭБ. Так, индийские исследователи создали липосомы, покрытые амфифильной L-DOPA (Amphi-DOPA), и ввели их мышам с привитой глиобластомой. Липосомы связывались с LAT и специфически аккумулировались в головном мозге. Когда в эти липосомы поместили ДНК-вакцину против глиобластомы, выживаемость мышей увеличивалась на 300% [55]! Впрочем, несмотря на впечатляющие результаты, здесь все пока остановилось на доклинических испытаниях.
Парамагнитные наночастицы
Управлять временем, местом и скоростью доставки препарата можно, если воспользоваться магнитными наночастицами. На сегодняшний день большее внимание привлекают суперпарамагнитные наночастицы оксида железа (superparamagnetic iron oxide nanoparticles, SPIONs). Размер частиц может варьировать от 10 до 100 нм, но чем частица меньше, тем магниточувствительность выше. При небольшом размере частиц и сила магнитного поля требуется меньше, что для клеток, безусловно, хорошо. Последние данные показывают, что SPIONs могут напрямую взаимодействовать с белками, образующими межклеточные контакты эндотелиальных клеток, такими как VE-кадгерин, что позволяет преодолевать ГЭБ не только с помощью нанопорации, но и парацеллюлярным путем. Для того, чтобы на поверхности SPIONs разместить лекарственное средство, их дополнительно покрывают различными полимерами и липидами (производят функционализацию) (рис. 10). Кроме того, дополнительные покровы помогают наночастицам дольше удерживаться в мозге. Например, покрытые полистиреном SPIONs остаются в паренхиме мозга в 25 раз дольше, чем непокрытые. SPIONs можно спрятать внутри липосомы, что обеспечивает полную проницаемость через ГЭБ и позволяет таким образом транспортировать пептиды и даже нейротрофические факторы [12]. На сегодняшний день SPIONs не применяются даже как контраст для МРТ. Коммерчески доступный контраст на основе супермаленьких SPIONs — Sinerem — был отозван с рынка еще в 2008 году. Каких-то выдающихся результатов в лечении заболеваний ЦНС, хотя бы в доклинических испытаниях, тоже пока нет. Вероятно, все упирается в токсичность SPIONs. Когда частицы лишаются своих полимерных покровов, их токсичность возрастает в шесть раз. «Голые» частицы склонны аккумулироваться и вызывать иммунный ответ, а кроме того, нарушают ионный гомеостаз, вызывают оксидативный стресс и даже нарушают репродуктивную функцию (к счастью, временно) [56].
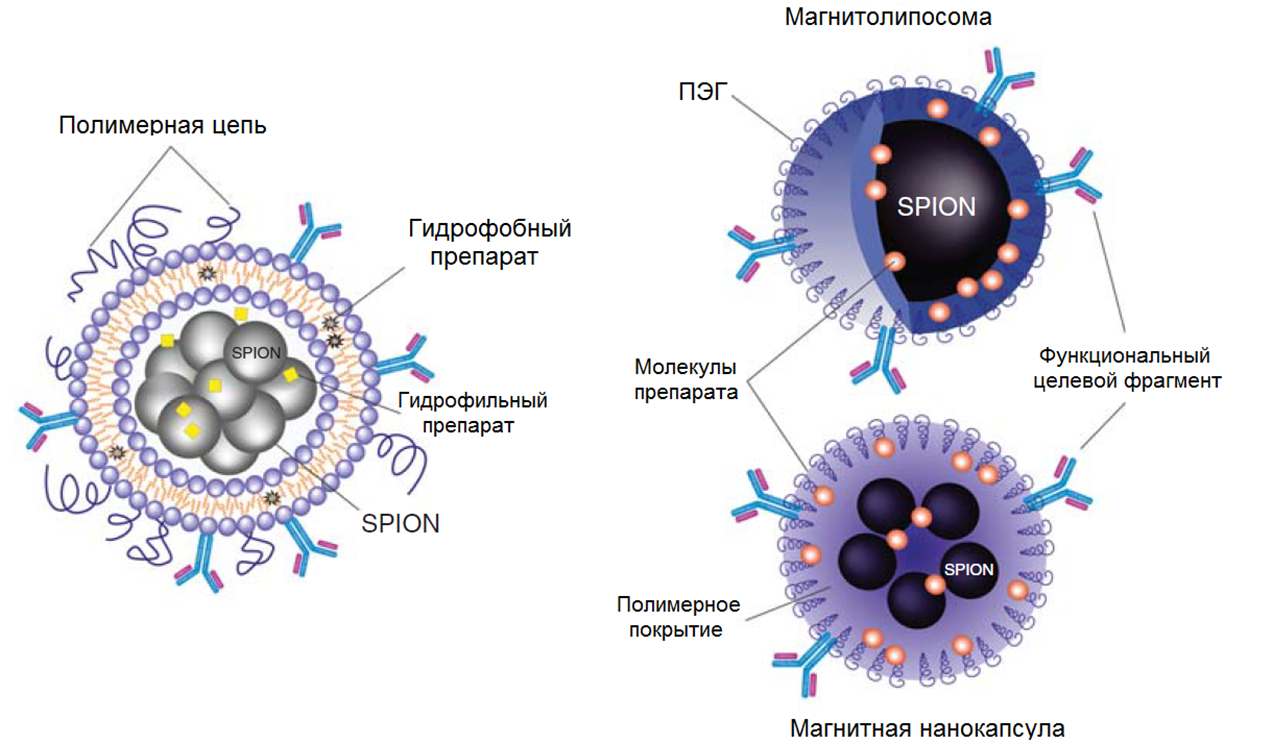
Рисунок 10. Примеры функционализации SPIONs и превращения их в магнитолипосомы.
Возможно, на фоне проблем со SPIONs больший успех может ожидать катионные магнитоэлектрические наночастицы (MENPs). Ядро частицы составляет покрытый полифенолом оксид железа (CoFe2O3), а оболочкой служит титанат бария (BaTiO3). MENPs проникают через ГЭБ под действием постоянного магнитного поля, а в переменном магнитном поле происходит высвобождение препарата. Это действительно похоже на управление скоростью и временем доставки. В нескольких исследованиях MENPs использовали для доставки средств против ВИЧ в нервные клетки — правда, пока что только in vitro. Это очень актуальная проблема, так как антиретровирусные препараты плохо проникают через ГЭБ, и в ЦНС сохраняется резервуар вируса. На мышах и бабуинах показано, что MENPs безопасны, но каких-либо терапевтических эффектов еще не исследовалось [57], [58].
Клетки-носители (концепция «Троянского коня»)
Через ГЭБ естественным путем в мозг просачиваются лейкоцитарные клетки (макрофаги, моноциты и нейтрофилы). А раз лейкоциты естественным образом оснащены всем необходимым инструментарием для пересечения ГЭБ, не проще ли использовать их как носители для лекарств? Для этого, конечно, лекарство нужно упаковать в наночастицу, чтобы оно не оказалось «переварено» внутри живого лейкоцита на полпути к цели. К примеру, в одном исследовании нейтрофилы, взятые от мышей, нагрузили липосомами с препаратом паклитаксел и ввели им обратно после того, как удалили привитую глиому [59]. Провоспалительные цитокины, в обилии секретируемые после операции, послужили для нейтрофилов «приманкой», и они безошибочно доставили лекарство в область резекции. Высокая же концентрация цитокинов стимулировала и секрецию липосом из нейтрофилов. Конечно, полностью удалить остатки опухоли не получилось, но повторный рост сильно замедлился.
Очевидные недостатки у метода тоже есть. Во-первых, клетка неминуемо «переварит» часть липосом вместе с лекарством. Во-вторых, далеко не все клетки, инъецированные в кровеносное русло, останутся в живых и доберутся до пораженной области. В-третьих (и это следует из предыдущего пункта), инъекция сколь-нибудь заметного количества лейкоцитов может спровоцировать иммунную активацию. В одной из работ подошли достаточно креативно к терапии ишемического инсульта. Исследователи решили взять на вооружение тромбоциты, но не сами клетки, а их мембрану [60]. Ядро наночастицы из декстрана содержало нейропротективное средство, а оболочкой была тромбоцитарная мембрана, конъюгированная с ТАТ-пептидом , расщепляемым тромбином, и активатором тканевого плазминогена. Здесь высокий уровень тромбина в ишемизированном участке выполнял функцию приманки и, действуя на активатор плазминогена, высвобождал содержимое наночастицы. На модельных крысах с индуцированным ишемическим инсультом благодаря такому подходу удалось добиться 60–70% снижения размера ишемической области, что впечатляет. Свое «НО» есть и здесь. При имитации тромбоцита и введении такой наночастицы в кровеносное русло возникает серьезный риск спровоцировать... тромбы.
Этот пептид — представитель большой группы CPPs (Cell-penetrating peptides): белков, которые способны проникать через клеточную мембрану. Как это точно происходит, пока неизвестно; конкретно ТАТ помогает вирусу ВИЧ проникать в человеческие клетки. Про «троянские» пептиды можно прочитать в статье, опубликованной «Биомолекулой» [61].
Это делается путем временного перевязывания срединно-мозговой артерии. Хотя в контексте указанного исследования адекватность такой модели вызывает сомнения, ведь тромба здесь не образуется. Но, с другой стороны, эффект есть? Есть.
Есть, однако, еще один вариант, как поставить на службу исследователям естественные клеточные механизмы. В крови циркулирует большое количество экзосом (о них есть статья на «Биомолекуле» [62]). Это такие маленькие (20–200 нм) везикулы, секретируемые клетками, обычно утыканные рецепторами. Среди молекулярного богатства на мембране экзосом имеются трансферриновые рецепторы. А мы уже знаем, что это верный способ проникнуть через ГЭБ. Одна группа исследователей попыталась использовать экзосомы для доставки дофамина в мозг мышей, у которых была смоделирована болезнь Паркинсона [63]. У этих же мышей был взят образец крови, выделены свежие экзосомы, проинкубированы с дофамином и введены обратно в кровеносное русло (рис. 11). Через 6–8 часов в головном мозге наблюдалась максимальная аккумуляция экзосом, а уровень дофамина повысился в 15 раз . У мышей также отмечалось восстановление дофаминовой нейротрансмиссии в поврежденном стриатуме. Но мы можем вспомнить третью главу данной статьи, где говорится про трансферриновые рецепторы. Авторы сообщили о низкой системной токсичности вводимых экзосом, но вместе с тем привели данные об уровне дофамина в периферических тканях и крови, и там он тоже повышен в десятки раз! Учитывая, сколько всего делает дофамин за пределами мозга — от контроля расслабления сосудов до регуляции выработки инсулина, — этого достаточно, чтобы насторожиться. Пожалуй, и в данном случае стоит серьезно задуматься о безопасности метода и не спешить экстраполировать все на пациентов.
Для сравнения, L-DOPA, стандартно применяемая для терапии паркинсонизма, имеет крайне низкую биодоступность, так как 99% вводимого препарата еще в периферическом кровотоке подвергается конвертации в дофамин, а он через ГЭБ проходит очень плохо.
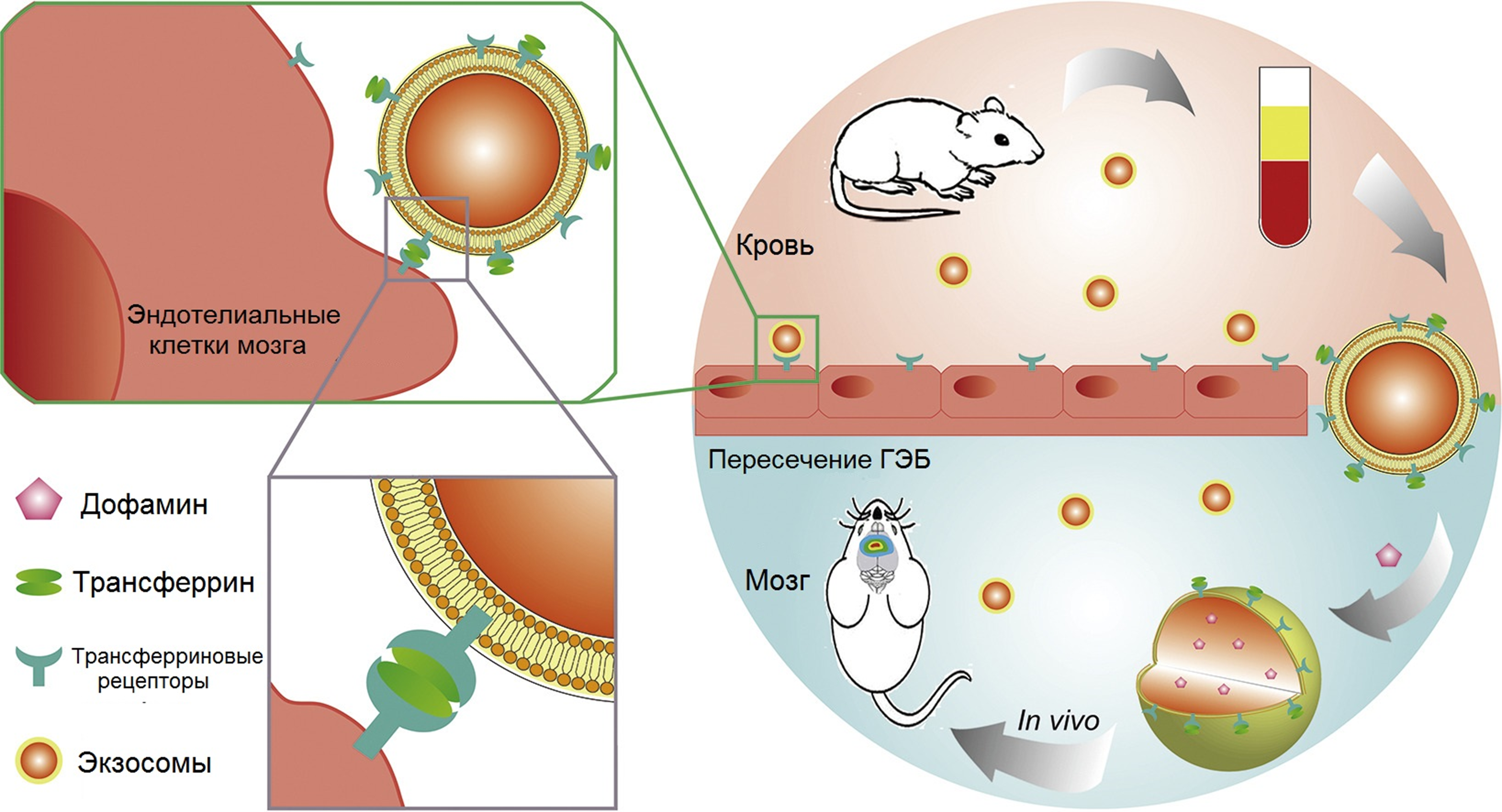
Рисунок 11. Применение экзосом для доставки дофамина в мозг мышей.
Заключение
... когда услышите звук трубы, тогда весь народ пусть воскликнет громким голосом, и стена города обрушится до своего основания...
В этой статье мы лишь коснулись темы адресной доставки терапевтических средств в мозг. Для подробного разбора понадобился бы увесистый том! Но кое-какие выводы можно сделать и на основе имеющейся информации. В глаза бросается, что, чем дальше мы удаляемся от грубых инвазивных методик преодоления ГЭБ в сторону более точных и вроде бы щадящих подходов, тем меньше мы видим клинических испытаний. Но есть и иная диспропорция. Чем ближе мы смотрим на неинвазивные методы, тем больше видим разнообразных подходов и усовершенствований. Многообразие подходов вместе с тем требует их детального сравнительного исследования для оценки эффективности и безопасности. К сожалению, таких работ сейчас практически нет. Исследователям приходится для аналитических обзоров экстрагировать данные из других исследований, многие из которых не соответствуют необходимым строгим критериям.
На примере синдрома Хантера видно, что можно лечить это заболевание путем инъекции вирусных частиц в мозг, а можно и неинвазивными методом. И клиницисты всегда с большей охотой выберут второй вариант, ведь цель — обеспечить надежным лечением как можно большее число пациентов. В большинстве случаев, если мы говорим не об опухолях, для инвазивных методов существуют альтернативы, но все упирается в недостаток данных об эффективности и безопасности. Как уже упоминалось, критерии безопасности из области нейроонкологии, где традиционно выше толерантность к «сопутствующему ущербу», неприменимы к лечению, скажем, деменции. Так как с мышей и крыс нельзя всё автоматически экстраполировать на человека (хотя бы по причине разного уровня экспрессии рецепторов и структурных белков ГЭБ), важны и нужны более детальные исследования, по возможности и на нечеловекообразных приматах.
Сказанное, однако, не означает, что нужно оставить поисковые исследования. Поиск новых молекулярных мишеней, компьютерное моделирование и синтез новых материалов должны продолжаться. Если будут обозначены (хотя бы пунктиром) наиболее перспективные направления, исследования в области адресной доставки получат новый импульс, и практические результаты не заставят себя долго ждать. Возможно, когда фармкомпании и исследовательские центры будут иметь на руках более полную информацию, они охотнее решатся на финансирование и организацию клинических испытаний. А там уже будут видны перспективы широкого внедрения в клиническую практику. Пока же остается надеяться на лучшее и готовить «осадные орудия».
Литература
- Valery L Feigin, Theo Vos, Emma Nichols, Mayowa O Owolabi, William M Carroll, et. al.. (2020). The global burden of neurological disorders: translating evidence into policy. The Lancet Neurology. 19, 255-265;
- Blood-brain barrier. Связующее между двумя мирами — кровеносной и центральной нервной системами;
- Hao-Li Liu, Po-Hung Hsu, Chung-Yin Lin, Chiun-Wei Huang, Wen-Yen Chai, et. al.. (2016). Focused Ultrasound Enhances Central Nervous System Delivery of Bevacizumab for Malignant Glioma Treatment. Radiology. 281, 99-108;
- Hans-Peter Hartung, Bruce A.C. Cree, Michael Barnett, Sven G. Meuth, Amit Bar-Or, Lawrence Steinman. (2023). Bioavailable central nervous system disease-modifying therapies for multiple sclerosis. Front. Immunol.. 14;
- Rebecca L. Siegel, Kimberly D. Miller, Hannah E. Fuchs, Ahmedin Jemal. (2021). Cancer Statistics, 2021. CA A Cancer J Clinicians. 71, 7-33;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Терапевтические моноклональные антитела;
- Свет в конце туннеля: генная терапия болезней зрения;
- Ликбез по ЦНС;
- Yuri Persidsky, Servio H. Ramirez, James Haorah, Georgette D. Kanmogne. (2006). Blood–brain Barrier: Structural Components and Function Under Physiologic and Pathologic Conditions. Jrnl Neuroimmune Pharm. 1, 223-236;
- William M. Pardridge. (2005). The blood-brain barrier: Bottleneck in brain drug development. Neurotherapeutics. 2, 3-14;
- Sukanya Bhunia, Nagesh Kolishetti, Arti Vashist, Adriana Yndart Arias, Deborah Brooks, Madhavan Nair. (2023). Drug Delivery to the Brain: Recent Advances and Unmet Challenges. Pharmaceutics. 15, 2658;
- Panagiotis Mastorakos, Dorian McGavern. (2019). The anatomy and immunology of vasculature in the central nervous system. Sci. Immunol.. 4;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Rrita Daci, Terence R. Flotte. (2024). Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. IJMS. 25, 1050;
- Christian Hinderer, Peter Bell, Charles H Vite, Jean-Pierre Louboutin, Rebecca Grant, et. al.. (2014). Widespread gene transfer in the central nervous system of cynomolgus macaques following delivery of AAV9 into the cisterna magna. Molecular Therapy - Methods & Clinical Development. 1, 14051;
- Priya U Kumthekar, Michael J Avram, Andrew B Lassman, Nancy U Lin, Eudocia Lee, et. al.. (2023). A phase I/II study of intrathecal trastuzumab in human epidermal growth factor receptor 2-positive (HER2-positive) cancer with leptomeningeal metastases: Safety, efficacy, and cerebrospinal fluid pharmacokinetics. Neuro-Oncology. 25, 557-565;
- Florence Oberkampf, Maya Gutierrez, Olfa Trabelsi Grati, Émilie Le Rhun, Olivier Trédan, et. al.. (2023). Phase II study of intrathecal administration of trastuzumab in patients with HER2-positive breast cancer with leptomeningeal metastasis. Neuro-Oncology. 25, 365-374;
- Miłosz Pinkiewicz, Mateusz Pinkiewicz, Jerzy Walecki, Artur Zaczyński, Michał Zawadzki. (2024). Breaking Barriers in Neuro-Oncology: A Scoping Literature Review on Invasive and Non-Invasive Techniques for Blood–Brain Barrier Disruption. Cancers. 16, 236;
- Daniel Kreatsoulas, Mark Damante, Santino Cua, Russell R. Lonser. (2024). Adjuvant convection-enhanced delivery for the treatment of brain tumors. J Neurooncol. 166, 243-255;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Alan Whone, Matthias Luz, Mihaela Boca, Max Woolley, Lucy Mooney, et. al.. (2019). Randomized trial of intermittent intraputamenal glial cell line-derived neurotrophic factor in Parkinson’s disease. Brain. 142, 512-525;
- Alan L. Whone, Mihaela Boca, Matthias Luz, Max Woolley, Lucy Mooney, et. al.. (2019). Extended Treatment with Glial Cell Line-Derived Neurotrophic Factor in Parkinson’s Disease. JPD. 9, 301-313;
- Henri J. Huttunen, Sigrid Booms, Magnus Sjögren, Vera Kerstens, Jarkko Johansson, et. al.. (2023). Intraputamenal Cerebral Dopamine Neurotrophic Factor in Parkinson's Disease: A Randomized, Double‐Blind, Multicenter Phase 1 Trial. Movement Disorders. 38, 1209-1222;
- John D. Heiss, Codrin Lungu, Dima A. Hammoud, Peter Herscovitch, Debra J. Ehrlich, et. al.. (2019). Trial of magnetic resonance–guided putaminal gene therapy for advanced Parkinson's disease. Movement Disorders. 34, 1073-1078;
- Bhuvic Patel, Peter H. Yang, Albert H. Kim. (2020). The effect of thermal therapy on the blood-brain barrier and blood-tumor barrier. International Journal of Hyperthermia. 37, 35-43;
- Afshin Salehi, Mounica R Paturu, Bhuvic Patel, Matthew D Cain, Tatenda Mahlokozera, et. al.. (2020). Therapeutic enhancement of blood–brain and blood–tumor barriers permeability by laser interstitial thermal therapy. Neuro-Oncology Advances. 2;
- От медицинской онкологии к молекулярной биологии рака;
- Jongha Lee, Hye Rim Cho, Gi Doo Cha, Hyunseon Seo, Seunghyun Lee, et. al.. (2019). Flexible, sticky, and biodegradable wireless device for drug delivery to brain tumors. Nat Commun. 10;
- Yang Xinchen, Tan Jing, Guan Jiaoqiong. (2023). Lipid-based nanoparticles via nose-to-brain delivery: a mini review. Front. Cell Dev. Biol.. 11;
- Thuy Trang Nguyen, Thi Thuy Dung Nguyen, Nguyen-Minh-An Tran, Giau Van Vo. (2022). Lipid-Based Nanocarriers via Nose-to-Brain Pathway for Central Nervous System Disorders. Neurochem Res. 47, 552-573;
- Anmol Arora, Shobhit Kumar, Javed Ali, Sanjula Baboota. (2020). Intranasal delivery of tetrabenazine nanoemulsion via olfactory region for better treatment of hyperkinetic movement associated with Huntington’s disease: Pharmacokinetic and brain delivery study. Chemistry and Physics of Lipids. 230, 104917;
- Clara Grosso, Aurora Silva, Cristina Delerue-Matos, Maria Fátima Barroso. (2023). Single and Multitarget Systems for Drug Delivery and Detection: Up-to-Date Strategies for Brain Disorders. Pharmaceuticals. 16, 1721;
- Liang Han. (2021). Modulation of the Blood–Brain Barrier for Drug Delivery to Brain. Pharmaceutics. 13, 2024;
- Taichi Sugawara, Kyoko Furuse, Tetsuhisa Otani, Tomohiko Wakayama, Mikio Furuse. (2021). Angulin-1 seals tricellular contacts independently of tricellulin and claudins. Journal of Cell Biology. 220;
- Susanne M. Krug, Tomohiro Hayaishi, Daisuke Iguchi, Akihiro Watari, Azusa Takahashi, et. al.. (2017). Angubindin-1, a novel paracellular absorption enhancer acting at the tricellular tight junction. Journal of Controlled Release. 260, 1-11;
- Satoshi Zeniya, Hiroya Kuwahara, Kaiichi Daizo, Akihiro Watari, Masuo Kondoh, et. al.. (2018). Angubindin-1 opens the blood–brain barrier in vivo for delivery of antisense oligonucleotide to the central nervous system. Journal of Controlled Release. 283, 126-134;
- Brij S. Karmur, Justine Philteos, Aram Abbasian, Brad E. Zacharia, Nir Lipsman, et. al.. (2020). Blood-Brain Barrier Disruption in Neuro-Oncology: Strategies, Failures, and Challenges to Overcome. Front. Oncol.. 10;
- E A Neuwelt, D L Goldman, S A Dahlborg, J Crossen, F Ramsey, et. al.. (1991). Primary CNS lymphoma treated with osmotic blood-brain barrier disruption: prolonged survival and preservation of cognitive function.. JCO. 9, 1580-1590;
- Paul C. Williams, W. David Henner, Roman-Goldstein Simon, Suellen A. Dahlborg, Robert E. Brummett, et. al.. (1995). Toxicity and Efficacy of Carboplatin and Etoposide in Conjunction with Disruption of the Blood-Brain Tumor Barrier in the Treatment of Intracranial Neoplasms. Neurosurgery. 37, 17-28;
- Ko-Ting Chen, Kuo-Chen Wei, Hao-Li Liu. (2021). Focused Ultrasound Combined with Microbubbles in Central Nervous System Applications. Pharmaceutics. 13, 1084;
- Ying Meng, Christopher B. Pople, Harriet Lea-Banks, Agessandro Abrahao, Benjamin Davidson, et. al.. (2019). Safety and efficacy of focused ultrasound induced blood-brain barrier opening, an integrative review of animal and human studies. Journal of Controlled Release. 309, 25-36;
- Nicolas Asquier, Guillaume Bouchoux, Michael Canney, Cyril Martin, Bruno Law-Ye, et. al.. (2020). Blood-brain barrier disruption in humans using an implantable ultrasound device: quantification with MR images and correlation with local acoustic pressure. Journal of Neurosurgery. 132, 875-883;
- Ying Meng, Kullervo Hynynen, Nir Lipsman. (2021). Applications of focused ultrasound in the brain: from thermoablation to drug delivery. Nat Rev Neurol. 17, 7-22;
- Skyler J. Mooney, Kairavi Shah, Sharon Yeung, Alison Burgess, Isabelle Aubert, Kullervo Hynynen. (2016). Focused Ultrasound-Induced Neurogenesis Requires an Increase in Blood-Brain Barrier Permeability. PLoS ONE. 11, e0159892;
- Alison Burgess, Tam Nhan, Clare Moffatt, A.L. Klibanov, Kullervo Hynynen. (2014). Analysis of focused ultrasound-induced blood–brain barrier permeability in a mouse model of Alzheimer's disease using two-photon microscopy. Journal of Controlled Release. 192, 243-248;
- Циклодекстрины — уникальные молекулы для создания современных лекарств и не только...;
- Jana Ghitman, Stefan Ioan Voicu. (2023). Controlled drug delivery mediated by cyclodextrin-based supramolecular self-assembled carriers: From design to clinical performances. Carbohydrate Polymer Technologies and Applications. 5, 100266;
- Tejaswi Koneru, Eva McCord, Shreya Pawar, Katyayani Tatiparti, Samaresh Sau, Arun K. Iyer. (2021). Transferrin: Biology and Use in Receptor-Targeted Nanotherapy of Gliomas. ACS Omega. 6, 8727-8733;
- Torayuki Okuyama, Yoshikatsu Eto, Norio Sakai, Kohtaro Minami, Tatsuyoshi Yamamoto, et. al.. (2019). Iduronate-2-Sulfatase with Anti-human Transferrin Receptor Antibody for Neuropathic Mucopolysaccharidosis II: A Phase 1/2 Trial. Molecular Therapy. 27, 456-464;
- Shreya Pawar, Tejaswi Koneru, Eva McCord, Katyayani Tatiparti, Samaresh Sau, Arun K Iyer. (2021). LDL receptors and their role in targeted therapy for glioma: a review. Drug Discovery Today. 26, 1212-1225;
- Jörg Kreuter, Dmitry Shamenkov, Valery Petrov, Peter Ramge, Klaus Cychutek, et. al.. (2002). Apolipoprotein-mediated Transport of Nanoparticle-bound Drugs Across the Blood-Brain Barrier. Journal of Drug Targeting. 10, 317-325;
- Qunqun Bao, Ping Hu, Yingying Xu, Tiansheng Cheng, Chenyang Wei, et. al.. (2018). Simultaneous Blood–Brain Barrier Crossing and Protection for Stroke Treatment Based on Edaravone-Loaded Ceria Nanoparticles. ACS Nano. 12, 6794-6805;
- Aman Chandra Kaushik, Shiv Bharadwaj, Sanjay Kumar, Dong-Qing Wei. (2018). Nano-particle mediated inhibition of Parkinson’s disease using computational biology approach. Sci Rep. 8;
- Sukanya Bhunia, Venugopal Vangala, Dwaipayan Bhattacharya, Halley Gora Ravuri, Madhusudana Kuncha, et. al.. (2017). Large Amino Acid Transporter 1 Selective Liposomes of
l -DOPA Functionalized Amphiphile for Combating Glioblastoma. Mol. Pharmaceutics. 14, 3834-3847; - Sophie Laurent, Amir Ata Saei, Shahed Behzadi, Arash Panahifar, Morteza Mahmoudi. (2014). Superparamagnetic iron oxide nanoparticles for delivery of therapeutic agents: opportunities and challenges. Expert Opinion on Drug Delivery. 11, 1449-1470;
- Ajeet Kaushik, Rahul D. Jayant, Roozbeh Nikkhah-Moshaie, Vinay Bhardwaj, Upal Roy, et. al.. (2016). Magnetically guided central nervous system delivery and toxicity evaluation of magneto-electric nanocarriers. Sci Rep. 6;
- Ajeet Kaushik, Jose Rodriguez, Dan Rothen, Vinay Bhardwaj, Rahul Dev Jayant, et. al.. (2019). MRI-Guided, Noninvasive Delivery of Magneto-Electric Drug Nanocarriers to the Brain in a Nonhuman Primate. ACS Appl. Bio Mater.. 2, 4826-4836;
- Jingwei Xue, Zekai Zhao, Lei Zhang, Lingjing Xue, Shiyang Shen, et. al.. (2017). Neutrophil-mediated anticancer drug delivery for suppression of postoperative malignant glioma recurrence. Nature Nanotech. 12, 692-700;
- Jianpei Xu, Xiaoqi Wang, Haoyuan Yin, Xiang Cao, Quanyin Hu, et. al.. (2019). Sequentially Site-Specific Delivery of Thrombolytics and Neuroprotectant for Enhanced Treatment of Ischemic Stroke. ACS Nano. 13, 8577-8588;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Экзосома — механизм координации и взаимопомощи клеток организма;
- Mengke Qu, Qing Lin, Luyi Huang, Yao Fu, Luyao Wang, et. al.. (2018). Dopamine-loaded blood exosomes targeted to brain for better treatment of Parkinson's disease. Journal of Controlled Release. 287, 156-166;
- O. Semyachkina-Glushkovskaya, A. Esmat, D. Bragin, O. Bragina, A. A. Shirokov, et. al.. (2020). Phenomenon of music-induced opening of the blood-brain barrier in healthy mice. Proc. R. Soc. B.. 287, 20202337;
- Anastasiya Runnova, Maksim Zhuravlev, Rodion Ukolov, Inna Blokhina, Alexander Dubrovski, et. al.. (2021). Modified wavelet analysis of ECoG-pattern as promising tool for detection of the blood–brain barrier leakage. Sci Rep. 11;
- Nadezhda Semenova, Konstantin Segreev, Andrei Slepnev, Anastasiya Runnova, Maxim Zhuravlev, et. al.. (2021). Blood-brain barrier permeability changes: nonlinear analysis of ECoG based on wavelet and machine learning approaches. Eur. Phys. J. Plus. 136;
- A. N. Pavlov, A. P. Khorovodov, A. T. Mamedova, A. A. Koronovskii, O. N. Pavlova, et. al.. (2021). Changes in blood–brain barrier permeability characterized from electroencephalograms with a combined wavelet and fluctuation analysis. Eur. Phys. J. Plus. 136;
- O. Semyachkina-Glushkovskaya, D. Bragin, O. Bragina, Y. Yang, A. Abdurashitov, et. al.. (2021). Mechanisms of Sound-Induced Opening of the Blood-Brain Barrier. Advances in Experimental Medicine and Biology. 197-202;
- Oxana Semyachkina-Glushkovskaya, Alexander Khorovodov, Ivan Fedosov, Alexey Pavlov, Alexander Shirokov, et. al.. (2021). A Novel Method to Stimulate Lymphatic Clearance of Beta-Amyloid from Mouse Brain Using Noninvasive Music-Induced Opening of the Blood–Brain Barrier with EEG Markers. Applied Sciences. 11, 10287;
- O.V. Semyachkina-Glushkovskaya, A.S. Karavaev, M.D. Prokhorov, A.E. Runnova, E.I. Borovkova, et. al.. (2023). EEG biomarkers of activation of the lymphatic drainage system of the brain during sleep and opening of the blood-brain barrier. Computational and Structural Biotechnology Journal. 21, 758-768;
- Oxana Semyachkina-Glushkovskaya, Sergey Diduk, Eroshova Anna, Dosadina Elina, Kruglov Artem, et. al.. (2022). Music improves the therapeutic effects of bevacizumab in rats with glioblastoma: Modulation of drug distribution to the brain. Front. Oncol.. 12.