Бактериофаги в действии: аспекты их практического применения в ветеринарии, сельском хозяйстве и экологии
20 мая 2022
Бактериофаги в действии: аспекты их практического применения в ветеринарии, сельском хозяйстве и экологии
- 3779
- 0
- 10
Бактериофаги находят применение в ветеринарии и различных областях сельского хозяйства: животноводстве, аквакультуре, растениеводстве, пищевой безопасности и др. Иллюстрация в высоком разрешении.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редактор
-
Рецензент
-
Иллюстратор
Использование на практике бактериофагов — вирусов, помогающих бороться с болезнетворными бактериями, — открывает всё новые перспективы. Препараты на основе бактериофагов хорошо себя зарекомендовали и уверенно завоевывают новые ниши на рынке. Появляется всё больше сторонников их применения в ветеринарии и сельском хозяйстве. При глубоком изучении механизма действия и правильном применении бактериофаги способны помочь человеку организовать вокруг себя безопасную окружающую среду — о чем мы и расскажем в очередной публикации спецпроекта.
Бактериофаги

Партнер спецпроекта — НПЦ «Микромир» — производитель препаратов с бактериофагами для применения в медицине и ветеринарии.
Бактериофаги — это вирусы, заражающие бактериальные клетки. Они составляют наиболее многочисленную и эволюционно древнюю группу вирусов в биосфере Земли. Бактериофаги играют важную роль в контроле численности микробных популяций и в горизонтальном переносе бактериальных генов, выступая в качестве векторных систем.
В спецпроекте мы дадим общую информацию о бактериофагах, истории их изучения, использовании в лаборатории, попытках применения в медицине и ветеринарии и возможных будущих применениях.
Бактериофаги — удивительные биологические агенты. Несмотря на достаточно простой функционал, история их открытия и происхождения увлечет любого даже самого требовательного режиссера-сценариста. В этом наши читатели могут убедиться самостоятельно, прочитав в спецпроекте «Биомолекулы», посвященном фагам, первую статью: «Огромный и загадочный мир бактериофагов» [1]. Если же знакомство с миром бактериальных вирусов состоялось, и интерес к этим необычным микроорганизмам не ослаб, то давайте разбираться в аспектах и возможностях применения препаратов бактериофагов в ветеринарии, сельском хозяйстве и экологии (рис. 1). О медицине же мы особо поговорим в следующей публикации.

Рисунок 1. Фаги vs антибиотики: вместо или вместе. Знакомимся с возможностями применения бактериофагов.
анимация Валерии Кузык
Ветеринарный рынок антибиотиков и фагов. Анализ, тренды, прогноз
До появления антибиотиков, по статистике, в США 30% смертей случалось из-за бактериальных инфекций [2]. И в медицинской сфере, и в ветеринарной практике внедрение антибактериальных препаратов стало важной исторической вехой, которой посвящен отдельный спецпроект «Биомолекулы» — «Антибиотики и антибиотикорезистентность». У домашних и сельскохозяйственных животных такие препараты используют для лечения инфекционных заболеваний, а также профилактически — для поддержания их здоровья и обеспечения производства продовольственной продукции во всем мире на жизненно необходимом уровне. Такое профилактическое применение антибиотиков в животноводстве законодательно ограничивается, но всё еще достаточно часто встречается.
Согласно некоторым источникам, 70% всех антибиотиков применяется в сельском хозяйстве, а в медицине — только около 20%! Однако по данным официальной статистики ЕС, пропорции антибиотиков, применяемых в медицине и животноводстве, существенно различаются в разных странах (рис. 2).
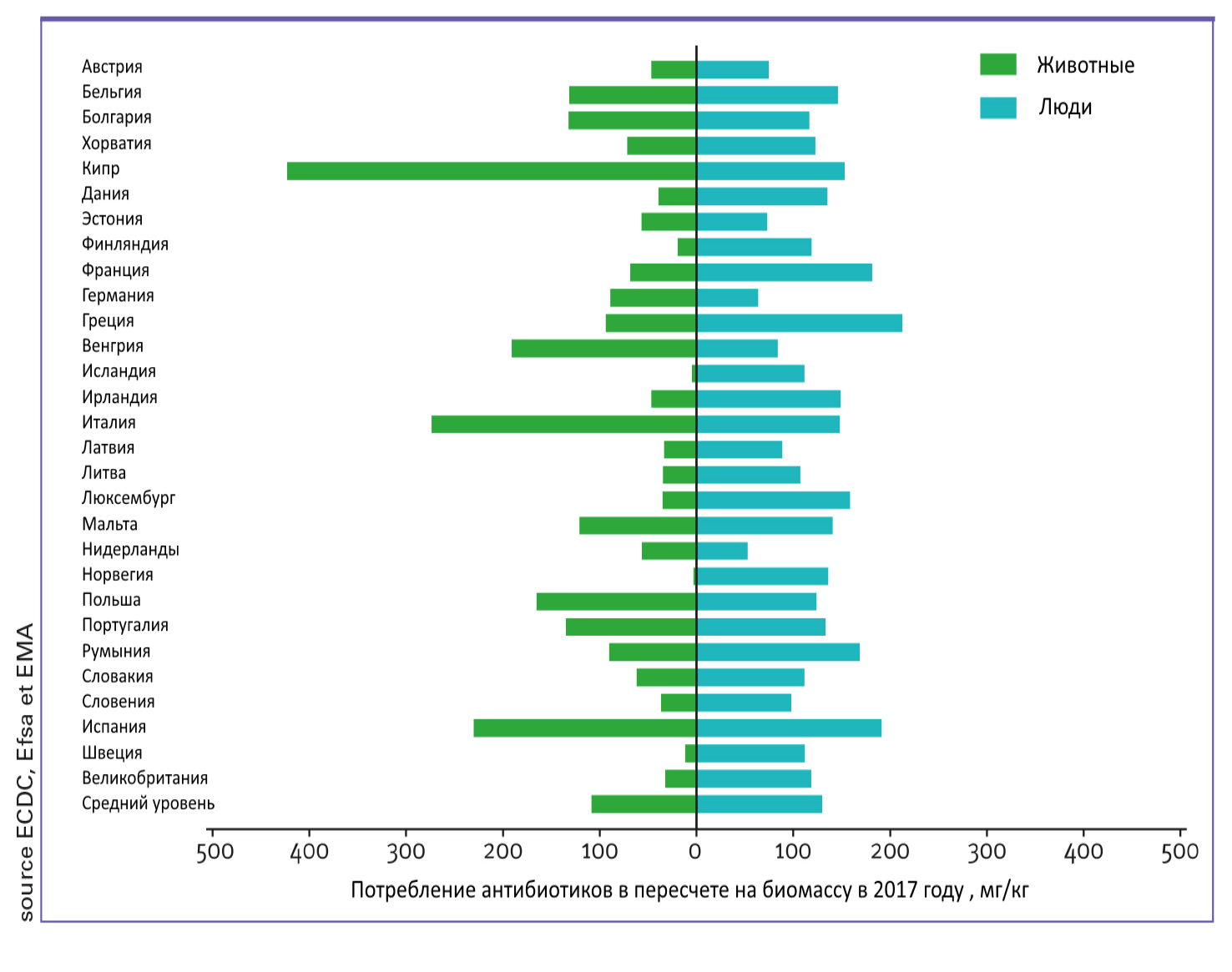
Рисунок 2. Сравнение потребления антибиотиков в медицине и ветеринарии в разных странах в 2017 г.
За так называемую «золотую эру» (1940–1962 годы) было открыто большинство классов антибиотиков, которые используются в ветеринарии до сих пор — например, тетрациклины. Объем мирового рынка ветеринарных антибиотиков в 2021 году составлял 1,2 млрд долларов, а к 2025 году, согласно прогнозам аналитической компании Coherent Market Insights, достигнет 1,5 млрд долларов. Среднегодовой темп роста объема мирового рынка ветеринарных антибиотиков — примерно 3,8%.
Топ ключевых игроков:
- Bayer AG;
- Boehringer Ingelheim GmbH;
- Ceva Sante Animale;
- Crystal Pharma;
- Dechra Pharmaceuticals;
- Huvepharma;
- Eli Lilly & Co;
- Elanko;
- Merk & Co;
- Sanofi;
- Vetoquinol USA;
- Virbac;
- Zoetis
и другие.
По регионам рынок ветеринарных антибиотиков сегментирован на Северную (основная доля рынка) и Латинскую Америки, Азиатско-Тихоокеанский регион (быстро растущая доля рынка), Европу (включая Россию), Ближний Восток и Африку.
Драйверами роста объемов рынка антибиотиков могут стать растущий спрос на животноводческую продукцию, вспышки инфекционных заболеваний, ввод новых препаратов, стратегические альянсы, а также инновационные технологические разработки продуктов для лечения тяжелых бактериальных инфекций.
Основным фактором, сдерживающим рост мирового рынка антибиотиков, остается развитие микробной устойчивости к ним. Уже сейчас из-за выработанной резистентности ограничен выбор антибиотиков для лечения бактериальных инфекций, что приводит к высокой заболеваемости и смертности.
Кроме того, свой вклад вносит значительный рост затрат на регистрацию лекарств, ужесточающаяся политика государственного регулирования и уменьшение числа компаний, занимающихся активными исследованиями.
Цены на антибиотики после окончания действия патента и начала выпуска дженериков снижаются; на рынке не запатентовано порядка 80% препаратов. Исследовательская деятельность становится всё более сложной и дорогостоящей, поэтому у фармацевтических компаний мало стимулов для разработки новых препаратов. Так, биофармацевтическая компания Achaogen, работающая над открытием, разработкой и выводом на рынок новых антибактериальных препаратов против грамотрицательных инфекционных агентов с множественной лекарственной устойчивостью, несмотря на многомиллионную поддержку государственными учреждениями, некоммерческими фондами и другими организациями, так и не стала коммерчески успешной. К тому же большинство новых антибиотиков продаются ограниченно, так как медработники держат их в запасе для самых тяжелых случаев. Например, в ветеринарии рекомендовано применение только четырех классов антибиотиков (рис. 3), и то с определенными ограничениями.
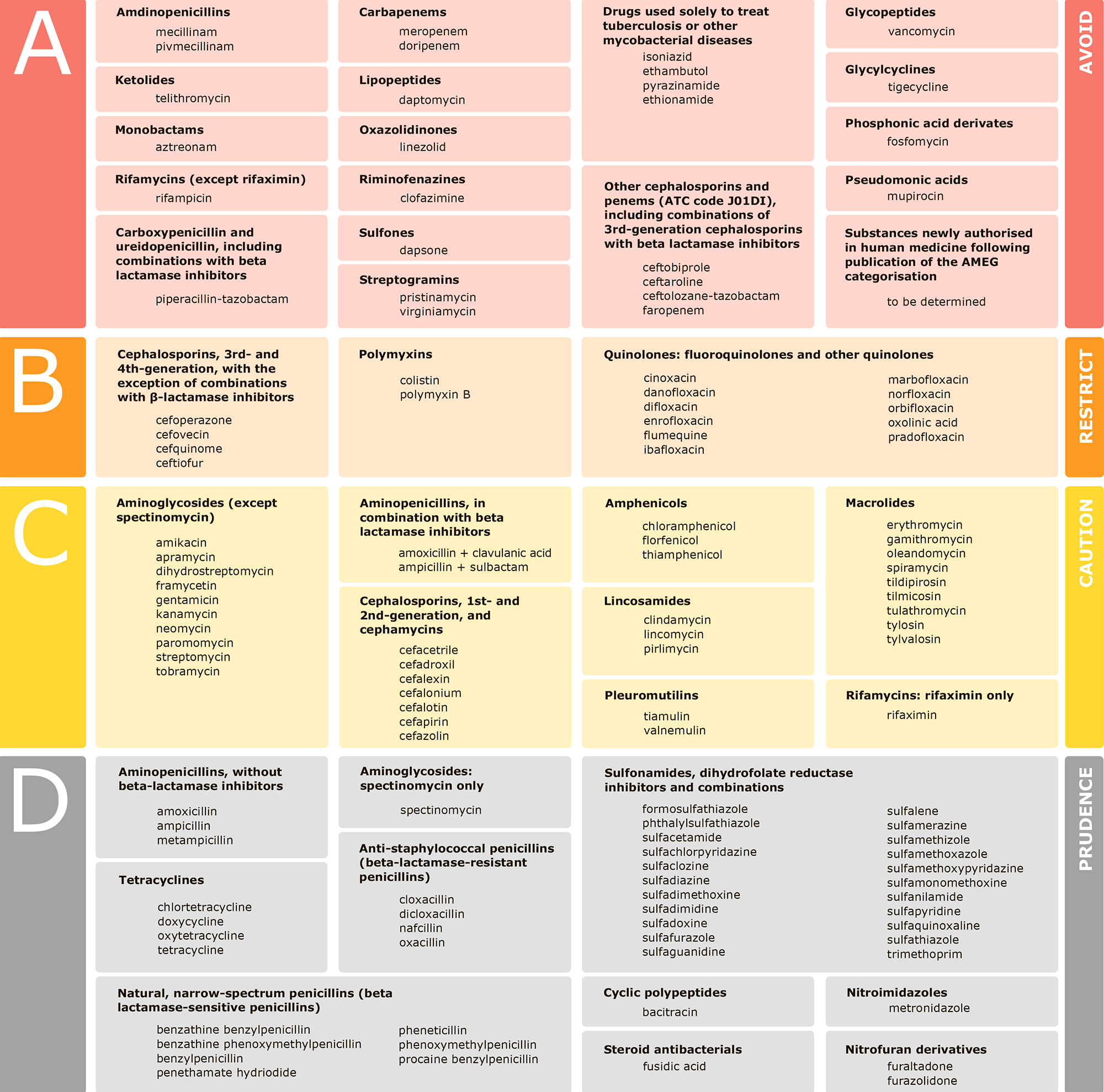
Рисунок 3. Европейское агентство по лекарственным средствам (European Medicines Agency, EMA) выпустило документ, содержащий категоризацию антибиотиков при назначении их животным. Классификация включает четыре категории, от A до D: Avoid — «Избегать», Restrict — «Ограничивать», Caution — «Осторожно» и Prudence — «Благоразумно». В документе содержатся названия классов антибиотиков, активные вещества, способы введения препаратов.
Инвестиционная привлекательность проектов, которые ставят целью победу над резистентностью бактерий с помощью новых антибиотиков, снижается. С 2003 по 2013 год меньше 5% венчурных инвестиций пошли в фармацевтические исследования и разработки по этой тематике [2].
При этом существует альтернатива антибиотикам — терапия и профилактика бактериальных инфекций с помощью вирусов — бактериофагов. Ключевыми игроками на рынке бактериофаговых препаратов являются компании:
- НПК «Микроген»;
- Proteon Pharmaceuticals;
- Phagelux;
- Intralytix;
- Micreos;
- Eliava BioPreparations;
- Locus Biosciences;
- Pharmex Group;
- Pherecydes Pharma;
- APS Biocontrol;
- Qingdao Phagepharm Bio-tech;
- Fixed-Phage Limited;
- Zeptometrix;
- Phage International;
- НПЦ «Микромир»;
- iNtODEWORLD;
- NEXTBIOTICS;
- Armata Pharmaceuticals;
- Innophage;
- Adaptive Phage Therapeutics;
- TechnoPhage
и другие.
Компания MarketWatch, входящая в состав Dow Jones & Company, в своем обзоре Global Phage Therapy market за 2022 год сообщает, что мировой рынок бактериофагов в 2020 году составил 29 млн. долларов; к 2027 году он по прогнозам достигнет 84 млн долларов, среднегодовой темп роста в 2021–2027 годах (Compound annual growth rate, CAGR) прогнозируется 17,6%. И если объем рынка фагов пока значительно проигрывает антибиотикам, то темпы роста выше почти в 4,5 раза, что подтверждает перспективность проектов, направленных на практическое применение фаговых препаратов.
Согласно отчету американской компании Credence Research, крупнейший региональный рынок бактериофагов, с долей более 37%, — Северная Америка. Важными факторами в завоевании такой существенной доли на рынке являются: осознание необходимости снизить количество применяемых антибиотиков за счет альтернативных продуктов, хорошо развитая исследовательская инфраструктура и наличие потенциального канала для фаговой терапии — большого числа животноводческих ферм. Европейский континент является вторым по величине рынком бактериофагов по причине широкого их применения в пищевой и экологической отраслях.
Ключевые тенденции на рынке бактериофагов:
- рост научных исследований в сфере практического применения фаготерапии;
- продолжение испытаний бактериофагов для лечения антибиотикорезистентных инфекций и одобрение фагопрепаратов регуляторными органами;
- увеличение частоты применения бактериофагов в пищевой промышленности, охране окружающей среды, ветеринарии.
Бактериофаги в сельском хозяйстве. Особенности и возможности
Одна из актуальных проблем ХХI века — обеспечение растущего населения планеты продовольствием. На решение этой проблемы направлены усилия и средства многих высокоразвитых стран. Один из путей увеличения количества продовольствия — применение в сельском хозяйстве биологически активных веществ, в том числе антимикробных препаратов. Спектр их воздействия чрезвычайно широк, а необходимость применения неоспорима, но настолько ли они «безобидны»? Как влияют на человечество и окружающую его среду в долгосрочной перспективе? А быть может, альтернативные варианты, та же фаготерапия, уже нашли своих потребителей?
Животноводство
Главной отраслью — потребителем антибиотиков в сельском хозяйстве является животноводство по следующим причинам:
- содержание большого количества животных на относительно малых площадях увеличивает риск и скорость распространения различных инфекций, и как следствие — повышает объемы используемых медикаментов;
- антибиотики позволяют интенсифицировать отрасль за счет стимуляции роста и набора массы животными [3];
- использование антибиотиков в профилактических целях, например для нивелирования последствий стресса у животных [4], [5] (скорее, исторически сложившаяся мера, нежели научно обоснованная).
Способствовали широкому распространению антибиотикотерапии ее доступность, большие объемы производства, безальтернативность и относительная дешевизна.
В 2021 году в мировом животноводстве использовано 160 000 т антибиотиков! При сохранении аналогичных темпов к 2030 году эта цифра может достигнуть 200 000 т [6]. А сколько же тонн антибиотиков применено в животноводстве на данную конкретную минуту? Интересно? Узнать эту цифру можно тут!
Антибиотики годами попадают в почву и воду с продуктами жизнедеятельности животных и сточными водами после обмывания стойл и птичников. Приспосабливаться к их постоянному присутствию стали не только болезнетворные бактерии, но и условные патогены. В случае возникновения дисбаланса микробиоты и присутствия дополнительных питательных веществ (например, при снижении иммунного статуса) условно патогенные бактерии активно размножаются и вызывают различные заболевания. Развитие и распространение микробной антибиотикорезистентности (МАР, англ. AMR — antimicrobial resistance) представляет проблему как для медицины, так и для ветеринарии. Устойчивые бактерии, переносимые сельскохозяйственными животными, могут передаваться людям через окружающую среду (например, контаминированную воду), через употребление в пищу продуктов, не подвергшихся достаточной термической обработке, или через перекрестную контаминацию других продуктов питания, а также при непосредственном контакте с животными.
К микроорганизмам, которые наиболее часто передаются человеку при непосредственном контакте с животными-носителями и/или через продукты питания, относятся: возбудители пищевых токсикоинфекций (сальмонеллы, кампилобактерии и листерии) и зооантропонозов — болезней, общих для человека и животных (мульти/панрезистентные энтерококки, псевдомонады, различные типы кишечной палочки и пр.).
Для борьбы с болезнями промышленного животноводства применяют две категории препаратов:
- Кормовые антибиотики, используемые как стимуляторы роста (АСР, англ. AGP — antibacterial growth promoters).
- Терапевтические антибиотики, используемые как в лечебных, так и профилактических целях.
Одной из основных причин развития МАР в животноводстве считается использование антибиотиков в субтерапевтических дозировках, как кормовых АСР. Это заставило прогрессивные страны задуматься о поэтапном сокращении, а затем и полном отказе от применения АСР, а позже и некоторых терапевтических препаратов (табл. 1).
| Год | Событие |
|---|---|
| 1969 | Доклад британского биолога М.М. Суонна, после которого в Европе впервые ввели ограничения применения антибиотиков и разделили их на «кормовые» и «терапевтические». Появился перечень безопасных для здоровья человека безрецептурных антибиотиков для использования в кормах. Было рекомендовано запретить использование пенициллина и тетрациклинов в кормах, а доступность терапевтических препаратов ограничить рецептурным назначением. |
| 1972 | В Европе запретили использование тетрациклина, пенициллина и стрептомицина в качестве АСР. |
| 1977 | Великобритания запустила программу «Ответственного применения антибиотиков в сельскохозяйственной сфере». |
| 1986 | Швеция запретила все АСР. |
| 1996 | В Дании свиноводы добровольно отказались от авопарцина. |
| 1997 | ВОЗ запретила применять в кормах антибиотики, общие для человека и животных. |
| 1998 | ЕС запретил применение авопарцина. Дания запретила вирджиниамицин и все АСР в свиноводстве. |
| 1999 | ЕС запретил тилозин, спирамицин, вирджиниамицин, цинкбацитрацин, карбадокс и олаквиндокс. Остались разрешенными: авиламицин, монензин, флавомицин и салиномицин. |
| 2000 | В Дании свиноводы добровольно отказались от всех АСР. |
| 16.09.2000 | В Торонто прошел Первый всемирный день антибиотикорезистентности. В докладе по серии инфекционных заболеваний — «Преодолеть резистентность к противомикробным препаратам» — бывший генеральный директор ВОЗ доктор Гро Харлем Брундтланд охарактеризовал растущую резистентность к противомикробным препаратам как «глобальный кризис». |
| 2005 | В Австралии состоялось первое совещание экспертов ВОЗ по критически важным антибиотикам, где их разделили на три группы (критически важные, очень важные и важные). |
| 2006 | ЕС принял постановление № 1831/2003, раздел 25 которого запрещал использование всех АСР в кормах для сельскохозяйственных животных, за исключением антипротозойных препаратов. |
| 2011 | 53 государства-члена Европейского региона ВОЗ приняли комплексный Европейский стратегический план действий по проблеме устойчивости к антибиотикам, предусматривающий, в частности, укрепление систем эпиднадзора для мониторинга использования антибиотиков. |
| 2012 | Великобритания запретила использование цефалоспоринов III и IV поколений, а также начала сокращать применение фторхинолонов. |
| 2014 | В США Барак Обама инициировал «Национальный план действий по борьбе с антибиотикорезистентными бактериями». |
| 2015 | ВОЗ начала разработку глобального и национальных планов действия по устойчивости к противомикробным препаратам (УПП). |
| Стартовала глобальная ежегодная кампания (с 2020 г. — 16–24 ноября) «Всемирная неделя правильного применения ПП», направленная на повышение осведомленности о проблеме устойчивости к противомикробным препаратам и пропаганду передовых методов, позволяющих замедлить появление и распространение лекарственно устойчивых инфекций, среди широкой общественности, медицинских работников и политиков. | |
| 2016 | Великобритания высказала намерение о полном отказе от колистина. |
| 2015–2018 | ЕС отказался от 31 значимого в медицине препарата; для применения в животноводстве оставили разрешенными всего 10 препаратов, 4 из которых — кокцидиостатики. |
| 2017 | Российское правительство утвердило «Стратегию предупреждения распространения МАР в РФ на период до 2030 года». |
| 2019 | Распоряжением Правительства Российской Федерации от 30.03.2019 № 604-р утвержден «План мероприятий на 2019-2024 по реализации Стратегии предупреждения распространения МАР». |
| 2020 | Федеральный закон от 30.12.2020 № 492-ФЗ «О биологической безопасности в Российской Федерации» ограничил отпуск и реализацию антибиотиков и фармацевтических субстанций при отсутствии медицинских показаний (вступил в силу 01.01.2022 г.). |
| 2021 | Утвержден план действий Сельскохозяйственной и продовольственной организации ООН (FАО) по МАР на 2021–2025 годы. |
Сейчас на фоне распространения антибиотикорезистентных штаммов микроорганизмов альтернативой антибактериальным препаратам могут служить бактериофаги.
Фаги существуют везде, где есть бактерии, и их численность в биосфере примерно на порядок больше. Поэтому поиск и выделение новых типов «борцов с бактериями» гораздо проще и привлекательнее экономически, чем синтез новых антибиотиков. Однако чтобы природный фаг стал препаратом-фагом, требуется ряд технологических стадий. Узнать об истории зарождения и развития фаготерапии, а также о процессе получения препаратов бактериофагов и их лабораторном и промышленном применении можно в статье «Биомолекулы» «Пожиратели бактерий: убийцы в роли спасителей» [7].
Отдельные попытки использования различных бактериофагов при лечении инфекционных болезней животных предпринимали еще в 1910–1930-х годах. Феликс Д'Эрелль (1917, 1928 и 1935 годы) пытался использовать фаги при пуллорозе-тифе у кур [8]. И.Ф. Квеситадзе (1957 год) применил бактериофаги для лечения 6000 больных сальмонеллезом телят; при этом эффективность фаготерапии в отдельных хозяйствах достигала 90–100%. К.Н. Шерстобаев (1949 год) использовал бактериофагов для лечения и профилактики колибактериоза поросят и отмечал выздоровление у 95,6% животных. И.Л. Бирюков и Р.К. Петренко (1958 год) сообщили, что получение цыплятами пуллорумфага защитило 90% из них в лабораторных и до 80% в производственных условиях от пуллороза [9].
Фаготерапия обладает рядом существенных преимуществ:
- высоко специфична при лечении инфекций и не подавляет нормальную микрофлору;
- безопасна и не имеет противопоказаний к применению;
- может использоваться не только для лечения, но и для профилактики бактериальных инфекций;
- снижает вероятность развития антибиотикорезистентности у микроорганизмов за счет уменьшения потребления антибиотиков;
- стимулирует гуморальный и клеточный иммунитеты: на фоне применения фагов увеличивается выработка иммуноглобулинов и Т-лимфоцитов [10–12];
- характеризуется более низким риском проявления токсического и аллергического эффекта и отсутствием случаев проявления тератогенного эффекта [13];
- эффективна не только в монотерапии, но и в комбинации с другими препаратами: применяется в составе комплексной терапии с противовоспалительными и противовирусными лекарствами, в заместительной терапии, комбинации с пробиотиками, пребиотиками, фитобиотиками и др.
В Европе, согласно принятому EMA 28.01.2022 «Документу по качеству, безопасности и эффективности бактериофагов как ветеринарных препаратов», бактериофаги могут применяться как альтернатива антибиотикам при соблюдении определенных требований.
В птицеводстве и свиноводстве бактериофагами пытаются контролировать популяционный баланс микрофлоры кишечника, уменьшают количество специфических патогенных микроорганизмов (Salmonella и E. coli), способствуя росту животных и повышая эффективность корма. Позволяют избежать таких последствий стресса и разрушения кишечной флоры пищеварительной системы, как диарея и снижение эффективности кормления (рис. 4).
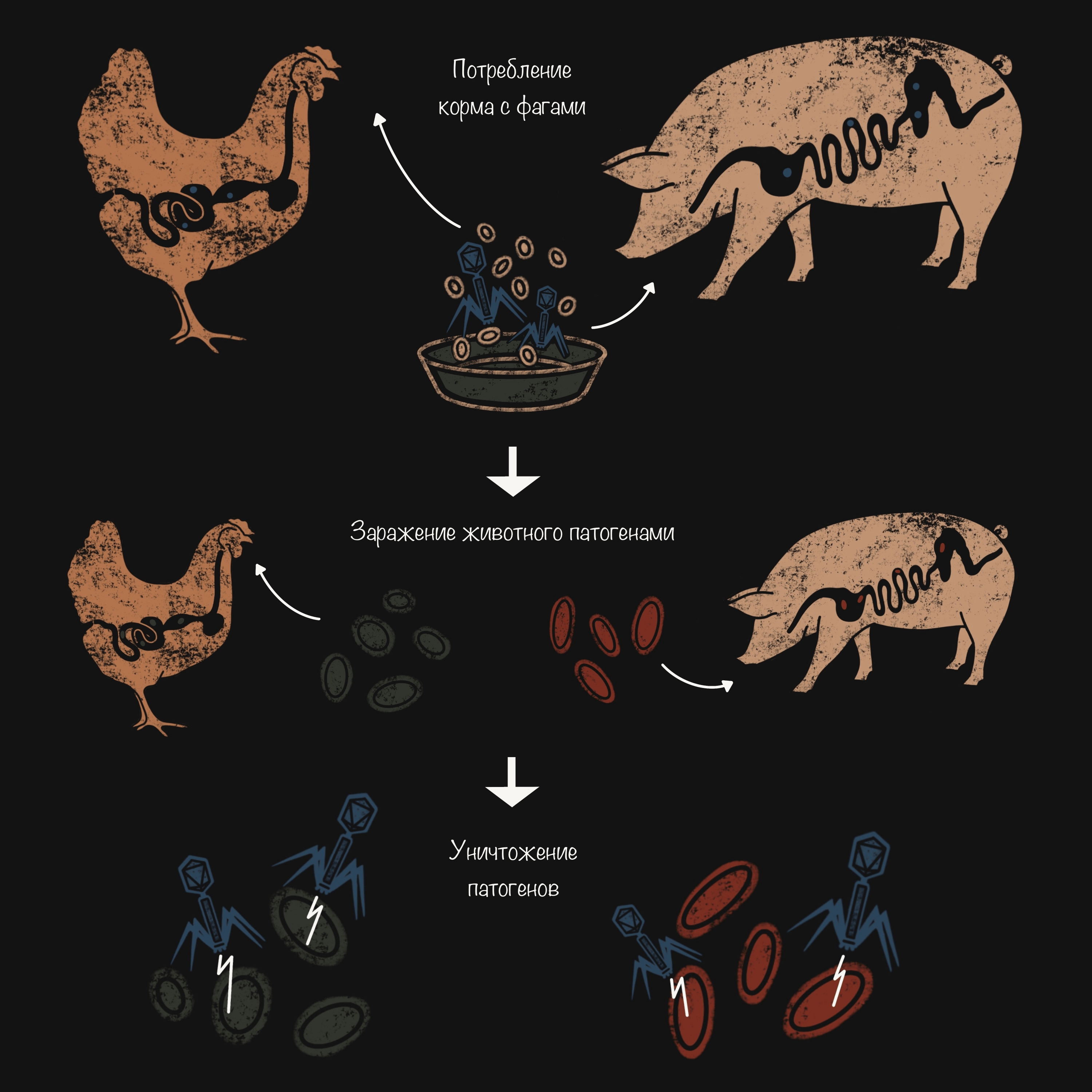
Рисунок 4. Препараты для домашней птицы и для свиней, каждый из которых содержит различные бактериофаги. Фаговый коктейль из шести литических бактериофагов Salmonella предназначен для лечения брюшного тифа, сальмонеллеза и диареи у домашней птицы [14]. Фаги, выделенные из культур S. typhimurium, S. bovismorbificans и S. derby, помогают избежать системного отека, колибактериоза, сальмонеллеза и диареи у свиней, а также могут применяться для обеспечения безопасности продуктов из свинины [15].
иллюстрация Анастасии Самоукиной
Для лечения сальмонеллеза птиц разработан препарат «Сальмофаг» (ФКП «Ставропольская биофабрика»), в состав которого входит коктейль бактериофагов. Он эффективен против возбудителей сальмонеллеза S. enteritidis и S. typhimurium — наиболее значимых в этиологии для промышленных и декоративных птиц, разводимых в России. Препарат применяют как перорально с питьевой водой, так и обрабатывают им птицу. «Сальмофаг» может применяться для терапии и профилактики сальмонеллеза как птиц, так и продуктов их убоя, при этом препарат не влияет на качество продуктов убоя и обеспечивает соответствие всем санитарным нормам.
Исследования показали, что эффективность бактериофагов может быть снижена из-за пищеварительных ферментов, экстремальных значений рН, высоких температур, иммунитета хозяина и других факторов окружающей среды. Таким образом, интерес ученых вызывает получение защищенных фагов, например микрокапсулированием, буферными системами и др. [16].
В молочном животноводстве одним из наиболее часто встречающихся в мире бактериальных заболеваний является мастит — воспаление молочной железы (рис. 5). Его обычно вызывают Escherichia coli, Streptococcus uberis, Staphylococcus aureus и Klebsiella pneumonia. Мастит не только неблагоприятно влияет на здоровье коров, но и снижает качество и количество молока (на 500–1000 литров в год), препятствует росту крупного рогатого скота, увеличивает расходы на его содержание
Одно из самых продолжительных статистических исследований клинического мастита коров и первую оценку его экономических последствий провели с 2015 по 2017 год в Китае [17]. Заболеваемость колебалась от 0,6% до 18,2% в месяц, что стоило от $12 000 до $76 000 на ферму в месяц. Фаги, относящиеся к семейству Myoviridae, продемонстрировали высокую эффективность, при этом оставаясь стабильными в широком диапазоне температур, рН и растворителях [18].
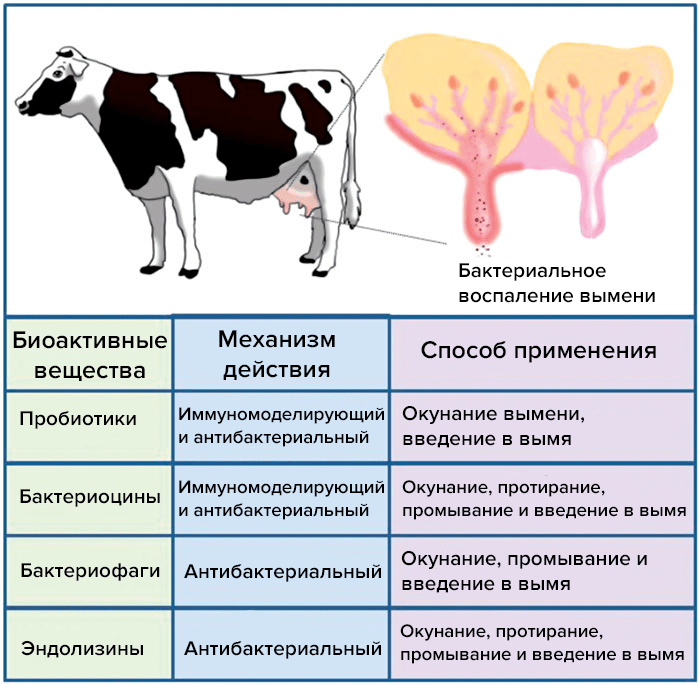
Рисунок 5. Альтернативные методы профилактики и лечения мастита крупного рогатого скота
Результаты исследований подтверждают, что коктейли, состоящие из нескольких фагов, значительно снижают количество бактерий, соматических клеток и воспалительных факторов, облегчают симптомы мастита у крупного рогатого скота и достигают того же эффекта, что и лечение антибиотиками. В целом фаговые коктейли могут быть многообещающей альтернативной терапией мастита [19], [20]. Хотя некоторые исследователи отмечают случаи реактогенности молочной железы после интрацистернального введения вирусного антигена. Реакция проявлялась ярко выраженными клиническими признаками серозно-фибринозного воспаления и была похожа на проявление неспецифического противовирусного иммунного ответа. Отмечается дозозависимая интенсивность соматической реакции и клинические проявления неспецифического ответа при введении инактивированных бактериофагов [19].
Экспериментальное средство на основе геля «Фагодерм» (ООО НПЦ «Микромир») показало свою эффективность в качестве альтернативы антибиотикам в следующих случаях:
- при профилактике мастита с эффективностью 87% [21];
- на ранних патогенетических этапах заболевания.
«Фагодерм» позволяет повысить качество молочной продукции, обеспечить ее экологичность за счет отсутствия остаточных количеств антибиотиков.
Другими часто встречающимися проблемами для крупного рогатого скота являются метрит и эндометрит. Это воспалительные заболевания эндометрия (внутренней слизистой оболочки) матки. В период отела организм коровы ослаблен и плохо сопротивляется микробам, поэтому патогены быстро разрастаются в маточных тканях, становясь причиной воспалительного процесса и интоксикации организма (рис. 6). Если вовремя не начать лечение, болезнь часто приводит к яловости (бесплодию) коровы, а реже становится причиной гангренозного воспаления, сепсиса и смерти животного. Самые распространенные возбудители эндометрита — Trueperella pyogenes, E. coli, Fusobacterium necrophorum, S. uberis. Литические бактериофаги обладают заметной антимикробной активностью в отношении штаммов E. coli из маток послеродовых молочных коров [22]. В отношении S. uberis литической активностью обладают эндолизины, полученные из профагов Streptococcus suis [23].
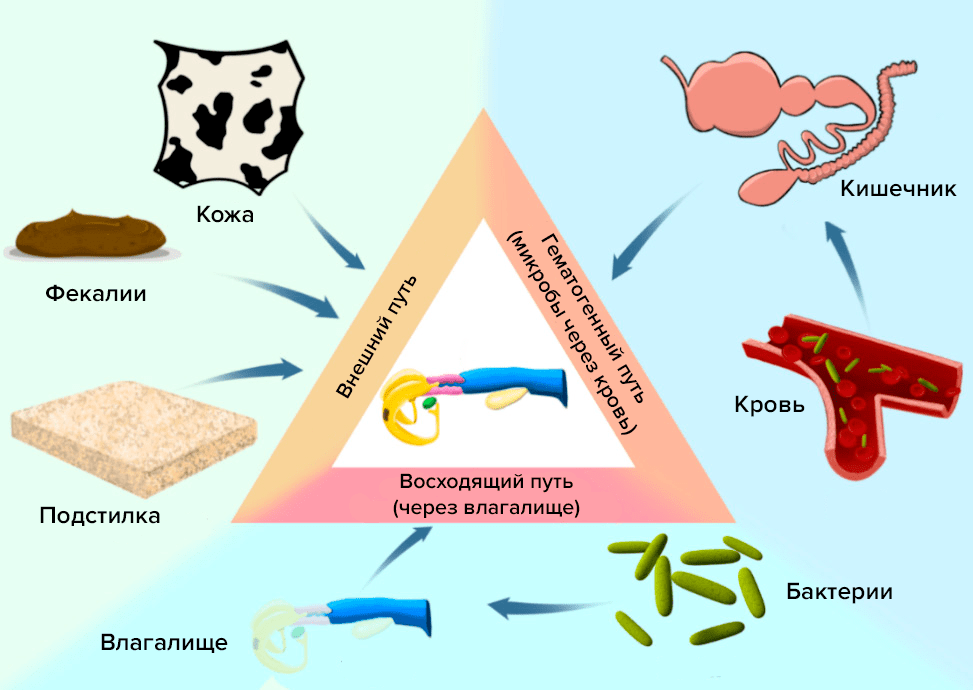
Рисунок 6. Возможные источники поступления микрофлоры в репродуктивный тракт: гематогенный путь (через кровь и кишечник), внешний путь (из окружающей среды), восходящий путь (из влагалища).
ООО НПЦ «Микромир» впервые в России зарегистрировал лекарственный препарат для ветеринарного применения на основе фагового коктейля. Он представляет собой суспензию бактериофагов в изотоническом физиологическом растворе, которую нужно вводить внутриматочно для профилактики и лечения эндометритов бактериальной этиологии коров. Бактериофаги в составе «Фагоутерина» активны и специфичны в отношении штаммов бактерий Escherichia coli, Enterococcus faecalis, Klebsiella pneumoniae, Pseudomonas aeruginosa, Proteus vulgaris, Staphylococcus aureus и Streptococcus pyogenes. «Фагоутерин» не оказывает негативного воздействия на нормофлору животного, он совместим с большинством антибиотиков, противовоспалительных препаратов и препаратов других групп, за исключением агрессивных антисептиков.
Домашние питомцы
Несмотря на то, что домашние животные или животные-компаньоны не связаны с пищевой цепью человека, они также могут рассматриваться как резервуары антибиотикорезистентных бактерий. Их близость к человеку делает их потенциальным очагом перекрестной передачи зоонозных бактерий, которые представляют угрозу для здоровья человека. В настоящее время значительно расширился круг видов, которые могут рассматриваться как животные-компаньоны: собаки, кошки, лошади, грызуны, морские свинки, рептилии и др. Социальная ответственность человека возросла в последние десятилетия, особенно в городских районах, принципы медикаментозного лечения домашних животных схожи с принятыми в обычной медицинской практике — нормой является назначение индивидуальной терапии. Из-за своей доступности для домашних животных чаще всего используются те же противомикробные препараты, что и для человека, что увеличивает вероятность развития МАР, и возникает необходимость исследовать альтернативы антибиотикам — бактериофаги (рис. 7).
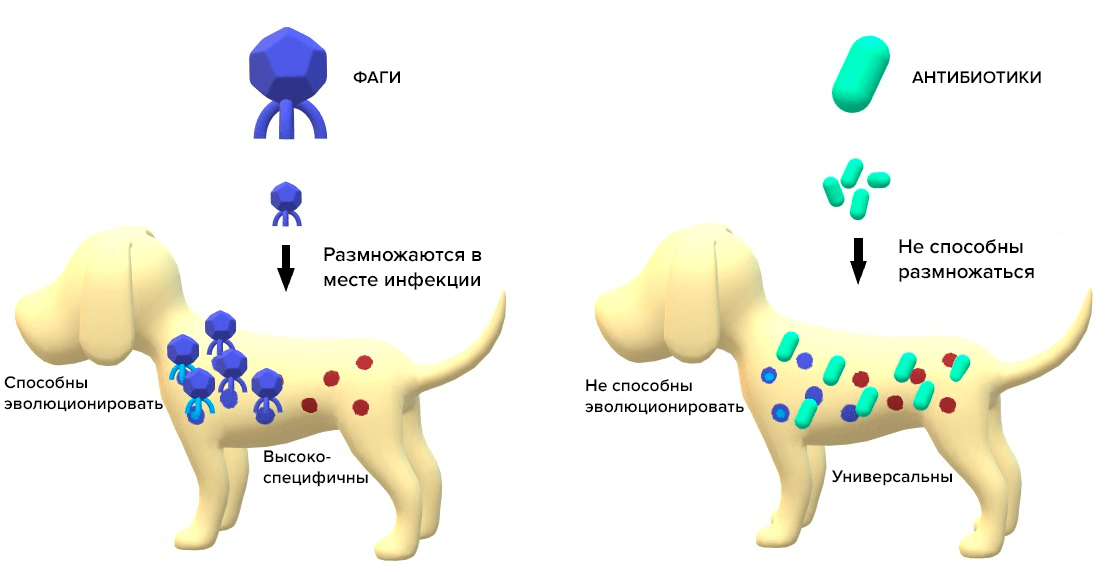
Рисунок 7. Основные различия действия фагов и антибиотиков на патогенные бактерии. Фаги способны размножаться в очаге инфекции, в отличие от антибиотиков. Фаги могут эволюционировать вместе с бактериями, в то время как антибиотики являются статичными структурами. Фаги очень специфичны для своих мишеней, в то время как антибиотики обладают широким спектром действия.
Например, фаготерапию предлагали использовать для лечения заболеваний собак, вызванных метициллинрезистентным штаммом Staphylococcus pseudointermedius, таких как инфекции мочевыводящих путей, наружный отит, пиодермальные инфекции, респираторные инфекции и инфекции половых путей [24]. Существуют фаги, полезные при лечении инфекций мочевыводящих путей у собак и кошек, вызванных уропатогенной кишечной палочкой [25].
Фаговая терапия также зарекомендовала себя при лечении болезней лошадей. Кератит, вызванный бактериями P. aeruginosa, приводит к повреждению роговицы, а в некоторых случаях даже к слепоте. Его терапия антибиотиками часто неэффективна. В научных исследованиях коктейль с фагами Myoviridae и Podoviridae продемонстрировал возможность излечения кератита лошадей [26].
Экзотические домашние животные (например рептилии) являются переносчиками сальмонелл, устойчивых к антибиотикам. Лечение их фагами Felix O1 (перорально) дало положительные результаты [27].
Аквакультура
Рыбы, находясь на протяжении всей своей жизни в воде, постоянно контактируют с многочисленными водными патогенными микроорганизмами. Интенсивное рыбоводство способствовало распространению многих бактериальных заболеваний и увеличению использования противомикробных препаратов, что, в свою очередь, привело к селекции устойчивых к антибиотикам бактерий и распространению у рыбных патогенов антибиотикорезистентных генов, способных переноситься к человеческим бактериям. Одной из стратегий сокращения использования антибиотиков в аквакультуре является внедрение методов выращивания, которые минимизируют уровень стресса рыб и снизят вероятность того, что инфекции потребуется лечить с применением антибиотиков. Разработано несколько альтернатив антибиотикам, включая пробиотики, фаговые препараты и эфирные масла, некоторые из которых успешно используются для борьбы с бактериальными инфекциями на рыбоводных фермах.
Распространенный патоген аквакультуры Vibrio harveyi вызывает заболевания у различных видов водных животных. Широкое использование антибиотиков для борьбы с V. harveyi привело к запрету импорта рыбы из Китая во многие страны из-за наличия остаточных количеств антибиотиков, при этом изоляты вибриона были устойчивы к сульфату колистина, гентамицину, тетрациклину, ампициллину, котримоксазолу и амоксициллину. Китайские ученые выделили из Larimichthys crocea в Восточно-Китайском море новый фаг vB_VhaM_pir03 (рис. 8), который у рыбок данио эффективно предотвращает (в 93,33% случаев) и контролирует (в 86,67% случаев) инфекцию. Эффективность фага указывает на его потенциал в качестве антибактериального средства для борьбы с вирулентной инфекцией V. harveyi и вибриозом в аквакультуре [28].
В качестве путей введения фагов в литературе описаны успешные примеры кормления, например, палтуса (Scophthalmus maximus L.) или креветок для защиты от V. harveyi [29], [30].
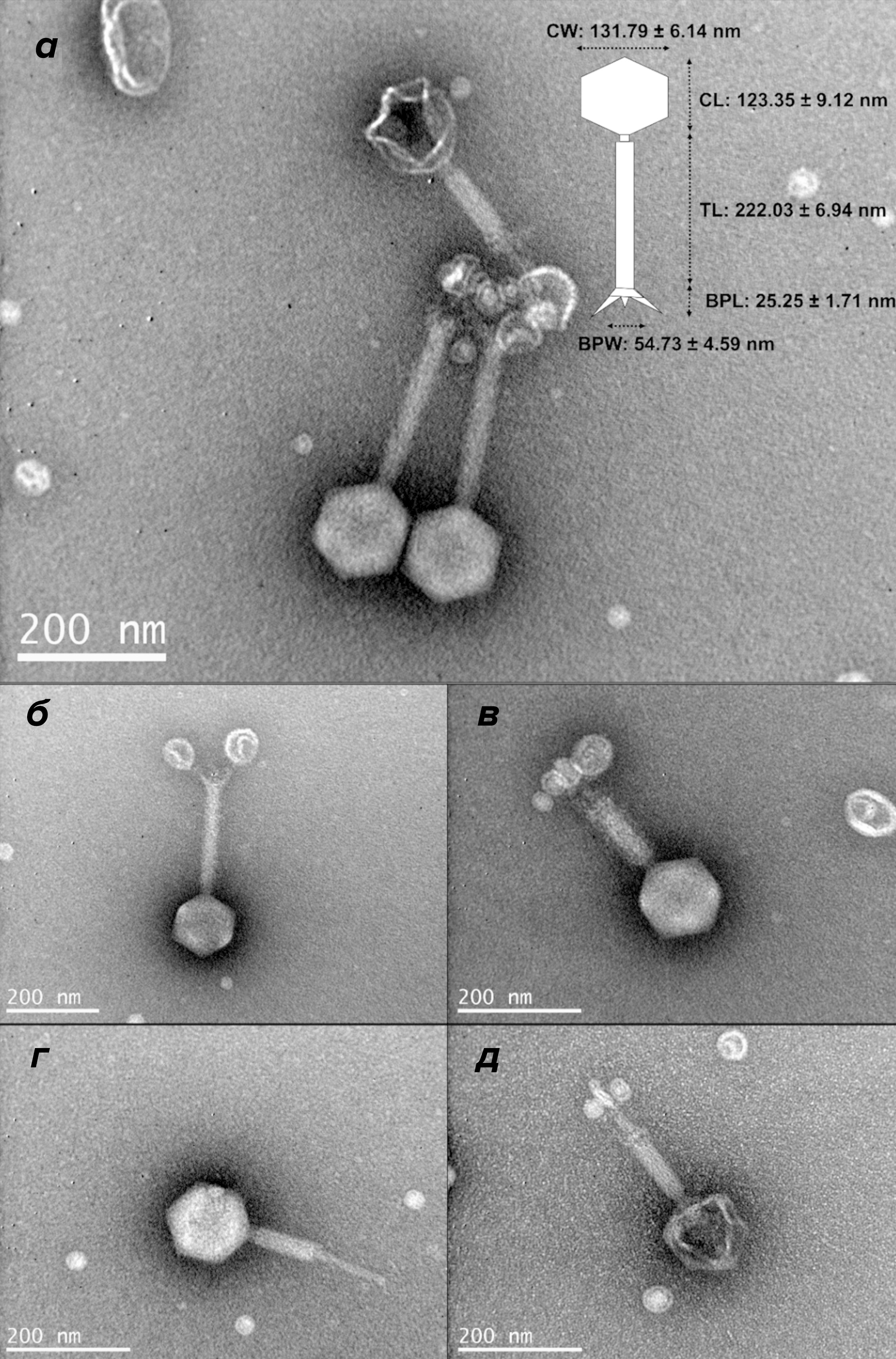
Рисунок 8. Электронная микрофотография фага vB_VhaM_pir03. а — Морфология и размеры вириона. CW — ширина капсида; CL — длина капсида; TL — длина хвоста; BPL — длина базальной пластинки; BPW — ширина базальной пластинки. б — Несокращённый хвост. в — Сокращенный хвост. г — Выдвинутая хвостовая трубка. д — Пустой капсид — без генетического материала.
Фаги вызывают всё больший интерес из-за их относительно безопасного статуса, широкого признания потребителями и потенциала для многоцелевого использования. Хотя применение этих альтернатив в аквакультуре является очень перспективным, необходимы и дальнейшие исследования, чтобы получить более полное представление о механизмах действия, улучшить их стабильность и оценить воздействие на окружающую среду и микробиоту хозяина [31].
Растениеводство
В 80-е годы ХХ века антибиотики начали использоваться в растениеводстве для ликвидации болезней, вызванных бактериями, у фруктовых, овощных и даже декоративных культур. Стрептомицин и окситетрациклин использовали для лечения бактериальных инфекций фруктовых культур, касугамицин и валидомицин — для борьбы с грибковыми болезнями риса, при этом обработке подвергались огромные территории. В 1995 году в США для обработки фруктовых деревьев использовали свыше 11 т стрептомицина и 6 т окситетрациклина, обработали 20% посадок яблоневых деревьев, 35–40% — персиковых деревьев, 4% — грушевых деревьев.
И хотя антибиотики в растениеводстве используются не так широко, как в медицине и ветеринарии, тем не менее появление устойчивых бактериальных патогенов является серьезной проблемой из-за снижения ими роста и продуктивности растений и пагубного влияния на окружающую среду и здоровье человека. Среди фитопатогенов насчитывается более 200 видов бактерий, наиболее значимыми являются представители родов Agrobacterium, Burkholderia, Dickeya, Erwinia, Ralstonia, Pectobacteria, Pseudomonas, Xanthomonas и Xylella.
Внимание исследователей сосредоточено на разработке альтернативной стратегии лечения бактериальных заболеваний растений. На эту роль подходит фаговая терапия, ее достижения в борьбе с фитобактериями растений (рис. 9) приведены в обзоре [32].
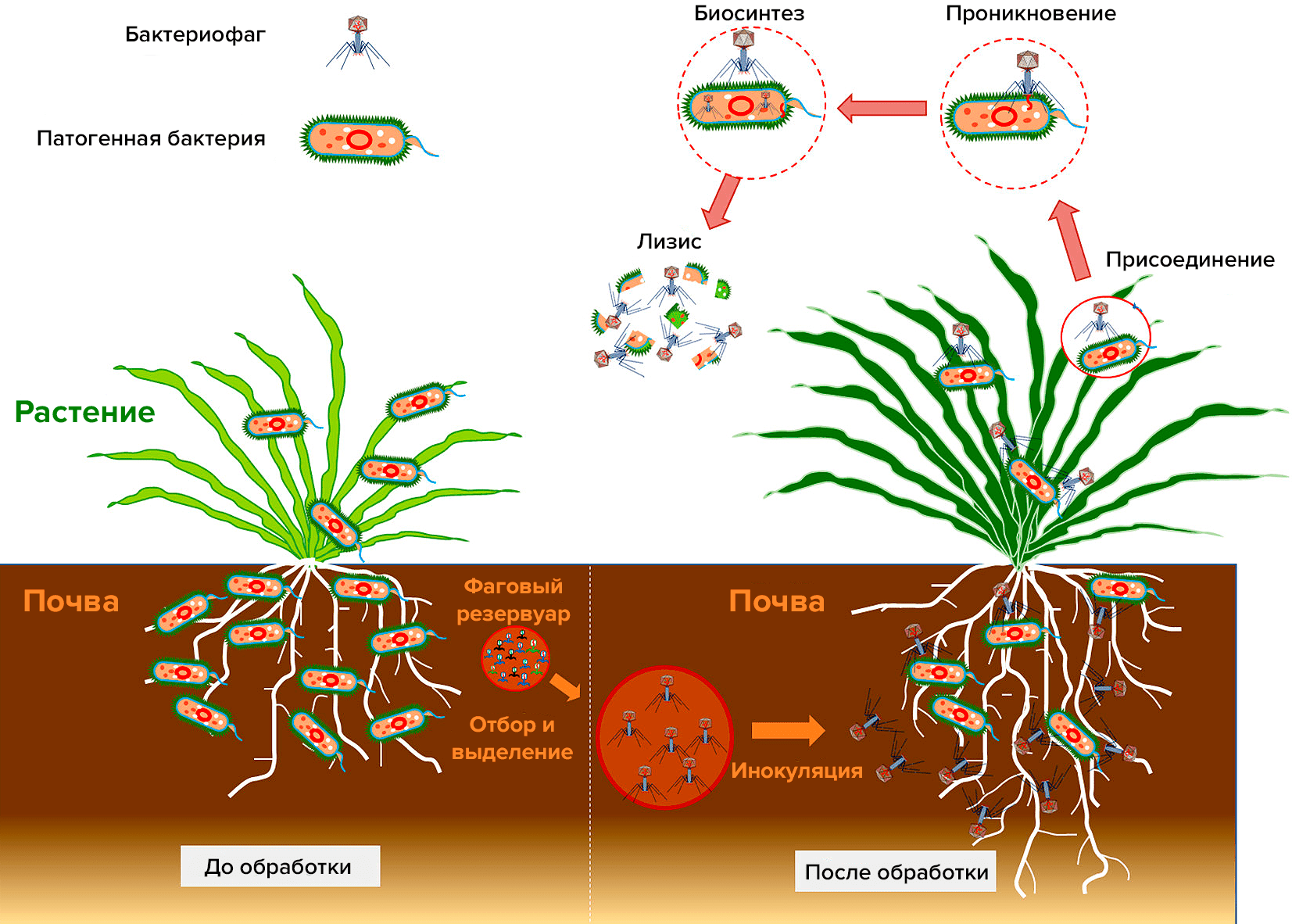
Рисунок 9. Бактериофаги борются с патогенными бактериями в системах «почва—растение». Фаговые коктейли можно применять различными способами: внекорневое опрыскивание, орошение почвы, инфильтрация и погружение.
Серьезную угрозу для винодельческой промышленности Европы представляют гамма-протеобактерии X. fastidiosa subsp. fastidiosa, вызывающие болезнь Пирса виноградных лоз. Подобранный коктейль из четырех литических фагов оказался эффективным терапевтическим агентом для биоконтроля X. fastidiosa, а также синдромов быстрого упадка оливы и ожога листьев олеандра, миндаля или кофе [33], [34].
И если винодельчество интерес вызывает не у всех, то картофелеводство — это отрасль стратегическая. И в ней у адептов фаготерапии тоже есть предложения — коктейль, состоящий из шести изолятов фагов, может убить 98% R. solanacearum, вызывающей бактериальное увядание картофеля и томатов [34], [35].
Фаги можно считать эффективными агентами снижения частоты заболеваний бактериальной фитофторы лука-порея, вызванной P. syringae pathovar porri, черной гнили брокколи, вызванной X. campestris pv. campestris, бактериальной пятнистости перца, вызванной X. euvesicatoria и других [32].
Аграрные фаговые препараты промышленно производятся и успешно применяются в сельском хозяйстве:
- «Мультифаг» (Белоруссия) включает консорциум бактериофагов фитопатогенных бактерий P. syringae, P. fluorescensи, P. putida и используется для защиты растений от бактериозов.
- «Пентафаг-С» (Украина) содержит вирионы пяти штаммов бактериальных вирусов, а также биологически активные вещества. Обладает профилактическим и лечебным действием против широкого спектра бактериозов плодовых и овощных культур. Применение приводит к подавлению проявлений бактериального рака и бактериальной пятнистости, снижает вероятность поражения растений мучнистой росой и паршой.
Применение фаговых коктейлей в качестве антимикробных агентов произвело революцию в стратегиях биоконтроля при комплексном лечении резистентных микробных патогенов без нанесения ущерба фауне и флоре. Однако необходимы дополнительные усилия для повышения их оптимальной эффективности, контроля устойчивых фитопатогенов и для расширения их доступности в полевых применениях.
Роль бактериофагов в регуляции экологического состояния окружающей среды
Бактериофаги — наиболее многочисленная, широко распространенная в биосфере и, предположительно, наиболее эволюционно древняя группа вирусов. Приблизительный размер их популяции составляет более 1030–1032 фагов; считается, что на одну бактерию приходится 10 фаговых частиц. В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии (рис. 10).
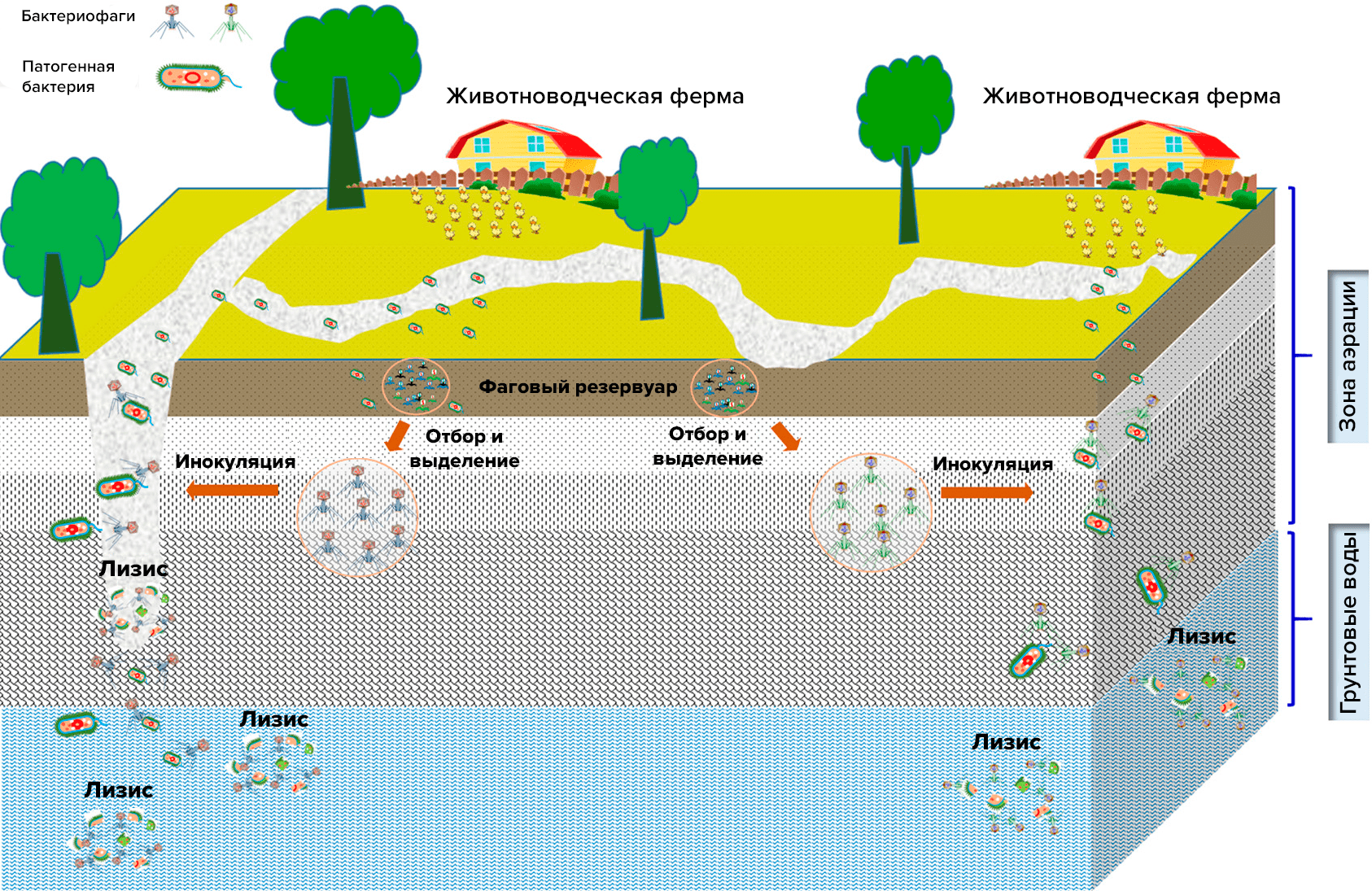
Рисунок 10. Чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т.д.) микроорганизмами, тем в большем количестве в нем встречаются соответствующие фаги.
Экология фагов изучает их взаимодействия с окружающей средой. Детальное изучение особенностей взаимоотношений бактерий и вирусов в средах организма человека и животных является основой для любых попыток управления этими процессами и обусловливает эффективность фаговой терапии у млекопитающих [36].
Далее рассмотрим более прикладной аспект экологии фагов — их вклад в экологическую безопасность.
Бактериофаги нашли применение в следующих областях (рис. 11):
- антибактериальная обработка продуктов;
- обеззараживание помещений пищевых производств;
- санитарная обработка рабочего пространства и оборудования;
- обеззараживание помещений больниц и ветеринарных клиник;
- проведение иных экологических мероприятий.

Рисунок 11. Вклад бактериофагов в экологическую безопасность
иллюстрация Анастасии Самоукиной
Экологическая безопасность неразрывно связана с доступом к достаточному количеству безопасных продуктов питания. Продукты, содержащие болезнетворные бактерии, вирусы, паразитов или вредные химические вещества, являются причиной более 200 заболеваний — от диареи до онкологических. По оценкам экспертов ВОЗ в бюллетене «Безопасность продуктов питания», от последствий потребления загрязненных пищевых продуктов ежегодно заболевают 600 миллионов человек, то есть почти каждый десятый житель планеты, а умирают 420 тысяч человек.
Как правило, заболевания пищевого происхождения — это инфекционные заболевания, вызванные бактериями: Salmonella, Campylobacter и энтерогеморрагический штамм кишечной палочки Escherichia coli, Listeria, холерный вибрион (Vibrio cholerae).
Основные средства лечения бактериальных инфекций — противомикробные препараты, например антибиотики. Тем не менее как уже говорилось выше, их нерациональное использование в медицине и ветеринарии привело к распространению резистентных бактерий и снижению эффективности лечения инфекционных болезней человека и животных. Резистентные бактерии попадают в пищевую цепочку человека посредством животных (например, Salmonella «входит» через кур).
Согласно докладу Всемирного банка «Экономическое бремя болезней пищевого происхождения в странах с низким и средним уровнем дохода» за 2018 г., совокупный экономический ущерб, связанный со снижением производительности труда, обусловленным болезнями пищевого происхождения, в странах с низким и средним уровнем дохода, по оценкам, составляет 95,2 млрд долларов, а ежегодный объем расходов на лечение болезней пищевого происхождения достигает 15 млрд долларов.
Эти проблемы возлагают дополнительную ответственность на:
- государственные органы управления, поскольку они играют ключевую роль в формулировании политики и создании нормативно-правовой базы;
- производителей продовольствия;
- работников пищевой промышленности.
Безопасность продуктов питания должна стать приоритетным вопросом общественного здравоохранения. Для оперативного обмена информацией, связанной с безопасностью продуктов питания, ВОЗ ведет тесное сотрудничество с Сельскохозяйственной и продовольственной организацией ООН (FАО), со Всемирной организацией по охране здоровья животных (МЭБ) и другими международными организациями.
Для обработки пищевого сырья, готовых продуктов и поверхностей, которые с ними контактируют, с целью уничтожения патогенных бактерий могут применяться не только антибиотики и дезинфектанты, но и литические бактериофаги. Такой подход получил название «фаговый биоконтроль». Он приобретает всё большую популярность в США и Европе, так как является эффективным, относительно недорогим, экологичным и социально ориентированным.
Большинство препаратов фагов, которые одобрены для применения в пищевой промышленности, не содержат никаких примесей или консервантов, следовательно, соответствуют требованиям к производству органических продуктов.
Что касается стоимости, то на сегодняшний день фаговый биоконтроль почти на порядок дешевле физических методов обработки (2–9 центов на килограмм продукта против 22–66 центов на килограмм продукта) и сравним по цене с применением жестких химических санитайзеров [37].
В США первый фагопрепарат для применения в пищевой промышленности был одобрен Управлением по санитарному надзору за качеством продуктов и медикаментов (FDA) в 2006 г. С тех пор FDA одобрило еще более десяти средств (табл. 2), а ряд препаратов в настоящее время проходит испытания [37].
| Препарат | Область применения |
|---|---|
| Ecolicide® | Препарат для борьбы с бактериями Escherichia coli. Применяется для устранения или значительного снижения загрязнения кишечной палочкой кормов для домашних животных. |
| Ecolicide PX™ | Препарат для борьбы с Escherichia coli в ходе предубойной подготовки. Применяется для устранения или значительного снижения загрязнения кишечной палочкой шкур животных. |
| EcoShield PX™ | Препарат для борьбы с бактериальным пищевым патогеном Escherichia coli, продуцирующим шига-токсин. Применяется для устранения или значительного снижения загрязнения пищевых продуктов шигатоксигенной E. coli. |
| EcoShield™ | Препарат для борьбы с Escherichia coli. Применяется для устранения загрязнения пищевых продуктов кишечной палочкой. |
| ListShield™ | Препарат для борьбы с пищевым бактериальным патогеном Listeria monocytogenes. Разработан для обработки продуктов питания с высоким риском заражения L. monocytogenes. Также может использоваться для устранения или значительного снижения уровня L. monocytogenes на оборудовании, поверхностях и т.д. на предприятиях пищевой промышленности. |
| SalmoFresh™ | Препарат для борьбы с бактериальным патогеном Salmonella enterica. Разработан для обработки пищевых продуктов с высоким риском заражения сальмонеллой. |
| ShigaShield™ | Препарат для борьбы с бактериальным патогеном Shigella, передающимся через воду и пищу. Разработан для обработки продуктов с высоким риском заражения: свежего и готового к употреблению мяса и птицы, рыбы, моллюсков, свежих и переработанных фруктов и овощей, а также молочных продуктов, включая сыр. |
| Listex™ | Препарат для борьбы с Listeria monocytogenes. Разработан для защиты рабочей среды и поверхностей (полы, стоки, конвейерные ленты, морозильные камеры и др.), контактирующих с пищевыми продуктами, от листерий. |
| PhageGuard S™ | Препарат для борьбы с Salmonella enterica. Используется для обработки продуктов переработки мяса и птицы с высоким риском заражения сальмонеллой. |
| Finalyse® | Препарат для борьбы с возбудителями сальмонеллезной и эшерихиозной инфекций. Используется в животноводстве и пищевой промышленности. |
Все аргументы «за» и «против» фагового биоконтроля представлены в таблице 3.
| Преимущества | Недостатки |
|---|---|
| Фаги имеют природное происхождение. | Не все фаги могут быть использованы для биоконтроля. Указанные преимущества касаются только диких штаммов вирулентных фагов. |
| Фаги специфичные, поражают только бактерии-мишени. | Не обеспечивают полной ликвидации патогенов, если продукты контаминированы видами и даже штаммами, которые не являются мишенями данных фагов. В случае развития вторичных инфекций или суперинфекций показано применение фаговых коктейлей, а не монопрепаратов. |
| Фаги могут быть использованы однократно. | Фаги действуют (жизнеспособны) только в присутствии бактерий-мишеней, кумулятивными свойствами не обладают. |
| Риск развития перекрестной устойчивости бактерий к антибиотикам отсутствует. | У бактерий всё же может развиваться устойчивость к фагам , но использование фаговых коктейлей снижает этот риск. |
| Новые фаги нужной специфичности можно относительно быстро найти, а их препараты относительно легко изготовить. | Быстрое введение в практику новых фаговых изолятов плохо совместимо с действующим законодательством и процедурами сертификации, кроме того, оно требует постоянно идущих исследований, выполняемых достаточно квалифицированными учеными. |
| Фаговые препараты малотоксичны и не оказывают негативного воздействия на среду. | |
| Фаги не влияют на органолептические, питательные и реологические свойства пищевых продуктов. |
Узнать о механизмах защиты бактерий от фагов можно в статье «Огромный и загадочный мир бактериофагов» [1]. Механизм защиты под названием CRISPR/Cas открывает потрясающие возможности для генной инженерии и биотехнологии, в чем можно убедится, прочитав статью «Просто о сложном: CRISPR/Cas» [38]. Бактерии и фаги в своем противоборстве — благодатная «почва» для исследователей. Ознакомиться со стратегиями противоборствующих сторон можно в статьях «Противофаговая линия Мажино в клетках прокариот: новые открытия» [39] и «Белок Ocr — швейцарский нож бактериофага T7» [40].
Заключение
В условиях роста мирового населения, повышения спроса на продукты питания, усиления интенсивности и индустриализации растениеводства и животноводства появляются как новые возможности, так и новые угрозы для безопасности. Использование фаготерапии в борьбе с бактериальными инфекциями безусловно открывает новые горизонты и позволяет добиться на практике значимых результатов.
Конечно, есть определенные нюансы в производстве и применении фаговых препаратов:
- соблюдение технологии производства: соответствия процесса требованиям GMP, тщательной очистки препаратов, хранения их в холодильнике и другие;
- необходимость в достаточно обширной фаговой коллекции с возможностью замены в препаратах «старых» фагов на «новые» для подбора эффективных фаговых коктейлей и борьбы с резистентностью бактерий.
Несмотря на это, фаготерапия очень уважаема ветеринарными врачами, животноводами и агрономами, в отличие от более скептического взгляда ученых. Возможно, это как раз тот случай, когда теория не успевает за практикой, и более пристальный взгляд ученых на закономерности и нюансы практического применения фагов поможет нам лучше понять биологию бактериофагов в будущем... Тогда возможностей применения фаготерапии как в сельском хозяйстве, так и в медицине станет гораздо больше. А какое место занимает сегодня фаготерапия в медицине, можно будет узнать из следующей статьи спецпроекта.
Литература
- Огромный и загадочный мир бактериофагов;
- Richard J. Fair, Yitzhak Tor. (2014). Antibiotics and Bacterial Resistance in the 21st Century. Perspect Medicin Chem. 6, PMC.S14459;
- J.I.R. Castanon. (2007). History of the Use of Antibiotic as Growth Promoters in European Poultry Feeds. Poultry Science. 86, 2466-2471;
- Eugeni Roura, Josep Homedes, Kirk C. Klasing. (1992). Prevention of Immunologic Stress Contributes to the Growth-Permitting Ability of Dietary Antibiotics in Chicks. The Journal of Nutrition. 122, 2383-2390;
- Emma T. Helm, Shelby Curry, Julian M. Trachsel, Martine Schroyen, Nicholas K. Gabler. (2019). Evaluating nursery pig responses to in-feed sub-therapeutic antibiotics. PLoS ONE. 14, e0216070;
- Маилянс Э. (2022). Антибиотики в животноводстве. Как снизить использование противомикробных препаратов в отрасли. «Агроинвестор»;
- Пожиратели бактерий: убийцы в роли спасителей;
- Под знаком бактериофага: Париж — Тбилиси. (2016). «Наука из первых рук»;
- Нифонтова В.В. и Чугунова Е.О. (2015). Получение бактериофагов и их применение в ветеринарии. «Вестник Пермского федерального исследовательского центра». 2, 54–59;
- Leili Aghebati-Maleki, Babak Bakhshinejad, Behzad Baradaran, Morteza Motallebnezhad, Ali Aghebati-Maleki, et. al.. (2016). Phage display as a promising approach for vaccine development. J Biomed Sci. 23;
- Иванова И.А., Труфанова А.А., Филиппенко А.В., Беспалова И.А., Омельченко Н.Д. (2019). Бактериофаги и иммунная система макроорганизма. «Журнал микробиологии, эпидемиологии и иммунобиологии». 6, 79–84;
- Ewa Jończyk-Matysiak, Beata Weber-Dąbrowska, Barbara Owczarek, Ryszard Międzybrodzki, Marzanna Łusiak-Szelachowska, et. al.. (2017). Phage-Phagocyte Interactions and Their Implications for Phage Application as Therapeutics. Viruses. 9, 150;
- Andrzej Górski, Ewa Jończyk-Matysiak, Marzanna Łusiak-Szelachowska, Ryszard Międzybrodzki, Beata Weber-Dąbrowska, Jan Borysowski. (2018). Phage therapy in allergic disorders?. Exp Biol Med (Maywood). 243, 534-537;
- V Clavijo, D Baquero, S Hernandez, J.C. Farfan, J Arias, et. al.. (2019). Phage cocktail SalmoFREE® reduces Salmonella on a commercial broiler farm. Poultry Science. 98, 5054-5063;
- Anisha M. Thanki, Nathan Brown, Andrew D. Millard, Martha R. J. Clokie. (2019). Genomic Characterization of Jumbo Salmonella Phages That Effectively Target United Kingdom Pig-Associated Salmonella Serotypes. Front. Microbiol.. 10;
- Karina Desiree, Sabrina Mosimann, Paul Ebner. (2021). Efficacy of phage therapy in pigs: systematic review and meta-analysis. Journal of Animal Science. 99;
- Wenjuan He, Shizhen Ma, Lei Lei, Junjia He, Xing Li, et. al.. (2020). Prevalence, etiology, and economic impact of clinical mastitis on large dairy farms in China. Veterinary Microbiology. 242, 108570;
- Mengting Guo, Ya Gao, Yibing Xue, Yuanping Liu, Xiaoyan Zeng, et. al.. (2021). Bacteriophage Cocktails Protect Dairy Cows Against Mastitis Caused By Drug Resistant Escherichia coli Infection. Front. Cell. Infect. Microbiol.. 11;
- E A Glazunov, N V Pimenov, E A Pustovit. (2020). Bacteriophage-mediated sensibilization of mammary gland. IOP Conf. Ser.: Earth Environ. Sci.. 548, 042047;
- M. Y. Ganaie, S. Qureshi, Z. Kashoo, S. A. Wani, M. I. Hussain, et. al.. (2018). Isolation and characterization of two lytic bacteriophages against Staphylococcus aureus from India: newer therapeutic agents against Bovine mastitis. Vet Res Commun. 42, 289-295;
- Пименов Н.В., Глазунов Е.А., Сотникова Л.Ф., Попова В.М., Жиленков Е.В., Юскевич В.В. (2016). Изучение профилактической и лечебной эффективности препарата бактериофагов при маститах у коров в условиях молочно-товарной фермы. Russian Journal of Agricultural and Socio-Economic Sciences. 53, 83–89;
- Sławomir Zduńczyk, Tomasz Janowski. (2020). Bacteriophages and associated endolysins in therapy and prevention of mastitis and metritis in cows: Current knowledge. Animal Reproduction Science. 218, 106504;
- Niels Vander Elst, Sara B. Linden, Rob Lavigne, Evelyne Meyer, Yves Briers, Daniel C. Nelson. (2020). Characterization of the Bacteriophage-Derived Endolysins PlySs2 and PlySs9 with In Vitro Lytic Activity against Bovine Mastitis Streptococcus uberis. Antibiotics. 9, 621;
- Stephanie A. Lynch, Karla J. Helbig. (2021). The Complex Diseases of Staphylococcus pseudintermedius in Canines: Where to Next?. Veterinary Sciences. 8, 11;
- T. Freitag, R.A. Squires, J. Schmid. (2008). Naturally occurring bacteriophages lyse a large proportion of canine and feline uropathogenic Escherichia coli isolates in vitro. Research in Veterinary Science. 85, 1-7;
- Takaaki Furusawa, Hidetomo Iwano, Yutaro Hiyashimizu, Kazuki Matsubara, Hidetoshi Higuchi, et. al.. (2016). Phage Therapy Is Effective in a Mouse Model of Bacterial Equine Keratitis. Appl Environ Microbiol. 82, 5332-5339;
- Kevin Renfert, Wolfgang Rabsch, Angelika Fruth, Stephanie Speck, Michael Pees. (2019). The use of a salmonella bacteriophage in bearded dragons: application, passage time and reisolation. Tierarztl Prax Ausg K. 47, 247-256;
- Liting Wu, Yuan Tian, Maoda Pang, Zhenquan Yang, Hongduo Bao, et. al.. (2021). A novel vibriophage vB_VhaS_PcB-1G capable of inhibiting virulent Vibrio harveyi pathogen. Aquaculture. 542, 736854;
- Huijing Cui, Cong Cong, Lili Wang, Xiaoyu Li, Jibin Li, et. al.. (2021). Protective effectiveness of feeding phage cocktails in controlling Vibrio harveyi infection of turbot Scophthalmus maximus. Aquaculture. 535, 736390;
- Зимин А.А. и Кононенко С.И. (2018). Применение бактериофагов для контроля заболеваний креветок, вызванных Vibrio harvei. «Сборник научных трудов Краснодарского научного центра по зоотехнии и ветеринарии». 7, 135–140;
- Jean Pierre González-Gómez, Osvaldo López-Cuevas, Nohelia Castro-del Campo, Irvin González-López, Célida Isabel Martínez-Rodríguez, et. al.. (2022). Genomic and biological characterization of the novel phages vB_VpaP_AL-1 and vB_VpaS_AL-2 infecting Vibrio parahaemolyticus associated with acute hepatopancreatic necrosis disease (AHPND). Virus Research. 312, 198719;
- Tahir Farooq, Muhammad Dilshad Hussain, Muhammad Taimoor Shakeel, Muhammad Tariqjaveed, Muhammad Naveed Aslam, et. al.. (2022). Deploying Viruses against Phytobacteria: Potential Use of Phage Cocktails as a Multifaceted Approach to Combat Resistant Bacterial Plant Pathogens. Viruses. 14, 171;
- S. J. Ahern, M. Das, T. S. Bhowmick, R. Young, C. F. Gonzalez. (2014). Characterization of Novel Virulent Broad-Host-Range Phages of Xylella fastidiosa and Xanthomonas. Journal of Bacteriology. 196, 459-471;
- Maria Saponari, Giuliana Loconsole, Daniele Cornara, Raymond K. Yokomi, Angelo De Stradis, et. al.. (2014). Infectivity and Transmission of <I>Xylella fastidiosa</I> by <I>Philaenus spumarius</I> (Hemiptera: Aphrophoridae) in Apulia, Italy. j econ entomol. 107, 1316-1319;
- Xiaofang Wang, Zhong Wei, Keming Yang, Jianing Wang, Alexandre Jousset, et. al.. (2019). Phage combination therapies for bacterial wilt disease in tomato. Nat Biotechnol. 37, 1513-1520;
- Летаров А.В., Голомидова А.К., Тарасян К.К. (2010). Экологические основы рациональной фаговой терапии. Acta Naturae (русскоязычная версия). 2, 66–79;
- Amit Vikram, Joelle Woolston, Alexander Sulakvelidze. (2021). Phage Biocontrol Applications in Food Production and Processing. Current Issues in Molecular Biology. 267-302;
- Просто о сложном: CRISPR/Cas;
- Противофаговая линия Мажино в клетках прокариот: новые открытия;
- Белок Ocr — швейцарский нож бактериофага T7;
- Angeliki Angelopoulou, Alicja K. Warda, Colin Hill, R. Paul Ross. (2019). Non-antibiotic microbial solutions for bovine mastitis – live biotherapeutics, bacteriophage, and phage lysins. Critical Reviews in Microbiology. 45, 564-580;
- Michael Appiah, Jun Wang, Wenfa Lu. (2020). Microflora in the Reproductive Tract of Cattle: A Review. Agriculture. 10, 232;
- Celia Ferriol-González, Pilar Domingo-Calap. (2021). Phage Therapy in Livestock and Companion Animals. Antibiotics. 10, 559;
- Gerald N. Misol, Constantina Kokkari, Pantelis Katharios. (2020). Biological and Genomic Characterization of a Novel Jumbo Bacteriophage, vB_VhaM_pir03 with Broad Host Lytic Activity against Vibrio harveyi. Pathogens. 9, 1051;
- Mao Ye, Mingming Sun, Dan Huang, Zhongyun Zhang, Hui Zhang, et. al.. (2019). A review of bacteriophage therapy for pathogenic bacteria inactivation in the soil environment. Environment International. 129, 488-496.