
Преодолевшие старение. Часть II. Дети подземелья
08 февраля 2016
Преодолевшие старение. Часть II. Дети подземелья
- 8364
- 0
- 12
Голый землекоп — укротитель рака и старения. Рисунок в полном размере можно посмотреть здесь.
рисунок автора статьи
-
Автор
-
Редакторы
-
Иллюстратор
Человек живет долго. С каждым десятилетием всё дольше. Но у него есть медицина. Слон живет столько же, а кит гораздо дольше — не пользуясь системой здравоохранения. Но они большие... Недавно человеку посчастливилось поближе познакомиться с очень маленьким и очень странным долгожителем. Он обитает в душном подземелье, не поддерживает постоянную температуру тела, формирует касты — как муравей. Подслеповат, как крот, голокож, как человек. Вот, пожалуй, и все аналогии. Дальше — сплошная уникальность. Не чувствует ожоги, почти не знает, что такое рак, атеросклероз и нейродегенерация, не проявляет классических признаков старения, переживает 30-летний рубеж... будучи мелким грызуном. С какими же секретами голого землекопа и его пушистых родственников-долгожителей предстоит работать человеку, чтобы продлить собственную здоровую жизнь?
Старение и долголетие
Цикл статей, задуманных в рамках спецпроекта «биомолекулы» для фонда «Наука за продление жизни».

В этом цикле рассмотрим общие проблемы старения клеток и организмов, научные подходы к долголетию и продлению здоровой жизни, связь сна и старения, питания и продолжительности жизни (обратимся к нутригеномике), расскажем про организмы с пренебрежимым старением, осветим темы (эпи)генетики старения и анабиоза.
Конечно, феномен старения настолько сложен, что пока рано говорить о радикальных успехах в борьбе с ним и даже о четком понимании его причин и механизмов. Но мы постараемся подобрать наиболее интересную и серьёзную информацию о нащупанных связях, модельных объектах, разрабатываемых и уже доступных технологиях коррекции возрастзависимых нарушений.
Краткое содержание спецпроекта освещено в видеоролике «Стареть или не стареть? // Всё как у зверей». Подробности же узнаете из наших статей.
Следите за обновлениями!
О феномене пренебрежимого старения и перспективах изучения животных, его демонстрирующих, речь шла ранее: «Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить» [1] и «Преодолевшие старение. Часть I. Кому выпал эволюционный джекпот?» [2]. Пожалуй, к самым интересным объектам биогеронтологических изысканий можно отнести млекопитающих, стареющих чрезвычайно медленно или почти не стареющих в человеческом понимании этого процесса. Но если экспериментировать с крупными, живущими более 100 лет организмами нереально, то мелкие, быстро размножающиеся и формирующие крупные популяции в естественных условиях и неволе животные были бы настоящим подарком для ученых.
И похоже, подходящих кандидатов уже нашли: долгой для своей весовой категории жизнью славятся некоторые роющие («подземные») грызуны, относящиеся к семействам Spalacidae (слепыш) и Bathyergidae (дамарский землекоп и голый землекоп, хотя последний стои́т на пороге выделения в семейство Heterocephalidae [3]). Эти животные (рис. 1) лишь изредка покидают душные и тесные системы подземных ходов и камер, то есть испытывают хронический дефицит кислорода и мирятся с избытком аммиака, углекислого газа и продукта его взаимодействия с водой — угольной кислотой. Условия можно назвать экстремальными, но относительно стабильными и выгодными с точки зрения безопасности: встречи с хищниками чрезвычайно редки. Ничтожность влияния врагов и негативных «наземных» экофакторов на мир этих грызунов эволюция учла, отобрав признаки, способствующие долгой здоровой жизни в условиях пониженной комфортности: замедленный обмен веществ, устойчивость к стрессам, раку, нейродегенерации.

Рисунок 1. Три подземных «богатыря». Слева направо: чемпион по продолжительности жизни — голый землекоп (Heterocephalus glaber, максимальная продолжительность жизни (МПЖ) превышает 32 года), слепыш (Spalax judaei, МПЖ 21 год) и дамарский землекоп (Fukomys damarensis, МПЖ в неволе 20 лет).
сайты www.lpzoo.org, www.paratiritis-news.com, www.houstonzoo.org соответственно
Особенно сильно природа поэкспериментировала над голым землекопом (см. врезку «Досье на голого землекопа»), обитателем восточноафриканских полупустынь и обладателем исключительного для млекопитающих плато на кривой смертности (рис. 2) [1]. А человек решил извлечь из этого пользу, изучив условия жизни грызуна и связав их с его уникальными свойствами.
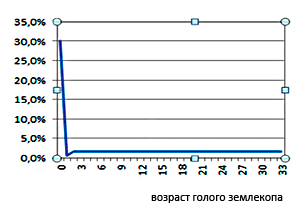
Рисунок 2. Иллюстративная кривая смертности голого землекопа. По оси ординат отложена вероятность умереть в течение года, плато отражает стабилизацию уровня смертности. Голый землекоп живет на порядок дольше мышей, проявляя признаки пренебрежимого старения. Кривая его смертности далека от «классической» экспоненты: у представителей разных возрастных когорт этого грызуна (кроме детской) почти равная вероятность умереть в течение года. Для описанных в научных статьях популяций плато точно пересекает 20-летний рубеж.
сайт nestarenie.ru (из лекционных материалов П. Федичева).
Кому, как не голому землекопу, нужно было уделить внимание в поиске факторов долгожительства? И с чего начать, как не с прочтения его генома? Однако биологи поступили разумно: кто-то секвенировал и сравнивал результаты с другими животными, кто-то погрузился в изучение уникальных «устойчивостей» землекопа. А некоторые команды сконцентрировались на подобных свойствах другого роющего грызуна — слепыша — и тоже не разочаровались.
Молекулярный фундамент долголетия землекопов
Еще в начале 1990-х ДНК-фингерпринтинг выявил крайне низкое генетическое разнообразие внутри колоний голого землекопа — примерно как у однояйцевых близнецов. Это закономерное следствие инбридинга, не снижающего, однако, жизнестойкости потомства. Потому вполне вероятно, что морфологические различия между особями формируются эпигенетическими механизмами, но какими — пока не известно. Геном голого землекопа впервые секвенировали в 2011 году [9], [10]. Оказалось, что при общем высоком сходстве с ДНК мышей и крыс (даже в порядке расположения генов) он обладает и рядом особенностей. Ниже перечислены те из них, которые могут иметь отношение к долголетию этого грызуна и потому требуют усиленного изучения (см. врезку «Геном голого землекопа»).
Теоретически вклад в долголетие голого землекопа могут вносить любые, если не все генетические особенности, связанные с работой митохондрий и моделированием теломер, с обменом и утилизацией макромолекул, балансом метаболических процессов и темпами деления клеток. И продлять жизнь они могут в том числе посредством устойчивости к раку и нейродегенерации.
В 2014 году свет увидела усовершенствованная версия прочтения генома Heterocephalus glaber, анализ которой выявил уникальные адаптации ДНК землекопа в участках, кодирующих опухолевый супрессор p53 и рецепторы гиалуронана CD44 и HMMR (RHAMM) [16]. Авторы исследования создали портал Naked Mole Rat Genome Resource — в помощь биологам, желающим использовать данные по геному голого землекопа в своей работе.
В том же 2014 секвенировали геном другого африканского землекопа — дамарского (в лаборатории Fukomys damarensis (рис. 1) доживает до 20 лет) — и сравнили его с геномом землекопа голого, а также сопоставили транскриптомы этих двух и нескольких родственных им видов подземных грызунов. Так удалось выявить общие генетические особенности зверьков-долгожителей и уникальные адаптации Heterocephalus glaber (перечислены в досье) [6]. Некоторые геномные находки подтвердились при изучении белков и клеточной физиологии землекопов.
Итак, что же отличает африканских грызунов-долгожителей?
- Особенности структуры и мощный конститутивный синтез глобинов позволяют землекопам эффективнее снабжать мозг кислородом. Пожизненно высокий уровень фактора роста и дифференцировки нейронов нейрегулина-1 (NRG-1) в мозге землекопов-долгожителей («неафриканского» слепыша в том числе) может вносить определяющий вклад в поддержание синаптической пластичности и стабильной работы нервной системы — непременного условия активного долголетия. Показано, что нейрегулиновый сигналинг спасает нейроны от «тирании» нейротоксинов — внешних и внутренних (например, при накоплении амилоидов). Предполагают также, что фактор NRG1 способен снижать тревожность, «вмешиваться» в социальную жизнь и даже выполнять функцию опухолевого супрессора. Косвенным индуктором синтеза NRG1 служит гипоксия. У грызунов уровень синтеза нейрегулина-1 в мозжечке прямо коррелирует с максимальной продолжительностью жизни (МПЖ), а у людей нарушения NRG1-сигнализации сопутствуют шизофрении, рассеянному склерозу и болезни Альгеймера [17].
- Низкая биологическая активность инсулина (из-за радикальных изменений β-цепи) и утилизация глюкозы альтернативным путем (возможно, посредством инсулиноподобного ростового фактора IGF2, обычно работающего до рождения) могут способствовать долголетию. У голого землекопа уровень гликированного гемоглобина в течение жизни стабилен, диабет не встречается. Для этого грызуна характерен и слабый тиреоидный сигналинг, что неудивительно: трийодтиронин поднимает уровень глюкозы в крови, ускоряет метаболизм, повышает температуру тела и потребность тканей в кислороде. У землекопов же, живущих в условиях отвратительного газо- и теплообмена, картина обратная. Есть мнение, что низкая активность этого гормона может продлевать жизнь за счет снижения температуры тела, интенсивности основного обмена, проницаемости мембран и активности определенных сигнальных путей.
- Инактивация гена FASTK может частично защищать от рака, воспаления и клеточного старения. Продукт гена — киназа, сенсор митохондриального стресса. Ее избыток (в клетках опухолей и при хронических воспалениях) задерживает Fas-опосредованный апоптоз. Ее отсутствие снижает онкогенный потенциал, способствует росту и восстановлению нейронов (у людей эти процессы с возрастом замедляются).
- Интенсивная продукция активных форм кислорода (АФК) и закономерный окислительный стресс не мешают землекопам жить долго. И это несмотря на слабую экспрессию генов некоторых пероксиредоксинов и низкую активность глутатионпероксидазы 1 — стандартных ферментов-антиоксидантов. Частично объяснить этот феномен для голого (но не дамарского) землекопа может замена в его β-актине окисляемых аминокислотных остатков на неокисляемые. В этом случае актин не деполимеризуется, не меняются регуляторные процессы. Зато высокий уровень АФК и окисленный актин — типичная находка у пожилых и страдающих нейродегенеративными болезнями людей. Тем не менее у голого землекопа общий высокий уровень окислительных повреждений белков, некоторых липидов и ДНК не нарушает их функции и не увеличивается с возрастом (в отличие от мышей) [18]. Интересно, что подобные — противоречащие свободнорадикальной теории старения — данные были получены в экспериментах с дрожжами: ограничение калорий продляло им жизнь, хотя при этом клеточное дыхание усиливалось, и АФК производилось больше [19], [20]. Судя по всему, для продления жизни важнее не избегать окислительного стресса, а вырабатывать механизмы, амортизирующие его эффекты или активирующие пути защиты от других повреждений. Вероятно, активная аутофагия (а значит, поддержание высококачественного пула митохондрий и аминокислотного гомеостаза) и структурная стабильность белков — в их числе. Предполагают, что центральную роль в регуляции всего комплекса защитных механизмов у видов-долгожителей может играть постоянная активность сигнального пути Nrf2 (рис. 4), пересекающегося с системами p53 и NF-κB [21], [22]. Подтверждает это стабильно высокая Nrf2-сигнализация в тканях всех долгоживущих грызунов, причем продолжительность жизни коррелирует не с общим уровнем этого белка, а именно с его сигнальной активностью. Последняя регулируется белковыми «иудами» Keap1 и βTrCP (рис. 4) — именно с их уровнями обратно коррелирует МПЖ грызунов [22].
- Уникальный процессинг 28S рРНК голого землекопа, вероятно, вносит вклад в высокую точность трансляции и потрясающую стабильность протеома. Оказалось, что при сходной скорости трансляции количество ошибочно включенных аминокислот в фибробластах голого землекопа в четыре раза ниже, чем в мышиных. Не исключено, что особая, двухфрагментная, 28S рРНК меняет фолдинг или динамику большой субъединицы рибосомы, повышая тем самым точность трансляции и снижая количество аномальных белков. Для протеома этого грызуна характерны: устойчивость белков к денатурации, пожизненно невысокий уровень их убиквитинирования и повышающаяся с годами активность протеасом (у мышей, наоборот, доля «приговоренных к смерти» белков растет, и «палачи»-протеасомы с нагрузкой справляются хуже). Получается, что высокоточный синтез и эффективные шаперонные системы формируют «здоровый» протеом, предохраняющий клетку от накопления агрегатов и прочих возрастзависимых эффектов. А с поврежденными белками, видимо, неплохо справляются активные протеасомы [23]. Но что самое интересное — транскрипцию генов протеасом и шаперонов регулирует тот же Nrf2.
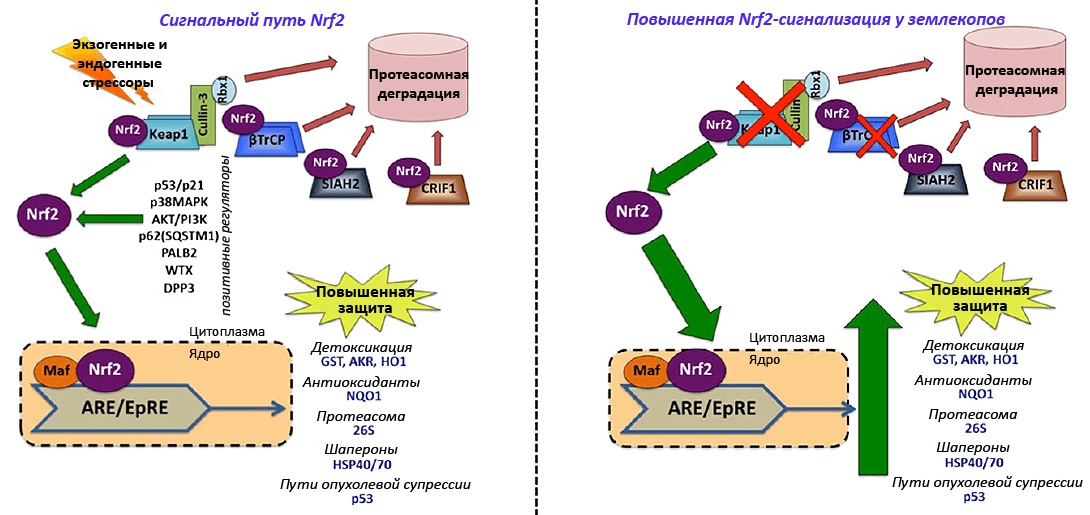
Рисунок 4. Цитопротекторный сигнальный путь Nrf2 (nuclear factor-erythroid 2-related factor-2). Этот путь регулирует транскрипцию более 200 генов, принимающих участие в антиоксидантном и противовоспалительном ответе организма на стрессы — «обыденные» (метаболические, типа окислительного) и «неожиданные» (токсины, поступившие извне). Белок Nrf2 синтезируется в эндоплазматическом ретикулуме (ЭПР) и может проникать в ядро, где активирует целевые гены. Стабильный уровень Nrf2 поддерживается путем модуляции его протеасомной деградации после убиквитинирования E3-убиквитинлигазным комплексом Cullin-3/Rbx1. В условиях гомеостаза Nrf2 связан в цитоплазме с «меткой деградации» Keap1 — субстратным адаптером убиквитинлигазы. Обрекают Nrf2 на деградацию и белки βTrCP, SIAH2, CRIF1. При стрессе конформационные изменения Keap1 делают невозможным убиквитинирование Nrf2, повышая тем самым продолжительность его «жизни» и величину пула свободного Nrf2. В итоге больше его молекул проникает в ядро, в комплексе с транскрипционным фактором Maf связывается с ARE/EpRE-локусом (antioxidant/electrophile response element) и индуцирует экспрессию генов, ответственных за синтез цитопротекторов и факторов контроля клеточного цикла. Неполноценность этого пути или подконтрольных компонентов характерна для многих патологий, особенно возрастзависимых (диабета, рака, нейродегенерации). Nrf2-путь постоянно гиперактивен у грызунов-долгожителей — благодаря снижению продукции негативных регуляторов Keap1 и βTrCP. Уровни экспрессии Nrf2-регулируемых генов в десятки раз (!) выше у голого землекопа по сравнению с мышами. Узлы этого пути (особенно синтез βTrCP) рассматривают в качестве перспективных целей для терапевтических агентов.
[22], рисунок адаптирован
Пока сложно делать общие выводы, ведь не все описанные молекулярные особенности изучались у большой выборки грызунов с разной МПЖ, да и того же слепыша. Вполне вероятно, что общий фундамент долголетия составляют механизмы устойчивости клеток землекопов ко всевозможным стрессовым факторам — от АФК и патологических белков до микотоксинов и ксенобиотиков. Это отчетливо проявляется, например, в исключительной невосприимчивости к раку и пожизненно стабильном поддержании мозговых функций этих животных. Особенности метаболизма глюкозы тоже могут влиять на продолжительность их жизни. Что же касается его величества Землекопа Голого, то большинству упоминаний о нём сопутствует слово «стабильность»: стабильная экспрессия большинства генов, стабильный протеом, стабильный уровень окисленных биомолекул, стабильная работа митохондрий и антиоксидантов, стабильный состав тела, стабильный темп метаболизма, стабильная работа органов. Вполне вероятно, что это свойство характерно и для его «товарищей» по подземелью.
Стратегии противораковой защиты грызунов-долгожителей
Важный, если не определяющий, вклад в долголетие землекопов вносит устойчивость к неоплазии — ведь основная причина смерти мышей и многих других млекопитающих — рак. Например, у некоторых линий мышей и крыс смертность от рака достигает 70–90%. В то же время долго не было известно ни одного случая развития этой патологии у голых землекопов (о двух особях с очагами, напоминающими карциномы, сообщили весной 2016 года). Их фибробласты репликативно не стареют (гены теломеразы экспрессируются у этих грызунов всю жизнь), однако в культуре делятся чрезвычайно медленно. Между скоростью деления репликативно не стареющих фибробластов in vitro и продолжительностью жизни существует обратная корреляция [24]. Потому главные вопросы, на которые должен «ответить» голый землекоп: какие механизмы столь надежно контролируют его клеточный цикл, и только ли они обеспечивают нечувствительность к раку? У других грызунов-долгожителей, судя по всему, тоже найдутся интересные ответы.
Противораковая защита состоит из многих взаимосвязанных звеньев: она предполагает и строгую регуляцию прохождения контрольных точек клеточного цикла, и репарацию повреждений ДНК, и репликативное старение, и апоптоз, и даже настройку интенсивности убиквитинзависимой утилизации белков. Межвидовые различия в любом из этих процессов объясняют разницу в предрасположенности животных к онкозаболеваниям и (частично) в средней продолжительности их жизни (рис. 5) [24]. Мыши и крысы десятилетиями верой и правдой служили биомедицинской науке [25], но они далеко не лучший объект для изучения онкорезистентности, поскольку восприимчивы к развитию рака гораздо больше, чем люди, не говоря уже о землекопах. Значит, какие-то профилактические механизмы у них не работают, и исследователи упускают важные антипролиферативные факторы. Известно, в частности, что у человека в контроле клеточного деления задействованы оба важнейших пути — pRb и p53, а у мышей и крыс роль первого минорна, то есть подстраховки практически нет — и это при том, что теломераза в их соматических клетках активна. Экспериментально установлено, что для малигнизации мышиных фибробластов достаточно нарушить две клеточные системы, а человеческих — целых шесть. Соответственно, мышиная модель мало пригодна для предсказания человеческих процессов, и отсутствие подходящих животных до сей поры прилично ограничивало темпы онкологических исследований. Если классические модельные грызуны незаменимы для отработки терапии, то недостающие знания по профилактике могут дать именно животные-долгожители, у которых механизмы онкозащиты работают как часы на протяжении всей жизни [26].
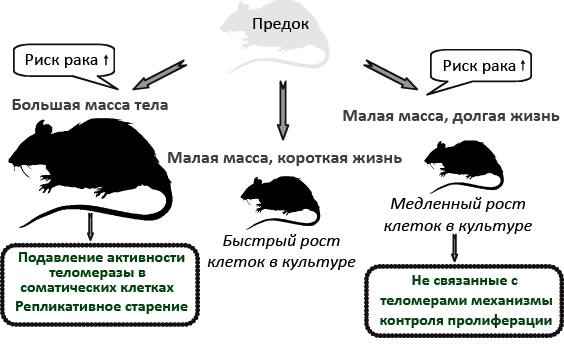
Рисунок 5. Антираковые стратегии грызунов в зависимости от массы тела и продолжительности жизни. Риск развития рака повышается с ростом числа удвоений ДНК и клеток — то есть с годами и увеличением размера тела. С другой стороны, опасность представляет и «трудолюбивая» теломераза. У крупных грызунов (капибар, американских дикобразов, бобров), как и у человека, соматическая теломераза неактивна, что со временем приводит к запрету на клеточное деление и предотвращает онкогенез. У всех мелких грызунов теломераза чрезвычайно активна, теломеры не укорачиваются, что не отменяет скоротечность жизни многих из них (крыс, мышей и др.). Последним, в отличие от долгожителей, эволюция из соображений экономии отказала в разнообразии систем противораковой защиты. Виды-долгожители (голый землекоп, слепыш, серая белка) не проявляют репликативного старения, однако выработали альтернативные механизмы защиты от рака: популяция их фибробластов в культуре растет медленно — как и у крупных грызунов с «ленивой» теломеразой.
[24], рисунок адаптирован
I. Тотальная зачистка территории (стратегия слепыша)
Общая реальность для подземных грызунов — гипоксия. Причем гипоксия пульсирующая — то больше кислорода, то меньше, а то и совсем нет. Не удивительно, что в организмах таких грызунов, помимо высокой васкуляризации, эффективного дыхания и активного кроветворения, выработаны разные клеточные страховочные механизмы, часть которых так или иначе связана с канцерогенезом.
Дальний родственник голого землекопа — слепыш (Spalax, blind mole-rat) — подземный грызун, распространенный на Среднем Востоке (рис. 1). Он тоже отличается долгожительством (20 лет — не предел) и онкорезистентностью: спонтанные опухоли за 50 лет у этих животных не наблюдали ни разу, да и к индуцированному раку они экстремально устойчивы.
Доктор Вера Горбунова и ее коллеги из Рочестерского унивеститета (Нью-Йорк) и других институтов США и Израиля в поисках объяснения такой устойчивости проанализировали in vitro рост фибробластов двух видов слепышей — Spalax judaei и Spalax golani. Клеточные популяции активно удваивались лишь 7–20 раз, затем «притормаживали» и начинали секретировать β-интерферон (IFN-β), который вызывал массовый клеточный некроз — происходило самоочищение популяции на пороге онкогенеза. Такого единомоментного «конца» исследователи ни разу не наблюдали при выращивании фибробластов 20 других видов грызунов. Этот феномен не был связан ни с условиями культивирования, ни с укорочением теломер (клетки слепыша репликативно не стареют). Зато подтвердилось участие в некротическом ответе белков — контролёров клеточного цикла p53 и pRb [27].
Интересно, что бόльшая часть клеток гибла именно от некроза (казалось бы, неточного процесса), в то время как у фибробластов мышей IFN-β вызывал апоптоз. Авторы работы связывают это с адаптивной точечной мутацией гена белка p53 у слепышей, позволяющей в условиях характерной для подземных туннелей гипоксии отключать клеточное деление, создавая условия для репарации, но не запускать апоптоз. Не исключено, что некроз — даже более эффективная превентивная процедура, ведь она позволяет зачистить подозрительное место качественнее, уничтожив «неблагонадежное» окружение, подвергшееся опухолевой сигнализации. Та же группа ученых показала, что фибробласты слепыша и даже их культуральная среда вызывали гибель различных линий опухолевых клеток, включая человеческие [26].
Еще интереснее то, что поведение культур фибробластов слепыша и голого землекопа сильно различается: предотвращение переразмножения фибробластов последнего достигается за счет сверхчувствительности к уплотнению популяции (см. ниже). Клетки голого землекопа на стресс предпочитают отвечать традиционным апоптозом — как клетки мышей и человека. Получается, что одной и той же цели даже родственные организмы-долгожители могут достигать разными способами (правда, в описанных случаях стратегии таки сходятся на pRb-пути).
У слепыша обнаружен целый спектр обусловленных адаптацией к гипоксии изменений структуры генов или их экспрессии. Причем многие из этих генов напрямую связаны с канцерогенезом. Упомянутая мутация гена опухолевого супрессора p53, например, вполне обычна для человеческих злокачественных опухолей, но, увы, приводит она к иному результату... Ген главного фактора роста эндотелия сосудов VEGF у Spalax экспрессируется по максимуму, причем конститутивно — как в опухолях. У онкобольных высокий уровень этого фактора в крови связывают с неблагоприятным прогнозом: провоцируемый им ангиогенез обеспечивает условия для отдаленного метастазирования [28], [29]. Слепышу же он просто облегчает снабжение тканей кислородом. С другой стороны, анализ транскриптома Spalax выявил много работающих генов, связанных с устойчивостью одновременно и к раку, и к гипоксии [27]. В частности, почти три десятка уникальных аминокислотных замен в транскрипционном факторе Nrf2 (у млекопитающих он очень консервативен) в сочетании с высоким базальным уровнем его синтеза могут вносить вклад в превосходную устойчивость клеток слепыша к канцерогенам и иным стрессовым факторам.
II. Укрепление и уборка периферии (стратегии слепыша и голого землекопа)
Как ни странно, проблему формирования и развития опухолей нельзя решить, сконцентрировавшись на «внутренней» жизни клеток: они ведь не в вакууме обитают, а в насыщенном их же продуктами биоматриксе, через который передают друг другу сигналы, удаляют отходы, оценивают «микроклимат». Внеклеточный матрикс — это не простой бульон, а каркас для поддержания тканевой архитектуры и барьер, защищающий клетки от инвазии повреждающих агентов. Основа матрикса — трехмерная сеть волокон коллагена и эластина, пространство между которыми заполнено «желе», содержащим в основном гиалуроновую кислоту, гликопротеины и протеогликаны. Матрикс играет важную роль в процессах ангиогенеза, воспаления, регенерации, а также адгезии, роста и метастазирования опухолей. Не удивительно, что компоненты матрикса грызунов-долгожителей привлекли особое внимание биологов.
1. Такая разная гепараназа
Углеводные цепи протеогликанов матрикса очень часто представлены гепарансульфатом. Гепарансульфатные протеогликаны, взаимодействуя с другими компонентами матрикса, образуют своеобразное депо для факторов роста и цитокинов. Соответственно, разрушение гепарансульфатного каркаса гепараназой (HPSE) сопровождается высвобождением этих молекул и низкомолекулярных фрагментов самогό гепарансульфата. Последние, судя по всему, повышают выработку интерлейкинов и прочих провоспалительных цитокинов лейкоцитами и клетками селезенки [30]. Ну а факторы роста могут сигнализировать клеткам, что пора делиться. Избыток такой сигнализации способен провоцировать рост опухоли и ее метастазирование через новую сосудистую сеть (один из факторов — как раз ангиогенный VEGF). И хотя в норме цели у гепараназы благие — ускорить заживление ткани и рост сосудов, — в случае с онкопатологией она работает во вред: гепарансульфата много в базальной мембране сосудов, служащей препятствием для проникновения оторвавшихся от первичной опухоли клеток в другие ткани. Давно отмечена повышенная и ухудшающая прогноз продукция этого фермента многими опухолями.
У слепыша (Spalax judaei) гепараназа синтезируется гораздо интенсивнее, чем у людей, и ее пре-мРНК сплайсируется несколькими альтернативными способами. Стандартный вариант фермента режет гепарансульфат «с аппетитом» — так же, как и человеческий вариант (гомология их генов высока — 85%). Однако у слепыша в условиях пульсовой гипоксии образуются и альтернативные белки, в том числе почти лишенные гепараназной активности (варианты 7 и 36). Несмотря на это первый из них не оказывает противораковый эффект (не связано ли это с описанной способностью гепараназы напрямую регулировать транскрипцию?), а вот второй... Введение конструкции, продуцирующей вариант 36, в клетки меланомы на 80% сокращало выход фрагментов гепарансульфата: нерабочий белок грызуна доминировал над активным меланоцитарным. Видимо, альтернативные варианты нужны слепышу для модуляции работы стандартного фермента при изменении условий. В экспериментах in vivo вариант 36 заметно снижал метастатическую активность меланомы и в разы замедлял рост глиомы у мышей [34]. Таким образом, альтернативный сплайсинг гепараназы слепыша можно включить в арсенал стратегий ингибирования ее человеческого аналога.
2. Макроглобулиновый клининг-менеджмент
Совсем недавно внимание биологов привлекло еще одно внеклеточное вещество — α-2-макроглобулин (A2M) плазмы крови, ингибитор всех классов протеиназ. Дело в том, что в печени голого землекопа его ген «считывается» в 140 раз чаще, чем в мышиной, да и у человека этого белка меньше [35]. Вероятно, на заре эволюции землекопов подземный образ жизни способствовал закреплению у них высокого уровня A2M как главного защитника от бактериальных протеиназ. У грызунов A2M — главный белок острой фазы (у нас основным считается С-реактивный белок). Человеческий A2M обратимо связывает цитокины и факторы роста, обеспечивая их гомеостаз в тканях, а также инактивирует всевозможные, в том числе опухолевые, протеиназы. Взаимодействие с протеиназами открывает у макроглобулина сайт связывания с рецептором LRP1 (CD91), контакт с которым запускает быстрое очищение крови и тканей от A2M-протеиназных комплексов (путем рецепторзависимого эндоцитоза).
С возрастом количество A2M у человека снижается, соответственно, падает и качество «уборки». Предполагают, что этот белок играет значительную роль в онкогенезе, воспалении, нейродегенерации и старении: показано, что его рецептор, LRP1, задействован в липидном обмене, очистке крови от альцгеймеровского амилоида, гормона лептина и стимулирующих прогрессирование рака факторов (в том числе VEGF). Описана и вспомогательная роль A2M в «обличении предателей» — презентировании раковых антигенов. Этот белок претендует на роль шаперона, предотвращающего белковую агрегацию, и «снабженца» клеток цинком — незаменимым помощником многих ферментов, гормонов и транскрипционных факторов (дефицит цинка связывают с развитием возрастзависимых заболеваний). Так или иначе, структурные различия макроглобулинов голого землекопа и человека уже установлены, осталось самое сложное — оценить их влияние на продолжительность жизни. Авторы работы [35] осторожно напоминают об улучшении когнитивных функций в нашумевшем эксперименте с вливаниями «молодой» крови старым мышам. Тогда эффект связывали с активацией белка Creb в дряхлеющем гиппокампе [36], однако было бы интересно установить и роль A2M в подобных процессах...
3. Гиалуроновая экспансия
Пожалуй, лучше всего описана противораковая стратегия, связанная с высокомолекулярной гиалуроновой кислотой внеклеточного матрикса голого землекопа.
Полисахарид гиалуроновая кислота (ГК, гиалуронан) создает на поверхности клеток связанный с мембранными рецепторами защитный покров, организуя протеогликаны и другие поверхностные белки и поддерживая запас воды. Средняя молекулярная масса ГК в нормальных биологических жидкостях и тканях человека высока — около 1–8 МДа. Защитную функцию этого полимера ослабляют свободные радикалы, которые он вынужден активно улавливать, например, при воспалении. Потому для поддержания тканевого гомеостаза и обновления внеклеточного матрикса жизненно необходим быстрый обмен ГК, оптимальный баланс между синтезом и деградацией, иначе накапливаются ее низкомолекулярные фрагменты. Эти фрагменты нарушают архитектуру матрикса и конкурируют за связывание как с рецепторами высокомолекулярного гиалуронана, так и с альтернативными структурами, что приводит к изменению кластеризации рецепторов, структуры цитоскелета и внутриклеточной сигнализации [37]. Таким образом, ГК можно рассматривать как сенсор деструктивных процессов в клеточном микроокружении. Изменение баланса низко- и высокомолекулярного полимера — стимул, приводящий в движение многочисленные механизмы клеточного ответа, часто лишь усиливающие воспаление и переводящие его в разряд хронического [38].
Связывание мелких фрагментов ГК с рецепторами типа CD44 и RHAMM/HMMR активирует сигнальные пути, стимулирующие не только воспаление, но и выживание, миграцию и инвазию опухолевых клеток (рис. 6) [40]. Снижение молекулярной массы ГК наблюдается и в хрящах пожилых людей, и в коже после УФ-облучения (В-типа), и в опухолях простаты [37]. А вот увеличение размера молекул ГК характерно как раз для наших любимых землекопов...
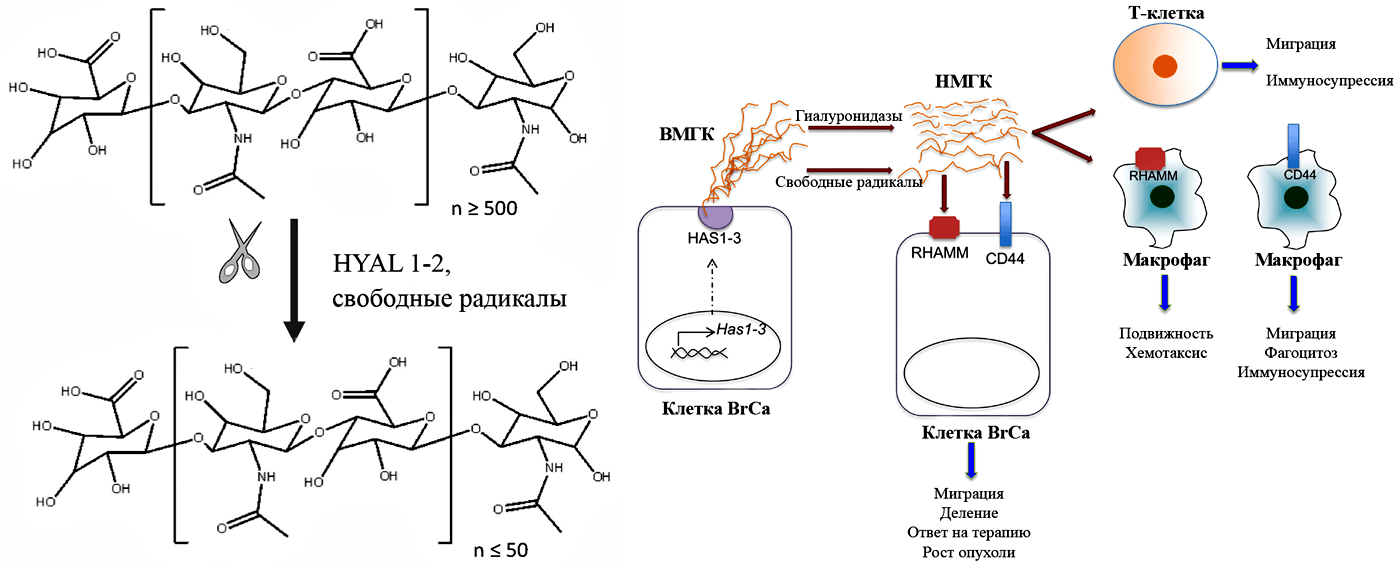
Рисунок 6. Деградация полимерной гиалуроновой кислоты (ГК) и влияние ее фрагментов на клетки в опухолевой микросреде. Слева — Синтезируемая в условиях гомеостаза высокомолекулярная ГК (≥ 500 дисахаридных единиц -β-1,4-GlcUA-β-1,3-GlcNAc-) разрушается на фрагменты (размером ≤ 50 дисахаридных единиц) под действием свободных радикалов и гиалуронидаз (HYAL1-2) в процессе повреждения тканей — при воспалении или онкогенезе. Фрагменты разной молекулярной массы выполняют разные функции: молекулы среднего размера (30–500 кДа) могут стимулировать деление клеток, а меньшего (Справа — В клетках карциномы молочной железы (Breast Cancer) и ее стромы мембранные гиалуронансинтазы (HAS1-3) интенсивно производят высокомолекулярную ГК (ВМГК), которая в опухолевой микросреде быстро разрушается до низкомолекулярных фрагментов (НМГК). Фрагменты связываются с рецепторами CD44 и RHAMM/HMMR (цитоплазматическая молекула, которая экспортируется на поверхность только в стрессовых условиях и взаимодействует с CD44), вызывая реорганизацию цитоскелета и активацию работы сигнальных путей (например, MAPK/ERK, Akt и FAK). В итоге активация экспрессии ряда генов транскрипционными факторами типа AP-1 (activator protein 1) и NFκB (nuclear factor kappa B) приводит к направленной миграции клеток и высвобождению провоспалительных цитокинов [40]. Такие цитокины выделяют и опухолевые клетки, и фибробласты, рекрутируя клетки врожденного иммунитета (нейтрофилы и макрофаги). Совместно все эти элементы производят факторы, ремоделирующие внеклеточный матрикс так, что создается особая «раковая» среда, поддерживающая рост и прогрессию опухоли. Формируется порочный круг.
В 2009 году Андрей Силуанов, Вера Горбунова и их коллеги обнаружили, что фибробласты голого землекопа проявляют двухуровневое контактное торможение деления — в отличие от одноуровневого у мышей и человека [41]. Контактное торможение — ключевой антираковый механизм, блокирующий деление клеток при достижении определенной их плотности (в культуре — обычно при формировании монослоя). Этот механизм ломается у клеток злокачественных опухолей, и они беспрепятственно наслаиваются друг на друга. Так вот фибробласты голого землекопа в культуре прекращают делиться при гораздо меньшей плотности, чем такие же клетки мышей. Этот процесс, названный ранним контактным ингибированием (РКИ), протекает при условии исправности p53- и pRb-путей или хотя бы одного из них: если утрачивается «выключатель» клеточного цикла pRb, то запускается апоптоз за счет страхующей системы p53 (это свойственно и мышам, и людям), а если портится только последняя — апоптоз происходит всё равно (это исключительное свойство голого землекопа). Но такая ситуация, видимо, складывается нечасто. Здесь стόит добавить, что у землекопа по сравнению с мышами базальный уровень синтеза белка p53 в фибробластах в 50 раз выше, и при стрессовых воздействиях он «подскакивает» активнее.
Известно, что у мышей и человека контактное торможение опосредуется мембранными рецепторами с дальнейшей индукцией p27Kip1 — ингибитора циклин-зависимых киназ (из семейства Cip/Kip-ингибиторов), который в ядре мешает фосфорилированию белка Rb, блокируя этим переход клетки из фазы G1 в фазу S, то есть запрещая ей делиться. У голого землекопа p27 тоже делает свое дело — но если отключено раннее торможение деления, которое обеспечивается ингибитором p16Ink4a из другого семейства, Ink4. Получается, что «обычное» p27-торможение лишь дополнительно страхует грызуна-долгожителя от канцерогенеза в случае сбоя в работе p16-зависимой системы РКИ (рис. 7, слева).
Но природа настолько прониклась симпатией к этому зверьку, что подарила ему еще один «антираковой щит». Если каким-то образом заставить работать в фибробластах землекопа комплекс онкогенов, то справиться с гиперпролиферацией посредством описанных систем супрессии ему не удастся — онкогены этому мешают. Однако, в отличие от экспрессирующих онкогены мышиных клеток, фибробласты землекопа быстро прекращают делиться, проявляя все признаки так называемого клеточного кризиса: дефекты хроматина, многоядерность, незавершенные деления и т.п. В таком состоянии клетки могут находиться довольно долго. Но подозревают, что если их много, то в конце концов патологическую зону подчищает некроз [42].
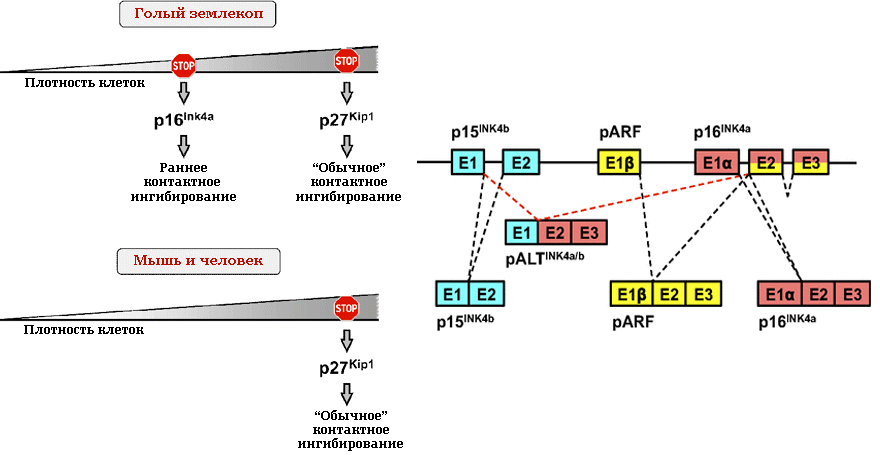
Рисунок 7. Многоуровневая защита от рака: особенности контактного ингибирования у голого землекопа. Слева — Сравнительная модель контактного ингибирования деления клеток землекопа, мыши и человека. Обычное контактное торможение, p27-опосредованное, характерно для клеток всех трех видов животных. Но у голого землекопа развился второй, ставший основным, уровень защиты от избыточной пролиферации — p16-опосредованное раннее контактное ингибирование (РКИ), не позволяющее культивируемым фибробластам плотно покрывать дно чашки Петри даже в один слой. Справа — Опухолевый супрессор pALTInk4a/b, дополнительный продукт локуса INK4a/b, задействованного в РКИ у голого землекопа. Буквами Е с порядковым номером обозначены экзоны локуса, символы α и β отражают принадлежность экзонов к разным рамкам считывания. p15Ink4b, p16Ink4a и ARF (p19ARF или p14ARF в зависимости от вида животного) — канонические транскрипты, pALTInk4a/b — уникальный, «землекоповый», результат альтернативного сплайсинга, объединяющий 5′ UTR-область и первый экзон p15 со вторым и третьим экзоном и 3′ UTR-областью p16.
В 2013 году выяснилось, что непосредственное отношение к феномену РКИ имеет гиалуроновая кислота, причем характерная именно для голого землекопа — экстремально высокомолекулярная (ЭВМГК), в пять раз превышающая по размеру молекулы ГК человека и мыши (в случае фибробластов кожи — 6–12 против 0,5–3 МДа) [43]. ЭВМГК накапливается в тканях землекопа благодаря низкой активности его гиалуронидаз и высокой процессивности гиалуронансинтазы 2 (HAS2) с уникальной структурой активного центра. Более того, клетки этого грызуна более восприимчивы к «гиалуроновому» сигналингу. Если же активировать гиалуронидазы или нокаутировать HAS2, среда для культивирования фибробластов теряет повышенную вязкость, а клетки становятся способными к малигнизации (мы помним, что низкомолекулярная ГК способствует пролиферации и воспалению). Однако физического присутствия ЭВМГК недостаточно для РКИ — необходима полноценная работа сигнального пути, связывающего ГК-рецепцию с индукцией генетического локуса INK4 (кодирующего опухолевые супрессоры p15Ink4b, Arf и p16Ink4a). Судя по всему, этот путь включает ГК-рецептор CD44 и белок цитоскелета NF2 (мерлин). Предполагают, что склонность к накоплению ЭВМГК изначально развилась у землекопов для поддержания эластичности кожи, что просто необходимо в тесных подземных туннелях, и затем это свойство легло в основу противораковой защиты и долголетия этих млекопитающих. Интересно, что ЭВМГК производят и клетки слепыша.
Поскольку локус INK4 в числе наиболее часто мутирующих при раке у людей, понимание механизмов его экспрессии сложно переоценить. Кроме того, он участвует в развитии репликативного, онкогениндуцированного и преждевременного стрессиндуцированного старения, а возможно, и возрастных болезней (интересно, что при старении повышается экспрессия гена p16, но не p15, хотя локус один, и сами они — потомки одного дуплицировавшегося в древности гена). Однако в нашем контексте особенно важно, что потеря работоспособности локуса делает невозможным и раннее контактное ингибирование у землекопа.
Совсем недавно было обнаружено, что INK4-локус этого грызуна содержит ранний терминатор трансляции и кодирует дополнительный, четвертый, продукт — гибрид p15Ink4b и p16Ink4a [44]. Этот новый белок, названный pALTInk4a/b (рис. 7, справа), содержится как в культивируемых клетках, так и в разных живых тканях землекопа, но ни у человека, ни у мыши обнаружить его не удалось. Синтез pALTInk4a/b клетками индуцируется в течение РКИ и при стрессовых воздействиях: УФ- и γ-облучении, утрате сцепления с субстратом и активации онкогенов. Гиперпродукция «четвертого» белка с большей вероятностью блокирует цикл клеток землекопа и человека, чем гиперпродукция p15Ink4b или p16Ink4a. Соотношение разных продуктов локуса, видимо, тканеспецифично и меняется в зависимости от интенсивности и набора стимулов.
Недавно было показано, что обычное контактное ингибирование (наряду с сывороточным голоданием, гипоксией и рапамицином) подавляет путь mTOR, а следовательно, и героконверсию — переход обратимого ареста клеточного цикла в глубокое сенесцентное состояние с патологическим профилем клеточной секреции [45]. Потому нельзя исключить вклад РКИ, действующего через необычный INK4-локус, в предотвращение не только рака, но и старения как такового у голого землекопа. Дополнительный ингибитор циклин-зависимых киназ, вероятно, служит добавочным «слоем» защиты и позволяет животному тонко регулировать работу контрольных точек клеточного цикла, обеспечивая баланс между пожизненной способностью к клеточной пролиферации и супрессией опухолей. Очевидно, что разные этапы синтеза, метаболизма и сигналинга гиалуроновой кислоты могут быть перспективными целями для терапевтических воздействий уже в организме человека.
Заключение о важности ОТК
Итак, подземные грызуны-долгожители выработали множественные, многоуровневые механизмы защиты от рака при сохранении функции теломеразы. Долголетие повышает шансы развития опухолей, а опухоли мешают жить долго. У животных с пренебрежимым или замедленным старением удивительным образом сочетается экстремально долгая молодость с экстремальной устойчивостью к раку. Очевидно, что важную роль в продлении жизни играет активность сигнальных путей транскрипционных факторов Nrf2 и p53. По всей видимости, строжайший, многоуровневый контроль клеточного цикла и качества внутри- и внеклеточных биомолекул — залог успеха многих пренебрежимо стареющих организмов. Возможно, что-то из спектра «животных» ответов на риск малигнизации и прочих возрастзависимых заболеваний удастся адаптировать для нужд медицины человеческой — пусть вначале в виде «костылей», фармпрепаратов, но всё же...
Литература
- Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить;
- Преодолевшие старение. Часть I. Кому выпал эволюционный джекпот?;
- Bruce D. Patterson, Nathan S. Upham. (2014). A newly recognized family from the Horn of Africa, the Heterocephalidae (Rodentia: Ctenohystrica). Zool J Linn Soc. 172, 942-963;
- Элементы: «Голых землекопов не жжет ни кислота, ни перец»;
- Thomas J Park, Ying Lu, René Jüttner, Ewan St. J Smith, Jing Hu, et. al.. (2008). Selective Inflammatory Pain Insensitivity in the African Naked Mole-Rat (Heterocephalus glaber). PLoS Biol. 6, e13;
- Xiaodong Fang, Inge Seim, Zhiyong Huang, Maxim V. Gerashchenko, Zhiqiang Xiong, et. al.. (2014). Adaptations to a Subterranean Environment and Longevity Revealed by the Analysis of Mole Rat Genomes. Cell Reports. 8, 1354-1364;
- Rochelle Buffenstein. (2008). Negligible senescence in the longest living rodent, the naked mole-rat: insights from a successfully aging species. J Comp Physiol B. 178, 439-445;
- «Научные идеи продления жизни». Буклет фонда «Наука за продление жизни»;
- Eun Bae Kim, Xiaodong Fang, Alexey A. Fushan, Zhiyong Huang, Alexei V. Lobanov, et. al.. (2011). Genome sequencing reveals insights into physiology and longevity of the naked mole rat. Nature. 479, 223-227;
- Элементы: «Геном голого землекопа — ключ к секрету долголетия?»;
- Вездесущий убиквитин;
- Старение — плата за подавление раковых опухолей?;
- Теломеры и новые мишени протоонкогенной терапии;
- Davies K.T., Bennett N.C., Tsagkogeorga G., Rossiter S.J., Faulkes C.G. (2015). Family wide molecular adaptations to underground life in African mole-rats revealed by phylogenomic analysis. Mol. Biol. Evol. 32, 3089–3107;
- Eloise Hudry, Debby Van Dam, Wim Kulik, Peter P De Deyn, Femke S Stet, et. al.. (2010). Adeno-associated Virus Gene Therapy With Cholesterol 24-Hydroxylase Reduces the Amyloid Pathology Before or After the Onset of Amyloid Plaques in Mouse Models of Alzheimer's Disease. Molecular Therapy. 18, 44-53;
- M. Keane, T. Craig, J. Alfoldi, A. M. Berlin, J. Johnson, et. al.. (2014). The Naked Mole Rat Genome Resource: facilitating analyses of cancer and longevity-related adaptations. Bioinformatics. 30, 3558-3560;
- Edrey Y.H., Casper D., Huchon D., Mele J., Gelfond J.A., Kristan D.M. et al. (2012). Sustained high levels of neuregulin-1 in the longest-lived rodents; a key determinant of rodent longevity. Aging Cell. 11, 213–222;
- V. I. Perez, R. Buffenstein, V. Masamsetti, S. Leonard, A. B. Salmon, et. al.. (2009). Protein stability and resistance to oxidative stress are determinants of longevity in the longest-living rodent, the naked mole-rat. Proceedings of the National Academy of Sciences. 106, 3059-3064;
- Su-Ju Lin, Matt Kaeberlein, Alex A. Andalis, Lori A. Sturtz, Pierre-Antoine Defossez, et. al.. (2002). Calorie restriction extends Saccharomyces cerevisiae lifespan by increasing respiration. Nature. 418, 344-348;
- John P. Aris, Ashley L. Alvers, Roy A. Ferraiuolo, Laura K. Fishwick, Amanda Hanvivatpong, et. al.. (2013). Autophagy and leucine promote chronological longevity and respiration proficiency during calorie restriction in yeast. Experimental Gerontology. 48, 1107-1119;
- Kaitlyn N. Lewis, Blazej Andziak, Ting Yang, Rochelle Buffenstein. (2013). The Naked Mole-Rat Response to Oxidative Stress: Just Deal with It. Antioxidants & Redox Signaling. 19, 1388-1399;
- Lewis K.N., Wason E., Edrey Y.H., Kristan D.M., Nevo E., Buffenstein R. (2015). Regulation of Nrf2 signaling and longevity in naturally long-lived rodents. PNAS. 112, 3722–3727;
- J. Azpurua, Z. Ke, I. X. Chen, Q. Zhang, D. N. Ermolenko, et. al.. (2013). Naked mole-rat has increased translational fidelity compared with the mouse, as well as a unique 28S ribosomal RNA cleavage. Proceedings of the National Academy of Sciences. 110, 17350-17355;
- Seluanov A., Hine C., Bozzella M., Hall A., Sasahara T.H., Ribeiro A.A. et al. (2008). Distinct tumor suppressor mechanisms evolve in rodent species that differ in size and lifespan. Aging Cell. 7, 813–823;
- Грызун особого назначения;
- Shams I., Manov I., Malik A., Band M., Avivi A. (2014). Underground fighting of cancer: Hypoxia-tolerant Spalax hides the key for treatment and prevention. The Plant & Animal Genome XXII Conference;
- V. Gorbunova, C. Hine, X. Tian, J. Ablaeva, A. V. Gudkov, et. al.. (2012). Cancer resistance in the blind mole rat is mediated by concerted necrotic cell death mechanism. Proceedings of the National Academy of Sciences. 109, 19392-19396;
- Обнаружены организаторы побега раковых клеток из первичного очага;
- Тернистый путь метастазов: через гипоксию в печень;
- Katharine J. Goodall, Ivan K. H. Poon, Simon Phipps, Mark D. Hulett. (2014). Soluble Heparan Sulfate Fragments Generated by Heparanase Trigger the Release of Pro-Inflammatory Cytokines through TLR-4. PLoS ONE. 9, e109596;
- Червякова Д. Новая стратегия противораковой терапии: ингибирование гепараназы. Интернет-журнал «Коммерческая биотехнология»;
- Claudio Pisano, Israel Vlodavsky, Neta Ilan, Franco Zunino. (2014). The potential of heparanase as a therapeutic target in cancer. Biochemical Pharmacology. 89, 12-19;
- C.R. Parish, C. Freeman, A.F. Ziolkowski, Y.Q. He, E.L. Sutcliffe, et. al.. (2013). Unexpected new roles for heparanase in Type 1 diabetes and immune gene regulation. Matrix Biology. 32, 228-233;
- N. J. Nasser, A. Avivi, I. Shafat, E. Edovitsky, E. Zcharia, et. al.. (2009). Alternatively spliced Spalax heparanase inhibits extracellular matrix degradation, tumor growth, and metastasis. Proceedings of the National Academy of Sciences. 106, 2253-2258;
- René Thieme, Susanne Kurz, Marlen Kolb, Tewodros Debebe, Susanne Holtze, et. al.. (2015). Analysis of Alpha-2 Macroglobulin from the Long-Lived and Cancer-Resistant Naked Mole-Rat and Human Plasma. PLoS ONE. 10, e0130470;
- Saul A Villeda, Kristopher E Plambeck, Jinte Middeldorp, Joseph M Castellano, Kira I Mosher, et. al.. (2014). Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nat Med. 20, 659-663;
- Cowman M.K., Lee H.G., Schwertfeger K.L., McCarthy J.B., Turley E.A. (2015). The content and size of hyaluronan in biological fluids and tissues. Front. Immunol. 6, 261;
- Misra S., Hascall V.C., Markwald R.R., Ghatak S. (2015). Interactions between hyaluronan and its receptors (CD44, RHAMM) regulate the activities of inflammation and cancer. Front. Immunol. 6, 201;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Schwertfeger K.L., Cowman M.K., Telmer P.G., Turley E.A., McCarthy J.B. (2015). Hyaluronan, inflammation, and breast cancer progression. Front. Immunol. 6, 236;
- A. Seluanov, C. Hine, J. Azpurua, M. Feigenson, M. Bozzella, et. al.. (2009). Hypersensitivity to contact inhibition provides a clue to cancer resistance of naked mole-rat. Proceedings of the National Academy of Sciences. 106, 19352-19357;
- Liang S., Mele J., Wu Y., Buffenstein R., Hornsby P.J. (2010). Resistance to experimental tumorigenesis in cells of a long-lived mammal, the naked mole-rat (Heterocephalus glaber). Aging Cell. 9, 626–635;
- Xiao Tian, Jorge Azpurua, Christopher Hine, Amita Vaidya, Max Myakishev-Rempel, et. al.. (2013). High-molecular-mass hyaluronan mediates the cancer resistance of the naked mole rat. Nature. 499, 346-349;
- Xiao Tian, Jorge Azpurua, Zhonghe Ke, Adeline Augereau, Zhengdong D. Zhang, et. al.. (2015). INK4locus of the tumor-resistant rodent, the naked mole rat, expresses a functional p15/p16 hybrid isoform. Proc Natl Acad Sci USA. 112, 1053-1058;
- O. V. Leontieva, Z. N. Demidenko, M. V. Blagosklonny. (2014). Contact inhibition and high cell density deactivate the mammalian target of rapamycin pathway, thus suppressing the senescence program. Proceedings of the National Academy of Sciences. 111, 8832-8837.







