
Искусственные клетки в борьбе с сахарным диабетом
31 января 2024
Искусственные клетки в борьбе с сахарным диабетом
- 2225
- 0
- 5
Исследователи научились наделять клетки несвойственными им функциями, нужными для терапии заболеваний. Создание искусственных клеток можно представить как сборку сложного механизма из множества разных деталей.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Активное развитие генной инженерии породило новое направление наук о жизни — синтетическую биологию. Ученые, работающие в этой сфере, создают живые системы с заданными свойствами, не имеющие аналогов в природе: например, микроорганизмы с искусственным геномом или «дизайнерские» ферменты. В этой статье мы рассмотрим, чего достиг научный прогресс в области применения искусственно созданных клеток для лечения диабета, а также пофантазируем, как в будущем синтетическая биология поможет пациентам поддерживать нужную концентрацию инсулина в крови.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла первое место в спецноминации «Синтетическая биология» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла первое место в спецноминации «Синтетическая биология» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Важность разработки эффективных методов борьбы с сахарным диабетом ни у кого не вызывает сомнений — в настоящее время более полумиллиарда человек живет с этим заболеванием. Вспомним, что в 2022 году население Земли достигло 8 миллиардов человек. Это значит, что в наши дни, когда побеждены многие инфекционные заболевания, как минимум каждый 16-й имеет диабет, а в некоторых странах статистика еще более удручающая. Повышенная концентрация сахара в крови при диабете — гипергликемия — может привести к различным осложнениям: от нарушений сердечно-сосудистой системы до потери зрения. Над поиском эффективных лекарств от диабета бьются давно — сейчас существует ряд хорошо известных стратегий лечения диабета, но они всё еще не позволяют с высокой точностью регулировать уровень глюкозы в крови. В статье будет рассказано, как ученые с помощью методов синтетической биологии стремятся перепрограммировать клетки, сделав их новым прорывным лекарством от диабета.
С чего началось лечение диабета?

Рисунок 1. На заре исследований инсулина.
В далеком 1920 году канадскому врачу и ученому Фредерику Бантингу было известно, что сахарный диабет возникает в результате недостатка гормона инсулина, секретируемого островками Лангерганса в поджелудочной железе. В то время все попытки исследователей по выделению чистого гормона заканчивались неудачей. Бантинг решил провести собственный эксперимент по выделению инсулина из поджелудочной железы собаки (рис.1). Для этого он перекрывал протоки железы, чтобы пищеварительный фермент трипсин не мог разрушать выделяемый инсулин.
После долгих трудов ученого с коллегами в 1922 году была успешно сделана инъекция инсулина 14-летнему пациенту с диабетом — Леонарду Томпсону, у которого значительно уменьшились симптомы болезни. Благодаря работе исследователей была подтверждена важнейшая роль инсулина в терапии сахарного диабета. В 1923 году Бантингу и его коллеге Джону Маклеоду была вручена Нобелевская премия по физиологии и медицине за открытие инсулина и прорыв в лечении болезни, которая до этого считалась смертным приговором.
Вернемся в настоящее
Спустя десятки лет после выделения инсулина Бантингом из поджелудочной железы ученые научились синтезировать гормон в микроскопических «биофабриках» — бактериях Escherichia coli. В настоящее время самыми распространенными методами лечения сахарного диабета являются инъекции бактериального инсулина и прием лекарственных препаратов — в зависимости от варианта заболевания. Для лечения диабета 1 типа, имеющего аутоиммунный механизм развития , традиционно применяют регулярные инъекции инсулина. Общепринятая стратегия коррекции диабета 2 типа, который также называют инсулинорезистентным, включает в себя те же инъекции с инсулином и применение средств, снижающих уровень сахара в крови или улучшающих чувствительность клеток к инсулину (ингибиторы альфа-глюкозидазы, агонисты GLP-1 и амилина).
За подробностями отсылаем к статье из Спецпроекта по аутоиммунным заболеваниям: «Сахарный диабет I типа, или Охота на поджелудочную железу» [2].
Но проблема сахарного диабета еще далека от своего разрешения. Побочные действия, жесткий режим приема и дозировок, отсутствие нужного эффекта у части пациентов — лишь некоторые из недостатков существующих методов лечения [3]. Трансплантация поджелудочной железы или отдельных островков Лангерганса является одним из вариантов терапии, однако и здесь есть свои проблемы — при пересадке возможен иммунный ответ на чужеродную ткань или орган, а доступность островков для трансплантации очень ограничена по сравнению со спросом на них [4]. Понимая необходимость разработки более эффективных и удобных для пациентов методов лечения диабета, ученые годами работают над созданием новых, порой весьма необычных, вариантов терапии, о которых будет рассказано дальше.
Достижения в области генетических технологий и накопление клинического опыта позволили генной и клеточной терапиям стать эффективными методами лечения пациентов с иммунодефицитами, онкологией и другими тяжелыми заболеваниями. Передовую терапию часто рассматривают для лечения сахарного диабета 1 типа, но пока что самые действенные разработки находятся на стадии доклинических испытаний (рис. 2) [5]. Пациенты с диабетом 1 типа остро нуждаются в инсулине, так как их β-клетки, продуцирующие гормон в поджелудочной железе, постоянно подвергаются атаке собственной иммунной системы. Создание неиссякаемого источника β-клеток из стволовых клеток [6] могло бы решить проблему с нехваткой материала для трансплантации. Также с помощью методов передовой терапии можно ввести человеку генетическую конструкцию или модифицированные клетки, чтобы инсулин стабильно вырабатывался в нужной концентрации в организме человека, и избавить пациентов с диабетом от постоянных подкожных инъекций.
Подробнее об этом можно прочитать в статье «Генная терапия: познакомьтесь с лекарствами будущего» [7] и других материалах спецпроекта «Генная и клеточная терапии».
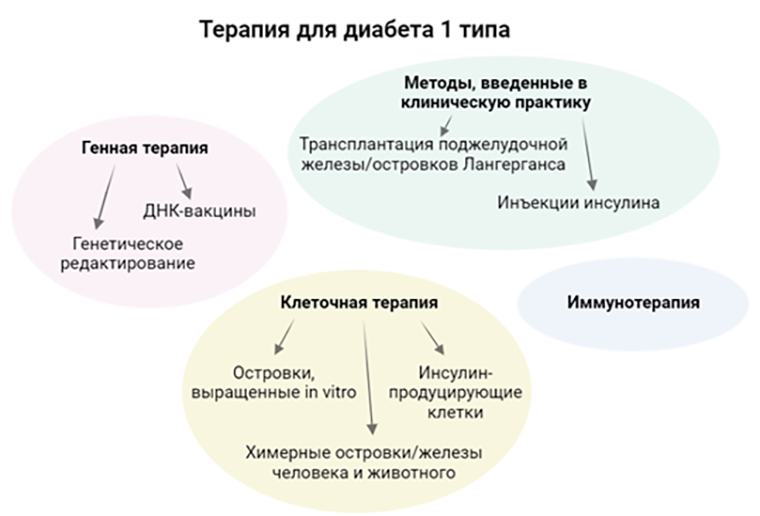
Рисунок 2. Методы терапии сахарного диабета 1 типа в реальной клинической практике — это лишь регулярные инъекции инсулина и трансплантация поджелудочной железы или тканей, синтезирующих этот гормон. Остальные представленные на схеме варианты очень перспективны, но пока не прошли всех стадий исследований на животных и людях. Методы клеточной терапии дают возможность получать продуцирующие инсулин клетки, ткани и даже органы из стволовых клеток. Симптомы сахарного диабета также могут быть снижены благодаря подходам генной терапии — например, экспрессии терапевтических белков в организме человека после введения генетической конструкции с помощью вектора. Применение иммунорегуляторных и противовоспалительных стратегий позволит снижать аутоиммунную атаку на β-клетки, продуцирующие инсулин.
Перечисленные методы передовой терапии считаются в научной среде многообещающими, поэтому такие подходы для лечения диабета продолжают глубоко изучать в лабораториях. В пытливых умах молекулярных биологов возник вопрос: а что, если придумать такие клетки, которые бы не зависели от успешности дифференцировки из стволовых клеток, могли бы самостоятельно детектировать уровень глюкозы в крови и в ответ производить инсулин? То есть вели бы себя как настоящие β-клетки. Наделение других типов клеток функцией синтеза инсулина может помочь избежать аутоиммуннных реакций на β-клетки при диабете 1 типа и апоптоза β-клеток, вызванного метаболическим стрессом, при диабете 2 типа [8].
Никакой магии — только синтетическая биология
Такое решение нашлось — это искусственные клетки, модифицированные с помощью генетических технологий для терапии диабета. Такие «умные» клетки работают по схеме простейшего компьютера: воспринимают сигнал — обрабатывают — выдают соответствующий результат. Для регулирования уровня сахара в крови при диабете 1 типа синтетические клетки должны точно измерить уровень глюкозы и выбросить нужно количество инсулина (рис. 3). В качестве основы для искусственных клеток международная группа ученых взяла клеточную линию HEK 293, полученную из эмбриональных почек человека [8]. HEK 293 отлично изучены, доступны и используются во многих лабораториях по всему миру.
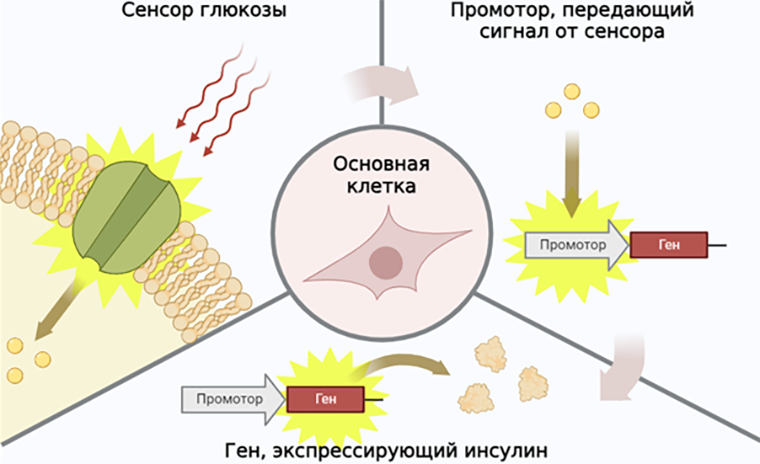
Рисунок 3. Базовые элементы искусственной клетки для борьбы с нехваткой инсулина.
рисунок автора на основе [8]
Выбор сенсора и чувствительного промотора
Важный элемент искусственной клетки — сенсор для определения концентрации глюкозы. Какую молекулярную структуру надо ввести в клетку HEK 293, чтобы она была максимально чувствительна к сахару? В настоящих β-клетках поджелудочной железы есть четыре компонента (рис. 4), ответственных за регуляцию выброса инсулина в ответ на повышение концентрации глюкозы:
- мембранный белок-переносчик глюкозы транспортирует глюкозу внутрь β-клеток, запуская каскад реакций, ведущих к синтезу инсулина;
- глюкокиназа подхватывает закачанную внутрь клеток глюкозу и фосфорилирует ее с образованием глюкозо-6-фосфата, который затем запускает гликолиз. А за ним начинается и цикл Кребса с образованием молекул АТФ;
- АТФ-чувствительный калиевый канал закрывается в ответ на увеличение концентрации АТФ и запускает деполяризацию клеточной мембраны (прямо как при потенциале действия в нейронах);
- потенциал-чувствительный кальциевый канал открывается в ответ на деполяризацию мембраны. Последующий приток кальция является основным спусковым крючком для выброса секреторных гранул инсулина из β-клеток [9].
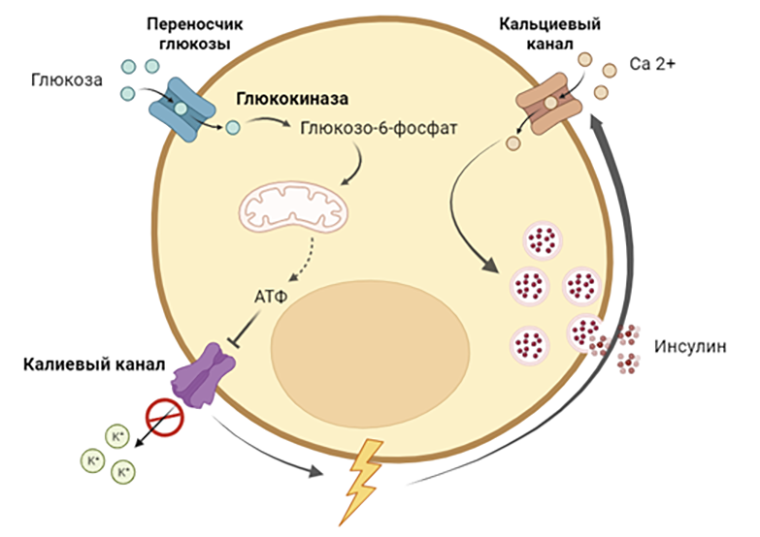
Рисунок 4. Cхема выброса секреторных гранул инсулина в ответ на повышение концентрации внеклеточной глюкозы β-клетками поджелудочной железы.
рисунок автора на основе [8]
Ученые трансфицировали клетки каждым из четырех компонентов, ответственным за регуляцию секреции инсулина, и наблюдали, в каком случае в ответ на повышение концентрации глюкозы клетка активнее всего экспрессировала ген-репортер, стоящий под выбранным кальций-чувствительным промотором (о нем поговорим чуть позже). Эффективнее всего реагировали на деполяризацию мембраны (возникающую после входа глюкозы во внутриклеточное пространство) клетки, трансфицированные потенциал-чувствительным кальциевым каналом Cav1.3.
Линия HEK 293 не имеет никакого отношения к секреции инсулина в ответ на приток кальция, а значит, нужно добавить в нее элемент, который будет реагировать на повышение его концентрации. Этой недостающей деталью пазла может стать кальций-чувствительный промотор. Он должен запускать транскрипцию гена инсулина в ответ на приток кальция. На роль кальций-чувствительного промотора ученые проверили несколько вариантов и остановились на искусственно созданном промоторе P-NFAT-3. Под действием кальция фактор NFAT-P превращается в NFAT и заставляет промотор P-NFAT активировать транскрипцию (рис. 5) [10].
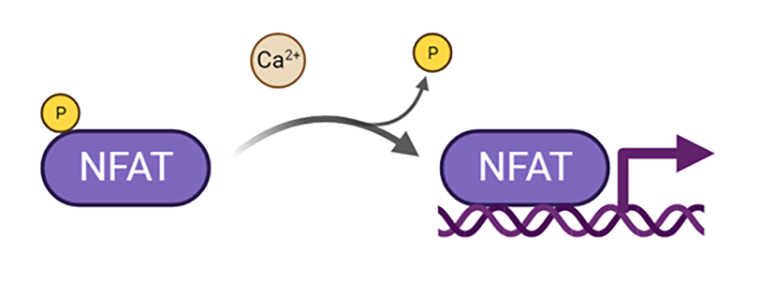
Рисунок 5. Схема активации кальций-чувствительного промотора.
рисунок автора на основе [10]
Как уже упоминалось ранее, диабет 1 типа в основном лечится регулярными инъекциями инсулина, а диабет 2 типа — препаратами, которые усиливают секрецию инсулина или повышают к нему чувствительность. Такими лекарствами от диабета 2 типа являются, например, аналоги GLP-1 . Инсулин может потребоваться и больным 2 типом диабета, когда пероральные препараты не могут должным образом контролировать уровень глюкозы в крови.
GLP-1 — инкретиновый гормон, который вырабатывается клетками тонкого кишечника в ответ на прием пищи и повышает секрецию инсулина β-клетками поджелудочной железы. Популярнейшим лекарством для диабетиков является миметик GLP-1 — семаглутид, о механизме действия которого и о его эффекте на всю фармацевтическую отрасль рассказано в статье «Оземпик: больше, чем средство для похудения» [11].
Последним этапом создания искусственной клетки было введение гена, экспрессирующего терапевтический белок под кальций-чувствительным промотором, — инсулина (рис. 6) или GLP-1.
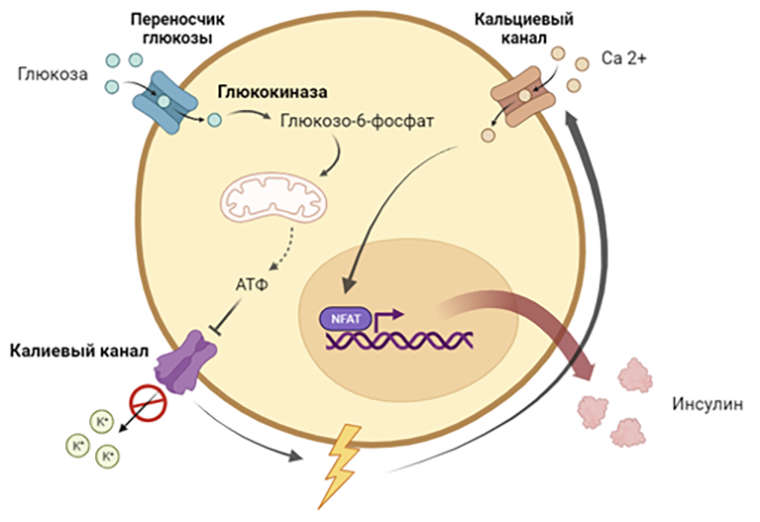
Рисунок 6. Схема синтетической клетки HEK-beta, продуцирующей инсулин. В отличие от настоящей β-клетки, схематично изображенной на рисунке 5, в искусственной клетке в ответ на деполяризацию мембраны сначала активируется транскрипция, а уже затем происходит секреция наработанного инсулина.
рисунок автора на основе [8]
Проверка на мышах-диабетиках
А теперь самое интересное — будут ли работать синтетические клетки в организме мышей и снижать гипергликемию? Для ответа на этот вопрос нужно доставить клетки (назовем их HEK-beta) внутрь животных. HEK-beta сначала поместили (инкапсулировали) в специальные альгинатные шарики диаметром 400 мкм, а затем с помощью шприца имплантировали их во внутрибрюшинное пространство мышам с диабетом. Альгинатные шарики играли роль «барьера» между искусственными клетками и иммунной системой хозяина, снижая вероятность отторжения имплантов [12].
Клетки, котрансфицированные плазмидами с геном кальциевых каналов Cav1.3 и геном GLP-1, существенно улучшили глюкозозависимую секрецию инсулина, а также снизили толерантность к глюкозе у мышей с диабетом 2 типа. А клетки с геном инсулина не только восстановили дефицит инсулина у мышей с диабетом 1 типа, но и скорректировали гипергликемию животных в течение 2–3 дней. В частности, гипогликемические побочные эффекты, возникающие в результате чрезмерной экспрессии инсулина при нормальном уровне сахара в крови, что часто происходит при регулярном введении инсулина пациентами, не были обнаружены.
Конечно, не стоит забывать и о рисках, сопутствующих любому лечению заболеваний с помощью клеток. Во-первых, это иммунная реакция организма на введенные аллогенные (чужеродные) клетки. Ученые стремятся разрабатывать определенные стратегии по снижению иммунного ответа реципиента — например, применение иммуносупрессивных препаратов или помещение клеток внутрь защитных биоматериалов, как было сделано с HEK-beta и альгинатными шариками. Если для терапии использовать β-клетки, полученные из индуцированных плюрипотентных клеток самого пациента с диабетом 1 типа (аутологичные клетки), то они все равно останутся объектом «охоты» его иммунной системы, так как диабет первого типа имеет аутоиммунный механизм развития. Во-вторых, искусственно созданные клетки с трансгеном, введенные в организм, могут вести себя непредсказуемо — например, спровоцировать развитие опухоли [13]. В ходе описанных в этой статье краткосрочных экспериментов на мышах не было обнаружено данных побочных эффектов, однако накопленный опыт в разработке методов клеточной терапии еще раз подчеркивает необходимость тщательного и долгого изучения, прежде чем искусственные клетки можно будет использовать в клинических условиях.
Сравним синтетические клетки с другими методами терапии?
Если мы говорим о применении таких искусственных клеток как о варианте клеточной терапии диабета у реальных людей, то нужно сравнить данный метод с другими возможными способами терапии клетками. Была проверена эффективность секреции инсулина в ответ на повышение концентрации глюкозы у описанных выше синтетических клеток HEK-beta, стабильной линии β-клеток 1.1E7 и островков Лангерганса.
Линия 1.1E7 была получена электрослиянием β-клеток из поджелудочной железы человека и иммортализированной линии эпителиальных клеток человека PANC-1 [14]. Новая линия имеет свойства «родительских» линий — бессмертие (то есть способность к бесконечному делению) от PANC-1 и способность производить инсулин в ответ на повышение концентрации глюкозы от β-клеток донора. Стоит заметить, что такая клеточная линия подходит для изучения работы β-клеток человека в лабораторных экспериментах, однако ее производительность несколько ниже, чем в настоящих клетках из островков Лангерганса [15].
Все три варианта в будущем потенциально могут использоваться для пересадки диабетикам и корректировки уровня сахара в крови. В экспериментах in vitro, то есть на специальной питательной среде, β-клетки и островки показали более низкий уровень секреции инсулина, чем синтетические клетки. А как обстоят дела при введении исследуемых вариантов мышам?
У мышей с диабетом первого типа β-клетки 1.1E7 и синтетические клетки одинакового понижали уровень сахара в крови в течение 1–2 часов после приема пищи. Однако уже на следующий день искусственные HEK-beta продемонстрировали свое преимущество перед линией β-клеток, эффективнее снизив гипергликемию у мышей. А через три недели синтетические клетки полностью восстановили уровень сахара в крови до значений здоровых животных (рис. 7). Инкапсулированные островки Лангерганса нормализовали гликемию только у половины мышей. Но сделали это с той же эффективностью, что и HEK-beta.
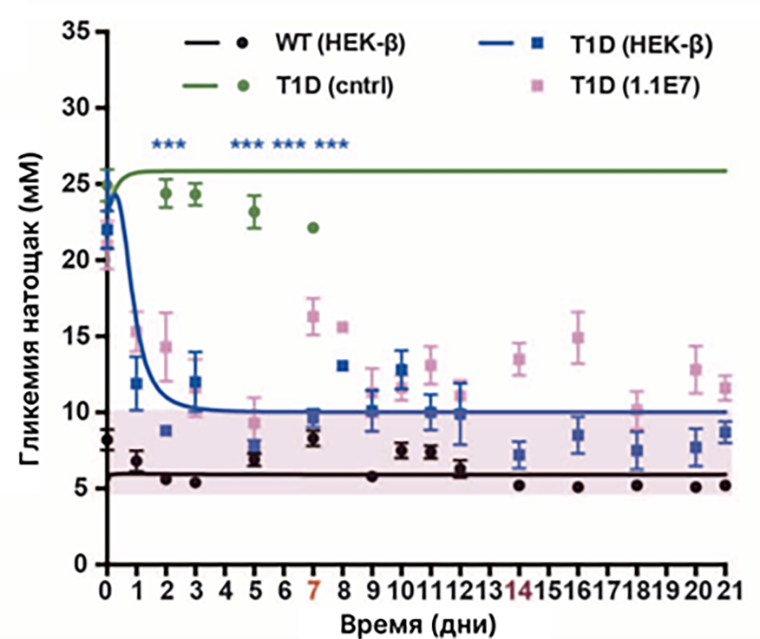
Рисунок 7. Снижение уровня глюкозы в крови у мышей с помощью HEK-beta. Здоровым мышам (WT) и с диабетом 1 типа (T1D) вводили искусственные HEK-beta с инсулином, β-клетки 1.1E7 или HEK-beta с GLP-1 в качестве отрицательного контроля (cntrl ). Через три недели HEK-beta полностью восстановили уровень сахара в крови до нормальных значений гликемии.
В этом случае уровень сахара в крови остается высоким, так как введение GLP-1 при диабете 1 типа неэффективно — он стимулирует выброс инсулина β-клетками, но при этом заболевании они разрушаются, и инсулину выделяться просто неоткуда.
Синтетические клетки — перспективная терапия или игрушка в руках ученых?
За последние десять лет в таких популярных научных журналах, как Science и Nature, вышло множество статей, посвященных созданию искусственных клеток, особенно в качестве возможной терапии диабета. Работающие в сфере синтетической биологии исследователи создают терапевтические клетки, наделяя их совершенно несвойственным им функционалом с помощью введения генетических конструкций. Учитывая все риски такой методики, возникает впечатление, что у подобных разработок не очень много шансов попасть в клиническую практику в ближайшее время. Однако с каждым годом интерес научного сообщества к этой теме продолжает расти. Проверка различных технологий получения искусственных клеток и накопление опыта по их применению на животных всё еще важны, даже если на первый взгляд такие подходы не выглядят практичными. Далее будут приведены несколько примеров создания искусственных клеток. А насколько перспективными могут оказаться такие разработки в будущем — решать читателю.
Если немного пофантазировать и вспомнить пару механизмов из генной инженерии и физиологии клетки, мы поймем, что любой компонент структуры «восприятие — обработка — ответ» в синтетических клетках реально заменить. К примеру, сенсор может реагировать не на концентрацию глюкозы в крови, а на температуру, магнитные поля, свет, иммунодепрессанты или биомаркеры заболеваний [16]. Клетку можно заставить транскрибировать терапевтический белок — тогда «элементом обработки информации» будет определенный промотор; а можно стимулировать секрецию образующихся в клетке гранул, и тогда вообще обойтись без процесса транскрипции.
Стратегия стимулирования выброса инсулина в обход транскрипции представляется довольно перспективной. Процесс синтеза белка с гена занимает довольно много времени и зависит от эффективности промотора, а пациентам нужен инсулин «здесь и сейчас» и в нужном количестве. Так, в 2021 году ученые создали β-клетки, выбрасывающие инсулин in vitro через 15 минут в ответ на освещение места подкожного введения клеток светом фонарика смартфона [17]. Это возможно благодаря оптогенетике [18] — области исследования клеток (в основном, нейронов), основанной на внедрении в них светочувствительных каналов, вызывающих изменение мембранного потенциала. За основу были взяты клетки уже знакомой нам линии β-клеток поджелудочной железы 1.1E7. Эти клетки были модифицированы таким образом, чтобы они накапливали в себе гранулы с инсулином, как и обычные β-клетки, однако не были чувствительны к глюкозе. Сенсором в данном случае являлся меланопсин — фоточувствительный пигмент сетчатки глаза. Помимо всего, он еще запускает каскад реакций, приводящий к повышению внутриклеточной концентрации кальция. В состоянии покоя такие клетки накапливают гранулы с инсулином. Если светить на клетки с оптогенетической конструкцией, то фотопигмент вызывает повышение концентрации кальция в клетке, деполяризацию мембраны и высвобождение гранул инсулина. У мышей с диабетом 1 типа после подкожного введения инкапсулированных клеток удалось значительно снизить гипергликемию в течение 30–60 минут (рис. 8).
Предполагаемыми преимуществами такого подхода являются:
- стимуляция секреции гранул инсулина в обход транскрипции, что позволяет быстрее снижать уровень сахара в крови;
- более высокая точность благодаря регистрации концентрации глюкозы с помощью электронного девайса (например, глюкометра), а не искусственных клеток, чья чувствительность и надежность пока еще не до конца изучены.
Но существует и ряд неудобств. Область введения искусственных клеток не должна находиться на свету, иначе может происходить ненужный выброс инсулина. Данные клетки не осуществляют самостоятельный контроль уровня глюкозы, они лишь реагируют на внешний стимул. А что будет, если у пациента нет под рукой источника света, а уровень инсулина нужно поднять? Возможность применения данного метода лечения в будущем остается вопросом.

Рисунок 8. Светочувствительные клетки выбрасывают инсулин. Слева: культивация клеток под действием света телефона. Справа: мыши с введенными подкожно капсулами с синтетическими клетками принимают «световые ванны».
Добавим в клетки немного электричества
Другая группа ученых использовала так называемый электрогенетический подход — они воздействовали на выброс инсулина стимуляцией током. Этот метод имеет некоторые преимущества перед оптогенетикой, так как является более энергоэффективным и менее токсичным (вспомним те же кардиостимуляторы, которые работают от батареи в течение минимум 15 лет) [19]. Клетку можно сделать чувствительной к электрическим импульсам, введя в ее мембрану потенциал-чувствительные ионные каналы, которые регулируют мембранный потенциал клетки. Под действием электричества такие каналы закрываются или открываются, регулируя прохождение определенных ионов через мембрану [16].
В начале статьи мы разобрались, что деполяризация мембраны β-клеток является важным фактором для запуска секреции гранул с инсулином. В HEK-beta деполяризация мембраны запускалась притоком глюкозы. В β-клетках с оптогенетической конструкцией — активацией меланопсина. В этом же эксперименте ученые создали электро-β-клетки, секретирующие инсулин при деполяризации мембраны в ответ на электростимуляцию. Клетки выращивали в специальных лунках, к краям которых были присоединены электроды. Максимальная активация системы достигалась при напряжении 50 В и длине импульса 2 мс. За основу взяли уже упомянутые выше нечувствительные к глюкозе β-клетки из линии 1.1E7 и ввели в них векторы с потенциал-чувствительными кальциевыми и калиевыми каналами, а также вектор с генами предшественника инсулина (проинсулин) и люциферазы (светящееся вещество-репортер для отслеживания успешности экспрессии проинсулина). В нестимулированном состоянии электро-β-клетки самостоятельно накапливают гранулы с инсулином и люциферазой. При воздействии тока открываются потенциал-чувствительные кальциевые каналы, повышается внутриклеточная концентрация кальция, происходит деполяризация мембраны и выброс содержимого секреторных гранул наружу (рис. 9). In vitro пиковое значение выхода инсулина в таких клетках достигалось уже через 10 минут!
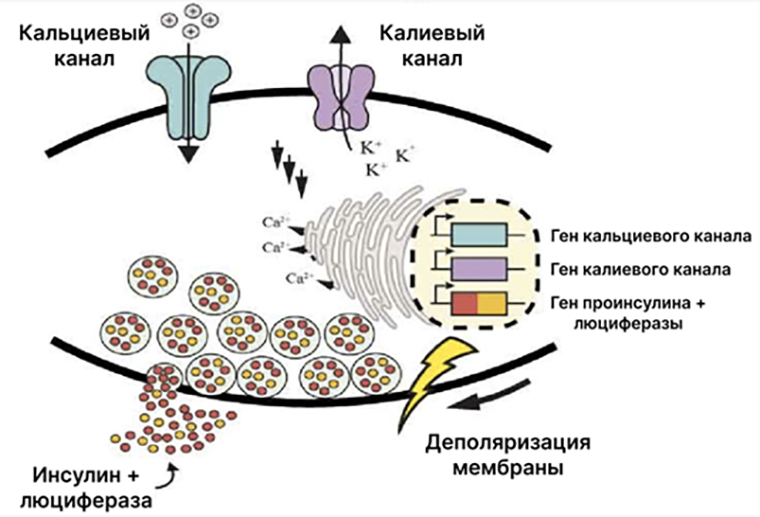
Рисунок 9. Схема секреции гранул с инсулином и люциферазой электро-β-клетками в ответ на стимуляцию током. Основными преимуществом такого подхода является высокая скорость секреции инсулина благодаря прямому воздействию на выброс везикул с инсулином, а не на транскрипцию.
Для проверки электро-β-клеток на мышах ученые разработали оснащенный электродами имплант с отсеком для синтетических клеток (рис. 10). Устройство работало без батареек, получая питание от генератора электромагнитного поля, связь с которым осуществлялась на клинически безопасной частоте 13,56 МГц. Искусственные клетки, растущие в виде монослоя в отсеке импланта, не могут поддерживать свою жизнедеятельность бесконечно, поэтому их заменяли раз в неделю с помощью шприца, без хирургического удаления импланта. Такие устройства, введенные мышам подкожно, не вызывали иммунной реакции или других побочных эффектов в течение трех недель эксперимента. А результаты тестов на толерантность к глюкозе у мышей с имплантами показали сопоставимую эффективность электро-β-клеток и трансплантируемых островков Лангерганса.
Аналогично предыдущему подходу, где секреция инсулина запускалась светом, электро-β-клетки не могут самостоятельно детектировать уровень глюкозы. Эту проблему можно решить, дополнив девайс микроглюкометром. Такой подход мог бы сочетать в себе точность определения концентрации сахара в крови как у электронных устройств, и эффективность секреции инсулина как у настоящих β-клеток.

Рисунок 10. Размер беспроводного биоэлектронного импланта по сравнению с монетой диаметром 27,4 мм.
Заглянем в будущее?
И это далеко не единственные примеры применения синтетических клеток для потенциального лечения диабета. Кто знает, может быть, в будущем такая технология подтвердит свою клиническую безопасность и эффективность и будет доступна каждому пациенту? Такие миниатюрные «клетки-компьютеры» внутри нас, реагирующие на внутренние или внешние сигналы и выбрасывающие в ответ терапевтический белок, могут пригодиться для лечения не только сахарного диабета, но и множества других тяжелых заболеваний. Одно понятно уже сейчас: синтетическая биология открывает простор для воображения и новых научных разработок в сфере создания искусственных клеток для решения проблем человечества.
Литература
- Wakana Sato, Tomasz Zajkowski, Felix Moser, Katarzyna P. Adamala. (2022). Synthetic cells in biomedical applications. WIREs Nanomed Nanobiotechnol. 14;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Santwana Padhi, Amit Kumar Nayak, Anindita Behera. (2020). Type II diabetes mellitus: a review on recent drug based therapeutics. Biomedicine & Pharmacotherapy. 131, 110708;
- Shuai Chen, Kechen Du, Chunlin Zou. (2020). Current progress in stem cell therapy for type 1 diabetes mellitus. Stem Cell Res Ther. 11;
- Dinesh Kumar Chellappan, Nandhini S. Sivam, Kai Xiang Teoh, Wai Pan Leong, Tai Zhen Fui, et. al.. (2018). Gene therapy and type 1 diabetes mellitus. Biomedicine & Pharmacotherapy. 108, 1188-1200;
- Такие разные стволовые клетки;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Mingqi Xie, Haifeng Ye, Hui Wang, Ghislaine Charpin-El Hamri, Claude Lormeau, et. al.. (2016). β-cell–mimetic designer cells provide closed-loop glycemic control. Science. 354, 1296-1301;
- Brandon B. Boland, Christopher J. Rhodes, Joseph S. Grimsby. (2017). The dynamic plasticity of insulin production in β-cells. Molecular Metabolism. 6, 958-973;
- J.W. Rooney, M.R. Hodge, P.G. McCaffrey, A. Rao, L.H. Glimcher. (1994). A common factor regulates both Th1- and Th2-specific cytokine gene expression.. The EMBO Journal. 13, 625-633;
- Оземпик: больше, чем средство для похудения;
- Arturo J Vegas, Omid Veiseh, Mads Gürtler, Jeffrey R Millman, Felicia W Pagliuca, et. al.. (2016). Long-term glycemic control using polymer-encapsulated human stem cell–derived beta cells in immune-competent mice. Nat Med. 22, 306-311;
- Cristina Aguayo-Mazzucato, Susan Bonner-Weir. (2010). Stem cell therapy for type 1 diabetes mellitus. Nat Rev Endocrinol. 6, 139-148;
- Katja Trontelj, Marko Ušaj, Damijan Miklavčič. (2010). Cell Electrofusion Visualized with Fluorescence Microscopy. JoVE;
- Jane T. McCluskey, Muhajir Hamid, Hong Guo-Parke, Neville H. McClenaghan, Ramon Gomis, Peter R. Flatt. (2011). Development and Functional Characterization of Insulin-releasing Human Pancreatic Beta Cell Lines Produced by Electrofusion. Journal of Biological Chemistry. 286, 21982-21992;
- Maysam Mansouri, Martin Fussenegger. (2022). Electrogenetics: Bridging synthetic biology and electronics to remotely control the behavior of mammalian designer cells. Current Opinion in Chemical Biology. 68, 102151;
- Maysam Mansouri, Shuai Xue, Marie‐Didiée Hussherr, Tobias Strittmatter, Gieri Camenisch, Martin Fussenegger. (2021). Smartphone‐Flashlight‐Mediated Remote Control of Rapid Insulin Secretion Restores Glucose Homeostasis in Experimental Type‐1 Diabetes. Small. 17;
- Светлая голова;
- Krzysztof Krawczyk, Shuai Xue, Peter Buchmann, Ghislaine Charpin-El-Hamri, Pratik Saxena, et. al.. (2020). Electrogenetic cellular insulin release for real-time glycemic control in type 1 diabetic mice. Science. 368, 993-1001.






