Искусство имитации: Как химики создают молекулы, вдохновленные природой
03 марта 2025
Искусство имитации: Как химики создают молекулы, вдохновленные природой
- 212
- 2
- 4
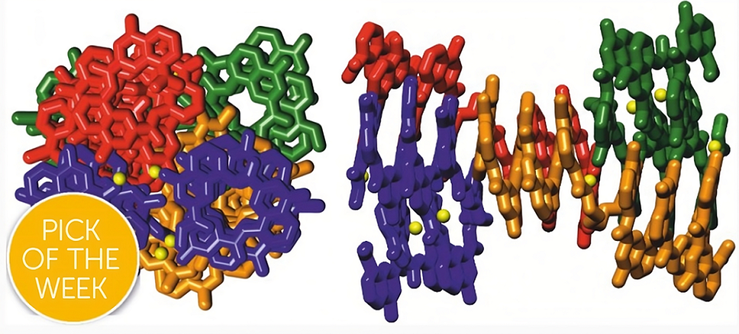
Четыре ароматических олигоамидных блока типа «спираль—поворот—спираль» собираются в органическом растворителе в абиотическую архитектуру с подобием четвертичной структуры.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Белки — это удивительные молекулы, чья структура определяет функцию, позволяя выполнять сложнейшие задачи, такие как транспорт кислорода, иммунная защита, реакции на многочисленные стимулы и катализ химических реакций. На протяжении десятилетий ученые стремились не только понять механизмы их работы, но и воссоздать эти свойства в искусственных системах. Однако воспроизвести сложный функционал белков на других субстратах требует невероятной изобретательности и очень тонкого подхода. Современные достижения в органической химии, молекулярном дизайне и методах синтеза открывают путь к созданию искусственных аналогов природных белков. И хотя эти аналоги еще далеки от полного воспроизведения их природных функций, они уже демонстрируют любопытные результаты. Эта статья расскажет историю одного из таких аналогов.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Мастерство природы
Белки — это удивительные молекулы, без которых жизнь в известной нам форме просто немыслима. Их уникальность заключается в тесной взаимосвязи между последовательностью аминокислот, из которых состоит белок; уникальной пространственной структурой молекулы; и незаменимой ролью, которую белок играет в живом организме. Точная организация аминокислотных остатков в процессе фолдинга [1], управляемая сетью слабых взаимодействий [2], придает белкам суперспособность участвовать во множестве химических реакций и молекулярных взаимодействий, образующих фундамент жизни. Например, гемоглобин принимает форму, позволяющую связывать молекулы кислорода в легких и высвобождать их в тканях. Антитела обладают специализированными участками, точно распознающими и связывающими чужеродные антигены, обеспечивая иммунную защиту. Нитрогеназа — мультифермент, играющий ключевую роль в азотном цикле, — имеет уникальную структуру, которая позволяет ей преобразовывать атмосферный азот в соединения, доступные для биологического использования [3].
Поразительно, что столь огромное разнообразие функций обеспечивается всего лишь 20 стандартными L-аминокислотами! Эта экономичность в сочетании с уникальными свойствами давно привлекали внимание ученых. Однако, чтобы по-настоящему понять, как эти молекулы функционируют и как можно воспроизвести их поведение, требовалось развитие методов и инструментов.
Скорая химическая помощь
Достижения в изучении белков были тесно связаны с прогрессом в органической химии. Прежде всего потому, что методы, позволяющие изучать структуру синтезированных молекул, можно было применить для изучения и природных.
Рентгеноструктурная кристаллография позволила увидеть, как расположены атомы в кристаллах, в том числе состоящих из биомолекул, с поразительной точностью. Ядерный магнитный резонанс (ЯМР) открыл возможность изучения молекул в растворах, предоставляя данные о том, как атомы и их окружение взаимодействуют друг с другом. Подробнее об этом рассказывается (и показывается) в статье «12 методов в картинках: структурная биология» [4]. Позволяя установить структуру молекул, они позволяли совершенствоваться самому процессу синтеза.
Менялся и сам процесс органического синтеза. В то время как появлялись аналитические методики, химики разрабатывали эмпирические правила, объясняющие, как взаимодействуют молекулы; формулировали основные механизмы органических реакций: SN1 и SN2, E1 и E2; описывали механизмы реакций присоединения, элиминирования перегруппировки и т.п. В совокупности с накопленным опытом и тысячами известных реакций, эти механизмы позволили предсказывать поведение молекул в различных условиях и стали мощным инструментом для планирования синтеза.
Важной вехой в истории синтеза стало создание методов синтеза аминокислотных цепей, таких как твердофазный синтез (рис. 1). Этот процесс можно сравнить с молекулярным конструктором: аминокислоты, одна за другой, присоединяются к цепи в определенной последовательности. Для этого каждая аминокислота защищается специальными химическими группами, предотвращающими нежелательные реакции, и прикрепляется к твердой опоре. После добавления каждого нового звена защитные группы удаляются, и цепь продолжает удлиняться. Это позволяет создавать пептиды с заранее заданной последовательностью.
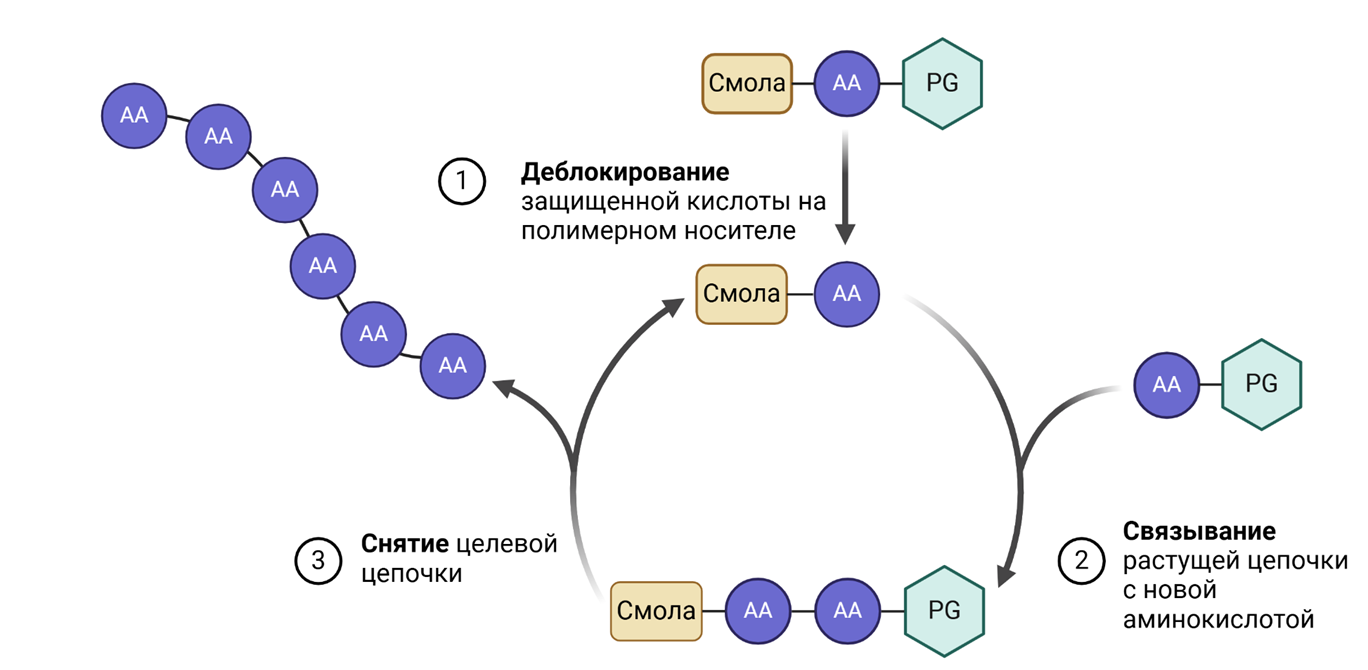
Рисунок 1. Упрощенная схема твердофазного синтеза пептидов. АА (amino acid) — аминокислоты; PG (protection group) — защитная группа; смола — полимерная опора, к которой и прикрепляется изначальный субстрат и на котором держится целевой полимер.
Эти достижения не только позволили воспроизводить природные молекулы, но и открыли новые горизонты. Включение нестандартных аминокислот, добавление функциональных групп или создание молекул, устойчивых к ферментативному разрушению, стали ключевыми преимуществами. Правда, приходится соблюдать несколько ограничений:
Ограничение по размеру и разнообразию мономеров. Синтезированные молекулы не могут быть слишком большими, да и использование слишком разных мономеров в одной полимерной цепи нежелательно, поскольку в случае многостадийного синтеза синтетических полимеров (а это почти все методы получения синтетических пептидов и нуклеиновых кислот) каждая стадия имеет ограниченную эффективность, и при увеличении длины полимерной молекулы кумулятивные потери становятся значительными. Ведь если эффективность каждой стадии составляет 95%, то для пептида из 10 аминокислот общий выход составит около 60%, а для 50-членника — всего только 8%.
Кроме того, с увеличением длины цепи возрастает вероятность образования побочных продуктов. Это может происходить из-за неполной защиты функциональных групп, рацемизации мономеров, побочных реакций и ряда других факторов. Образовавшиеся побочные продукты могут быть похожи на целевое соединение, что усложняет их очистку.
Ограничение по возможностям прогнозирования конформации. Разработка любого сложного полимера, особенно синтетического рецептора или катализатора, требует предсказания, как ее структурные элементы будут располагаться в пространстве относительно друг друга. А из-за вращения вокруг одинарных связей молекулы могут принимать различные пространственные конформации, которые в теории могут иметь разные физико-химические свойства. И чем длиннее полимер, тем больше таких конформаций он может принять. Из-за этого молекулы приходится делать более «жесткими», то есть включать элементы, которые фиксируют молекулу в определенном положении.
В связи с этими ограничениями выбор строительных блоков — мономеров — играет ключевую роль в создании искусственных полимерных молекул.
Фолдинг — молекулярное оригами
И всё же, законы природы универсальны. Любые полимерные молекулы стремятся к состоянию с минимальной свободной энергией — такому, где взаимодействия, такие как водородные связи, гидрофобные эффекты и электростатические силы, приводят к образованию устойчивых трехмерных структур. «Биомолекула» уже много писала об этом — читайте, например, фундаментальные труды «Проблема фолдинга белка» [1] и «Роль слабых взаимодействий в биополимерах» [2].
Однако процесс сворачивания, или фолдинга, значительно сложнее, чем может показаться. Не все взаимодействия внутри молекулярной цепи оказываются энергетически выгодными. Например, ближайшие контакты между соседними остатками цепи могут вызывать «напряжение» — ситуация, когда атомы оказываются слишком близко друг к другу, и их отталкивающие силы или неблагоприятные углы приводят к нестабильности структуры. Такие конфигурации лишь увеличивают общую энергию системы.
Напротив, более удаленные взаимодействия внутри цепи, такие как водородные связи между участками, находящимися на некотором расстоянии, или гидрофобные эффекты [5], когда неполярные участки цепи стремятся избегать контакта с водой, способствуют образованию стабильных структур. Примером является ɑ-спираль, в которой карбонильный кислород (C=O) одной аминокислоты (i) взаимодействует с амидным водородом (N—H) аминокислоты, находящейся на четыре остатка дальше по цепи (i+4). Это создает регулярную спиральную форму, стабилизированную множеством повторяющихся водородных связей (рис. 2) [6]. Замечательную историю о том, как Лайнус Полинг — один из величайших химиков 20 века — открыл ɑ-спираль буквально на кончике пера, «Биомолекула» рассказывала в материале «На заре молекулярной графики» [7].
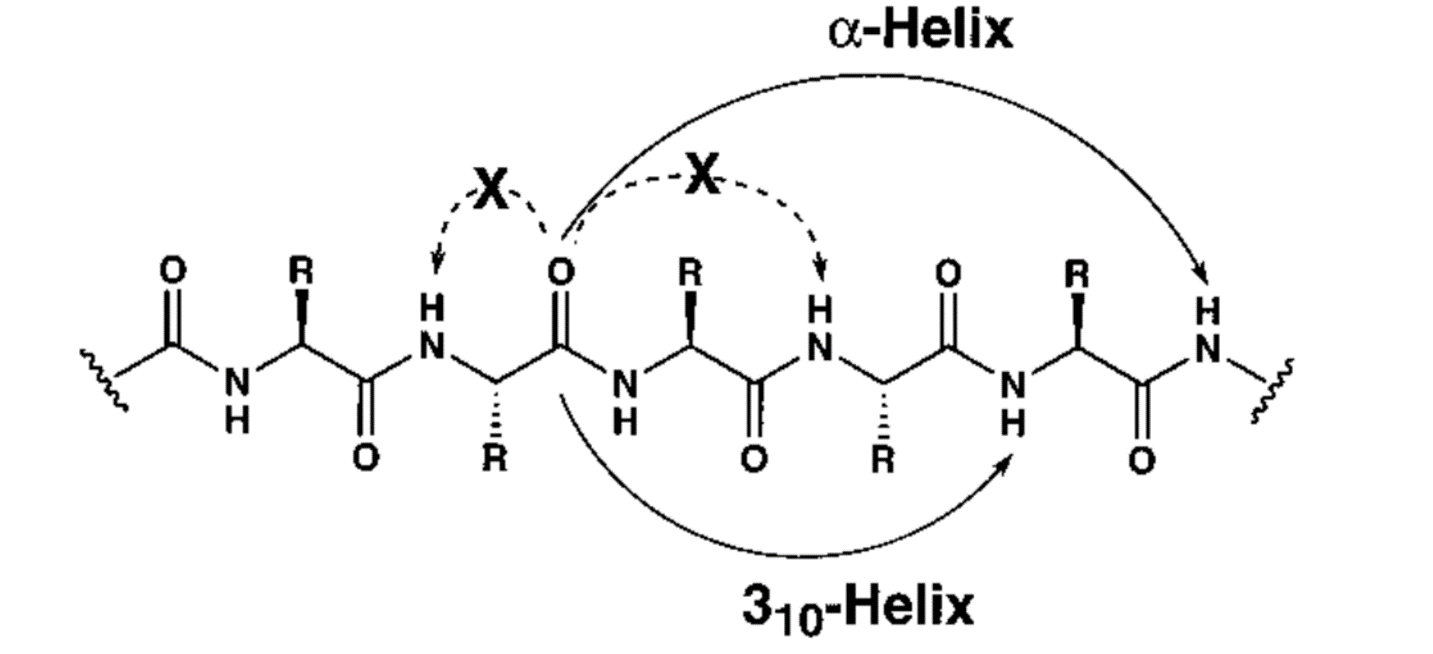
Рисунок 2. Схема полипептида, состоящего из α-аминокислот с боковыми группами R. Сплошные изогнутые стрелки показывают места, где формируются водородные связи, необходимые для образования спирали. В зависимости от боковой группы R и типа структуры могут возникать разные виды спиралей. На рисунке представлены два варианта: ɑ-спираль (водородные связи между карбонильным кислородом остатка i и амидным водородом остатка i+4) и 3₁₀-спираль (связи между карбонильным кислородом остатка i и амидным водородом остатка i+3). Пунктирные изогнутые стрелки обозначают невыгодные водородные связи между соседними группами. Такие связи вызывают напряжение и мешают формированию стабильной структуры.
Принцип, по которому формируются спирали в белках, можно обобщить на любые полимеры, обладающие взаимодополняющими «липкими участками». Помимо водородных связей, в их качестве могут выступать гидрофобные взаимодействия между неполярными участками, ионные связи между заряженными группами, а также π—π-стэкинг между ароматическими системами. Если такие участки расположены в правильной последовательности и занимают определенные позиции, их взаимодействие будет способствовать формированию устойчивых трехмерных структур [6].
Первые попытки
Простота паттерна, необходимого для формирования структуры спирали, и ее стабильность сделали ее удобным объектом для математических моделей, а также удобным шаблоном для химиков. Один из пионеров такого моделирования — Самуэль Геллман: профессор кафедры химии Университета Висконсин-Мэдисон и, наверное, один из главных энтузиастов имитации биомолекул на альтернативных субстратах. По крайней мере, он крайне ясно описал в своем «манифесте» основную идею такого подхода к дизайну: если в природе фолдинг полимерных цепей приводит к структурам, способным выполнять сложные химические операции (такие как катализ, специфическое связывание, перенос электронов), то те же свойства можно придать и искусственным полимерам. Важно лишь научиться контролировать процесс их сворачивания и обеспечивать стабильность. А поскольку химики не ограничены в выборе «строительных блоков» для создания полимеров, это открывает путь не только к имитации природных процессов, но и к созданию молекул, не существовавших до этого в природе [6].
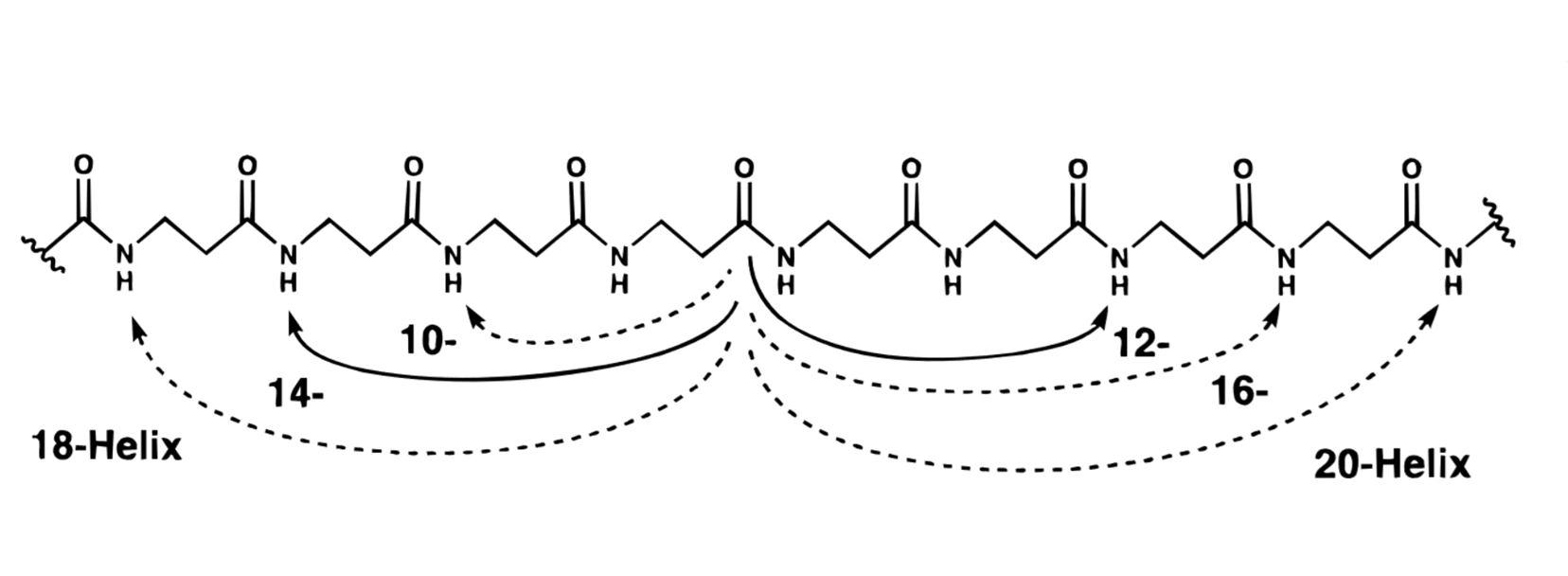
И всё же на ранних этапах исследований полученные молекулы довольно мало отличались от своих природных прототипов: Геллман с коллегами использовали простые β-аминокислоты, такие как β-аланин. Эта молекула способна формировать различные типы спиралей в зависимости от положения взаимодействующих амидных (—NH—) и карбонильных групп (C=O). Тип спиралей зависел от количества от атомов, участвующих в формировании витка, которое могло варьироваться от 10 до 20 с шагом в два атома (рис. 3А) [8], [9].
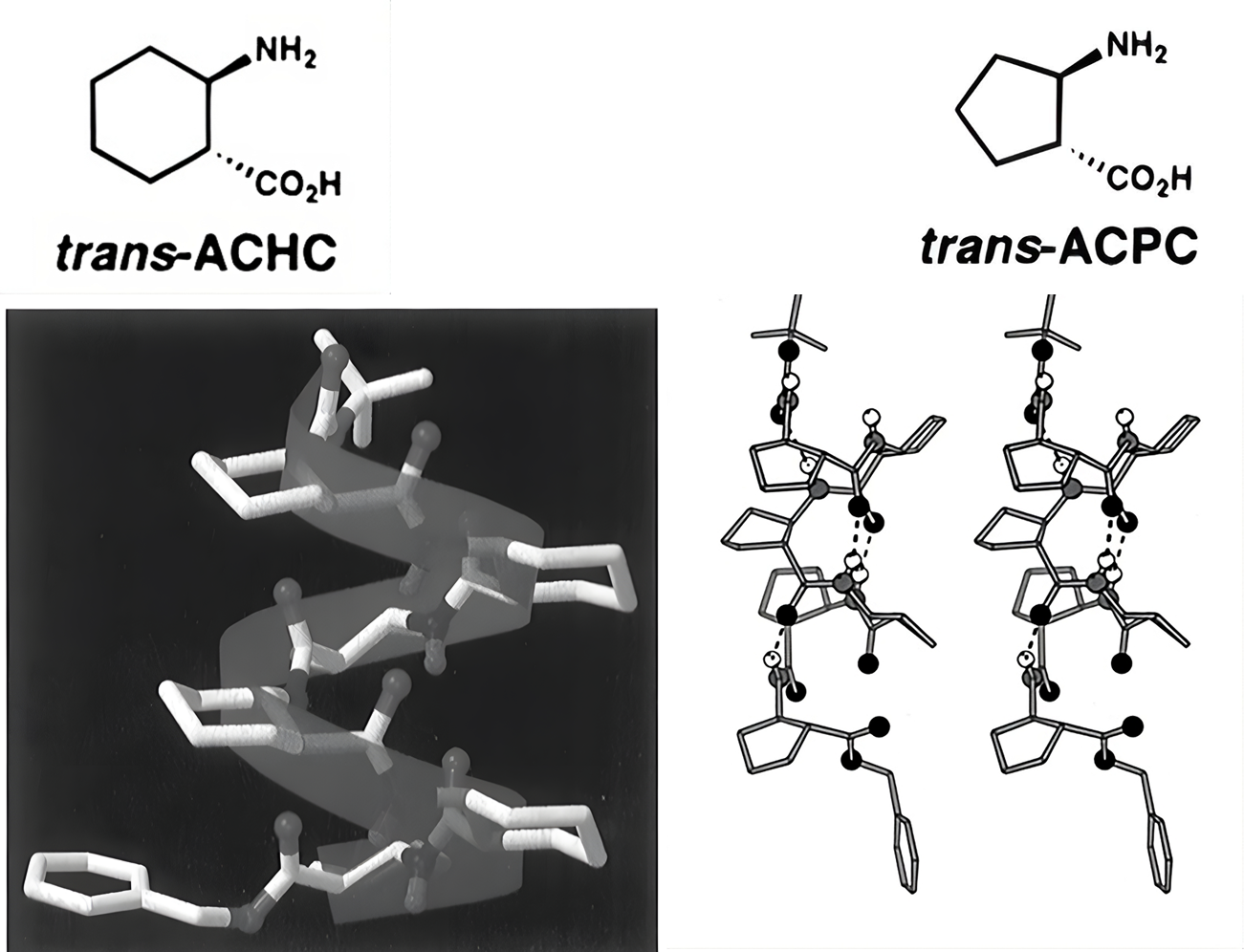
Однако такие спирали были недостаточно стабильными, особенно в растворе, и чтобы решить эту проблему, исследователи добавили жесткость в молекулу, включив в ее структуру небольшие кольца из атомов углерода. Используя компьютерное моделирование, ученые протестировали 72 возможных варианта спиралей, изменяя размер углеродных колец и их положение. В результате самыми устойчивыми структурами оказались 14-спираль, построенная на основе транс-2-аминоциклогексанкарбоновой кислоты (транс-ACHC), и 12-спираль на основе транс-2-аминциклопентанкарбоновой кислотой(транс-ACPC). Циклическая структура ограничивала свободу вращения и создавала стерические препятствия, стабилизируя спирали в определенной конформации (рис. 3Б в крутилке).
Впоследствии множество групп адаптировали и развили подход Геллмана. Природные пептиды стали аналогами для разработки огромного количество полимеров на основе самых разнообразных β-, γ- и δ-гомологов аминокислот, собранных с использованием различных типов связей, таких как амидные, сульфонамидные, сульфоксиминовые, N-оксоамидные, мочевинные, гидразидные [10]. Каждый из этих подходов обладает своими преимуществами, и без десятка лет экспертизы сложно судить об их полном потенциале.
Мечтают ли химики о фолдамерах?
Деятельность химика в некоторых аспектах напоминает исследование загадочного архива, оставленного природой, предшествующими поколениями ученых и коллегами из смежных областей. Этот архив наполнен множеством потенциально ценных артефактов — инструментов, чья полезность может быть раскрыта — если не в этом десятилетии (или столетии), то в следующем. Однако большинство этих находок сопровождаются нечеткими схемами и фрагментарными заметками. Детально описаны их строение и материал, но как именно использовать их для создания чего-то нового и значимого, остается загадкой, требующей долгих лет — а порой и десятилетий — кропотливого исследования и экспериментов. Например, реакция Штаудингера была описана в 1919 году, но только через 80 лет ее потенциал был раскрыт и положен в основу целого направления в исследованиях биоортогональных реакций. (Больше можно узнать из материала «Наука, описывающая жизнь — лауреаты Нобелевской премии по химии (2022)» [11].) Трудность в том, что проводить исследования с прицелом на признание спустя десятилетия довольно сложно. По итогу, почти как в искусстве, направление исследований становится во многом отражением его автора, его опыта в конкретном разделе химии, знаний и интересов.
Существует множество подходов к созданию синтетических аналогов биомолекул, но один из них особенно близок мне благодаря профессору Ивану Хуку. Так сложилось, что я оказался именно в его группе. В рамках магистерского курса по органической химии предстояло пройти практику в одной из университетских лабораторий. После некоторых раздумий я выбрал лабораторию профессора Хука, поскольку она была одной из немногих, где изучали вопросы на стыке химии и биохимии. Эта междисциплинарность показалась мне по-своему притягательной.
Опуская детали, его группу можно условно разделить на две части: «хардкорные» химики-синтетики, которые сосредоточены на поиске и оптимизации методов синтеза молекул и исследовании их свойств и геометрии; и «междисциплинарники», работающие с готовыми молекулами. Последние тестируют, как они взаимодействуют с потенциально интересными вещами, например, с важными функциональными белками, а также ищут и стараются реализовать способы применения. Но основной класс молекул, который при этом используется — продукт видения конкретного человека.
Иван Хук на данный момент занимает кафедру химической биологии для исследования лекарств на фармацевтическом факультете Мюнхенского университета (LMU), а химию изучал в Высшей нормальной школе в Париже. Eго внимание химика сконцентрировано главным образом на вопросах синтеза и наиболее подходящих для этого инструментах. Но желание синтезировать синтетические аналоги биомолекул преследует его на протяжении всей жизни. Свою аспирантуру он посвятил синтезу синтетического рецептора аденина (с использованием ароматических гетероциклов как основы), а после года докторантуры в конце концов он оказался в лаборатории Жан-Мари Лена, оказавшего на его работу весьма существенное влияние, — об этом знаменитом нобелиате «Биомолекула» рассказывала в статье «Раздвинувший границы химии» [12].
Собственный подход
Эта работа, в свою очередь, стала основой для разработки молекул, для которых образование спиралей больше не зависело от металлических центров. Для этого команда исследователей сосредоточилась на структурах, форма которых определялась бы исключительно внутримолекулярными водородными связями и ароматическими стекинг-взаимодействиями. Результатом стали молекулы с изгибами в цепи, обусловленными водородными связями внутри 2′-пиридил-2-пиридинкарбоксамидных блоков (рис. 5Б). Эти взаимодействия задавали форму молекулы, приводя к ее закручиванию в спираль [18].
Будучи схожими с β-пептидами на основе неприродных аминокислот, достаточно длинные цепи из ароматических амидов обладают устойчивостью к гидролизу и куда большей предсказуемостью в сворачивании, в сравнении с теми же β-аминокислотами. Поскольку их молекулярный каркас крайне «жесткий» из-за перекрывающихся ароматических электронных облаков, основные взаимодействующие элементы лежат в одной плоскости. В то же время каждая последующая связь располагается немного под углом относительно предыдущей, что придает молекуле по мере роста форму серпа или арки. Это можно сравнить с соединением палочек под постоянным углом менее 180° друг с другом — даже если они прямые сами по себе, вся структура постепенно начнет изгибаться и закручиваться, приобретая форму арки. По мере удлинения цепи, концы арки в конечном итоге встречаются и отталкиваются, скручивая всю двумерную структуру в спираль. Дополнительная стабилизация происходит за счет стэкинга [20].
Помимо того, что благодаря такой предсказуемости параметры конечной структуры можно рассчитать буквально с помощью карандаша и бумаги, такой подход стал замечательной отправной точкой для исследований еще и потому, что процесс приготовления мономеров был сравнительно простым, а синтез самих полимеров базировался на хорошо изученных методах и легко подвергался автоматизации. Более того, простота синтеза в дальнейшем облегчала внедрение модификаций. А сами модификации позволяли исследовать их влияние на параметры конечной полимерной спирали [20].
По результатам многолетний исследований, синтезированные спирали стало можно буквально настраивать, получив нечто наподобие библиотеки в программировании — набор готовых подходов и инструментов, которые можно использовать для создании более сложных структур (рис. 6) [20].
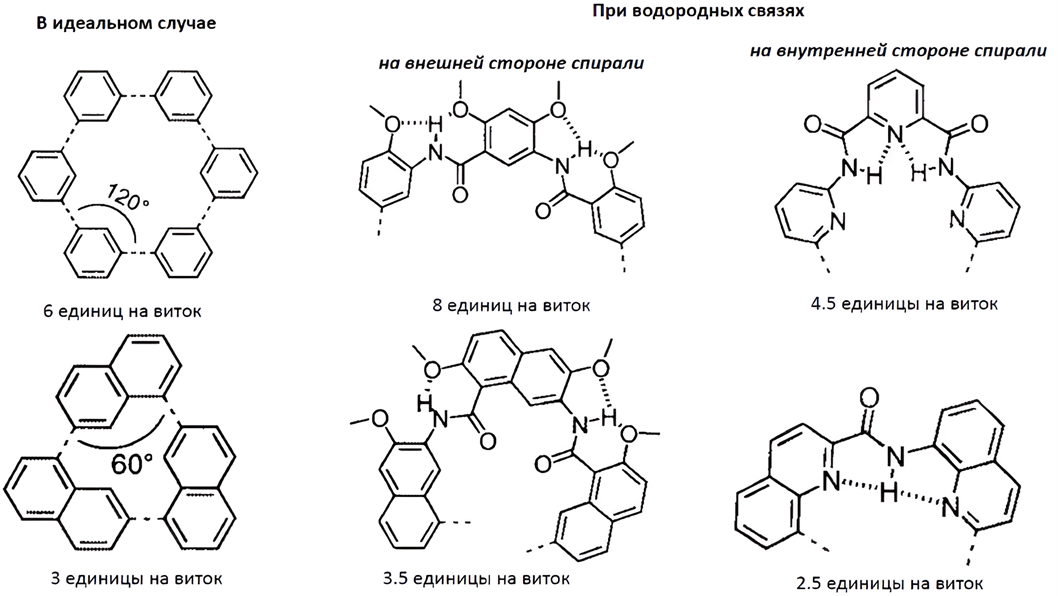
Рисунок 6. На параметры спирали можно воздействовать, изменяя размер мономеров, положение функциональных групп и, как следствие, характер и расположение водородных связей. При идеальном использовании шестичленных ароматических колец формируется структура с 6 единицами на виток, тогда как для десятичленных колец характерна структура с 3 единицами на виток. Кроме того, расположение водородных связей на внешней стороне спирали приводит к ее растяжению, а на внутренней — к сжатию, что позволяет дополнительно регулировать форму и диаметр спирали.
Творчество в лаборатории
Даже концентрируясь главным образом на спиралях, в группе Хука создали несколько довольно впечатляющих конструкций. Благодаря точной регуляции параметров синтетических спиралей — шаг, диаметр, угол наклона, количество оборотов, конформация и стабильность, а также модификации мономеров — были созданы структурные аналоги ДНК (рис. 7). Например, в одной из работ 2018 года была показана спираль с добавлением фосфонатной группы в нужное место, что сделало ее способной взаимодействовать с белками, такими как гистоноподобные белки бактерий. Также аналоги оказались достаточно эффективными для ингибирования ферментов, таких как Top1 и HIV-IN, которые играют ключевую роль в жизненных циклах клеток и вирусов: Top1 участвует в регуляции топологии ДНК, облегчая ее репликацию и транскрипцию, а HIV-IN (интеграза ВИЧ) отвечает за интеграцию вирусной ДНК в геном клетки-хозяина [21].
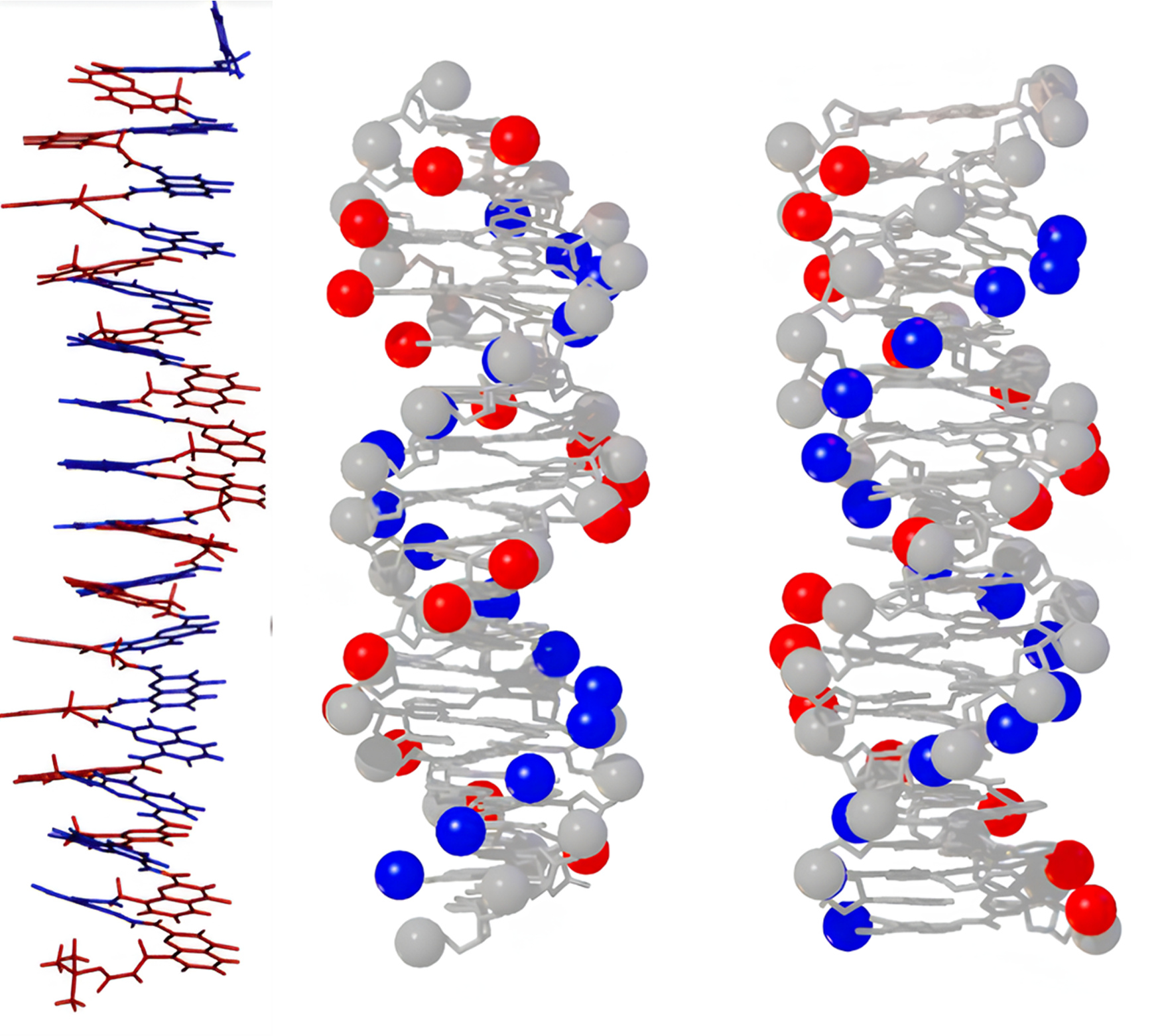
Рисунок 7. Ароматический олигоамид, имитирующий ДНК. Мономерами являются два производных 8-амино-2-хинолинкарбоновой кислоты. Диаметр внутреннего ароматического ядра этой спирали составляет около 9,4 Å, что близко к размеру пары оснований В-ДНК (~9,0 Å между атомами азота пурина и пиримидина). Кроме того, шаг спирали олигоамида (~3,5 Å) соответствует расстоянию между парами оснований в ДНК. Слева: кристаллическая структура. Cправа: наложения кристаллической структуры спирали из ароматических олигоамидов с 16 парами оснований В-ДНК. Шариками обозначены фосфатные группы: синие — принадлежащие 8-амино-2-хинолинкарбоновой кислоте, красные — 8-метиламино-2-хинолинкарбоновой кислоте. Фосфатная группа самой ДНК обозначена серыми шариками.

Рисунок 8. Правильный подбор и модификация мономеров позволяют синтезировать спиральные цепи, которые, объединяясь в двойную спираль, образуют полость, способную избирательно связывать определенные молекулы благодаря точному расположению функциональных групп. Структура на рисунке селективно формирует комплекс с определенными формами арабинозы и ксилулозы. Тонкие серые и черные трубки показывают кристаллическую структуру молекулы-хозяина, а толстые — молекул-гостей.
Интересным направлением стало использование искусственно синтезированных спиралей как основы для создания селективных фильтров. В 2020 году группа показала, что сочетание двух олигоамидных спиралей формирует полость, идеально подходящую для взаимодействия с определенными молекулами. Одна из таких капсул продемонстрировала высокую селективность к сочетанию арабинозы и ксилулозы, значительно превосходя по аффинности взаимодействие с любыми другими молекулами (рис. 8) [22].
Всё это может показаться своего рода игрой с конструктором, и в некотором смысле так оно и есть. Ведь для создания любой молекулярной конструкции требуется сочетание творческого подхода и глубокого понимания химии. Нужно не только вообразить желаемую структуру, но и найти способы ее реализации. А уж источником вдохновения для таких конструкций вполне могут служить биомолекулы.
Но мало просто скопировать уже существующие молекулы, имитация — это не копирование. Сложно судить о понимании любого объекта, если не можешь его реконструировать. Тонкие различия между моделями, которые создаются в лаборатории и их природными прототипами позволяют детально изучать ключевые механизмы биологических процессов, такие как катализ ферментов или селективное распознавание молекул. Имитируя их, можно куда лучше понять, что именно важно для их функционирования. Способность создавать искусственные аналоги — это путь не только к новым технологиям, но и к фундаментальному пониманию биологии.
Литература
- Проблема фолдинга белка;
- Роль слабых взаимодействий в биополимерах;
- Одиссея азота;
- 12 методов в картинках: структурная биология;
- Физическая водобоязнь;
- Samuel H. Gellman. (1998). Foldamers: A Manifesto. Acc. Chem. Res.. 31, 173-180;
- На заре молекулярной графики;
- Daniel H. Appella, Laurie A. Christianson, Isabella L. Karle, Douglas R. Powell, Samuel H. Gellman. (1996). β-Peptide Foldamers: Robust Helix Formation in a New Family of β-Amino Acid Oligomers. J. Am. Chem. Soc.. 118, 13071-13072;
- Daniel H. Appella, Laurie A. Christianson, Daniel A. Klein, Michele R. Richards, Douglas R. Powell, Samuel H. Gellman. (1999). Synthesis and Structural Characterization of Helix-Forming β-Peptides: trans-2-Aminocyclopentanecarboxylic Acid Oligomers. J. Am. Chem. Soc.. 121, 7574-7581;
- Hecht S., Huc I. Foldamers: Structure, Properties, and Applications. Wiley, 2007. — 456 p.;
- Наука, описывающая жизнь — лауреаты Нобелевской премии по химии (2022);
- Раздвинувший границы химии;
- Короновавший ионы;
- Jean‐Marie Lehn. (1988). Supramolecular Chemistry—Scope and Perspectives Molecules, Supermolecules, and Molecular Devices (Nobel Lecture). Angew. Chem. Int. Ed. Engl.. 27, 89-112;
- Неизвестные пептиды: «теневая» система биорегуляции;
- Лен Ж.-М. Супрамолекулярная химия. Концепции и перспективы. Новосибирск: «Наука», 1998;
- Claude Piguet, Gérald Bernardinelli, Gérard Hopfgartner. (1997). Helicates as Versatile Supramolecular Complexes. Chem. Rev.. 97, 2005-2062;
- Volker Berl, Ivan Huc, Richard G. Khoury, Michael J. Krische, Jean-Marie Lehn. (2000). Interconversion of single and double helices formed from synthetic molecular strands. Nature. 407, 720-723;
- Hua Jiang, Jean-Michel Léger, Ivan Huc. (2003). Aromatic δ-Peptides. J. Am. Chem. Soc.. 125, 3448-3449;
- Ivan Huc. (2004). Aromatic Oligoamide Foldamers. Eur J Org Chem. 2004, 17-29;
- Krzysztof Ziach, Céline Chollet, Vincent Parissi, Panchami Prabhakaran, Mathieu Marchivie, et. al.. (2018). Single helically folded aromatic oligoamides that mimic the charge surface of double-stranded B-DNA. Nature Chem. 10, 511-518;
- Pedro Mateus, Nagula Chandramouli, Cameron D. Mackereth, Brice Kauffmann, Yann Ferrand, Ivan Huc. (2020). Allosteric Recognition of Homomeric and Heteromeric Pairs of Monosaccharides by a Foldamer Capsule. Angew Chem Int Ed. 59, 5797-5805.