Микробиоэлектроника: как подключить к сети компьютер, спроектированный три миллиарда лет назад
31 октября 2019
Микробиоэлектроника: как подключить к сети компьютер, спроектированный три миллиарда лет назад
- 1535
- 1
- 8
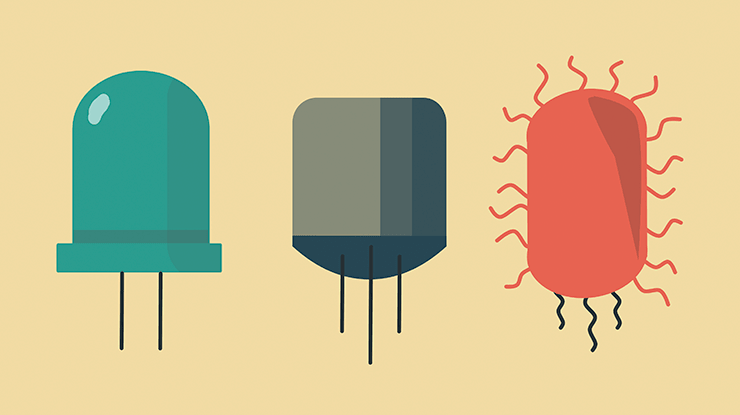
Электронные компоненты: диод, транзистор и бактерия Shewanella oneidensis
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Электрогенные бактерии уже миллионы лет взаимодействуют с миром с помощью электрических сигналов. Каждая бактерия представляет собой одновременно сложный компьютер и фабрику по производству химических соединений. Работая на стыке электроники и микробиологии, ученые доказали: вполне возможно, что в будущем микробы помогут нам изобрести новые технологии диагностики заболеваний и наладить экологически чистые процессы производства; они проследят за качеством воды, быстро обнаруживая и устраняя загрязнения; создадут материалы для квантовых компьютеров; и может быть, даже пригодятся для полетов в космос. Эта статья — о самых интересных инновациях в области микробиоэлектроники и о перспективах ее реального применения.
Конкурс «био/мол/текст»-2019
 Эта работа заняла первое место в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Эта работа заняла первое место в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Самая древняя электротехника
Посмотрите на заглавную картинку статьи. У нас есть диод, транзистор и бактерия Shewanella oneidensis, впервые обнаруженная на дне озера Онайда в Нью-Йорке [1]. Эти три «устройства» имеют больше общего, чем может показаться на первый взгляд: Shewanella — тоже элемент электронных цепей, она участвует в электрических взаимодействиях с окружающей средой. Такие «электрогенные» бактерии умеют обмениваться электронами с минералами или другими живыми организмами [2]. В течение последних десятилетий ученые обнаружили, что они наполняют нашу планету — в воде, почве, на дне океана и даже у нас в желудке [3] расположились живые электронные сети.
Если подумать, в этом нет ничего удивительного: обмен электронов необходим для химических преобразований и поэтому составляет основу жизни. Для Shewanella, например, способность передавать электроны за пределы клетки играет важную роль в метаболизме. В процессе клеточного дыхания бактерии нужно избавляться от «лишних» электронов. Часто для этого они используют кислород, играющий роль конечного акцептора (то есть последнего элемента электронтранспортной цепи). В условиях дефицита кислорода, Shewanella вместо него передает электроны атомам металлов, находящихся в минералах за пределами клетки [4]. Shewanella и некоторые другие электрогенные бактерии также способны получать электроны извне и использовать их в различных внутриклеточных процессах.
Сегодня известно несколько механизмов, с помощью которых бактерии обмениваются электронами с внешней средой (рис. 1). Например, электроны могут попадать за пределы клетки через специальные белковые комплексы, встроенные во внешнюю клеточную мембрану, и через них передаваться на поверхность металла [5]. Другой способ — использование молекул-медиаторов, которые получают электроны от белковых комплексов, либо от белков непосредственно внутри клетки. Еще один интересный механизм — передача электронов по специальным проводящим нитям, которые представляют собой нечто вроде электрических проводов, растущих на поверхности бактерии [6].
«Биомолекула» уже рассказывала про «нанопровода» из бактериальных структур: «Металлическая проводимость биологических структур» [7]. — Ред.
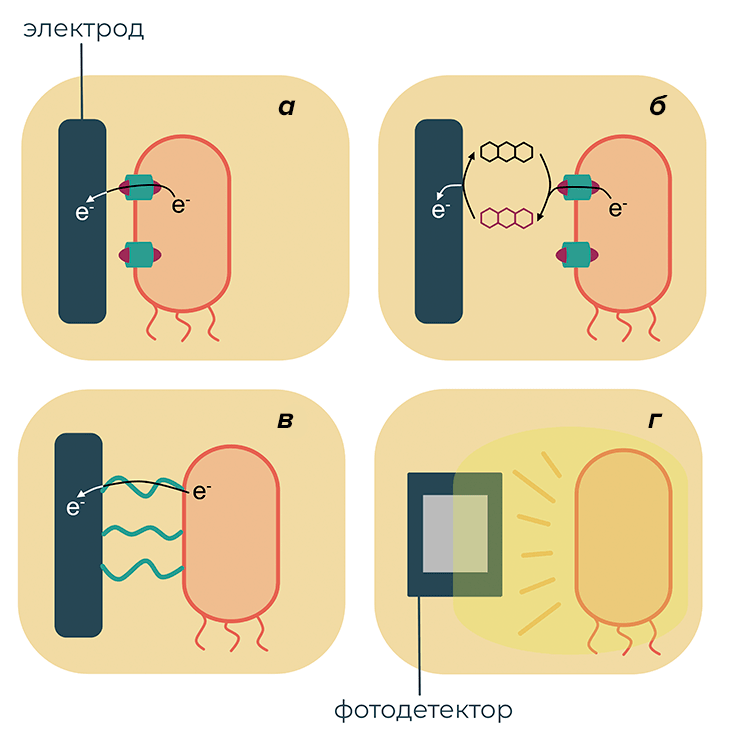
Рисунок 1. Механизмы взаимодействия бактерий с электроникой. а — Прямой перенос электронов через белковые мембранные комплексы, содержащие цитохромы для создания протонных градиентов. Этот механизм характерен, например, для бактерии Geobacter sulfurreducens. б — Гибридный перенос электронов с помощью молекул-медиаторов. Shewanella oneidensis — одна из бактерий, использующих такой способ передачи электронов: Shewanella выделяет флавиновые ферменты, которые передают электроны на анод. в — Перенос электронов через белковые нити (пили), содержащие цепи ароматических аминокислот, — еще один механизм, характерный для Geobacter sulfurreducens. г — Взаимодействие бактерии с электроникой при помощи света. Этот тип взаимодействия не встречается в природе, но может быть использован для генетически модифицированных бактерий.
рисунок автора статьи на основе [5]
Электрические свойства бактерий предоставляют нам возможность напрямую «подключить» их к нашим гаджетам, создав устройства с уникальными характеристиками, совмещающими возможности электроники и биологии. Кроме непосредственного обмена электронами, можно задействовать и менее очевидные механизмы взаимодействия живых организмов с электроникой: например посредством света или звука [8], [9]. Вооружившись этими идеями, исследователи работают над созданием биоэлектронных технологий для решения проблем в самых разнообразных областях: в фундаментальной науке, медицине, фармацевтике, экологии и энергетике (рис. 2). В этой статье речь пойдет исключительно о бактериях. Если вы хотите узнать о таких возможностях биоэлектроники, как взаимодействие электрических сигналов с живыми тканями, обратитесь к статье «Биомолекулы» об органической биоэлектронике [10].
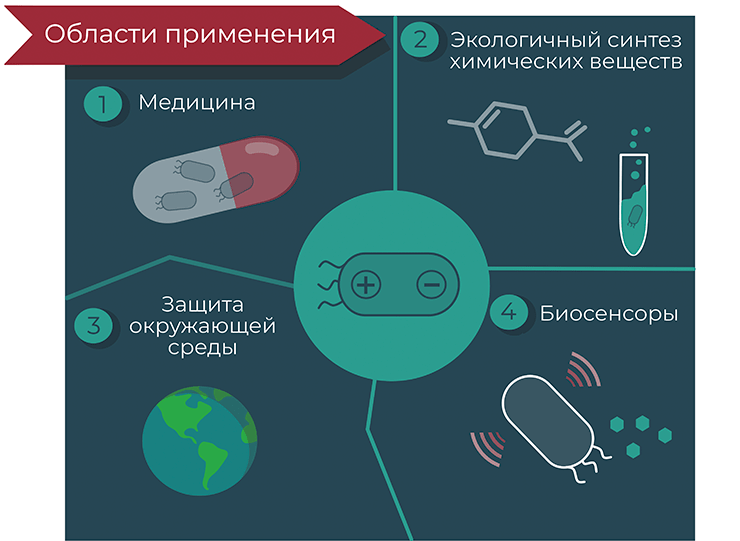
Рисунок 2. Основные области применения микробиоэлектроники. Ученые разрабатывают методы использования микробиоэлектроники в таких областях, как медицина (для диагностики заболеваний и секреции лекарств), биосинтез полезных продуктов (топливо, растворители, биоматериалы), а также биоремедиация и создание биосенсоров, которые могут обнаружить токсичные вещества в воде или почве.
рисунок автора статьи
Биоэлектронная капсула: мини-лаборатория в желудке
Возможно, предложение проглотить колонию генетически модифицированных бактерий не всем покажется привлекательным. Тем не менее ученые работают над проектами медицинских технологий, предполагающих использование таких бактерий прямо в организме человека. Одно из направлений исследований — диагностика желудочно-кишечных заболеваний. Обычно болезни желудка диагностируют с помощью УЗИ, эндоскопии или анализа кала. Недостаток этих методов в том, что они не способны измерить уровень различных химических веществ непосредственно в желудочном тракте. Поэтому они не предоставляют точную информацию о биомаркерах болезни [11]. Чтобы решить эту проблему, ученые из Массачусетского технологического института (MIT) запрограммировали бактерии для создания электронной капсулы, которая проводит анализы прямо в желудке и передает информацию на смартфон в реальном времени [12]. Они продемонстрировали принцип работы капсулы на примере диагностики внутреннего кровотечения.
Для воплощения своей идеи ученые применили методы синтетической биологии [13], [14] — науки, которая видит в каждой живой клетке компьютер: он принимает сигналы из окружающей среды, производит вычисления и выдает на их основе определенный результат. Программа действий записана в ДНК, и с помощью генетических модификаций можно запрограммировать бактерии на выполнение интересующих нас действий. В случае электронный капсулы, ученые взяли бактерию Escherichia coli и установили в нее следующую генетическую программу: при обнаружении биомаркера кровотечения бактерия начинает производить люминесцентный белок. Свет регистрируется фотодетекторами в капсуле, и сигнал дистанционно передается на компьютер или смартфон.
Чтобы создать нужную генетическую программу, ученым понадобились гены для производства люминесцентного белка и гены, отвечающие за способность бактерии реагировать на гем (биомаркер крови). В присутствии гема, транскрипция люминесцентных генов активируется, и бактерии начинают светиться. Все необходимые гены помещаются на плазмиды (маленькие кольцевые молекулы ДНК), которые вводятся в E. coli. Более подробно механизм действия показан на рисунке 3.
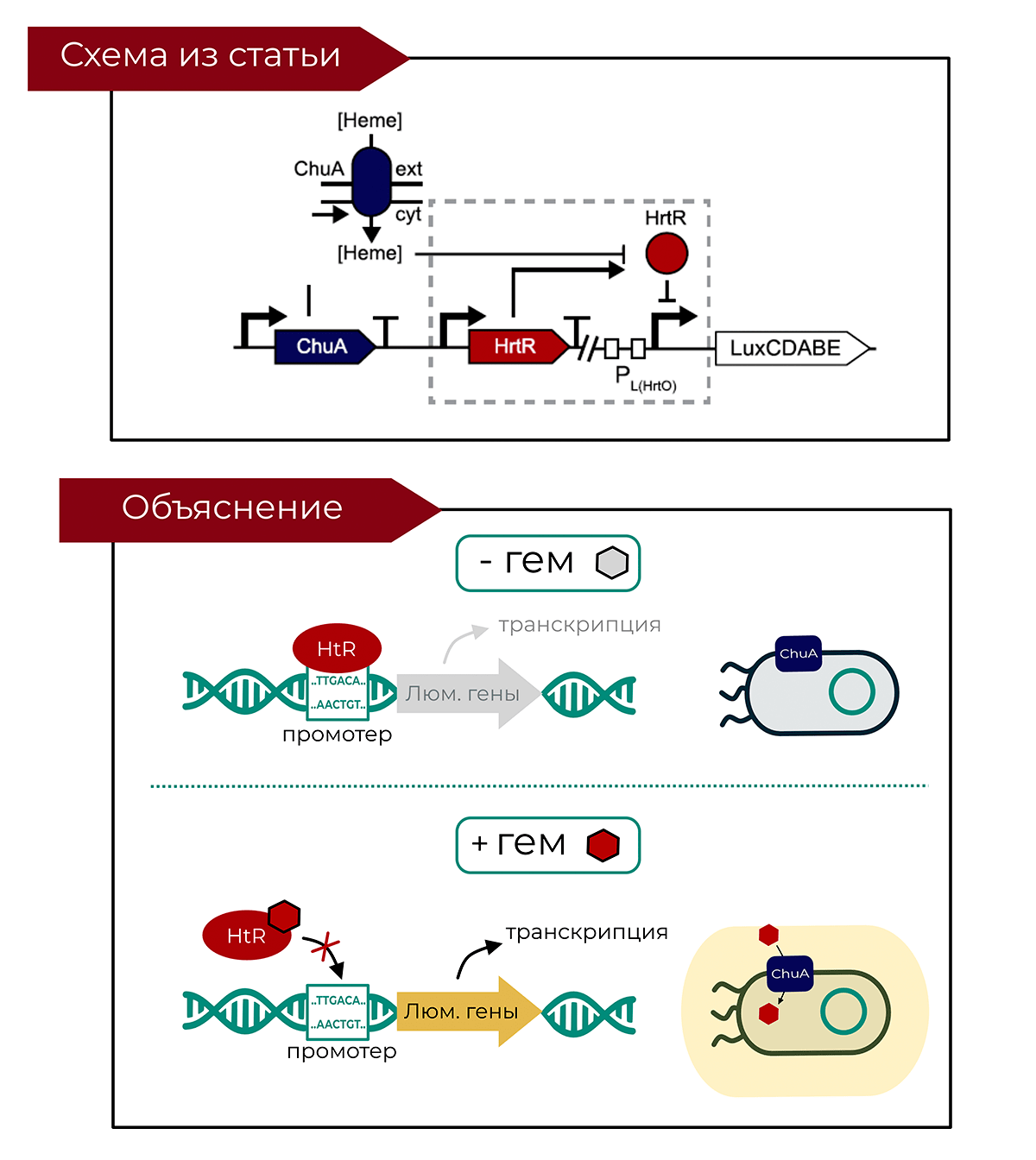
Рисунок 3. Генетическая программа для обнаружения биомаркера кровотечения. Репрессор HtR блокирует транскрипцию генов, отвечающих за производство люминесцентного белка. Когда гем проникает в клетку через мембранный белок ChuA, он связывается с репрессором и деактивирует его. Это включает экспрессию генов и ведет к производству люминесцентного белка, благодаря которому бактерия начинает светиться.
Как видно на подробной схеме устройства, бактерии находятся в полупроницаемом отсеке, который не дает им проникнуть за пределы капсулы, но открывает доступ молекулам биомаркеров (рис. 4). Фотодетекторы, принимающие световой сигнал, находятся рядом с отсеком за прозрачным разделителем. Такая капсула представляет собой пример того, как бактерии могут стать полноценной частью электронного устройства.
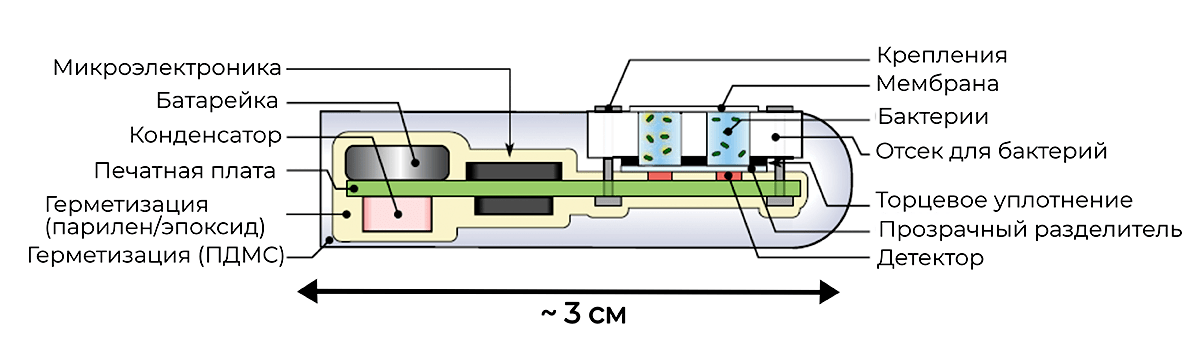
Рисунок 4. Схема устройства электронной капсулы. Отсек с бактериями отделен от внешней среды полупроницаемой мембраной, пропускающей молекулы биомаркеров, которые включают гены люминесценции, но препятствующей движению бактерий. Основные электронные компоненты капсулы включают четыре фототранзистора, реагирующие на люминесцентный сигнал, миниатюрную литиевую батарейку, микроконтроллер и печатную плату (которая содержит антенну и кварцевый генератор). При обнаружении света, фотодетекторы посылают сообщение активировать радиосигнал, который дистанционно передается на приемник, подключенный к смартфону или компьютеру.
Чтобы доказать возможность использования капсулы в клинических условиях, исследователи протестировали ее в желудочном тракте свиней (рис. 5). Для этого свиньям ввели содержащий кровь раствор, после чего в их желудок поместили капсулу. Сигнал, передаваемый с капсулы на смартфон, записывался в течение двух часов. Полученные результаты показывают, что капсула успешно определяет наличие крови в желудке, и сигнал легко считывается с компьютера.
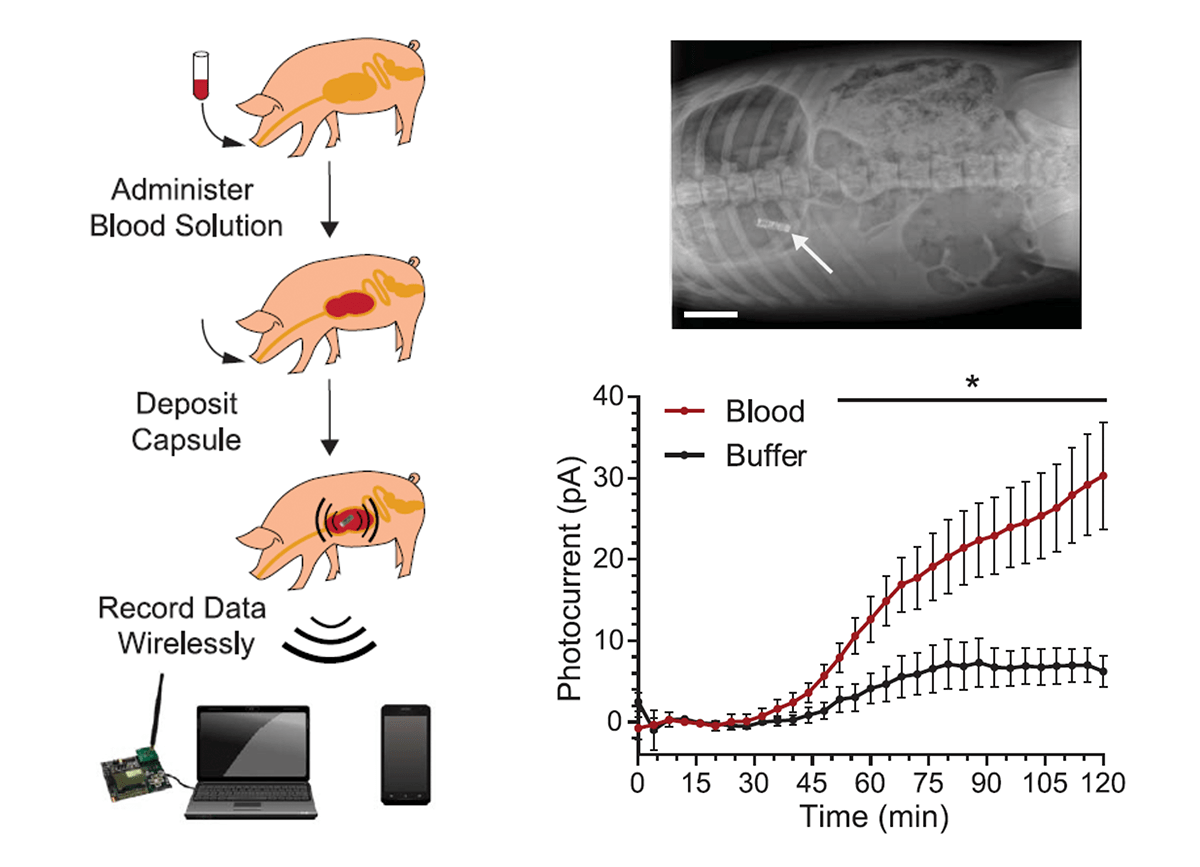
Рисунок 5. Тестирование капсулы для диагностики внутреннего кровотечения в желудочном тракте свиней. Свиньям ввели раствор, содержащий гидрокарбонат, глюкозу и 0,25 мл крови. Контрольная группа получила раствор без крови. Электронную капсулу ввели в желудок при помощи зонда. На всем протяжении эксперимента (два часа), капсула оставалась в брюшной полости, что позволило считать стабильный сигнал при реакции капсулы на биомаркер крови. Капсула засекла сигнал после задержки в 52 минуты. По окончании эксперимента, сигнал от свиней, получивших раствор с кровью, был в пять раз выше, чем от контрольной группы: это показывает, что капсула успешно определяет наличие крови в желудке.
В дальнейшем возможности капсулы можно расширить, встроив в бактерии генетические программы для обнаружения широкого спектра различных химических веществ. Исследователи надеются, что в будущем пациенту достаточно будет проглотить такую капсулу — и врачи получат необходимую информацию о биомаркерах болезни. Правда, для этого капсулу придется уменьшить по крайней мере в три раза: недавно на конференции по биоэлектронике мне удалось подержать в руках прототип, и я испытала определенное сочувствие к лабораторным свинкам.
Электронный контроль над действиями бактерий
Соображения безопасности и необходимость контролировать действия генетически модифицированных бактерий — главные препятствия на пути их широкого использования в медицине и других областях. При создании таких устройств, как биоэлектронная капсула, возникает вопрос об обратной связи: можно ли придумать механизм дистанционного управления бактериями, чтобы, например, регулировать скорость их размножения или выключать по сигналу ту или иную генетическую программу?
Исследователи из университета Мэриленд в своей статье, опубликованной в журнале Nature, предложили принцип работы такой системы [15]. Чтобы контролировать бактерий с помощью электроники, необходимо преобразовать электрический сигнал в биологический. В этом и заключается главная идея исследователей: они запрограммировали бактерии таким образом, чтобы, находясь вблизи электрода, они реагировали на включение электрического тока и меняли определенные биологические параметры. Понять, как это работает, несложно: электрический ток на катоде окисляет специальные молекулы — переносчики электронов, — они проникают через клеточную мембрану в бактерию E. coli и запускают изменения в транскрипции генов (рис. 6а).
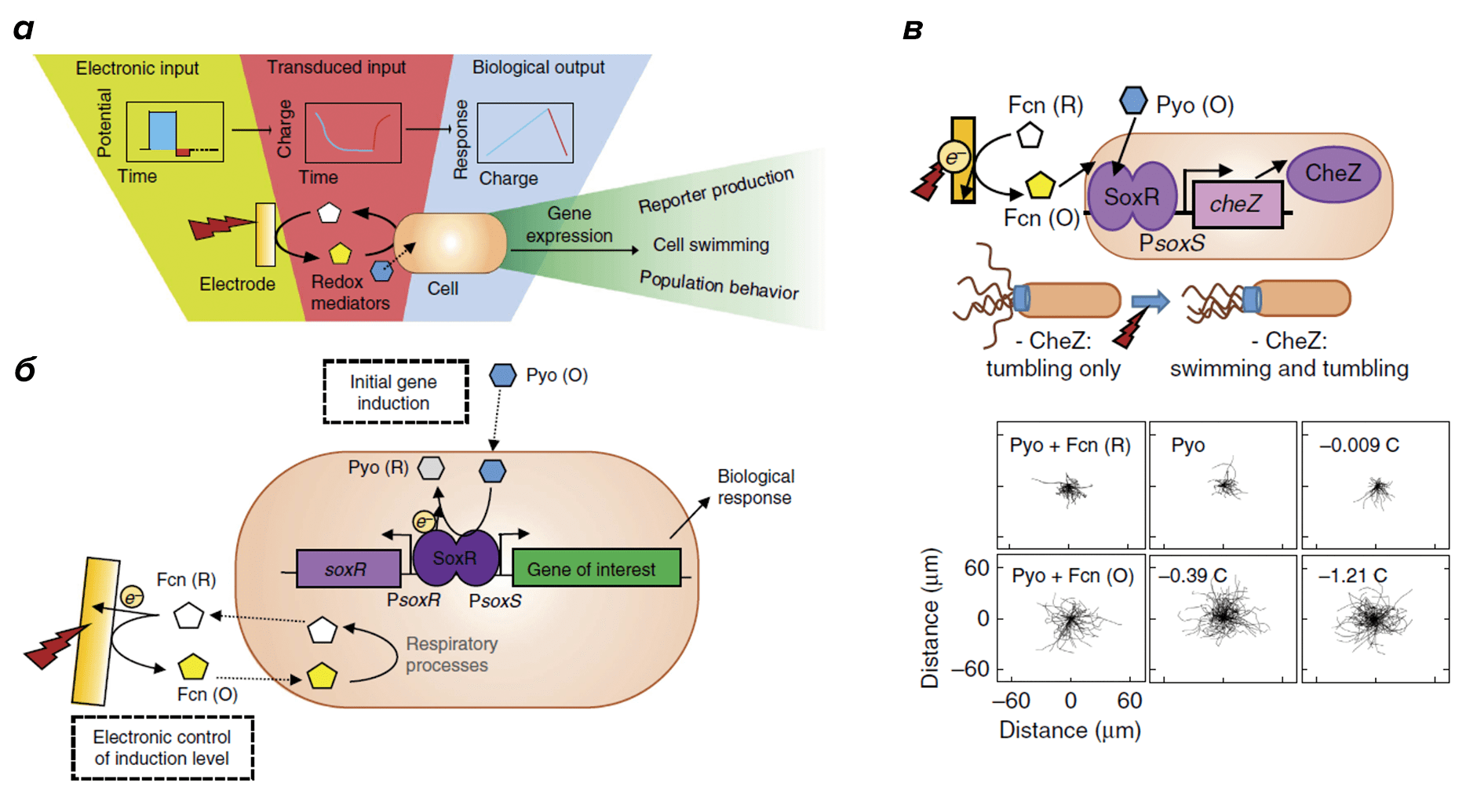
Рисунок 6. Электронный контроль над действиями бактерий. а — Преобразование электрического сигнала в биологический с помощью молекул, переносящих электроны. б — Контроль экспрессии генов с помощью электрического тока. Переносчик электронов pyocyanin (Pyo), попадая в клетку, слабо окисляет SoxR. Другой переносчик — ferricyanide (Fcn) — после взаимодействия с катодом усиливает этот эффект, принимая электроны от Pyo и возвращая Pyo в окисленное состояние. Таким образом, уровень экспрессии генов зависит от силы тока на катоде. в — Движение бактерий под воздействием тока. Окисление SoxR включает транскрипцию гена cheZ, необходимого для движения.
Чтобы заставить бактерий реагировать на включение тока, ученые опять взломали и перенастроили одну из уже существующих генетических программ. Эта программа — SoxRS-регулон E. coli. Когда бактерия испытывает окислительный стресс (при повышенном уровне активных форм кислорода в клетке [16]), белок SoxR окисляется и запускает производство другого белка — SoxS, — который, в свою очередь, включает транскрипцию более 15 генов, отвечающих за защиту от стресса [17]. Используя последовательности ДНК из SoxRS-регулона, ученые создали программу, в которой окисление SoxR инициирует транскрипцию интересующего их гена. Например, гена, отвечающего за производство флуоресцентного белка. Когда химические медиаторы, получив электроны, проникают в клетку и окисляют SoxR, включается транскрипция нашего гена, и бактерии начинают флуоресцировать. Более подробное описание функции медиаторов можно найти в подписи к рисунку 6б.
Ученые показали, как можно использовать такой подход, чтобы управлять движением бактерий. Для этого они сначала удалили ген cheZ, отвечающий за подвижность E. coli. Без этого гена E. coli не может включить движение жгутиков, и бактерии способны только крутиться на одном месте. Затем исследователи встроили cheZ в описанную выше генетическую программу, составленную из элементов SoxRS-регулона. Благодаря этому ген cheZ включался при наличии электрического тока и молекул-медиаторов. Исследователи создали специальный видео-алгоритм, который записывает и анализирует движение бактерий. Как видно из полученных результатов (рис. 6в), бактерии двигаются гораздо активнее, когда выполнены все упомянутые условия, причем степень подвижности зависит от силы тока.
Преимущество системы, позволяющей с помощью электрического сигнала контролировать экспрессию генов, — в ее универсальности. Вместо гена cheZ можно использовать любой другой и таким образом управлять интересующими функциями клетки. Но стоит отметить, что одно из ограничений разработки состоит в невозможности независимо управлять несколькими генами одновременно. Чтобы решить эту проблему, авторы статьи продолжают исследовать свойства белков, способных включать транскрипцию генов в ответ на окисление или восстановление.
Биосенсоры и биоремедиация
Если мы сможем создать надежные системы контроля за генномодифицированными микробами, это расширит возможности синтетической биологии и биоэлектроники [10] не только в медицине, но и в таких областях как энергетика и экология. Ученые уже сегодня работают над проектами применения бактерий для решения проблем, вызванных глобальным потеплением и загрязнением окружающей среды [18], [19]. Один из примеров таких разработок — модификация микробов для очистки воды от опасных химикатов.
Подземные источники и открытые водоемы — важный ресурс питьевой воды во всем мире. Но чаще всего воду из них нельзя использовать без многоступенчатой предварительной очистки: она может быть заражена тяжелыми металлами, углеводородными соединениями и вредными органическими веществами. Современные фильтрационные и химические методы не могут полностью решить эту проблему. Они не способны очистить большие водоемы, требуют серьезных энергетических и денежных затрат и иногда вызывают нежелательные побочные эффекты [20]. Разумеется, на помощь опять приходят бактерии. Они умеют не только распознавать присутствие токсинов в воде или почве, но и изолировать их или превращать в менее опасные соединения.
Вооружившись этими свойствами микробов, ученые разрабатывают биосенсоры [21] и новые методы биоремедиации (очистки окружающей среды с помощью живых организмов). Использование бактерий в таких технологиях имеет несколько важных преимуществ. Они чувствительны к малейшим изменением концентрации химических веществ, что может обеспечить высокую точность измерений [22]. Кроме того, бактерии могут выжить практически в любых природных условиях — даже в таких, которые обычно выводят из строя стандартные электронные приборы.
«Биомолекула» уже несколько раз затрагивала вопросы биоремедиации: «Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области» [23] и «Биодеградация ксенобиотиков как самозащита природы» [24]. — Ред.
Биосенсоры: обнаружение токсичных веществ
Самый распространенный тип биосенсоров представляет собой группу бактерий, которые реагируют на стимул в виде определенного химического вещества и производят флуоресцентный белок [25]. Однако здесь есть одна проблема: биосенсор подобного типа имеет очень ограниченные возможности реального применения. Если он находится, например, в почве или глубоко под водой, очень сложно будет считать сигнал [26]. Более функциональный биосенсор должен уметь передавать сигнал дистанционно. В идеале, он должен в реальном времени посылать нам информацию об уровне токсинов. Как и в случае с биоэлектронной капсулой, такого эффекта легче всего добиться путем создания интерфейса между бактериями и электроникой.
Исследователи из Корнеллского университета использовали этот подход, чтобы создать биосенсор для обнаружения мышьяка [27]. Они задействовали электрогенные свойства бактерии Shewanella oneidensis: как уже было отмечено, Shewanella может переносить электроны за пределы клетки и передавать их на электрод, вызывая электрический ток. Ученые удалили один из генов Shewanella, отвечающих за эту функцию, и поместили его на плазмиду, где он включался только в присутствии мышьяка в его наиболее токсичной форме (AsO33−). Удаленный ген mtrB кодирует белок, который участвует в передаче электронов через внешнюю клеточную мембрану. Исследователи продемонстрировали, что бактерии, содержащие плазмиду, реагируют на мышьяк в питательной среде и переносят электроны за пределы клетки, за чем можно проследить по увеличению тока на аноде (рис. 7).
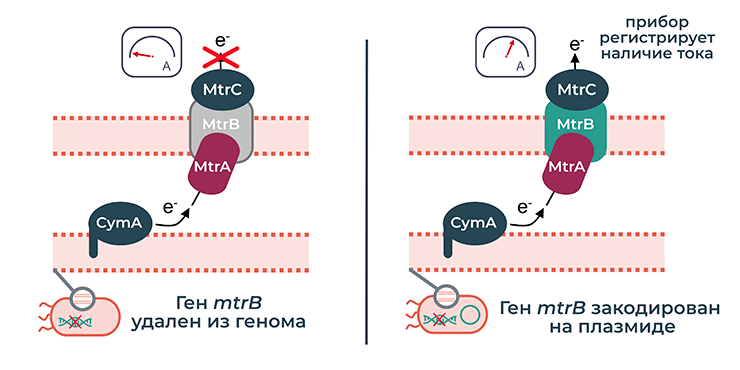
Рисунок 7. Механизм работы биосенсора для обнаружения мышьяка. Мембранные белки бактерии Shewanella oneidensis CymA, MtrA, MtrB и MtrC отвечают за способность Shewanella передавать электроны за пределы клетки. Ген mtrB удалили из генома и поместили на плазмиду, где его транскрипция включалась только в присутствии мышьяка. В результате этого увеличение тока на аноде можно было наблюдать только при наличии достаточно высокой концентрации мышьяка.
рисунок автора статьи на основе [27]
Благодаря этой генетической программе электрический ток увеличивается пропорционально концентрации мышьяка, что позволяет устройству оценивать количество тяжелого металла, вступающего в контакт с бактериями. Если внимательно прочитать статью, то можно заметить, что ученые столкнулись с одной проблемой: нижний порог детекции биосенсора — примерно пять миллиграммов мышьяка на литр, что во много раз выше допустимого для здоровья уровня. Это значит, что биосенсор не сможет обнаружить мышьяк в низких, но все-таки крайне опасных для здоровья концентрациях. С тех пор другие исследовательские группы сумели разрешить эту трудность.
В одной из последних публикаций ученым удалось уменьшить нижнюю границу обнаружения мышьяка в тысячу раз: для их биосенсора она составляет пять микрограммов на литр [28]. Чтобы добиться этого результата, исследователи добавили в генетическую программу бактерий усилитель сигнала, работающий по аналогии с электронным усилителем — но только увеличивающий не электрическую мощность, а уровень транскрипции генов.
Биоремедиация
Бактерии в природе работают как фабрики по переработке мусора. Они способствуют распаду органических соединений, поддерживая круговорот веществ. Можно ли заставить их эффективно бороться с антропогенными загрязнениями? Исследователи уже давно заинтересовались этим вопросом: они считают, что биоремедиация поможет нам справиться со многими негативными последствиями химических выбросов в воде, почве и атмосфере [19]. В связи с этим одна из важных целей синтетической биологии — создание интегрированных биосистем для мониторинга и очистки воды. Для этого ученым и инженерам понадобятся не только точные биосенсоры, но и бактерии, запрограммированные на устранение опасных форм химических соединений.
Многие токсичные вещества могут быть преобразованы в менее опасные или нерастворимые формы через окислительно-восстановительные реакции (рис. 8). Бактерии могут эффективно проводить эти реакции благодаря ферментам, ускоряющим химические процессы. Для этого им чаще всего необходим внешний источник электронов, поэтому такие реакции проводят на катоде или на аноде микробного топливного элемента [29].
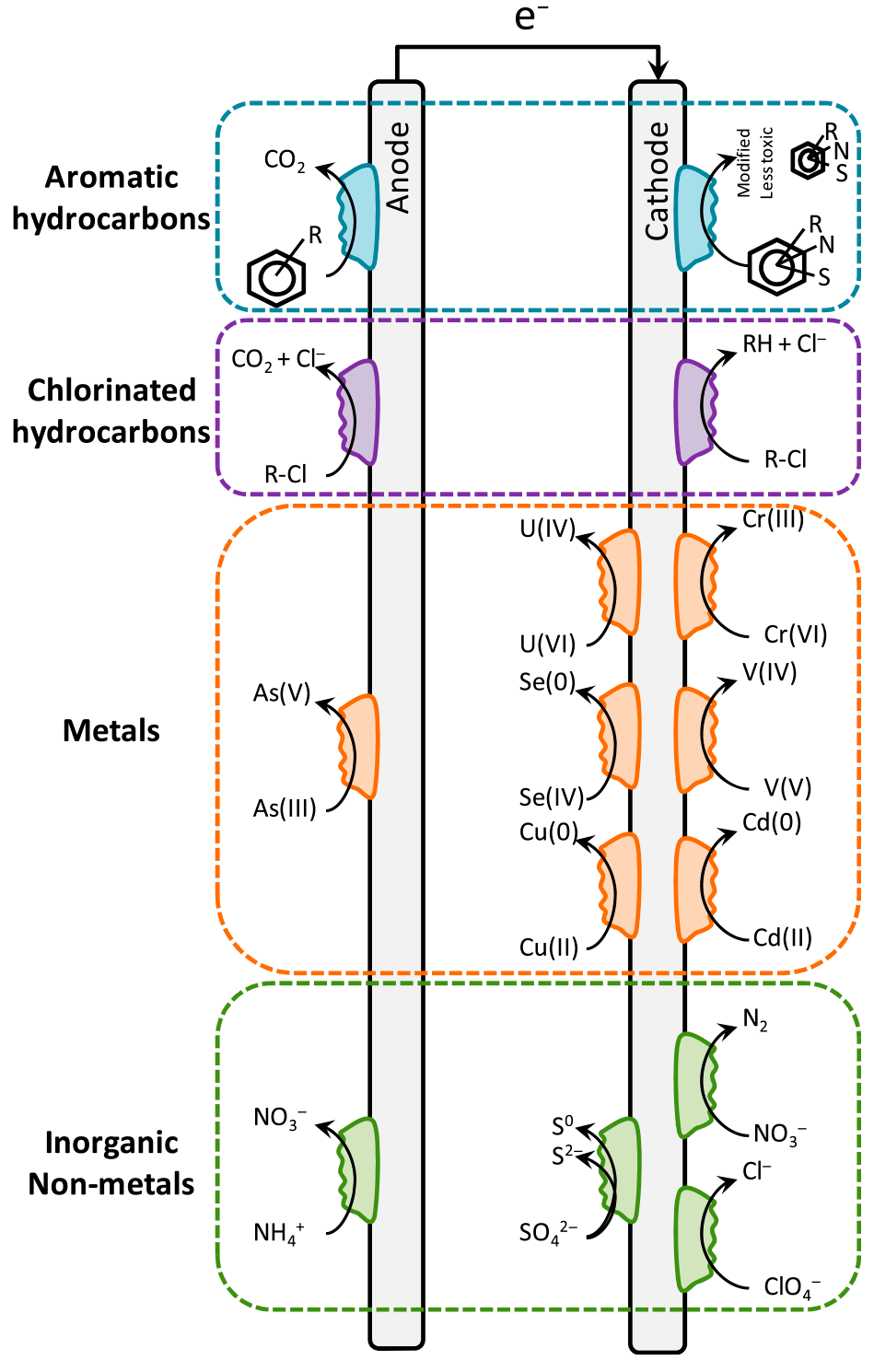
Рисунок 8. Микробный топливный элемент, поддерживающий реакции окисления и восстановления для устранения основных форм химического загрязнения воды. Реакции окисления и восстановления могут быть использованы для борьбы со многими формами химического загрязнения (ароматическими и хлороорганическими соединениями, тяжелыми металлами и неорганическими веществами). Реакции окисления проводятся на аноде, где в результате химической реакции электроны передаются на анод, приводя к генерации тока. На катоде происходит обратный процесс: электрический ток поставляет электроны для реакций восстановления.
Продолжим пример с мышьяком, который встречается в воде в основном в двух формах: As(III) (арсенит) и As(V) (арсенат). Арсенит крайне опасен для здоровья, но при окислении превращается в арсенат, который менее токсичен и плохо растворяется в воде.
Ученых из испанского Университета Жироны заинтересовали возможности применения биоэлектроники для биоремедиации мышьяка. Они провели исследование, целью которого было изучить способности бактерий преобразовывать арсенит в менее токсичную форму [30]. Статьи, опубликованные ранее, уже доказали, что микробные топливные элементы успешно справляются с загрязнениями в виде перхлоратов [31], сульфатов [32], хрома [33], нитрата [34] и других веществ. Поэтому ученые взяли на вооружение стандартный дизайн устройства: микробный топливный элемент, состоящий из анодной и катодной камер. Они разделены мембраной, которая пропускает протоны, полученные в результате окисления субстрата на аноде. Электроны с анода перетекают на положительно заряженный анод, где нейтрализуют протоны, таким образом поддерживая баланс зарядов (рис. 9) [35].
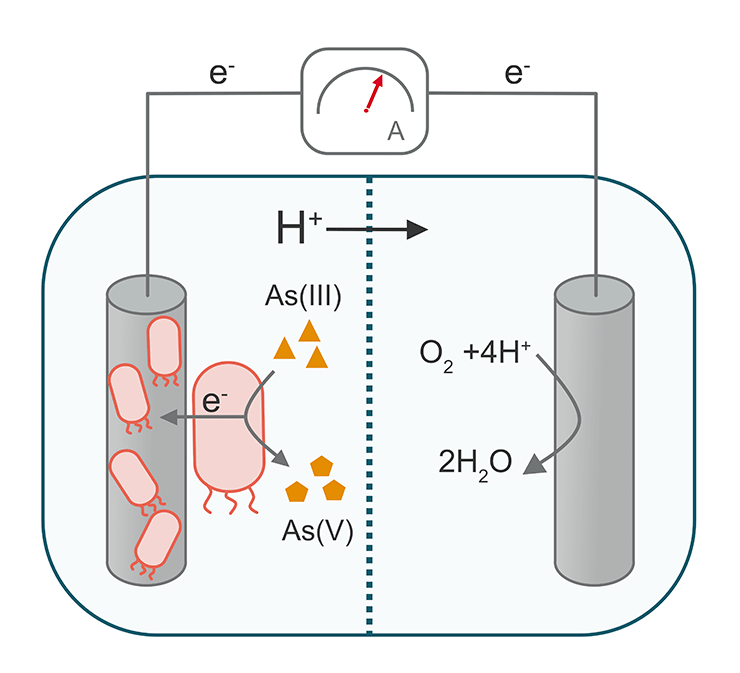
Рисунок 9. Микробный топливный элемент для преобразования As(III) в As(V). Бактерии формируют биопленку на аноде, что позволяет ускорить реакцию передачи электронов, полученных в результате преобразования As(III) в As(V). Катодная и анодная камеры разделены мембраной, которая пропускает ионы, но задерживает движение бактерий.
Ученым оставалось только найти бактерии, которые хорошо умеют превращать As(III) в As(V). Они получили образец воды из вулканической местности с высоким содержанием арсенита, надеясь обнаружить бактерии, приспособленные к высоким уровням мышьяка. Изолировав микробы, они измерили их окислительную активность и обнаружили, что они образуют биопленки на поверхности электрода, что позволяет ускорить обмен электронов и эффективно преобразовывать As(III) в As(V). Благодаря этому концентрация арсенита в растворе с бактериями быстро уменьшилась — пропорционально увеличению количества As(V). Ученые также продемонстрировали способность бактерий окислять арсенит в анаэробных условиях, что позволяет рассматривать их разработку в качестве прототипа реального устройства, которое может работать в воде или почве с низким содержанием кислорода.
На пути к экологичному производству: биоэлектросинтез
Биоремедиация не сможет значительно повлиять на состояние окружающей среды, если мы не будем бороться с главной причиной загрязнений — с производствами, опирающимися на ископаемые источники энергии и выделяющими в атмосферу вредные вещества. Поэтому еще одна цель биоэлектроники состоит в разработке технологий для создания экологичной промышленности. Главным инструментом микробиологов в этом контексте является биоэлектросинтез: использование бактерий на катоде микробного топливного элемента, где они обеспечивают обмен электронами для проведения химических реакций [36].
Основной тип микроорганизмов для биоэлектросинтеза — автотрофы. Они преобразуют неорганические вещества (чаще всего CO2) в сложные химические продукты. Ученые хотят заставить такие организмы производить нужные нам соединения, ведь автотрофы не выделяют CO2, а, наоборот, поглощают углекислый газ в качестве источника углерода [37]. Это свойство полезно в переработке органических отходов: углеродосодержащих газов, животных и растительных, а также бытовых отходов. Все они содержат соединения углерода, и их можно газифицировать, чтобы «кормить» полученным газом автотрофов, пока они синтезируют для нас нужные продукты.
Первые успехи в области биоэлектросинтеза были достигнуты благодаря исследованию свойств ацетогенных бактерий (ацетогенов) [38]. Это автотрофные микробы, синтезирующие вещества, предшественником которых является ацетил-КоА. Для поддержания метаболизма им необходимы водород, углекислый газ и источник электронов. Ученые обнаружили, что, если закрепить бактерий на катоде и увеличить поставку тока, ацетогены будут производить полезные химикаты в коммерчески значимых объемах [39]. Исследования показали, что даже без генетических модификаций разные типы ацетогенов способны синтезировать такие химические соединения, как ацетат, лактат, этанол и 2,3-бутандиол (рис. 10). Учитывая, что эти вещества используются в огромных объемах по всему миру для производства топлива, полимеров, лекарств и даже косметики, биоэлектросинтез может стать важным шагом на пути к экологически чистому химическому синтезу.
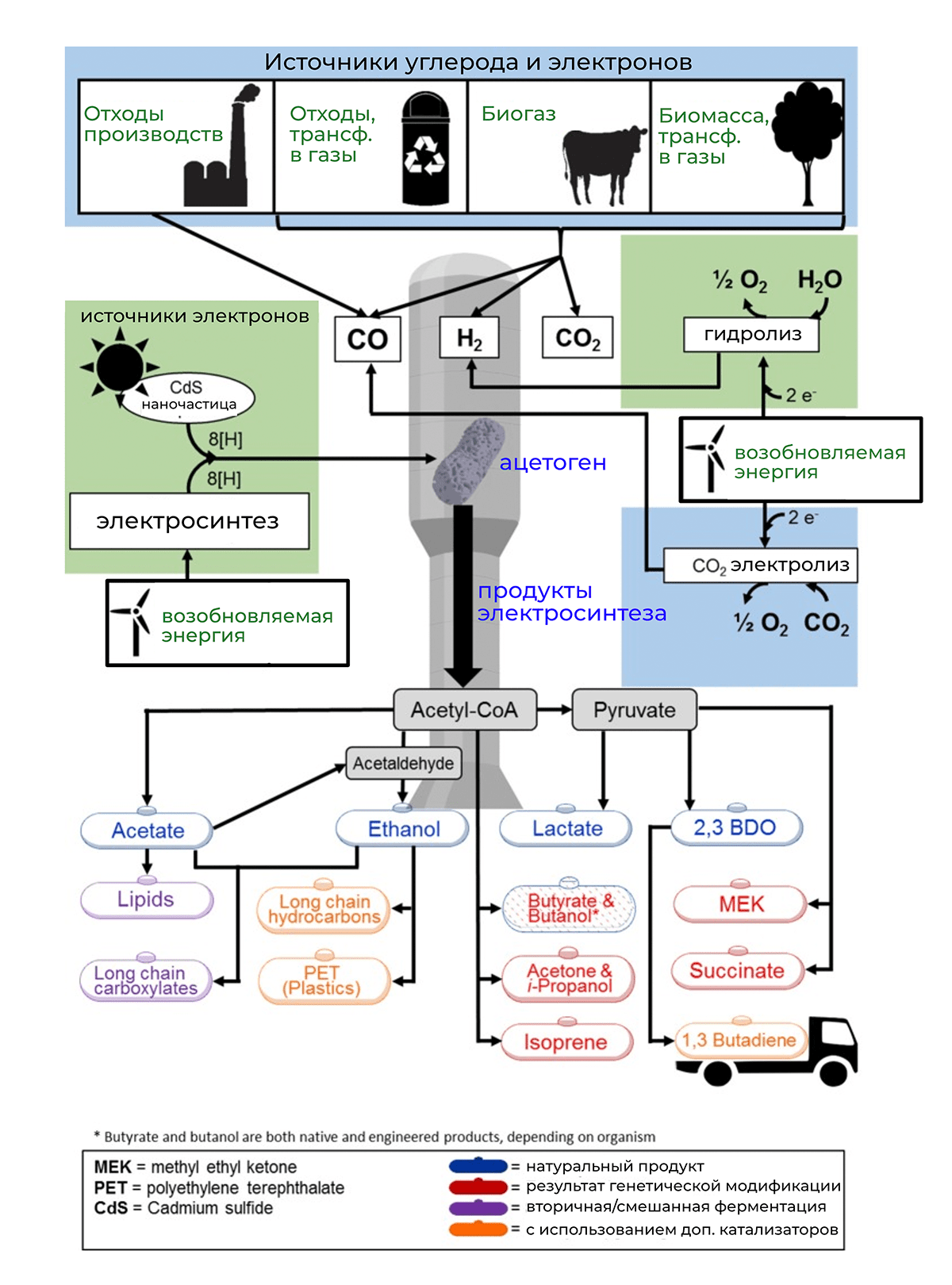
Рисунок 10. Биоэлектросинтез на основе ацетогенных бактерий: источники исходного сырья и продукты производства. Для синтеза полезных химических веществ ацетогенам необходимы газифицированные углеродосодержащие отходы и источник электронов. При условии, что электроны поставляются с использованием возобновляемых источников энергии, такой процесс производства полностью независим от ископаемых углеводородов. Ацетил-КоА преобразуется (в зависимости от типа электрогена) в ацетат, этанол, лактат или 2,3-бутандиол. Новые генетические программы или дополнительные катализаторы могут быть использованы для расширения спектра производимых веществ, чтобы обеспечить синтез таких продуктов как ацетон, изопрен, полиэтилен и др.
[39], рисунок адаптирован
Производство перечисленных продуктов — важное достижение, но ученые надеются, что синтетическая биология поможет увеличить список веществ, получаемых путем биоэлектросинтеза. Как показано на рисунке 10, модификация ацетогенов и создание новых генетических программ добавили к продуктам их метаболизма целый ряд соединений, которые можно использовать, например, для производства пластика и каучука. Один из интересных примеров таких разработок — новый способ биосинтеза алканов (соединений углерода, часто используемых в производстве пластика, красок и растворителей), изобретенный учеными из финского Технологического института Тампере [40]. Их подход основан на идее сотрудничества двух типов бактерий: ацетогена Acetobacterium woodii и генетически модифицированной бактерии Acinetobacter baylyi. Ацетоген, как и в предыдущих исследованиях, синтезирует ацетат. Но отличие заключается в том, что после этого ацетат поступает на следующее звено конвейера: A. baylyi, запрограммированная на производство двух необходимых ферментов, преобразует ацетат в алканы. Таким образом ученые разрешили проблему синтеза длинных углеводородных молекул, который раньше не получалось осуществить, работая исключительно с метаболизмом ацетогенов.
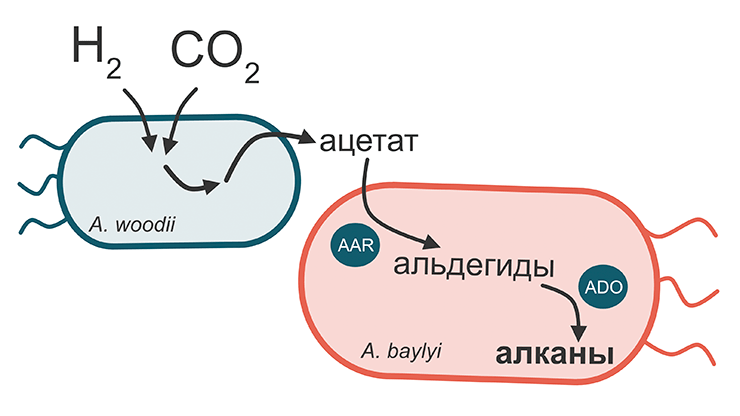
Рисунок 11. «Сотрудничество» бактерий A. woodii и A. baylyi для синтеза алканов. Ацетоген A. woodii производит ацетат, который используется бактерией А. baylyi для синтеза алканов. A. baylyi содержит плазмиду для экспрессии ферментов AAR (acyl-ACP reductase) и ADO (aldehyde deformylating oxygenase), которые катализируют необходимые реакции.
рисунок автора статьи на основе [40]
Ацетогены хорошо справляются с синтезом некоторых соединений углерода, но чтобы создавать более сложные материалы, необходимы и другие типы микроорганизмов. И ученые в который раз обратились к самой любимой в биоэлектронике бактерии: Shewanella oneidensis. Ее способность передавать электроны за пределы клетки позволила исследователям из Университета Санта Круз использовать Shewanella в реакции восстановления оксида графена [41]. Смешав в пробирке с питательной средой бактерии и оксид графена, ученые наблюдали, как жидкость постепенно темнеет, свидетельствуя об образовании графеновых пленок. Электроны, поставляемые Shewanella, участвуют в реакции восстановления, в результате которой оксид графена теряет функциональные группы, превращаясь в тонкие графеновые пластины (рис. 15). Так был разработан метод биосинтеза графена — ценного материала, имеющего высокую электропроводность и минимальную толщину в один атомный слой. Благодаря этим свойствам графен начинает получать распространение в электронике, энергетике и медицине [42]. С ним связаны надежды на создание инновационных нанотехнологий, квантовых компьютеров, микропроцессоров с высокой мощностью, непроницаемых мембран и химических сенсоров [43].
Проанализировав свойства графена, изолированного из пробирки с бактериями, ученые продемонстрировали, что он имеет хорошие электрохимические характеристики и по качеству не уступает графену, синтезированному стандартными способами. Биосинтез предлагает перспективную альтернативу прежним химическим методам, которые, как правило, дороги и экологически небезопасны. Простота разработки предполагает, что будет несложно увеличить масштаб процесса до размеров биореактора.
Биоэлектросинтез — не просто очередная инновационная идея, которая работает только в лаборатории. Некоторые компании уже сегодня используют биотехнологии для коммерческого производства материалов и химикатов. В партнерстве с китайскими производителями, компания LanzaTech в 2018 году запустила первый в мире стартап для экологичного производства этанола из углеводородных отходов [44]. Завод стартапа использует анаэробных бактерий, которые ферментируют углеродосодержащие газы (продукты выброса других предприятий) и синтезируют этанол. На основе этанола LanzaTech производит авиатопливо, дизель и другие вещества. В партнерстве с Boeing и Virginia Atlantic LanzaTech провела первый коммерческий рейс, использовавший такое топливо, полученное из индустриальных отходов [45]. Кроме топлива, LanzaTech разрабатывает технологии применения бактерий для коммерческого производства пластика, резины и других продуктов.
Если такие разработки получат широкое распространение, индустриальные отходы и парниковые газы превратятся в возобновляемый источник энергии. У предприятий появится стимул для сбора отходов в качестве полезного сырья, и это поможет уменьшить объемы выбросов. К сожалению, успех LanzaTech на сегодняшний день является скорее исключением из правила. Некоторые компании по производству зеленой энергии с помощью бактерий обанкротились, не справившись с конкуренцией. Поэтому ученые продолжают свою работу по усовершенствованию биоэлектросинтеза и надеются, что скоро эффективность технологии сможет обеспечить производителям коммерческий успех.
Дальнейшие перспективы
Я работаю в лаборатории в Университете Райса, где мы изучаем молекулярные процессы, связанные с движением электронов в клетке, и исследуем возможности создания интерфейсов между биологическими процессами и электроникой. Защищая докторскую диссертацию по биоэлектронике, один из студентов нашей лаборатории процитировал бихимика Альберта Сент-Дьёрдьи: «Жизнь — это не более чем электрон в поисках места для отдыха». Именно эта универсальность позволяет нам использовать электричество, чтобы контролировать как устройства, созданные человеком, так и живые системы. Если мы продолжим изучение свойств электрогенных бактерий, биоэлектронике откроются новые, еще более широкие перспективы. Мечты на будущее уже включают такие проекты, как синтез еды для астронавтов с помощью бактерий или создание прочных материалов для ракет [46]. Хотя некоторые утверждают, что полеты в космос — это скучно, и биоэлектроника должна помочь нам создать драконов. Но другие возражают, что гораздо лучше заставить бактерии строить нам живые дома. Но есть и ученые, которые указывают на необоснованные законы насчет ГМО во многих странах и на огромное количество нерешенных этических вопросов. На необходимость повышать планку научной осведомленности в обществе, чтобы можно было вести осмысленный диалог, который поможет нам преодолеть пропасть между захватывающими научными разработками и реальностью.
Литература
- K. Venkateswaran, D. P. Moser, M. E. Dollhopf, D. P. Lies, D. A. Saffarini, et. al.. (1999). Polyphasic taxonomy of the genus Shewanella and description of Shewanella oneidensis sp. nov.. International Journal of Systematic Bacteriology. 49, 705-724;
- Frauke Kracke, Igor Vassilev, Jens O. Krömer. (2015). Microbial electron transport and energy conservation – the foundation for optimizing bioelectrochemical systems. Front. Microbiol.. 6;
- Divya Naradasu, Waheed Miran, Mitsuo Sakamoto, Akihiro Okamoto. (2019). Isolation and Characterization of Human Gut Bacteria Capable of Extracellular Electron Transport by Electrochemical Techniques. Front. Microbiol.. 9;
- Sebastian Beblawy, Thea Bursac, Catarina Paquete, Ricardo Louro, Thomas A. Clarke, Johannes Gescher. (2018). Extracellular reduction of solid electron acceptors by Shewanella oneidensis. Molecular Microbiology. 109, 571-583;
- Michaela A. TerAvest, Caroline M. Ajo-Franklin. (2016). Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol. Bioeng.. 113, 687-697;
- Kenneth H. Nealson, Annette R. Rowe. (2016). Electromicrobiology: realities, grand challenges, goals and predictions. Microb. Biotechnol.. 9, 595-600;
- Металлическая проводимость биологических структур;
- Anselm Levskaya, Aaron A. Chevalier, Jeffrey J. Tabor, Zachary Booth Simpson, Laura A. Lavery, et. al.. (2005). Engineering Escherichia coli to see light. Nature. 438, 441-442;
- Raymond W. Bourdeau, Audrey Lee-Gosselin, Anupama Lakshmanan, Arash Farhadi, Sripriya Ravindra Kumar, et. al.. (2018). Acoustic reporter genes for noninvasive imaging of microorganisms in mammalian hosts. Nature. 553, 86-90;
- Органическая биоэлектроника: как электропроводящие полимеры помогают совмещать электронику и живые ткани;
- Stonesifer E. (2004). Common laboratory and diagnostic testing in patients with gastrointestinal disease. AACN Clin. Issues. 15, 582–594;
- Mark Mimee, Phillip Nadeau, Alison Hayward, Sean Carim, Sarah Flanagan, et. al.. (2018). An ingestible bacterial-electronic system to monitor gastrointestinal health. Science. 360, 915-918;
- Синтетическая биология: от программирования компьютеров к программированию клеток;
- Синтетическая биология: от наблюдения к вмешательству;
- Tanya Tschirhart, Eunkyoung Kim, Ryan McKay, Hana Ueda, Hsuan-Chen Wu, et. al.. (2017). Electronic control of gene expression and cell behaviour in Escherichia coli through redox signalling. Nat Commun. 8;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Philippe Gaudu, Namdoo Moon, Bernard Weiss. (1997). Regulation of thesoxRSOxidative Stress Regulon. J. Biol. Chem.. 272, 5082-5086;
- Athanasakoglou A.P. (2019). Using synthetic biology to fight environmental pollution: new insights into an old problem. PLOS Blogs;
- Pavel Dvořák, Pablo I. Nikel, Jiří Damborský, Víctor de Lorenzo. (2017). Bioremediation 3 . 0 : Engineering pollutant-removing bacteria in the times of systemic biology. Biotechnology Advances. 35, 845-866;
- Narcís Pous, Maria Dolors Balaguer, Jesús Colprim, Sebastià Puig. (2018). Opportunities for groundwater microbial electro-remediation. Microb. Biotechnol.. 11, 119-135;
- Miso Park, Shen-Long Tsai, Wilfred Chen. (2013). Microbial Biosensors: Engineered Microorganisms as the Sensing Machinery. Sensors. 13, 5777-5795;
- Ji Won Lim, Dogyeong Ha, Jongwan Lee, Sung Kuk Lee, Taesung Kim. (2015). Review of Micro/Nanotechnologies for Microbial Biosensors. Front. Bioeng. Biotechnol.. 3;
- Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области;
- Биодеградация ксенобиотиков как самозащита природы;
- Maria Strianese, Maria Staiano, Giuseppe Ruggiero, Tullio Labella, Claudio Pellecchia, Sabato D’Auria. (2012). Fluorescence-Based Biosensors. Methods in Molecular Biology. 193-216;
- Hsiao-Ying Cheng, Caroline A. Masiello, Ilenne Del Valle, Xiaodong Gao, George N. Bennett, Jonathan J. Silberg. (2018). Ratiometric Gas Reporting: A Nondisruptive Approach To Monitor Gene Expression in Soils. ACS Synth. Biol.. 7, 903-911;
- Dylan P. Webster, Michaela A. TerAvest, Devin F.R. Doud, Arun Chakravorty, Eric C. Holmes, et. al.. (2014). An arsenic-specific biosensor with genetically engineered Shewanella oneidensis in a bioelectrochemical system. Biosensors and Bioelectronics. 62, 320-324;
- L.A. Pola-López, J.L. Camas-Anzueto, A. Martínez-Antonio, M.C. Luján-Hidalgo, G. Anzueto-Sánchez, et. al.. (2018). Novel arsenic biosensor “POLA” obtained by a genetically modified E. coli bioreporter cell. Sensors and Actuators B: Chemical. 254, 1061-1068;
- Komal Agrawal, Nisha Bhardwaj, Bikash Kumar, Venkatesh Chaturvedi, Pradeep Verma. (2019). Microbial Fuel Cell. Microbial Wastewater Treatment. 175-194;
- Narcis Pous, Barbara Casentini, Simona Rossetti, Stefano Fazi, Sebastià Puig, Federico Aulenta. (2015). Anaerobic arsenite oxidation with an electrode serving as the sole electron acceptor: A novel approach to the bioremediation of arsenic-polluted groundwater. Journal of Hazardous Materials. 283, 617-622;
- Caitlyn S. Butler, Peter Clauwaert, Stefan J. Green, Willy Verstraete, Robert Nerenberg. (2010). Bioelectrochemical Perchlorate Reduction in a Microbial Fuel Cell. Environ. Sci. Technol.. 44, 4685-4691;
- M. Coma, S. Puig, N. Pous, M.D. Balaguer, J. Colprim. (2013). Biocatalysed sulphate removal in a BES cathode. Bioresource Technology. 130, 218-223;
- Nikolaos Xafenias, Yue Zhang, Charles J. Banks. (2013). Enhanced Performance of Hexavalent Chromium Reducing Cathodes in the Presence ofShewanella oneidensisMR-1 and Lactate. Environ. Sci. Technol.. 47, 4512-4520;
- Narcis Pous, Sebastià Puig, Marta Coma, Maria D. Balaguer, Jesus Colprim. (2013). Bioremediation of nitrate-polluted groundwater in a microbial fuel cell. J. Chem. Technol. Biotechnol.. 88, 1690-1696;
- Anthony J. Slate, Kathryn A. Whitehead, Dale A.C. Brownson, Craig E. Banks. (2019). Microbial fuel cells: An overview of current technology. Renewable and Sustainable Energy Reviews. 101, 60-81;
- Korneel Rabaey, René A. Rozendal. (2010). Microbial electrosynthesis — revisiting the electrical route for microbial production. Nat Rev Microbiol. 8, 706-716;
- Gugan Jabeen, Robina Farooq. (2016). Bio-electrochemical synthesis of commodity chemicals by autotrophic acetogens utilizing CO2 for environmental remediation. J Biosci. 41, 367-380;
- Harold D May, Patrick J Evans, Edward V LaBelle. (2016). The bioelectrosynthesis of acetate. Current Opinion in Biotechnology. 42, 225-233;
- FungMin Liew, Michael E. Martin, Ryan C. Tappel, Björn D. Heijstra, Christophe Mihalcea, Michael Köpke. (2016). Gas Fermentation—A Flexible Platform for Commercial Scale Production of Low-Carbon-Fuels and Chemicals from Waste and Renewable Feedstocks. Front. Microbiol.. 7;
- Tapio Lehtinen, Henri Virtanen, Suvi Santala, Ville Santala. (2018). Production of alkanes from CO2 by engineered bacteria. Biotechnol Biofuels. 11;
- Gongming Wang, Fang Qian, Chad W. Saltikov, Yongqin Jiao, Yat Li. (2011). Microbial reduction of graphene oxide by Shewanella. Nano Res.. 4, 563-570;
- Velram Balaji Mohan, Kin-tak Lau, David Hui, Debes Bhattacharyya. (2018). Graphene-based materials and their composites: A review on production, applications and product limitations. Composites Part B: Engineering. 142, 200-220;
- Brahim Aïssa, Nasir K. Memon, Adnan Ali, Marwan K. Khraisheh. (2015). Recent Progress in the Growth and Applications of Graphene as a Smart Material: A Review. Front. Mater.. 2;
- World’s first commercial waste gas to ethanol plant starts up. (2018). LanzaTech;
- Virgin Atlantic and LanzaTech celebrate as revolutionary sustainable fuel project takes flight. (2018). LanzaTech;
- Synthetic biology. (2017). NASA.