
МикроРНК с огромным влиянием — за что вручили Нобелевскую премию по медицине (2024)
08 октября 2024
МикроРНК с огромным влиянием — за что вручили Нобелевскую премию по медицине (2024)
- 2557
- 0
- 11
Виктор Эмброс и Гэри Равкун — лауреаты Нобелевской премии по физиологии и медицине 2024 года.
Рисунок в полном размере.
коллаж автора на основе иллюстрации Нобелевского комитета
-
Автор
-
Редакторы
Нарушения в работе микроРНК стимулируют развитие раковых опухолей, но без этих молекул наш организм вообще не сможет нормально развиваться. Сегодня лаборатории, где исследуют микроРНК, работают в каждом приличном научном центре, хотя их первое исследование увидело свет всего 31 год назад. Нобелевскую премию по физиологии и медицине в 2024 году получили ученые, которые первыми обнаружили, насколько микроРНК влияют на все живые организмы. В этой статье мы расскажем историю открытия, которое изменило современную биологию.
Жизнь любой клетки определяет набор генов, с которых считывается информация: полный их комплект (практически) идентичен в любой из клеток организма, а вот какое подмножество будет активно — за этим и стоит индивидуальность. Фрагменты генетических последовательностей, по которым как по инструкции будут собираться белки, переносятся в матрице мРНК. В целом, весь процесс, начиная с транскрипции РНК и заканчивая синтезированными по ним белками, называют экспрессией генов. До открытия нынешних нобелевских лауреатов считалось, что ее могут регулировать только белки, которые влияют на считывание информации конкретных генов в ядре.
История открытия
Виктор Эмброс и Гэри Равкун работали над C. elegans: маленьким червем, очень удобным для генетических исследований — почитайте про него и вы: «Модельные организмы: нематода» [1]. Эмброс был занят мутантом по гену lin-4: из-за нарушений в нем у червей не развивались целые органы, включая вульву, из-за чего яйца накапливались внутри червей и привлекали внимание исследователей (рис. 1). Это объясняли тем, что lin-4 служит переключателем между разными этапами развития червя. Из-за сбоя в нем некоторые генетические программы зацикливаются, а другие не запускаются вовсе. В это же время Гэри Равкун озадачился похожей проблемой — он работал с мутантом по гену lin-14, черви с нарушением которого пропускали личиночную стадию развития и не вырастали до нормальных размеров (рис. 1) [2].
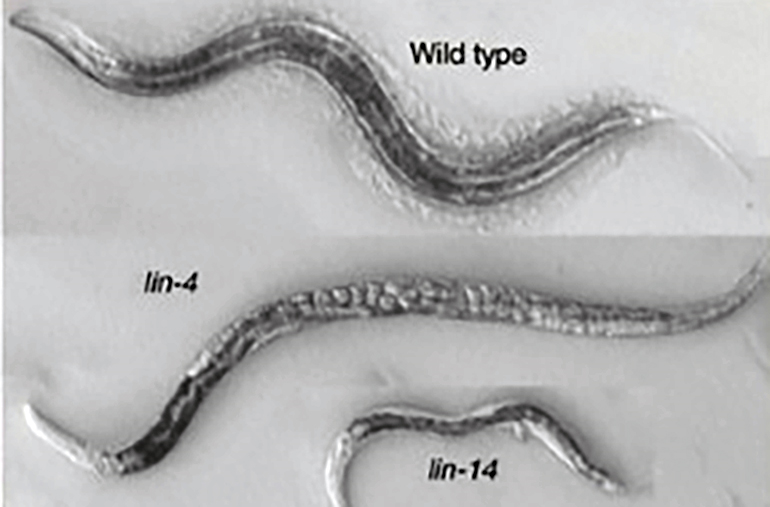
Рисунок 1. Черви Эмброса и Равкуна: мутанты C. elegans lin-4 и lin-14 с нарушенным развитием. Мутанты по гену lin-4 накапливают яйца без формирования вульвы, в то время как мутанты по гену lin-14 не вырастают до нормальных размеров и пропускают стадию личинки в развитии.
В поисках ответов Эмброс и Равкун прочитали последовательность двух «влиятельных» генов («Биомолекула» рассказывала о секвенировании [3]), а затем сравнили их друг с другом. Оба ученых заметили необычное совпадение между частями lin-4 и lin-14: элементы lin-4 были комплементарны фрагменту lin-14. Добавляло странности и то, что эти участки не кодировали никаких белков, но изменения именно в них нарушали развитие C. elegans. Исследователи понимали, что lin-4 подавлял экспрессию lin-14, но не было ясно, как такое возможно — вроде у гена же нет продукта?
В лаборатории Эмброса были заняты тем, что происходит с некодирующим, но таким важным участком lin-4. Он был слишком короток для кодирования белка, но тем не менее РНК на его матрице синтезировалась — то есть этот ген не такой уж и некодирующий: не кодирует он только белок, а вот короткую РНК очень даже кодирует. РНК была и впрямь коротка: всего 21 нуклеотид; поэтому ее назвали микроРНК (microRNA, miRNA). Совпадение между фрагментами lin-4 и lin-14 подсказало, что микроРНК lin-4 может связываться с мРНК lin-14. Да, комплементарный фрагмент lin-14 не кодировал белок, но в матрицу мРНК он с гена копировался. Эксперименты подтвердили, что микроРНК lin-4 может находить мРНК lin-14 именно благодаря этой некодирующей регуляторной части.
Эмброс и Равкун опубликовали исследования мутантов C. elegans в научном журнале Cell в 1993 году [4], [5]. Тогда открытие нового способа регуляции экспрессии генов не вызвало немедленного фурора. Он выглядел так необычно, что его сочли экзотикой, особенностью нематод, очередной причудой природы. Дело в том, что ген lin-4 был найден только среди этой группы червей, и вроде бы никак не касался прочих организмов.
Открытия продолжаются
В 2000 году Равкун опубликовал данные о гене let-7 [6] — он также кодировал регуляторную микроРНК, которая переключала C. elegans с личиночной стадии развития. Но let-7 уже был распространен среди самых разных животных, от дрозофилы до человека. Исследование заставило признать, что микроРНК — важные регуляторы экспрессии генов не только у червей.
На сегодняшний день только в геноме человека выявлено больше тысячи генов с последовательностями микроРНК, и они контролируют экспрессию более 60% генов! В первых исследованиях предполагали, что микроРНК влияют на экспрессию генов только в многоклеточных организмах. Биологи знали, что микроРНК служат переключателями, которые направляют дифференцировку клеток. Поэтому, думали они, организмам из одной клетки микроРНК не нужны. Однако в 2007 году всех удивили публикации о десятках микроРНК одноклеточной водоросли хламидомонады [7], [8]. В том числе среди них обнаружились переключатели, отвечающие за производство гамет — «Биомолекула» рассказывала об этом открытии [9]. Теперь же мы знаем, что микроРНК так давно управляют экспрессией генов, что даже вирусы используют их для заражения и распространения [10]. Бактерии также имеют арсенал микроРНК и используют его уже для защиты от бактериофагов. «Биомолекула» рассказывала об этом и о микроРНК, которые работают в патологическом для человека холерном вибрионе [11].
К сегодняшнему дню мы знаем о сборке и работе микроРНК в деталях. После ряда преобразований она объединяется с несколькими белками в RISC (RNA-induced silencing complex — РНК-индуцируемый комплекс выключения гена). Комплекс «ловит» мРНК с комплементарными их микроРНК фрагментами и «разрезает» их или мешает синтезировать с них белок (рис. 2) [12]. В результате белок с мРНК не считывается, и мРНК уничтожается. То есть экспрессия гена нарушается, даже если мРНК синтезируется с него нормально. Этот процесс может выглядеть как «костыль», но он регулирует судьбу клеток и развитие организма в целом. «Биомолекула» подробно рассказала о многих исследованиях, связанных с микроРНК, мы привели их во врезке ниже.
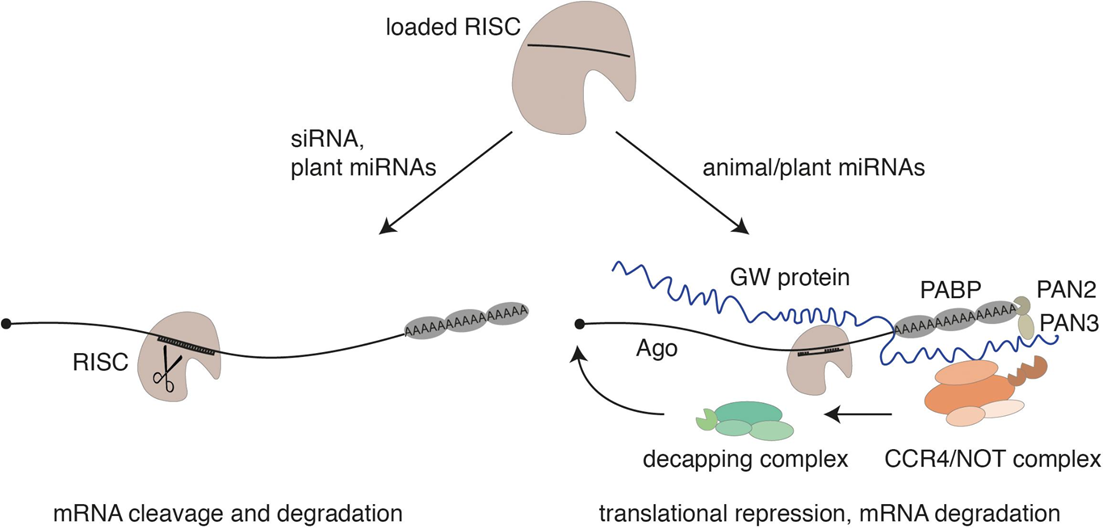
Рисунок 2. Механизм подавления работы мРНК комплексом RISC.
Слева: в случае идеальной комплементарности киРНК или миРНК (что часто наблюдается у растений) мРНК расщепляется комплексом RISC напрямую.
Справа: у животных микроРНК лишь частично комплементарны своим целевым РНК, поэтому расщепить мРНК помогают белки семейства GW. Они привлекают поли-(A)-связывающие белки (PABP) или комплексы деаденилазы PAN2/PAN3 и CCR4/NOT. Они сначала лишают мРНК фрагментов, которые защищали ее от уничтожения, и затем она уничтожается.
МикроРНК в терапии рака
Нарушение экспрессии и регуляции микроРНК наблюдается при многих расстройствах здоровья: болезни Альцгеймера, вирусных инфекциях, аутоиммунных, воспалительных и даже психиатрических заболеваниях. Активнее всего исследуется вовлечение микроРНК в онкогенез. Если сосредоточиться на их влиянии, то можно сказать, что нормальное состояние клетки — следствие баланса между действием разных микроРНК. С одной стороны — онкогенные микроРНК, с другой — микроРНК, подавляющие развитие опухолевых клеток. Тогда онкологическое заболевание — это смещение баланса. Связь этого дисбаланса со многими видами раками уже подтверждена [13]. «Биомолекула» подробно разбирала эту тему: «МикроРНК в канцерогенезе: тонкая грань между спасением и разрушением» [14] и «МикроРНК участвуют в регуляции метастазирования опухолей» [15]. Конечно, разработчики терапий стремятся настроить эти процессы так, чтобы вернуть всё в нормальное состояние.
На сегодня почти три десятка терапевтических молекул на основе микроРНК дошли до клинических исследований на человеке. Как правило, пока что в результате выясняется, что мы еще знаем недостаточно, чтобы применять их на людях. Например, проверка выглядевшего очень перспективно препарата MRX34 окончилась неудачей. Это препарат на основе РНК, которая имитирует действие микроРНК-34а — важного супрессора опухолей. Выработка микроРНК-34а часто подавлена при развитии таких типов рака, как немелкоклеточный рак легких, гепатоцеллюлярная карцинома, рак толстой кишки, рак яичников и рак шейки матки. Молекулы MRX34 же должны были тормозить процессы в раковых клетках. К сожалению, их применение вызвало опасные иммунные реакции, из-за чего несколько пациентов погибли. Ряд таких неудач подчеркивает влияние микроРНК на жизненно важные процессы. Это мотивирует ученых лучше изучить их функции, чтобы создать новые безопасные и эффективные лекарства.
Подготовлено на основе пресс-релиза Нобелевского комитета.
Литература
- Модельные организмы: нематода;
- Victor Ambros. (2008). The evolution of our thinking about microRNAs. Nat Med. 14, 1036-1040;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Rosalind C. Lee, Rhonda L. Feinbaum, Victor Ambros. (1993). The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 75, 843-854;
- Bruce Wightman, Ilho Ha, Gary Ruvkun. (1993). Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 75, 855-862;
- Brenda J. Reinhart, Frank J. Slack, Michael Basson, Amy E. Pasquinelli, Jill C. Bettinger, et. al.. (2000). The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature. 403, 901-906;
- T. Zhao, G. Li, S. Mi, S. Li, G. J. Hannon, et. al.. (2007). A complex system of small RNAs in the unicellular green alga Chlamydomonas reinhardtii. Genes & Development. 21, 1190-1203;
- Attila Molnár, Frank Schwach, David J. Studholme, Eva C. Thuenemann, David C. Baulcombe. (2007). miRNAs control gene expression in the single-cell alga Chlamydomonas reinhardtii. Nature. 447, 1126-1129;
- МикроРНК впервые обнаружены в одноклеточном организме;
- Patrice Bruscella, Silvia Bottini, Camille Baudesson, Jean-Michel Pawlotsky, Cyrille Feray, Michele Trabucchi. (2017). Viruses and miRNAs: More Friends than Foes. Front. Microbiol.. 8;
- Большие дела небольших молекул: как малые РНК дирижируют генами бактерий;
- Julia Neumeier, Gunter Meister. (2021). siRNA Specificity: RNAi Mechanisms and Strategies to Reduce Off-Target Effects. Front. Plant Sci.. 11;
- Kaladhar B Reddy. (2015). MicroRNA (miRNA) in cancer. Cancer Cell Int. 15;
- МикроРНК в канцерогенезе: тонкая грань между спасением и разрушением;
- МикроРНК участвуют в регуляции метастазирования опухолей;
- Обо всех РНК на свете, больших и малых;
- Кодирующие некодирующие РНК;
- Есть ли смысл в антисенсах?;
- РНК-интерференция: повторный успех.






