
Модельные организмы: данио рерио
05 августа 2020
Модельные организмы: данио рерио
- 3342
- 0
- 6
Август с данио рерио — «рабочей зеброй» экспериментальной биологии
иллюстрация Ксении Сайфулиной
-
Авторы
-
Редакторы
-
Иллюстратор
Темы
«Границы ключ переломлен пополам...» Многие морские водоемы из предыдущего выпуска нашего сериала по известным всем причинам оказались недоступными. Давайте погрузимся в пресную воду вместе с героиней очередного листа календаря — рыбкой данио рерио. В далекую доинтернетную эпоху каждый интересующийся биологией школьник нес домой в полиэтиленовом пакете аквариумных рыбок с птичьего рынка. Среди них были жители тропических Америк — пецилии, меченосцы, гуппи, — и азиаты — данио, барбусы, гурами. Никто не мог предполагать, что одна из этих декоративных рыбок уже через пару десятков лет будет полноправным участником исследований в биологии развития и нейронауках, помогать лечить болезни сердца и рак!
Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!
Первая рыбка — моя! — Зебрафиш, или дамский чулок — Скоростное развитие — Рыбка лечит человека — Но у нее же нет легких!
Несмотря на многообразие костных рыб, больше двухсот лет основной биологической моделью из этой группы была знакомая многим золотая рыбка — одомашненная разновидность золотого карася (Carassius auratus). Она помогла сделать важные открытия в области биологии развития и иммунологии. На поле модельных рыбок были и есть и другие игроки, причем из разных отрядов лучеперых рыб. Среди них японская оризия, или медака, (Oryzias latipes) из отряда сарганообразные , трехиглая колюшка (Gasterosteus aculeatus) из скорпенообразных, зеленый меченосец (Xiphophorus hellerii) из карпозубообразных и прочие [1]. В 1960 году американский исследователь Джордж Стрейзингер, страстный поклонник тропических рыбок, выбрал новый объект для своих работ по изучению эмбрионального развития позвоночных [2]. Им оказалась обычная обитательница многих любительских аквариумов — рыбка данио рерио (Danio rerio), которая за свой полосатый окрас на английском называется zebrafish. Вообще с названиями на русском языке у этой рыбки дела не очень. Общепринятого названия у нее, похоже, так и не возникло. «Данио» и «данио рерио» звучат благозвучно, копируя латынь. На заре отечественной аквариумистики любители пытались придумать рыбке русское название. Получилось так себе — «дамский чулок». Наконец, в новейшей истории исследователи иногда называют этих рыбок неуклюжей калькой с английского — «зебрафиш» — и даже «зебраданио» по одному из вариантов латинского названия рода.
Самый известный нам представитель этого отряда — сайра, имеющая большое промысловое значение.
Новая экспериментальная модель далеко не сразу привлекла других исследователей, но сейчас, из-за нескольких удобных особенностей, о которых мы расскажем дальше, данио — одно из самых распространенных модельных животных. С помощью этих рыб исследуют развитие позвоночных, их иммунитет, физиологию, а также воздействие на эмбрионы и взрослых животных токсинов и лекарственных средств. Рыбки участвуют в опытах по исследованию поведенческих реакций в разных обстоятельствах. И, конечно, данио — прекрасный объект для генетических исследований, которые занимают особое место в жизни одного из соавторов этого материала.
Как же данио рерио освоил почти все ниши экспериментальной биологии? Причина в исключительном удобстве содержания и наблюдения за этими рыбами. Развитие данио от икринки (яйца) до малька (эмбриона) занимает всего три дня. С относительно большими и прозрачными эмбрионами легко производить манипуляции. Взрослые особи небольшие — помещаются в спичечный коробок — и неприхотливы к условиям содержания. У данио высокая репродуктивная способность [3] — при оптимальных условиях они способны выметать до трехсот икринок в неделю! Представьте, что вы работаете над кандидатской диссертацией, где в качестве модели нужно использовать позвоночных. И уже за первый год работы у вас есть шансы получить данные на сотнях и даже тысячах особей, тогда как ваш коллега из соседней лаборатории только получил нужную линию мышей и приступил к экспериментам!
Это, конечно, шутка. Любой модельный организм в чем-то уникален и приспособлен в науке для своих целей.
Более широкое применение по сравнению с другими модельными видами рыб данио получили за счет возможности масштабирования экспериментов с ними путем высокопроизводительного анализа. Коммерческие компании предлагают готовые решения по размещению аквариумов с различными вариантами автоматизации [4], и это позволяет небольшой группе исследователей работать сразу с тысячами организмов (рис. 1).

Рисунок 1. Аквариумная система одной из лабораторий, работающих с данио рерио. В каждом аквариуме (танке) могут содержаться от десятков до сотен рыбок.
В 2003 году, вскоре после обнародования генома человека, был получен первый вариант генома данио рерио. Затем стартовал проект, в котором по очереди выключали («нокаутировали») все белок-кодирующие гены рыбы и определяли фенотипы полученных мутантов [5]. Например, данио в норме способны к регенерации желудочков сердца после их частичного удаления. Инактивирующие мутации в гене ttk, кодирующем фермент киназу Mps1, один из регуляторов клеточного цикла, приводят к потере такой сверхспособности [6]. А ведь сходный ген есть и у человека, и он тоже участвует в регенерации, правда, мы к ней способны гораздо меньше, чем рыбки.
Позднее исследователи обнаружили в геноме данио более 150 генов, кодирующих микроРНК [7], общих для всех известных позвоночных организмов. Без этих РНК развитие эмбриона идет неправильно, а иногда останавливается на одном из этапов [8]. Мутируя гены данио, а также иногда добавляя в геном рыбки участки чужой ДНК — трансгены, — исследователи смогли подробно исследовать развитие всех ее тканей и органов. Так, на протяжении тридцати лет данио рерио служит основной моделью в биологии развития. Недавно созданные методы анализа транскриптомов (всей совокупности РНК) или полного генома единичных клеток [9] немедленно применили к клеткам и тканям данио (рис. 2). И сейчас в распоряжении исследователей есть целые атласы развития этой рыбки, по которым можно отследить изменения профиля генной экспрессии от оплодотворенной яйцеклетки к тканям взрослого животного [10], [11].
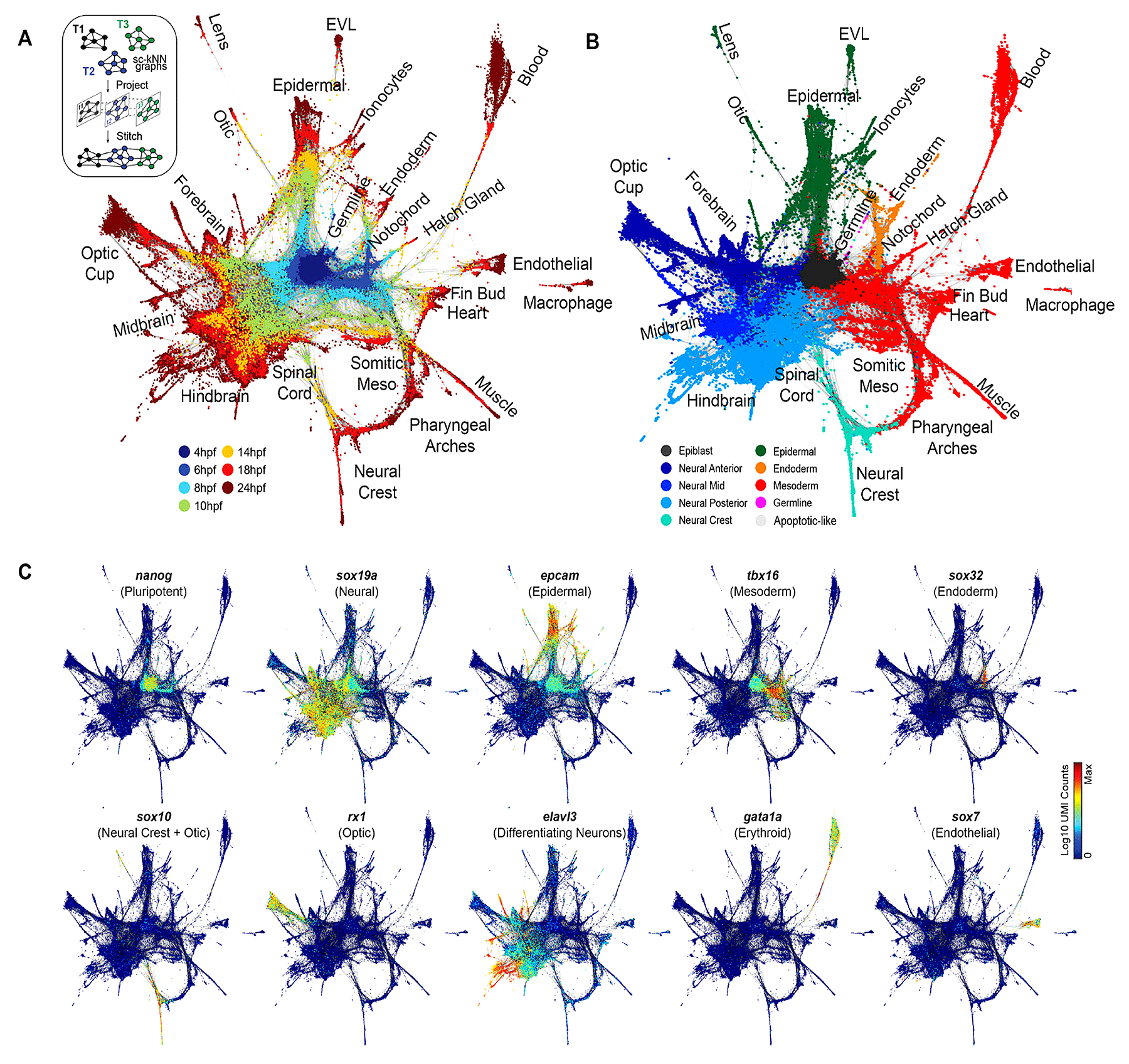
Рисунок 2. С помощью методов секвенирования единичных клеток можно отследить, как происходит развитие тканей и органов
Теперь перейдем к любимой теме одного из авторов этого эссе, который работает врачом-генетиком. Как рыбка данио помогла понять природу генетических заболеваний человека и даже подступиться к их эффективному лечению?
Несмотря на многие миллионы лет, прошедшие с разделения наших видов, данио рерио и человек имеют 70% ортологичных генов [12]. В том числе, в геноме рыбки находятся гомологи 80% генов, ответственных у человека за наследственные моногенные заболевания [13]. Среди последних известно несколько сотен тяжелых неврологических болезней, одна из которых — спинальная мышечная атрофия (СМА) [14], [15]. Самая частая причина СМА — гомозиготная делеция 7-го и 8-го экзонов в гене Smn1, что приводит к разрушению альфа-мотонейронов спинного мозга и, в итоге, к смертельному заболеванию [16]. Исследователи смогли смоделировать этот синдром на линии данио с «нокаутом» гена Smn1 и заодно обнаружили другие гены, которые могут влиять на развитие заболевания. Одним из них оказался ген белка пластина-3 (PLS3). Усиление экспрессии этого гена и синтеза соответствующего белка в экспериментах снижало проявление нервно-мышечной симптоматики [17], [18]. Обнаружение таких генов-модификаторов может, с одной стороны, помочь глубже понять механизм развития наследственного синдрома, а с другой — предоставить новые потенциальные мишени для терапевтического воздействия.
Другой пример использования модели данио в области медицинской генетики — поиск терапии наследственного синдрома Драве. Это заболевание вызвано патогенными мутациями в гене SCN1A, кодирующем одну из субъединиц потенциал-зависимого натриевого канала нейронов головного мозга [19]. У детей с синдромом Драве обычно на фоне полного благополучия в возрасте 1–2 лет «дебютируют», как принято выражаться в медицине, приступы судорожной активности. После начала приступов происходит регресс психоречевого развития, нарушаются двигательные функции. Проблема в том, что судороги при синдроме Драве не снимаются обычными противоэпилептическими препаратами.
Подробнее о работе подобных ионных каналов можно прочитать в статье «Нейробиология» [20] нашего спецпроекта «12 методов молекулярной биологии».
Поэтому исследователи решили выбрать потенциальное лекарство от этого синдрома путем перебора множества известных соединений. А в качестве модели выбрали линию-мутант данио рерио, имитирующую человеческий синдром Драве. Оказывается, у таких рыбок так же, как и у пациентов, возникает эпилептическая активность. Рыбьи приступы можно отслеживать с помощью автоматической системы, которая наблюдает за движениями мальков в каждой отдельной лунке планшета (рис. 3). В ходе работы исследовали более тысячи соединений, которые могли влиять на судорожные приступы. Из них только двадцать смогли продемонстрировать возвращение двигательного поведения до состояния контрольных, здоровых мальков. Всего четыре вещества из двадцати оказались при этом нетоксичными. Их воздействие исследовали более пристально, снимая рыбкам электроэнцефалограммы. В итоге, только диметадион — антагонист кальциевых каналов Т-типа — обеспечил больным малькам нормальную энцефалограмму [21]. В этом примере из тысячи веществ был выбран для дальнейшего исследования только один препарат. Представьте, что у человека известно больше тысячи генов, мутации в которых вызывают эпилептические приступы. Работы у нашей рыбки хватит еще надолго. Обратите внимание, что в этой работе, с учетом всех повторов, использовалось несколько тысяч особей данио! Насколько же проще было сделать такой эксперимент на рыбках, чем на известных модельных млекопитающих.
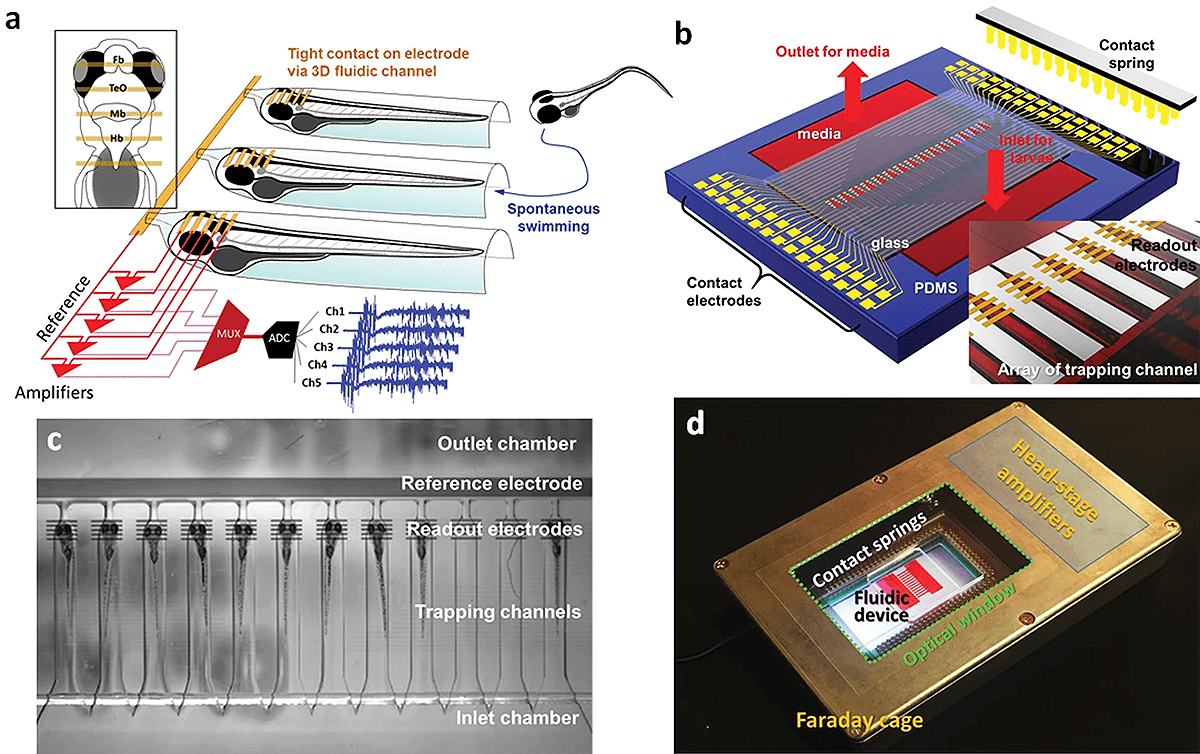
Рисунок 3. Технологическая платформа для исследований электрической активности головного мозга данио рерио
Данио — хорошая модель не только для редких наследственных, но и для распространенных заболеваний. Например, проблемы подбора лекарственной терапии существуют и для некоторых злокачественных опухолей. Живучие, адаптируемые к воздействию рыбки специальных линий позволяют пересадить им культуры опухолевых клеток от пациентов (рис. 4). Так буквально за несколько дней удается протестировать на реальных опухолях эффекты разных лекарственных препаратов [22]. Помимо рака, на рыбках исследуют такие связанные друг с другом состояния как инсулиннезависимый диабет и ожирение [23], [24].
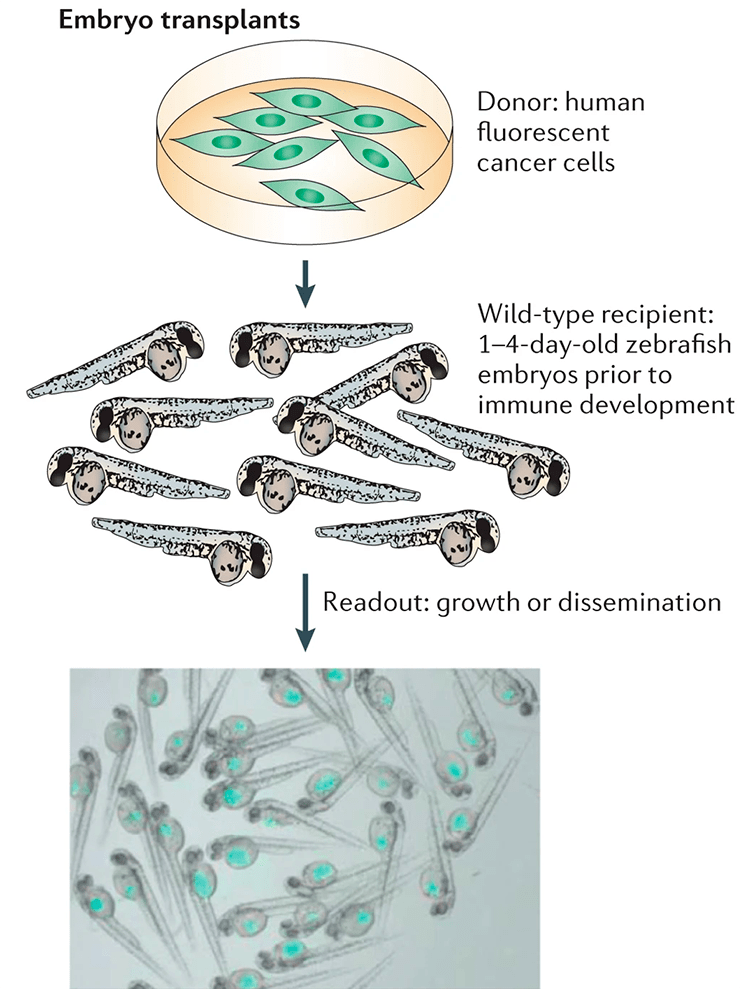
Рисунок 4. Трансплантация клеток опухоли пациента для последующего лекарственного скрининга
Может быть, все физиологические и патологические процессы нашего организма нужно воссоздавать на этой прекрасной модели? Отметим, что у нее все же есть ограничения. Например, дыхательная система рыб, как читатели хорошо знают, принципиально отличается от нашей. Совсем иначе у них работает и выделительная система. Однако, для обширного поля экспериментов на данио остаются более общие для позвоночных процессы — тканевое развитие, нервная деятельность, воспаление, регенерация, неспецифический иммунитет и другие.
Данио — это первое позвоночное в нашем хит-параде, и насколько же хорошо это неприхотливое, быстро размножающееся существо моделирует болезни человека! Дальше — больше, нас ждут еще более близкие родственники. В следующей серии это, по сути, четвероногое — великая и ужасная шпорцевая лягушка Xenopus laevis.

Рисунок 5. Данио рерио — герой календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. На тех, кто успел приобрести календарь, фаг уже взирает со стенки, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте на стенку! Ну а кто всё же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
иллюстрация Ксении Сайфулиной
Литература
- Laia Ribas, Francesc Piferrer. (2014). The zebrafish (Danio rerio) as a model organism, with emphasis on applications for finfish aquaculture research. Rev Aquacult. 6, 209-240;
- Walker C. and Streisinger G. (1983). Induction of mutations by gamma-rays in pregonial germ cells of zebrafish embryos. Genetics. 103, 125–136;
- Westerfield M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio) (4th Edition). Univ. of Oregon Press, Eugene, 2000;
- Filip Miscevic, Ori Rotstein, Xiao-Yan Wen. (2012). Advances in Zebrafish High Content and High Throughput Technologies. CCHTS. 15, 515-521;
- Kerstin Howe, Matthew D. Clark, Carlos F. Torroja, James Torrance, Camille Berthelot, et. al.. (2013). The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503;
- K. D. Poss. (2002). Heart Regeneration in Zebrafish. Science. 298, 2188-2190;
- Обо всех РНК на свете, больших и малых;
- E. Wienholds. (2005). MicroRNA Expression in Zebrafish Embryonic Development. Science. 309, 310-311;
- Секвенирование единичных клеток (версия — Metazoa);
- Daniel E. Wagner, Caleb Weinreb, Zach M. Collins, James A. Briggs, Sean G. Megason, Allon M. Klein. (2018). Single-cell mapping of gene expression landscapes and lineage in the zebrafish embryo. Science. 360, 981-987;
- Monica Tambalo, Richard Mitter, David G. Wilkinson. (2020). A single cell transcriptome atlas of the developing zebrafish hindbrain. Development. 147, dev184143;
- Ross N. W. Kettleborough, Elisabeth M. Busch-Nentwich, Steven A. Harvey, Christopher M. Dooley, Ewart de Bruijn, et. al.. (2013). A systematic genome-wide analysis of zebrafish protein-coding gene function. Nature. 496, 494-497;
- Máté Varga, Dorottya Ralbovszki, Eszter Balogh, Renáta Hamar, Magdolna Keszthelyi, Kálmán Tory. (2018). Zebrafish Models of Rare Hereditary Pediatric Diseases. Diseases. 6, 43;
- Надежда для СМАйликов;
- Самое дорогостоящее лекарство в мире;
- Suzie Lefebvre, Lydie Bürglen, Sophie Reboullet, Olivier Clermont, Philippe Burlet, et. al.. (1995). Identification and characterization of a spinal muscular atrophy-determining gene. Cell. 80, 155-165;
- L. T. Hao, M. Wolman, M. Granato, C. E. Beattie. (2012). Survival Motor Neuron Affects Plastin 3 Protein Levels Leading to Motor Defects. Journal of Neuroscience. 32, 5074-5084;
- Michelle L. McWhorter, Umrao R. Monani, Arthur H.M. Burghes, Christine E. Beattie. (2003). Knockdown of the survival motor neuron (Smn) protein in zebrafish causes defects in motor axon outgrowth and pathfinding. Journal of Cell Biology. 162, 919-932;
- Lieve Claes, Jurgen Del-Favero, Berten Ceulemans, Lieven Lagae, Christine Van Broeckhoven, Peter De Jonghe. (2001). De Novo Mutations in the Sodium-Channel Gene SCN1A Cause Severe Myoclonic Epilepsy of Infancy. The American Journal of Human Genetics. 68, 1327-1332;
- 12 методов в картинках: нейробиология;
- Matthew T. Dinday, Scott C. Baraban. (2015). Large-Scale Phenotype-Based Antiepileptic Drug Screening in a Zebrafish Model of Dravet Syndrome. eneuro. 2, ENEURO.0068-15.2015;
- Jianhong Lin, Weihong Zhang, Jian-Jun Zhao, Ariel H. Kwart, Chun Yang, et. al.. (2016). A clinically relevant in vivo zebrafish model of human multiple myeloma to study preclinical therapeutic efficacy. Blood. 128, 249-252;
- Takehiko Oka, Yuhei Nishimura, Liqing Zang, Minoru Hirano, Yasuhito Shimada, et. al.. (2010). Diet-induced obesity in zebrafish shares common pathophysiological pathways with mammalian obesity. BMC Physiology. 10, 21;
- Bo Chen, Yang-Min Zheng, Jing-Pu Zhang. (2018). Comparative Study of Different Diets-Induced NAFLD Models of Zebrafish. Front. Endocrinol.. 9;
- SoonGweon Hong, Philip Lee, Scott C. Baraban, Luke P. Lee. (2016). A Novel Long-term, Multi-Channel and Non-invasive Electrophysiology Platform for Zebrafish. Sci Rep. 6;
- Richard White, Kristin Rose, Leonard Zon. (2013). Zebrafish cancer: the state of the art and the path forward. Nat Rev Cancer. 13, 624-636.







