
Модельные организмы: фаг лямбда
07 января 2020
Модельные организмы: фаг лямбда
- 4596
- 4
- 13
Герой января: фаг лямбда
иллюстрация Ксении Сайфулиной
-
Автор
-
Редакторы
-
Иллюстратор
Неутомимо начнем Новый год с фага лямбда. Еще не успеют степлиться последние капли недопитого шампанского на кухне — а фаг уже с вами. И, когда вы ближе к вечеру откроете телефон или комп, фаг уже будет смотреть на вас своими голубыми-голубыми глазами... Стоп, какие еще глаза у фага?! Может, и никаких — всё это было для привлечения внимания к нашей первой публикации в цикле о модельных организмах. Вперед!
Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!
Беглый молекулярный каскад — Лизис и лизогения — Самый первый геном — Эстер Ледерберг — Стимпанк — Вирус кишечной палочки
Свой рассказ я начинаю с вируса. Вирус, как говорят учебники, это простейшая форма жизни. А живой ли он? Есть обоснованное мнение, что вирус получает свойства живого, «оживает», только когда попадает внутрь клетки. Действительно, размножение этого внутриклеточного паразита возможно только внутри клетки, где он использует клеточные ресурсы. На мой взгляд, более точно вирус можно назвать не организмом, а странствующим молекулярным каскадом.
А раз вирус такой примитивный, он, что, самый эволюционно древний в нашем списке? Скорее всего, нет, поскольку не способные к самостоятельной жизни вирусы возникли вторично как паразиты бактерий. Как известно любому молекулярному биологу, геном бактериальных клеток можно изменить, грубо говоря, добавив в среду с клетками ничем не приправленные куски ДНК. Этот метод назвали трансформацией. Путешествующие (правда, с низкой эффективностью) из клетки в клетку куски ДНК в какой-то момент научились носить с собой — в виде геномного кода и реальной белковой оболочки — молекулярный каскад для собственного воспроизводства. Процесс передачи генетического материала с помощью такой конструкции назвали специальным термином — «трансдукция».
Фаг λ (лямбда) и его открытие связаны с другим модельным организмом из нашего бестиария: он паразитирует на энтеробактерии — кишечной палочке Escherichia coli. Именно поэтому его точное биологическое название — вирус лямбда эшерихии. В самом начале наблюдений за никак не охарактеризованным тогда патогенным агентом бактерий выяснили, что он может действовать на клетки бактерии двояко. В одних случаях, попав в них, вирус быстро размножается и выходит наружу в виде частиц, разрушая клетки. Эту реакцию назвали литической, а сам процесс — лизисом. В других ситуациях вирус как будто куда-то исчезал без видимого вреда для клеток. На самом деле его крошечный геном из линейной двухцепочечной ДНК встраивался в специальное место в геноме бактерии, где и таился в виде профага до неблагоприятной ситуации. Такое поведение назвали лизогенией. Если бы всякое нападение вируса заканчивалось лизисом, клетки-мишени бы, наверное, вымерли, а за ними — и сам паразит.
Благодаря лизогении удалось изучить важные механизмы генетической рекомбинации . Всё, что делают вирусы с клетками, украдено у самих клеток. Ведь вирусы — это беглые клеточные молекулярные каскады. Поэтому данные, полученные на вирусах, как правило, пригождаются для всей клеточной науки. Маленький, но информационно насыщенный геном фага лямбда длиной всего около 50 тысяч нуклеотидных пар был первым самостоятельным геномом, полную последовательность которого определил человек. Этот геном не был секвенирован целенаправленно в промышленном стиле, как это делается сейчас [1], а скорее, компилирован из большого количества работ по генетике фага. Подробная карта генома была представлена в 1983 году [2].
Как читатель уже, должно быть, понял, огромный пласт молекулярной биологии открыли на вирусах. Но нельзя же про всё это рассказать в одной небольшой заметке. Поэтому за наглядными, но поучительными началами молекулярной биологии мы направляем вас к нашему одноименному иллюстрированному материалу [3]. — Ред.
Вначале бактериофаги изучали как минимальную действующую молекулярную модель, просто потому что с ней могли иметь дело методы того времени. Сегодня интерес к ним подпитывается многими общественно значимыми направлениями науки и техники. Например, ставший сейчас притчей во языцех молекулярный каскад, пригодный для редактирования геномов — CRISPR-Cas, — возник в бактериях в качестве системы адаптивного иммунитета. Он призван природой резать ДНК напавших на клетку бактериофагов, а вовсе не геномы подопытных существ под твердой рукой демиурга. Бактериофаги также исследуются на предмет борьбы с бактериями, патогенными для человека и животных. Сегодня серьезной проблемой стала устойчивость бактериальных штаммов, циркулирующих в населенных человеком местах, к большинству групп антибиотиков [4]. Лечение бактериофагами всерьез рассматривают как альтернативу химиотерапии устойчивых к антибиотикам бактериальных инфекций. Неспецифические штаммы бактериофагов использовали в советской медицине еще с середины прошлого века. Сейчас, несмотря на некоторый скептицизм в этой области [5], наблюдается взрыв интереса к препаратам на основе бактериофагов, которые проходят клинические испытания по современным принципам доказательной медицины [6]. Одно из таких испытаний совсем недавно привело к излечению тяжелой микобактериальной инфекции у подростка с муковисцидозом [10]. Отмечу, что сегодня фаговая терапия становится персонализированной, когда состав препарата подбирают или конструируют, зная особенности возбудителя инфекции у каждого конкретного пациента.
Частица бактериофага элегантно сконструирована, несмотря на скромный набор составных элементов: геном вируса лямбда кодирует всего 12–14 отдельных белков. Фаг напоминает футуристического робота или, наоборот, деталь старинного механизма. Неслучайно частица бактериофага вдохновляет художников и дизайнеров в стиле стимпанк, которые охотно используют мотивы этого вируса в своих картинах и принтах (рис. 2).
Рисунок 2. Бактериофаг в стиле стимпанк. Для точности заметим, что прототипом для него, похоже, был не фаг лямбда.
Вернусь к основной теме нашего рассказа. Почему именно фаг лямбда считается модельным (рис. 3)? Ведь биосферу, по оценкам, населяют десятки миллионов разных видов бактериофагов общей численностью 1031 экземпляров [8]. Всё просто — это же вирус эшерихии, то есть кишечной палочки. Именно она на момент его открытия утвердилась в качестве главной модельной бактерии. И поражающий ее фаг автоматически стал модельным. Не стоит при этом думать, что это единственный модельный бактериофаг. Например, другой вирус эшерихии, T4, использовался в знаменитой работе Крика и соавторов, где они доказали триплетный характер генетического кода [9].
Поговорили о вирусе, а вначале-то, наверное, надо было узнать больше о том, кого он заражает? Ведь вирус вторичен, а клетка первична. Но ничего, терпеть осталось недолго. Следующая статья спецпроекта выйдет через месяц и как раз и расскажет о кишечной палочке — хозяйке бактериофага лямбда.
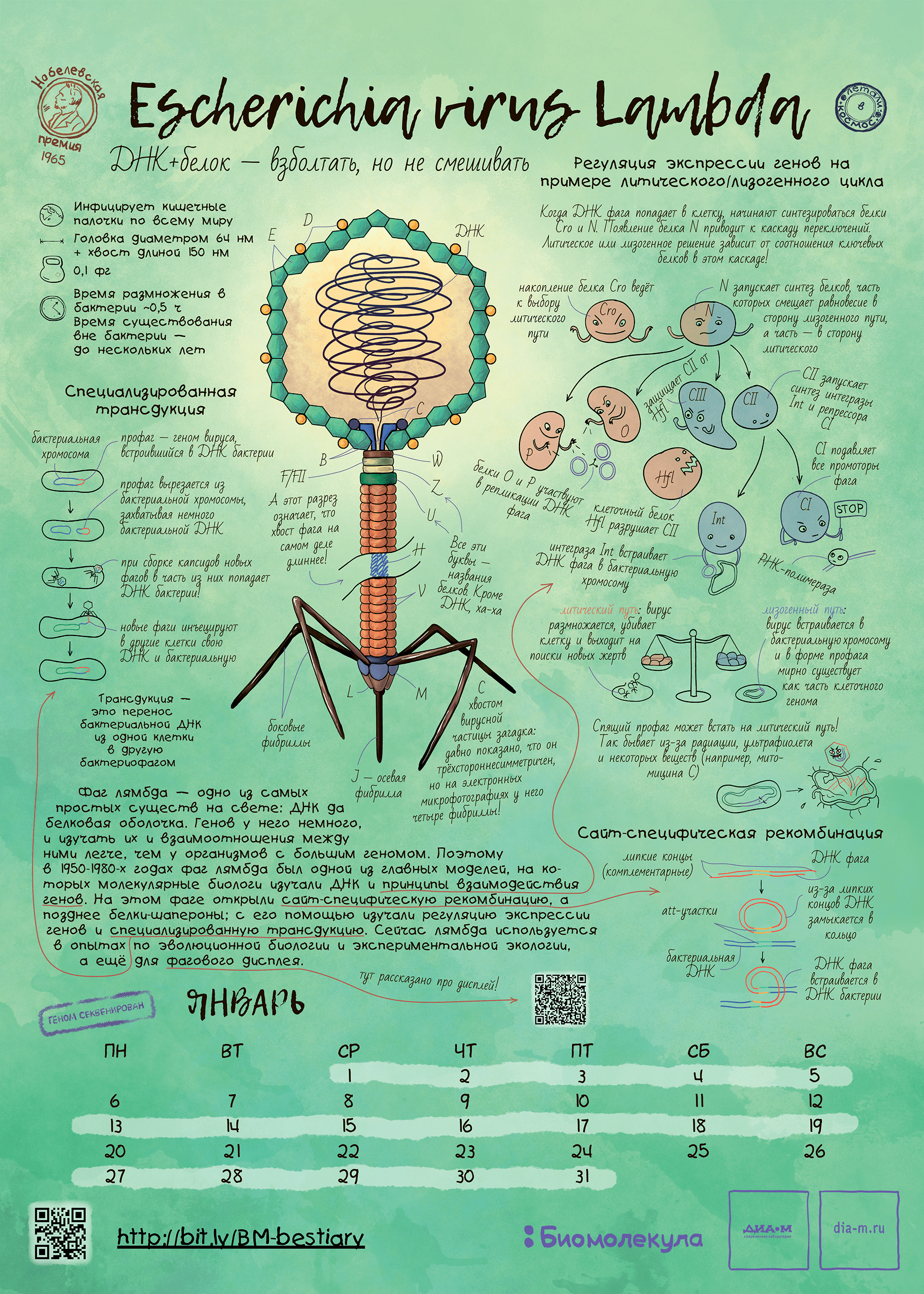
Рисунок 3. Бактериофаг лямбда как герой календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. На тех, кто успел приобрести календарь, фаг уже взирает со стенки, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте на стенку! Ну а кто все же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
иллюстрация Ксении Сайфулиной
Литература
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Hendrix R.W., Roberts J., Stahl F., Weisberg R.E. Lambda II. NY: Cold Spring Harbor Laboratory, 1983;
- Молекулярная биология;
- По следам антибиотиков: что могло пойти не так и как это исправить?;
- Smith D. (2018). Why bacteriophage therapy won't solve the problem of antibiotic resistance. Forbes;
- Charles Schmidt. (2019). Phage therapy’s latest makeover. Nat Biotechnol. 37, 581-586;
- Lederberg E.M. and Lederberg J. (1953). Genetic studies of lysogenicity in Escherichia coli. Genetics. 38, 51–64;
- Dias R.S., Eller M.R., Salgado R.L., da Silva C.C., De Paula S.O. The use of phage: Therapy, biocontrol and commercial microbiology. In: Bacteriophages: Biology, Applications and Role in Health and Disease / ed. by Denton C. and Crosby R.J. Nova Science Publishers, 2013;
- F. H. C. CRICK, LESLIE BARNETT, S. BRENNER, R. J. WATTS-TOBIN. (1961). General Nature of the Genetic Code for Proteins. Nature. 192, 1227-1232;
- Rebekah M. Dedrick, Carlos A. Guerrero-Bustamante, Rebecca A. Garlena, Daniel A. Russell, Katrina Ford, et. al.. (2019). Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. Nat Med. 25, 730-733.







