Органы из лаборатории
17 июля 2015
Органы из лаборатории
- 3814
- 0
- 5
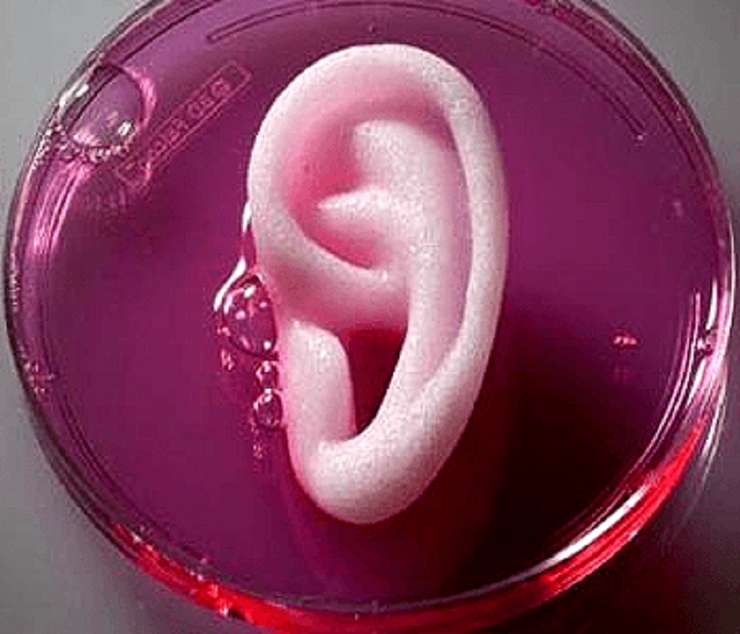
Протезы ушной раковины бывают разные. Например, их печатают из полимеров на 3D-принтере. А у бостонских биоинженеров «человеческое» ухо из овечьих и коровьих клеток росло на каркасе из титановой проволоки, а затем на спине крысы. Не за горами тот день, когда протез будет выращен из собственных хрящевых клеток человека.
Рисунок в полном размере.
фото с сайта catherinealdrinbio.wix.com
-
Автор
-
Редакторы
Искусственные органы нужны не только для пересадок. На них еще можно тестировать лекарства и изучать межклеточные взаимодействия. В зависимости от целей, для которых получают искусственный орган, он может в различной степени походить на орган природный. Поэтому для разных задач подходят разные стратегии воспроизведения работы органов и их систем. Основным принципам этих стратегий и посвящен наш обзор.
Органы на чипе
Прежде чем тестировать лекарство на людях, оно должно пройти проверку в условиях, максимально сходных с условиями внутри человеческого организма. Что больше похоже на человека — мышь или человеческие клетки, живущие отдельно от организма, — это спорный вопрос. Но совершенно точно можно сказать, что ставить эксперименты на клетках, а не на целых животных, проще, дешевле и этичнее. Кроме того, на клетках можно проверять, подходит ли определенный метод лечения конкретному пациенту — а это уже путь к индивидуальной медицине. Поэтому многие ученые работают над системами, в которых человеческие клетки могли бы чувствовать себя так же, как внутри родного организма. Чем лучше мы сможем смоделировать в таких системах условия жизни клеток внутри организма человека, тем спокойнее можно будет допускать лекарства, протестированные в этих системах, до клинических испытаний — проверки на людях.
Моделирование условий — это основное требование к тест-системам для лекарств. Форму и природную структуру реальных органов им точно отражать не обязательно. Благодаря этому тест-системы можно сделать, во-первых, компактными, а во-вторых, модульными — совмещаемыми друг с другом в разных комбинациях. Эти возможности используют разработчики «органов на чипах» — матриц размером с кредитную карточку, ячейки которых заселяют человеческими клетками. Ячейки соединяют каналами, имитирующими сосудистую сеть. Чип нужно содержать в реакторе, который прогоняет по «сосудам» питательные растворы под правильным давлением. Некоторые реакторы даже имитируют биение сердца — для большей достоверности в моделировании кровотока. Кроме того, реактор поддерживает правильную температуру чипа, а также накачивает в раствор газ для имитации дыхания.

Рисунок 1. Чип-призер Лондонского музея дизайна моделирует легкое. Каналы чипа делятся на две части пористой мембраной, с одной стороны которой сидят клетки легкого, а с другой — клетки стенки сосуда. Со стороны клеток легкого подходит воздух, а со стороны клеток сосудов циркулирует жидкость, изображающая кровь. В голубые лунки можно добавлять то, что поступает в систему из воздуха (болезнетворные бактерии или лекарство-аэрозоль), а в красные — то, что должно попасть в кровь (например, клетки иммунной системы, чтобы изучать ее реакцию на легочную инфекцию).
На чипах уже воспроизвели работу многих органов и тканей — печени, почек, легкого, жировой ткани, мышц [1]. Удалось воспроизвести и структуру гематоэнцефалического барьера, который препятствует попаданию из крови в мозг многих лекарств и токсичных веществ. Добились успехов в конструировании органов на чипах и российские ученые. Исследователи из компании «Биоклиникум» поставили себе амбициозную задачу — отразить на одном чипе работу и взаимодействие всех органов, на которые может повлиять лекарство [2]. Они уже получили систему, моделирующую шесть самых важных органов, состояние которых прежде всего волнует разработчиков лекарств: кишечник, печень, легкие, сердце, мозг и кожу. В такой системе можно изучать, куда попадет лекарство, если его вводить внутривенно, перорально или наносить на кожу, а также следить за временем жизни его молекул в организме. Например, после прохождения через клетки печени лекарство должно метаболизироваться, чтобы его концентрация в крови со временем уменьшалась.
Органы на чипах не только полезные, но и стильные: разработанная в Гарварде модель (рис. 1) даже получила премию Лондонского музея дизайна за лучшее дизайнерское решение этого года [3].
3D-печать
3D-принтеры уже умеют печатать довольно широким спектром материалов, в том числе биоматриксами и даже живыми клетками [4–6]. В отличие от чипов, эта технология позволяет получить органы желаемой формы, в том числе идеально подходящие определенному пациенту. А чтобы орган не вызывал отторжения, его нужно печатать из собственных клеток пациента. Для этого из его жировой ткани аккуратно отбирают стволовые клетки, которые можно перепрограммировать в клетки самых разных необходимых специализаций. В «картриджах» биопринтера клетки содержатся в специальном геле, который не позволяет им слипаться. А когда клетки выходят из него на специальную подложку, которая служит «бумагой», они слипаются под действием сил поверхностного натяжения.
Биопринтер печатает орган в соответствии с загруженной в него компьютерной моделью, которая должна быть детально проработанной. Самые продвинутые биопринтеры уже умеют печатать несколькими разными типами клеток, что абсолютно необходимо для воссоздания сложных органов. Помимо основных рабочих клеток органа нужно напечатать как минимум сосуды, которые будут снабжать его питательными веществами и отводить отходы жизнедеятельности. Подробно 3D-печать сосудов описана в статье [4].
Напечатанный орган помещают в специальный реактор, который поддерживает его жизнедеятельность. Пока орган находится в реакторе, его сосудистая сеть продолжает развиваться.
Биопечатью у нас в стране занимается компания 3D Bioprinting Solutions, разработавшая первый российский биопринтер (рис. 2) [7], [8]. Недавно нашим соотечественникам удалось напечатать на нём функциональную щитовидную железу, снабженную сосудами и вырабатывающую гормон тироксин. На сегодняшний день щитовидная железа — один из самых сложных органов, созданных с помощью 3D-печати. В основном этим методом сейчас получают более простые структуры — хрящи и фрагменты кожи. Напечатать такие сложные органы, как печень и почки, для функционирования которых очень важна микроструктура, по прогнозам ученых, получится лишь через 10–15 лет. Пока ученые могут печатать лишь небольшие фрагменты таких органов или их мини-варианты — органоиды (не следует путать с внутриклеточными структурами!). За биением напечатанных на 3D-принтере сердечных органоидов можно понаблюдать прямо сейчас:
Видео 1. Выращенные в лаборатории клетки сердца.
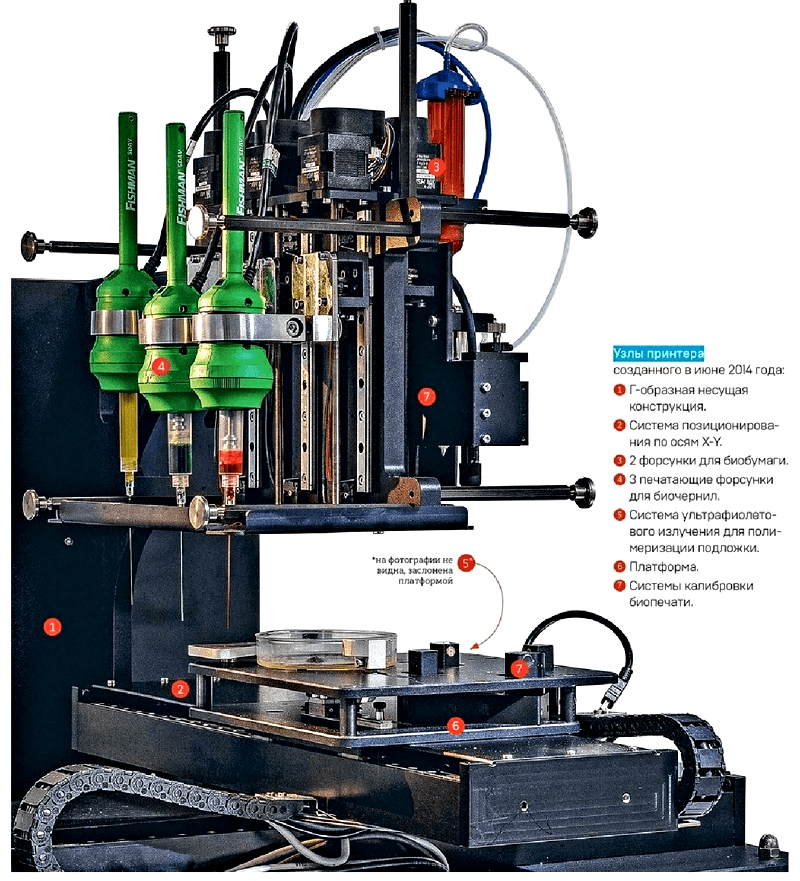
Рисунок 2. Биопринтер компании 3D Bioprinting Solutions, разработанный в России. Позволяет печатать как отдельными клетками, так и их небольшими конгломератами, которые называют сфероидами. Устройство принтера: 1 — Г-образная несущая конструкция; 2 — Система позиционирования по осям X-Y; 3 — Форсунки для биобумаги (2 шт.); 4 — Печатающие форсунки для биочернил (3 шт.); 5 — Система УФ-излучения для полимеризации подложки; 6 — Платформа; 7 — Системы калибровки печати.
Эмбриональные зачатки
Еще один способ получить орган искусственным путем — это скопировать у природы не его окончательный вид, а лишь начальные этапы развития. В идеале, если правильно подобрать условия, зачаток самостоятельно будет развиваться так же, как в эмбрионе [9]. Вырастить таким образом готовые органы вряд ли получится — ведь условия придется постоянно менять по мере его роста. Тем не менее достаточно развившийся зачаток можно пересадить реципиенту, в организме которого он сформируется окончательно, заодно приспособившись к новому окружению. План выглядит сложным, но успешные примеры его применения уже известны. Например, в 2013 году японским исследователям удалось имитировать условия эмбрионального развития зачатка печени [10]. Секрет успеха состоял в подборе правильного соотношения разных типов клеток (клеток эндодермы печени, мезенхимных стволовых клеток и клеток сосудов), а также подходящей подложки. За несколько суток на обычной чашке Петри исследователям удалось вырастить зачатки печени, напоминающие эмбриональные. Такие зачатки пересаживали лабораторным мышам. Спустя несколько дней сосуды зачатка объединялись с сосудами мыши, и в кровоток животного начинали поступать производимые новой «печенью» белки. Когда в «родной» печени мыши начинался гепатит, «новый» орган помогал им лучше справляться с болезнью.
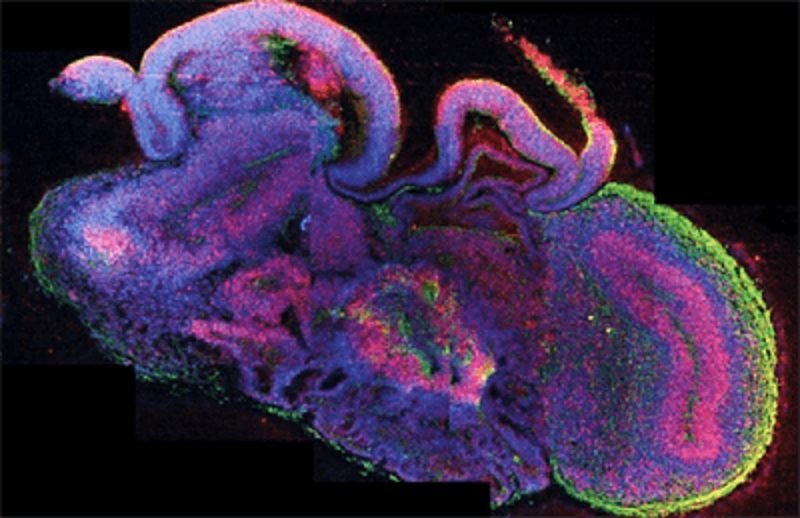
Рисунок 3. Развитие зачатка человеческого мозга, выращенного из стволовых клеток. Красным окрашивали клетки — предшественники нейронов, а зеленым — сформировавшиеся нейроны.
Самое интересное, что путем имитации эмбрионального развития можно получить даже зачатки мозга человека [11]. Ученые из Австрийской академии наук начали со стволовых клеток и подобрали условия, в которых нужно запустить их дифференцировку. При правильных условиях удается получить зачатки мозга с клетками различной специализации — нейронами и глией. На выращенных зачатках размером с горошину можно разглядеть намечающийся передний мозг и даже развивающуюся сетчатку (рис. 3).
Такие мини-мозги едва ли пригодятся в качестве трансплантатов, зато с их помощью можно изучать патологии развития мозга. Например, когда исследователи попытались вырастить органоиды из клеток людей с микроцефалией, они обнаружили, что клетки таких пациентов меньше делились и преждевременно приступали к дифференцировке в нейроны. Вводя в органоиды белок CDK5RAP2, ген которого у микроцефалов несет мутацию, ученым удалось получить из дефектных клеток нормальные органоиды. Таким образом, при попытке воспроизвести эмбриональное развитие больного органа можно больше узнать о причинах нарушения его структуры и функций.
Полное воспроизводство
Наконец, многие ученые хотят получить не чипы и не эмбриональные зачатки, а прямо-таки настоящие рабочие органы человека. Причем прямо сейчас, а не когда биопринтеры достаточно разовьются, чтобы научиться печатать все нужные органы, включая самые сложные. Эти ученые идут своим путем, непростым, но тоже перспективным. Чтобы получить полноценный искусственный орган, сначала готовят каркас анатомической формы, а затем заселяют его клетками реципиента, для которого предназначен орган (про выращивание органов на специальных каркасах читайте в статьях [5] и [6]). Первая работа по такой схеме была проведена еще в начале 90-х годов — тогда ученые вырастили искусственное ухо [12]. В качестве инкубатора для выращивания клеток использовали живую мышь, которой каркас уха из полиэстера, засеянный хондроцитами теленка, вживили под кожу. В процессе роста клеток полиэстерная основа деградировала, так что в итоге получился чистый хрящ в форме человеческого уха.
Сейчас такие жестокие методы выращивания искусственных органов уже не применяются, и для каждого из них проектируют инкубаторы анатомической формы. Внутренняя камера инкубатора должна подходить по форме к заселяемой клетками основе. Реактор должен тонко регулировать поток питательных растворов через разные части органа, потому что от этого зависят локальные плотности клеток. Деликатный и сложный процесс формирования полноценного органа в инкубаторе идет несколько недель, и принципиально упростить его, судя по всему, невозможно. В таком инкубаторе были выращены человеческие кости анатомической формы, полученные с использованием фибробластов человека [13]. Фибробласты располагаются на поверхности кожи, и получать их значительно легче, чем стволовые клетки.
Поэтому недавно разработанные методы перепрограммирования специализированных клеток в стволовые значительно облегчили процедуры выращивания искусственных органов из клеток пациентов. Каркасы для искусственных человеческих костей были получены из кости теленка, полностью очищенной от клеток. Ее внеклеточный материал вполне подходит в качестве замены человеческого. Затем основы заселили мезенхимными клетками, полученными из фибробластов пациента с помощью перепрограммирования, и поместили в специальный инкубатор. После имплантации кости хорошо приживались — вокруг них образовывались хрящевые капсулы, туда прорастали сосуды и приползали хозяйские клетки-остеокласты, занимающиеся перестройкой костной ткани (рис. 4). Подобным же образом — заселяя основы органов животных, очищенных от их клеток, клетками человека, — можно получать и более сложные органы: например, американские ученые вырастили сердце из человеческих клеток.

Рисунок 4. 3D-модели искусственных костей после выращивания в инкубаторе (верхний ряд) и через 12 недель после имплантации (нижний ряд). Модели получены методом компьютерной томографии. Аббревиатуры обозначают названия клеточных линий человека, из которых были выращены косточки. Видно, что в организме (in vivo) вещество кости стало более плотным, то есть костная ткань после имплантации прижилась и продолжала развиваться.
В России тоже идут работы по получению искусственных органов из собственных клеток пациентов. В 2012 году, например, в Краснодарской краевой клинической больнице № 1 была проведена трансплантация трахеи и части гортани, полученных из клеток пациентки, повредившей трахею в автомобильной аварии [14]. Работа велась при участии сотрудников Каролинского института, в котором специалисты клиники прошли стажировку. Основу трахеи, выполненную из нанокомпозитного материала, засеяли клетками, полученными из костного мозга пациентки, и поместили в инкубатор на 48 часов, чтобы клетки закрепились. Дальнейшее развитие органа проходило уже в теле пациентки после операции.
Перспективы, фантазии, трансгуманизм
Технологии выращивания органов в лабораторных условиях развиваются такими темпами, что, возможно, совсем скоро люди уже не будут страдать от недостатка своих составных (запасных) частей. Случайные травмы важнейших частей тела перестанут быть трагедиями, исчезнут гигантские очереди за донорскими органами. Что самое замечательное, развивается индивидуальный подход — уже можно выращивать косточки анатомической формы, а когда-то, вероятно, можно будет воспроизводить нужные органы вплоть до деталей клеточного строения. Тогда все части человека станут потенциально заменимыми. Оставим философам вопросы о том, будет ли прежним человек, все постаревшие части которого заменили новыми (см. «корабль Тесея»). И будем радоваться тому, что этот человек точно не умрет из-за нелепой случайности, не дождавшись своей очереди на донорский орган.
Литература
- Vivien Marx. (2015). Organs from the lab. Nature. 522, 373-377;
- Аксенова Л. (2013). Гомункулус отрастит сердце. Портал «Газета.ru»;
- Модели человеческих органов стали дизайнерским решением года. (2015). Портал Lenta.ru.;
- Тканевая инженерия — окно в современную медицину;
- Тканевая инженерия: мы живем в матрице;
- Кровеносные сосуды XXI века;
- Зимина Т. (2015). Часть тела. Отпечатано в России. «Кот Шрёдингера». 3;
- Зимина Т. (2013). Биопринтингом тканей и органов занялись в Москве. «Наука и жизнь»;
- Желудок размером с горошину + человеческий кишечник, выращенный в мыши;
- Takanori Takebe, Keisuke Sekine, Masahiro Enomura, Hiroyuki Koike, Masaki Kimura, et. al.. (2013). Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499, 481-484;
- Madeline A. Lancaster, Magdalena Renner, Carol-Anne Martin, Daniel Wenzel, Louise S. Bicknell, et. al.. (2013). Cerebral organoids model human brain development and microcephaly. Nature. 501, 373-379;
- Charles A. Vacanti, Linda G. Cima, Dianne Ratkowski, Joseph Upton, Joseph P. Vacanti. (1991). Tissue Engineered Growth of New Cartilage in the Shape of a Human Ear Using Synthetic Polymers Seeded with Chondrocytes. MRS Proc.. 252;
- Giuseppe Maria de Peppo, Iván Marcos-Campos, David John Kahler, Dana Alsalman, Linshan Shang, et. al.. (2013). Engineering bone tissue substitutes from human induced pluripotent stem cells. Proc. Natl. Acad. Sci. U.S.A.. 110, 8680-8685;
- Колпаков Г. (2012). Операция по «мегагранту». Портал «Газета.ru»..