
Желудок размером с горошину + человеческий кишечник, выращенный в мыши
03 ноября 2014
Желудок размером с горошину + человеческий кишечник, выращенный в мыши
- 1191
- 0
- 1
Масса стволовых клеток — это, своего рода, куча конструктора Lego, которая сама будет себя собирать, надо лишь разгадать, когда и какими веществами ее «полить»
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Две независимые исследовательские команды из университета в Цинциннати (США) сделали очередной шаг вперед в выращивании человеческих органов из стволовых клеток. Они создали минижелудок, похожий по структуре на настоящий, и функциональный кишечник, который способен переваривать пищу.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучшее новостное сообщение».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Тканевая инженерия достигла немалых высот в наши дни. С появлением индуцированных плюрипотентных стволовых клеток (ИПСК [1–3]), которые теоретически можно превратить в любые клетки, ученые научились выращивать на биоразлагаемых каркасах ткани некоторых гомогенных органов, например почек, печени и др. [4–6]. Недавно в лабораторных условиях вырастили тимус [7]. В 2011 году впервые была успешно произведена пересадка искусственно выращенной трахеи [8]. Вырастить половые органы тоже возможно. Однако многослойные сложно организованные органы, такие как кишечник и желудок, в которых каждая ткань обладает уникальными свойствами и функциями, методами тканевой инженерии воспроизвести куда сложнее.
Искусственно созданные человеческие органы можно использовать не только для трансплантации, но и в качестве моделей для изучения заболеваний, поскольку не всегда эксперименты на животных дают полную картину процессов, происходящих у человека. Именно такая ситуация возникает при изучении особенностей пищеварительной системы человека. Поэтому для исследования процессов в человеческом кишечнике приходится использовать культуры клеток, что, разумеется, далеко не полностью отражает реальные механизмы физиологических процессов в норме и патологии. Ученые умы долго искали выход. И, по-видимому, наконец-то нашли.
Нет — не беда, вырастим
Материалом для создания органов в лабораторных условиях служат плюрипотентные стволовые клетки. Их можно получить из эмбрионов (эмбриональные стволовые клетки, ЭСК) или превратить в них обычные клетки (ИПСК). Чтобы ИПСК сформировали нужную структуру, они должны получить «инструкции» от окружающих тканей и клеток в виде различных (как правило, химических) сигналов. Масса таких клеток — это, своего рода, куча конструктора «Lego», которая сама будет себя собирать, надо лишь разгадать, когда и какими веществами ее полить. Многие факторы участвуют в образовании органа: биопотенциалы клеток, поверхностное натяжение и деформации, градиенты концентраций различных морфогенов [9] и др. Для искусственного выращивания органа in vitro (в пробирке) биоинженеры предпочитают использовать коктейли из нескольких сигнальных соединений.
Группа ученых из университета в Цинциннати (США), возглавляемая Джеймсом Уэллсом, смогла создать маленький желудок диаметром 3 мм in vitro [10] (рис. 1); статья опубликована в журнале Nature 29 октября 2014 года. Язвы, рак желудка и другие желудочно-кишечные заболевания весьма распространены среди населения земного шара (ими страдают примерно 10% людей). Развитие таких заболевания в ряде случаев может быть вызвано бактерией Helicobacter pylori. Однако животная модель не лучшим образом подходит для изучения этиологии заболеваний желудка и разработки новых методов их лечения. Поэтому Уэллс и коллеги решили создать модель человеческого желудка, так называемый органоид, используя ЧЭСК или ИПСК (рис. 2). Органоиды — это не совсем органы, а скорее трехмерная органоподобная структура, которая может обладать лишь частью свойств настоящего органа и отличаться от него по размерам.
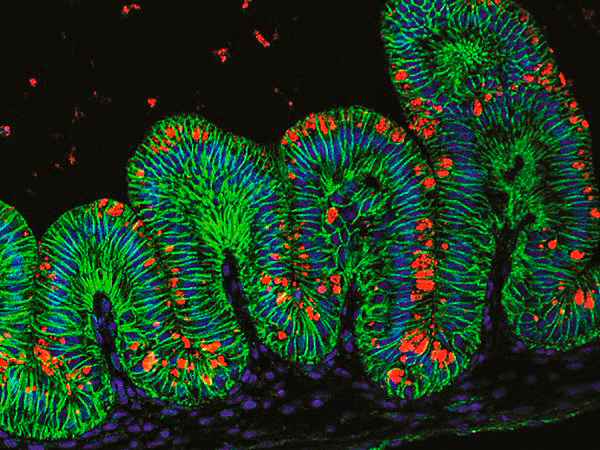
Рисунок 1. Иммунофлуоресцентная окраска среза желудка, выращенного in vitro
Желудок имеет сложную трехмерную структуру, и его внутреннюю выстилку можно разделить на два функционально различающихся отдела: тело, где вырабатываются пептидазы и кислоты, и привратник, в котором находятся клетки, продуцирующие слизь и эндокринные клетки. Чтобы создать желудок (точнее органоид) своими руками, исследователи проанализировали то, как желудок формируется у мышей в процессе эмбрионального развития, и какие сигнальные каскады участвуют в этом процессе. Как оказалось, о сигнальных путях, регулирующих формирование желудка, известно немногое. Уэллсу и коллегам удалось показать, что эмбриональное развитие желудка у мышей in vivo происходит в три этапа:
- Образование нежелезистой части желудка.
- Специализация желудка на тело и привратник (антральный эпителий).
- Морфогенез (рост и дифференцировка) клеток эпителия.
Исследователи постарались повторить эти шаги in vitro и вырастить из стволовых клеток желудок, ткани которого обладали бы соответствующими свойствами и экспрессировали бы характерные для желудка маркерные гены (рис. 2).
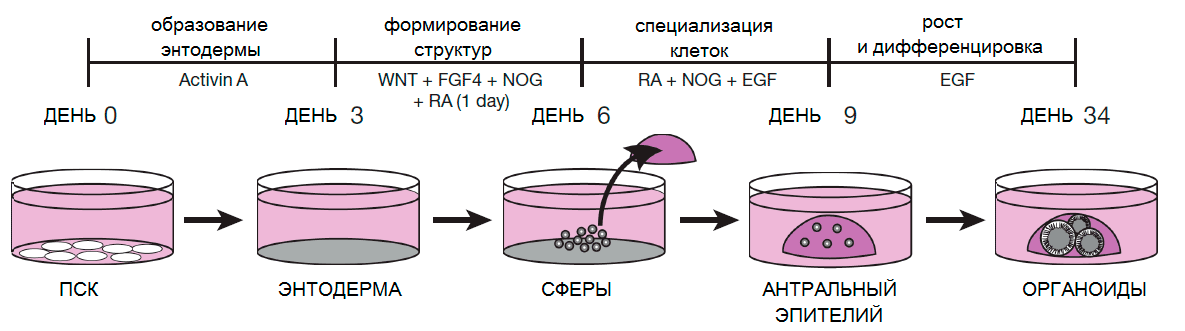
Рисунок 2. Схема эксперимента по выращиванию желудочного органоида in vitro
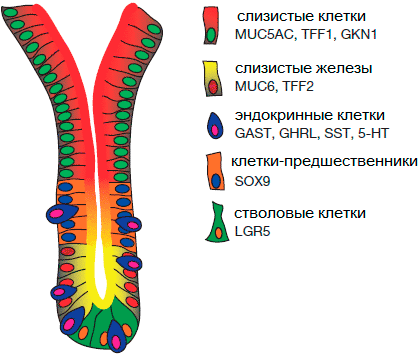
Рисунок 3. Схема гистологического строения желудочного органоида
Первый этап создания желудочного органоида заключался в следующем: стволовые клетки дифференцировали в клетки энтодермы, использовав активин А, чтобы создать плоский слой, образующийся во время раннего эмбрионального развития [11]. Далее (на третий день инкубации в чашке Петри) ученые добавили два морфогена — WNT [12] и FGF, — которые обеспечили переход от плоской структуры к трехмерной. В результате получились шарообразные полые клеточные массы.
Ключевой момент — добавление после третьего дня белка Noggin (морфоген мышечных, костных и нервных тканей), который блокирует образование задней кишки и активирует формирование передней и ее производных, в том числе желудка. Для следующей стадии полученные структуры поместили на биоразлагаемый каркас и постепенно добавляли ретиноевую кислоту (метаболит витамина А, многофункциональный морфоген, участвующий в развитии кишечника и его производных [13]), что способствовало дальнейшему формированию полости и привратника, продуцирующего пищеварительные ферменты. Создать часть желудка, продуцирующую соляную кислоту, авторам пока не удалось, но они активно работают над этим. Финальный этап создания органоида (9–34 день) осуществляется благодаря добавлению EGF (эпидермальный фактор роста, ускоряющий рост и деление эпителиальных клеток). Органоид формирует полноценный сложноорганизованный колончатый эпителий, содержащий стволовые, эндокринные и вырабатывающие слизь клетки (рис. 3). Таким образом, авторам по большей части удалось повторить основные этапы эмбрионального развития in vitro и воссоздать уменьшенную модель желудка из плюрипотентных стволовых клеток.
Органоид и инфекция
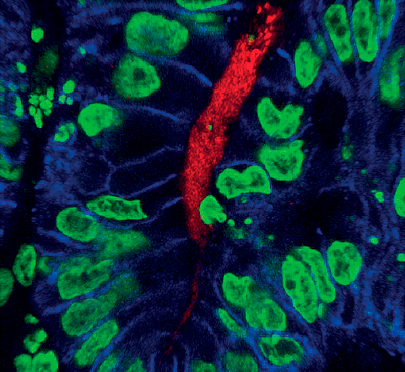
Рисунок 4. Инъекция Helicobacter pylori в полость органоида
Изучить патогенное действие бактерии Helicobacter pylori на мышиной модели невозможно, поскольку у мышей она не вызывает столь острой и явной реакции, как у людей. Поэтому H. pylori ввели в полость выращенного органоида (рис. 4). Наблюдался острый ответ, схожий с таковым в человеческом организме; бактерия вызывала повышение пролиферации клеток, активируя онкоген с-Мет. Более того, исследователи показали, что аттенюированная (обезвреженная) бактерия, лишенная вирулентного фактора CagA, никак не влияла на искусственный желудок.
Несмотря на то, что органоиды всего несколько миллиметров в диаметре и не имеют кровеносных сосудов, иммунных клеток и не могут перерабатывать пищу, структура их секретирующих желез и наличие главных маркеров тканей желудка говорят о том, что это нечто весьма схоже с желудком. К тому же создать такой минижелудок можно всего за месяц. Будущие цели Уэллса — вырастить донорскую ткань, с помощью которой можно будет заживлять язвы желудка. Выращивание полноценной индивидуальной ткани желудка в чашке Петри — большое техническое достижение.
Животные — «инкубаторы» для органов
Одно дело кропотливо растить и удобрять орган in vitro, совсем другое — «заставить» чей-нибудь организм выращивать этот орган. Именно это и сделала вторая группа ученых из детского медицинского центра в Цинциннати (США). Используя человеческие ЭСК (ЧЭСК), они вырастили небольшой человеческий кишечник в почечных капсулах мышей in vivo [14]. Статья опубликована в Nature medicine 19 октября 2014 года.
Майкл Хелмрат (руководитель исследования) вместе с коллегами имплантировали человеческие кишечные органоиды (ЧКО), созданные in vitro из человеческих плюрипотентных стволовых клеток (ЧПСК) или ИПСК, в почечные капсулы иммунодефицитных мышей (рис. 5). В организме животных ЧКО самоорганизуются, растут и васкуляризируются, к ним поступают кровь и питательные вещества, в них формируются крипты и ворсинки, как и в настоящем кишечнике. Спустя 6 недель после имплантации ЧКО сильно увеличивается в размере: в 50–100 раз, что уже больше, чем почка мыши-«реципиента». Приходит время собирать «урожай» для дальнейших исследований.
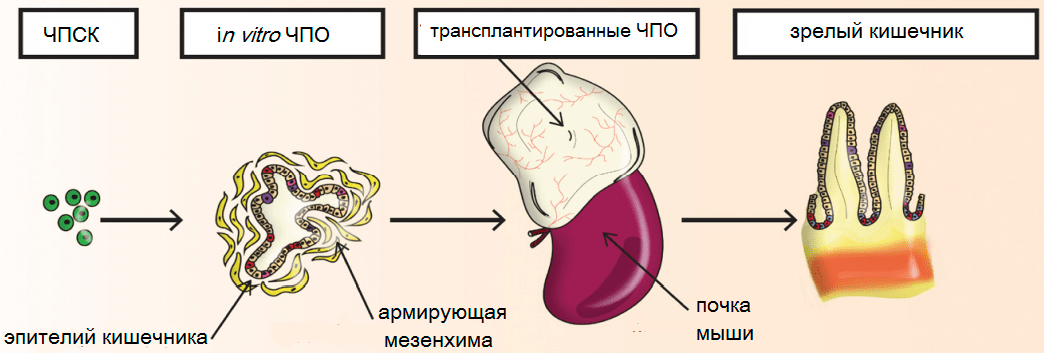
Рисунок 5. Схема выращивания человеческого кишечного органоида (ЧКО) in vivo
На гистологических срезах ЧКО, выращенных in vivo, заметно значительно большее сходство с настоящим кишечником, чем в «in vitro-версии»: просвет ЧКО, как и полагается, заполнен слизью, имеются все основные клеточные линии кишечника: энтероциты, бокаловидные клетки, клетки Панета, энтероэндокринные клетки, — и все они имеют правильное расположение (рис. 6)!

Рисунок 6. Гистологические срезы выращенных in vivo кишечников. Условные обозначения: VIL — энтероциты; MUC2 — бокаловидные клетки; LYSO — клетки Панета; CHGA — энтероэндокринные клетки; ECAD — кадгерин; DAPI — окраска на ядра.
В ЧКО даже сохраняются пулы стволовых клеток, обеспечивающих самообновление кишечного эпителия. Формируются также подслизистый и гладкомышечный слои. Большинство тканей ЧКО, в том числе и мезенхимальные, имело человеческое происхождение, поскольку окрашивалось на человеческий ядерный антиген (HuNuc). Однако лимфатические и кровеносные сосуды развивались от мышей. Выращенные in vivo кишечники даже обладают способностью поглощать и переваривать пищу, чего не наблюдается в «in vitro-версии».
Итак, используя мышей (или других животных) как инкубаторы, в недалеком будущем станет возможным выращивать человеческие ткани и органы. Полученные таким путем органы можно использовать как для трансплантации, так и для физиологических исследований.
Надо отметить, что это не первые работы такого рода: в 2013 году группа японских ученых сообщила о технологии получения человеческих органов в свиньях. Принцип примерно тот же. Допустим, вам нужна поджелудочная железа. Вы берете свинью (точнее, ее эмбрион), выключаете у нее ген, отвечающий за формирование поджелудочной железы, и трансплантируете в такой эмбрион человеческую стволовую клетку. В итоге развивается свинья с человеческой поджелудочной железой. Но пока такому амбициозному проекту по этическим причинам не дали зеленый свет.
Литература
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- M. Takasato, P. X. Er, M. Becroft, J. M. Vanslambrouck, E. G. Stanley, et. al.. (2014). Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nat Cell Biol. 16, 118-126;
- Saiyong Zhu, Milad Rezvani, Jack Harbell, Aras N. Mattis, Alan R. Wolfe, et. al.. (2014). Mouse liver repopulation with hepatocytes generated from human fibroblasts. Nature. 508, 93-97;
- Тканевая инженерия: мы живем в матрице;
- Nicholas Bredenkamp, Svetlana Ulyanchenko, Kathy Emma O’Neill, Nancy Ruth Manley, Harsh Jayesh Vaidya, Catherine Clare Blackburn. (2014). An organized and functional thymus generated from FOXN1-reprogrammed fibroblasts. Nat Cell Biol. 16, 902-908;
- Тканевая инженерия — окно в современную медицину;
- Дай пять: как математика управляет развитием пальцев;
- Kyle W. McCracken, Emily M. Catá, Calyn M. Crawford, Katie L. Sinagoga, Michael Schumacher, et. al.. (2014). Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature. 516, 400-404;
- Kevin A D'Amour, Alan D Agulnick, Susan Eliazer, Olivia G Kelly, Evert Kroon, Emmanuel E Baetge. (2005). Efficient differentiation of human embryonic stem cells to definitive endoderm. Nat Biotechnol. 23, 1534-1541;
- Важнейшие стрелочники клеток организма: белки Wnt;
- R Zeng, C Oderup, R Yuan, M Lee, A Habtezion, et. al.. (2013). Retinoic acid regulates the development of a gut-homing precursor for intestinal dendritic cells. Mucosal Immunol. 6, 847-856;
- Carey L Watson, Maxime M Mahe, Jorge Múnera, Jonathan C Howell, Nambirajan Sundaram, et. al.. (2014). An in vivo model of human small intestine using pluripotent stem cells. Nat Med. 20, 1310-1314.








