Почему в Рязани грибы с глазами?
04 марта 2024
Почему в Рязани грибы с глазами?
- 387
- 0
- 1
Всё живое объединяет солнечный свет и его бодрящая энергия!
Рисунок в полном размере.
авторский коллаж (грибы с глазами — с сайта celes.club)
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Ответ на поставленный вопрос будем искать в светочувствительных системах человека и приматов; мышей и птичек; комаров и бабочек; простейшего многоклеточного животного трихоплакса; растения Арабидопсис; в бактериальных генах, которые повлияли на формирование зрения многоклеточных; и даже у грибов Aspergillus nidulans и Neurospora crassa. В этой статье представлены данные последних исследований спектральной чувствительности грибов, пластинчатых животных и человека, а также рассмотрены реакции ДНК на ультрафиолетовый свет разных диапазонов и участие в этом «цинковых пальцев». Наличие бактерий-симбионтов в синцитиальных сетях грибов и трихоплакса и успехи в «программировании» бактериальных ДНК создают предпосылки для использования этих организмов как модельных, а также создания существ, которых ранее не было в природе.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Исследовать — это видеть то, что видят все, но думать так, как не думает никто.
— нобелевский лауреат Альберт Сент-Дьёрди
Вопросы светочувствительности биологических объектов на разных ступенях эволюционной лестницы были и остаются в центре внимания биологов, в том числе вдохновляя их на создание новых технологий; «Биомолекула» также регулярно публикует статьи об этом [1]. Простейшей формой зрения можно назвать способность растений тянуться к свету (фототропизм) и простейших — перемещаться на освещенное место или прочь от него (фототаксис).
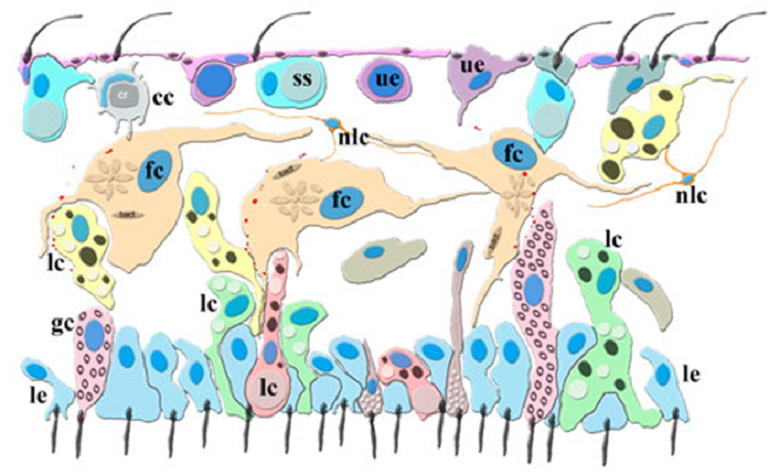
Читатели конкурса «Био/мол/текст» в 2022 году, возможно, помнят мою статью «Сколько глаз у трихоплакса?» [2], в которой была приоткрыта тайна цветного зрительного анализатора у простейшего многоклеточного животного трихоплакса семейства Пластинчатых (Placozoa). Высказанная идея о протомозге у Трихоплакса нашла отражение в последующих работах американского нейробиолога из Университета Флориды Леонида Мороза и сотрудницы Института высшей нервной деятельности и нейрофизиологии (Москва) Дарьи Романовой по формированию модели клеточного строения трихоплакса с учетом плакозоанских нейроидных клеток (nlc-нейроидоподобные клетки) в декабре 2022 года [3].
В журнале Science в 2022 году вышла статья «Синцитиальная нервная сеть гребневика проливает новый свет на раннюю эволюцию нервных систем» [4], в которой сообщается о том, что аксоны нейронов и клетки мезоглии образуют тонкие синцитиальные сети, которые не были обнаружены ранее применяемыми методами. Система волокнистых клеток Трихоплакса, образующая безсинаптическую субэпителиальную синцитиальную сеть, пока не до конца исследована, при этом это хорошая модель для изучения ранних синцитиальных сетей, подобных тем, что встречаются у высших грибов.
Известно, что гифы грибов образуют синцитиальные сети, которые растут и образуют новые связи между собой. В работе по анализу светочувствительной системы гифов грибного мицелия [5] показано, что гифы грибов Aspergillus nidulans и Neurospora crassa обладают собственной светочувствительной системой. Красный (650 нм), синий (460 нм) и ультрафиолетовый свет (380 нм) не вызывает у грибов поведенческой реакции, как у трихоплакса, однако вызывает генетический отклик со стороны ДНК ядра гифа. Такая форма отклика может иметь далекие эволюционные последствия. Этот отклик может проявиться у трихоплакса и в зрительном анализаторе человека.
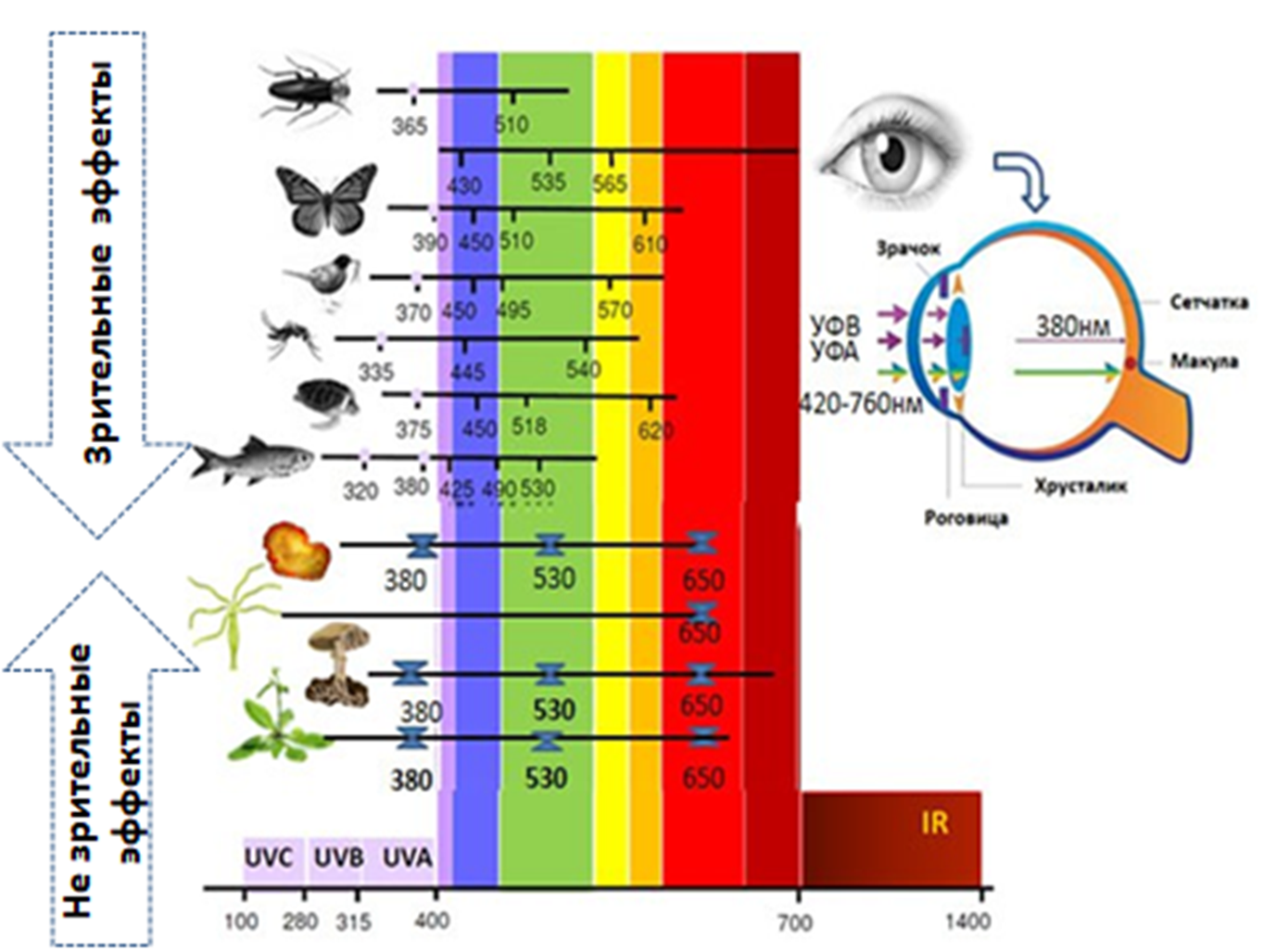
С точки зрения биологии очень важно определить эволюционный момент, когда у живых организмов преобладали незрительные эффекты от воздействия света. Рассмотрим обобщенную схему светочувствительности опсинов различных организмов (рис. 1) [6].
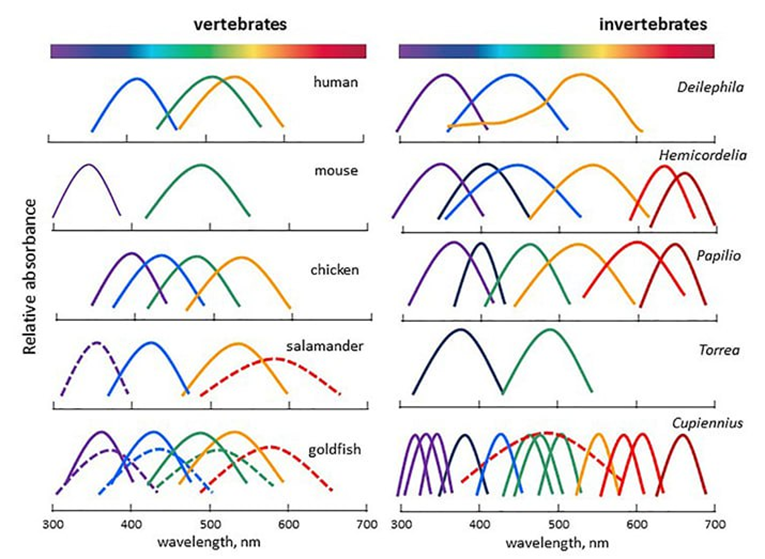
Также на рис. 1А представлена светопроницаемость глаза человека для различных длин волн, из которой видно, что на сетчатку глаза человека попадает УФ-А (380 нм) и остальные цвета радуги. Такое многообразие светочувствительности у животных обусловлено наличием различных опсинов (светочувствительных белков). Максимум спектральной чувствительности во всех случаях определяется средой обитания организмов и их образом жизни. На рис. 1Б приведены кривые спектральной чувствительности опсинов некоторых видов животных: наибольшее число опсинов (12) имеет ночной паук Cupiennius salei, живущий при низкой освещенности; каждый его опсин имеет узкий спектр светочувствительности.
В основном биологи занимаются изучением зрения, не уделяя должного внимания незрительным эффектам воздействия света. Главный изучаемый незрительный эффект — циркадные ритмы. Управляющий ими молекулярный механизм состоит из сложной сети петель обратной связи, которые устанавливают 24-часовые циклы экспрессии генов во всех тканях [7].
В таблице 1 представлена совокупность опсинов, характерных для зрительного анализатора человека.
| Аббревиатура | Название | Расположение | Роль | Спектральная чувствительность, нм | |||
|---|---|---|---|---|---|---|---|
| В глазу | Вне глаза | У мыши | У человека | ||||
| OPN1 | |||||||
| OPN1LW | L-опсин колбочек | Колбочки | Зрение | 560 | |||
| OPN1MW | M-опсин колбочек | Колбочки | Зрение | 510 | 530 | ||
| OPN1SW | S-опсин колбочек | Колбочки | Кожа | Зрение | 360 | 420 | |
| OPN2 | Родопсин | Палочки | Палочки | Кожа | Зрение | 500 | |
| OPN3 | Энцефалопсин | Палочки, колбочки, плексиформные слои, ганглионарные клетки (ГК) | Кожа Мозг |
Незрительный | |||
| OPN4 | Меланопсин | Светочувствительные ГК сетчатки | Незрительный | 480 | |||
| OPN5 | Нейропсин | ГК | Кожа | Незрительный | 380 | ||
| RRH | Перопсин | Пигментный эпителий сетчатки (ПЭС) | Незрительный | ||||
| RGR | GPCR сетчатки | ПЭС | Незрительный | ||||
Традиционно для человека в основном рассматривается совокупность опсинов, отвечающих за зрительные эффекты, но не рассматриваются опсины, отвечающие за незрительные эффекты. Из таблицы 1 видно, что за незрительные эффекты отвечают опсины 3, 4, 5; особенный интерес представляет опсин 5, который имеет светочувствительность в области УФ-А и участвует в регуляции оптической оси глаза. Для биологии важно понять, как проявляют себя опсины в мозговой ткани многоклеточных, а также в коже человека. На рис. 2 приведено распределение опсинов в клетках кожи человека [9].
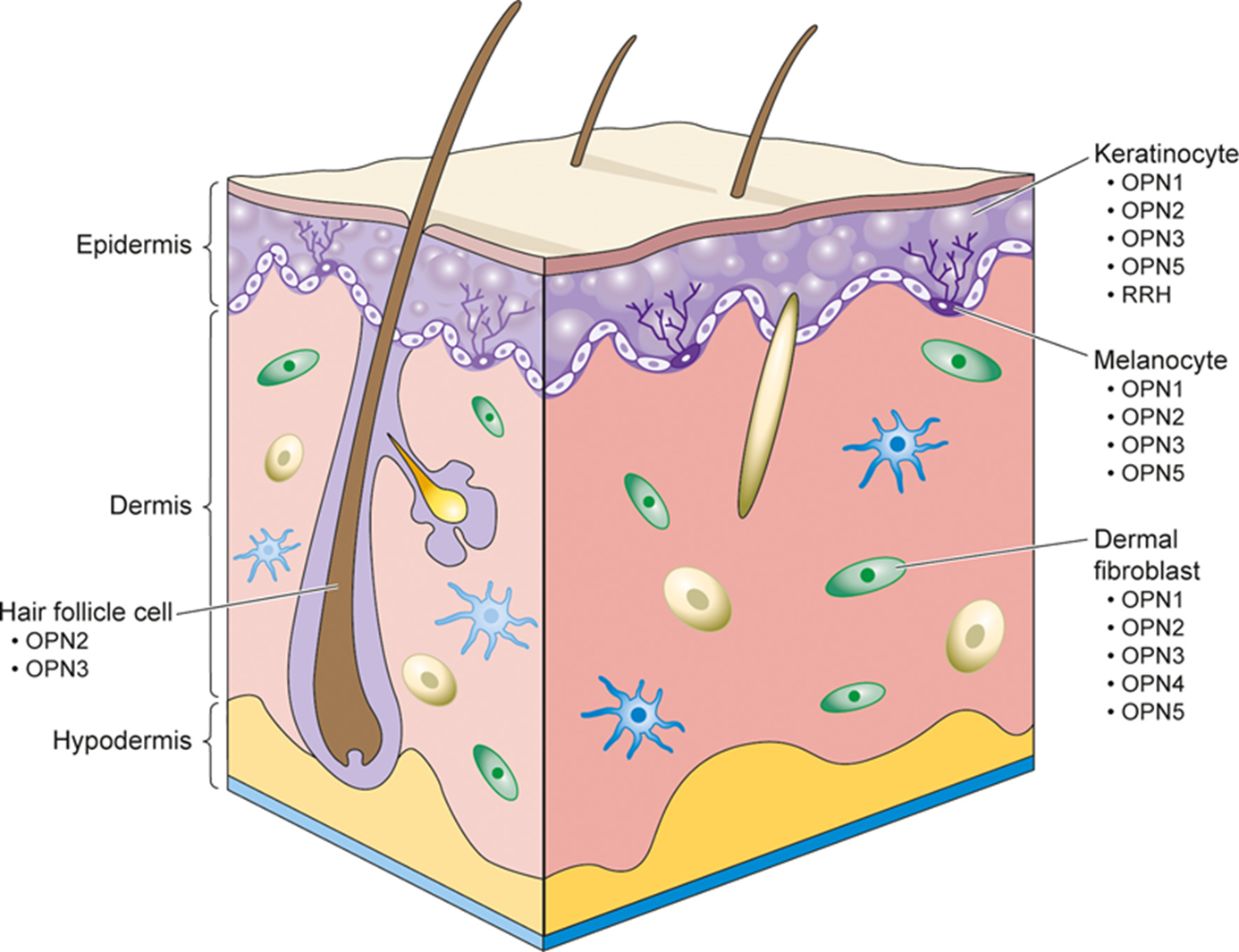
Рисунок 2. Экспрессия опсинов в типах клеток кожи человека.
Для опсинов, экспрессируемых в клетках кожи, в таблице 2 приведены длины волн, к которым они чувствительны.
| Название | G-белок | Длина волны поглощения | Цвет |
|---|---|---|---|
| C-opsin (ciliary) | |||
| Blue opsin (OPN1-SW) | Gt | ~425 nm | Violet-blue |
| Green opsin (OPN1-MW) | Gt/Gs | ~530 nm | Green |
| Red opsin (OPN1-LW) | Gt | ~560 nm | Yellow-orange |
| Rhodopsin (OPN2) | Gt | ~500 nm | Green |
| Encephalopsin/panopsin (OPN3) |
Gi/Go | ~420–527 nm | Violet-green |
| R-opsin/(rhabdomeric) | |||
| Melanopsin | Gq | ~480 nm | Blue-green |
| Mollusk visual opsins | Gq | ||
| Arthropod visual opsins | Gq | ||
| Tetraopsin (group 4 opsins) | |||
| Retinochrome | |||
| Retinal GPCR opsin (RGR) | ~470 nm | Blue-green | |
| Peropsin (RRH) | |||
| Neuropsin (OPN5) | ~380 nm | Ultraviolet | |
Кожа наиболее широко подвергается действию света. Тем не менее, роль опсинов в коже человека изучена недостаточно [9]. Светочувствительная система есть и в коже рыб. Например, экспрессия опсина SWS1 в коже рыбы-кабана предполагает дермальную спектральную чувствительность, совпадающую с коротковолновым спектром, характерным для коралловых рифов [10].
В природе гены меняются в результате изменения условий внешней среды. Например, два вида цихлид обитают в озере Виктория, в Африке, вид Pundamilia nyererei, самцы которого имеют красную окраску, и вид Pundamilia pundamilia, самцы которого обладают голубой окраской. Самки обоих видов, практически идентичны и обладают желтой окраской. Красные самцы цихлид живут исключительно на глубине, а голубые обитают на мелководьях. Самки же отличаются светочувствительностью зрения: одни хорошо видят красные оттенки, другие — голубые, ну и половые предпочтения у них соответствующие (рис. 3) [11].
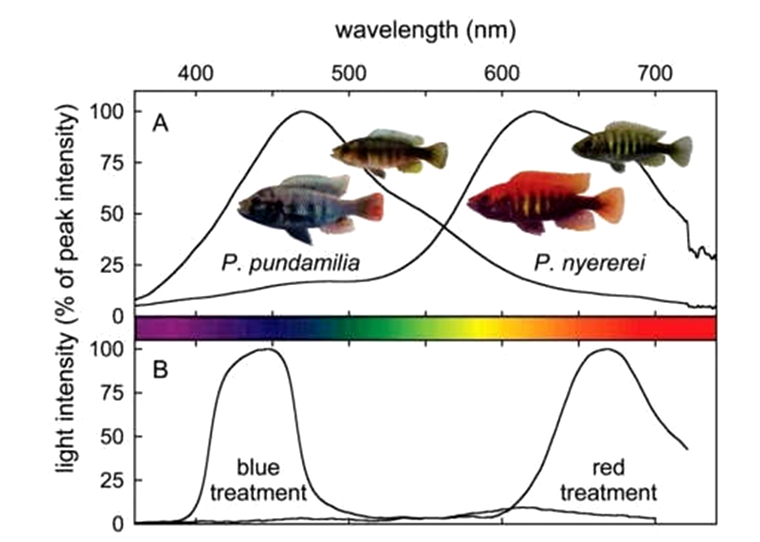
Рисунок 3. Распределение светочувствительных опсинов у цихлид озера Виктория, Африка.
В природе широко распространен горизонтальный перенос генов [12]: бактерии легко обмениваются генами, упакованными в вирусы или мобильные фрагменты ДНК, называемые транспозонами, или даже в виде свободноплавающей ДНК. Микробный ген, получивший название IRBP (интерфоторецепторный ретиноид-связывающий белок), важен для зрения позвоночных. Белок, который он кодирует, находится в пространстве между сетчаткой и пигментным эпителием [13].
В некоторых случаях в клетку может попасть и просто свободноплавающая ДНК. В аквариум вместе со свободноплавающими генами, кодирующими зеленый флуоресцентный белок, поместили личинок рыбок Данио (Danio rerio) и угря. После дня плавания в условиях электрических разрядов угрей некоторые личинки начали светиться зеленым под УФ-А-лучами, указывая на то, что клетки рыбок Данио восприняли чужеродные гены и начали экспрессировать их. Вновь приобретенная ДНК быстро разлагалась — личинки светились всего около недели, — но это заставило ученых задуматься: могло ли дикое животное приобрести гены таким образом и передать их своему потомству [14]?
Глава 1. Воздействие света на трихоплакс

Рисунок 4. Внешний вид и форма Трихоплакса (Placozoa). Плакозой — маленькое уплощенное животное, обычно около одного миллиметра в поперечнике и около 25 мкм в толщину.
По эволюционной шкале намного ниже рыбок Данио находится первое многоклеточное животное трихоплакс (рис. 4), скромно ползающий в придонном слое «мусорной ДНК». Он обитает на коралловых рифах в сложной цветовой среде, которая формируется в результате воздействия света, проникающего на глубину от 5 до 20 метров в диапазоне от зеленого до УФ-А, вызывающего свечение кораллов, распространяющееся на всю местную микробиоту. Клетки трихоплакса не образуют ткани, а в межклеточное пространство могут попадать частички свободноплавающей чужой ДНК.
В ходе исследований реакции трихоплакса на цветные стимулы было обнаружено наличие у него RGB-таксиса. При этом от красного поляризованного света животное убегает, при зеленом поляризованном свете он останавливается и распластывается, а на ближний УФ-А проявляет положительный фототаксис и делается более энергичным [2].
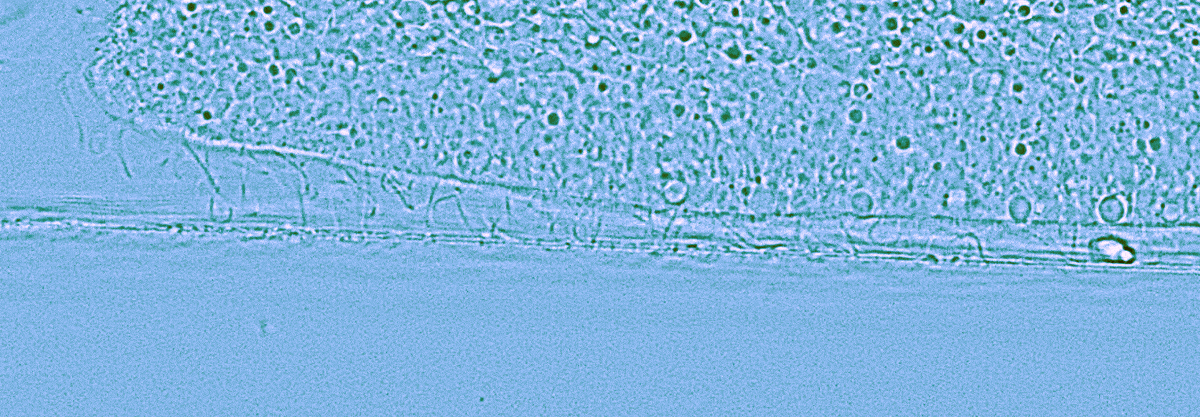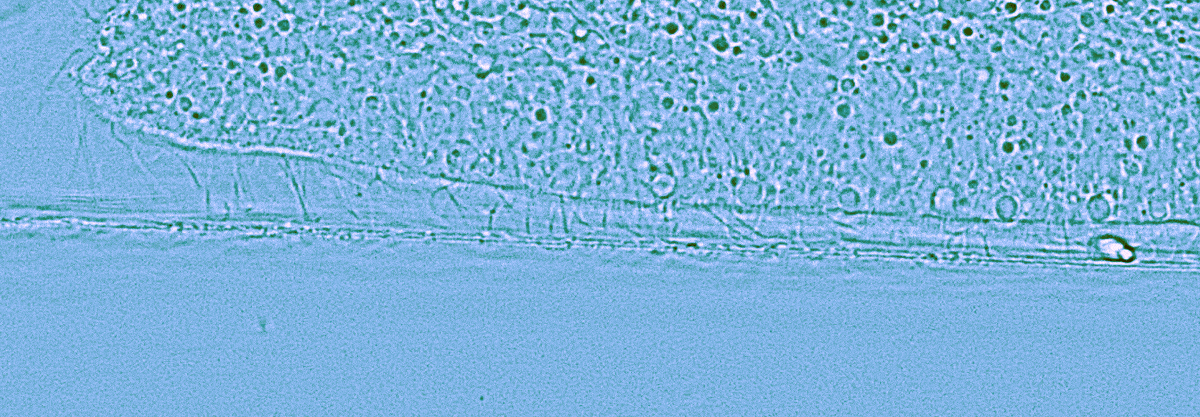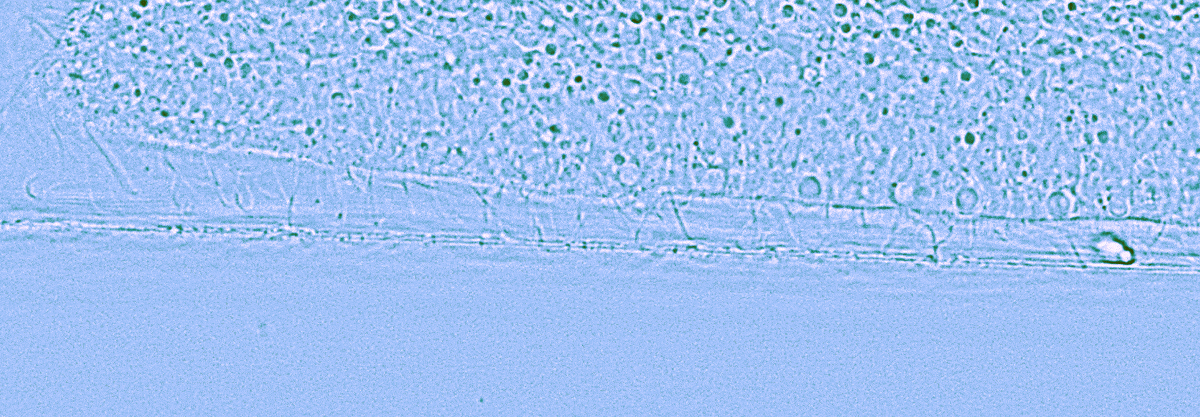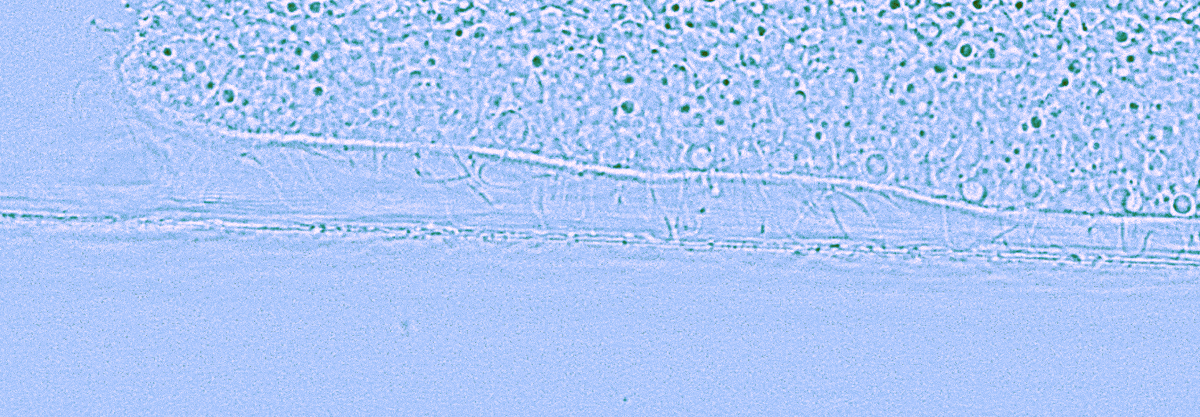
Рисунок 5. Увеличенный вид трихоплакса сбоку. Движение по поверхности показывает, как тысячи ресничек на его нижней стороне дают ему неповторимую походку.
Трихоплакс перемещается по водорослевому мату с помощью ворсинок на дорсальном слое, согласованное движение которых обеспечивает ему перемещение при подаче разных световых стимулов (рис. 5). Это говорит о том, что между светочувствительной системой и клетками дорсального слоя существует обмен информацией — видимо, посредством синцитиальной сети волокнистых клеток, расположенных в среднем слое тела. Кроме светочувствительности и наличия у трихоплакса опсинов к зеленому и красному свету, у трихоплакса есть кристаллические клетки, содержащие кристалл арагонита, «обложенного» митохондриями. Этот кристалл переизлучает УФ-А в красный свет, который митохондрии и поглощают [15], чтобы выделять больше АТФ и придать трихоплаксу новый импульс. Часть света УФ-А, попадает на комплекс криптохром/фотолиазу (CRY/PL) и может приводить к экспрессии генов и репарации ДНК [16] кристаллической клетки трихоплакса. Кристаллические клетки, как правило, содержат один кристалл арагонита (рис. 7) [17].
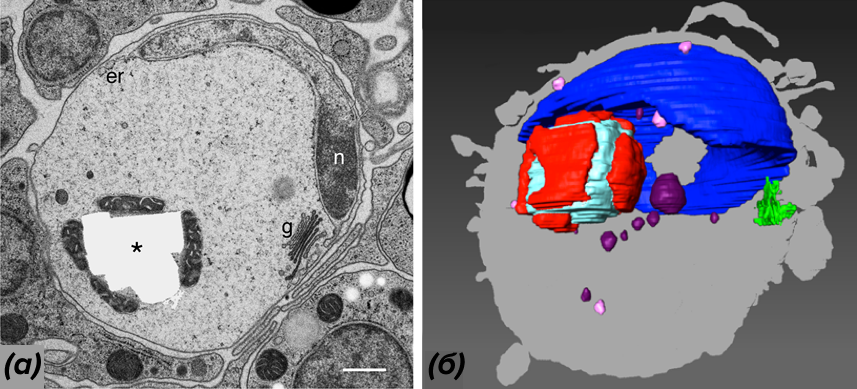
Рисунок 6. Кристаллическая клетка Трихоплакса.
(а) — разрез кристаллической ячейки по ПЭМ показывает пустоту, ранее занятую кристаллом (*) и окруженную митохондриями. Уплощенное ядро кристаллической ячейки (n) прижато к клеточной мембране. К разреженным дополнительным включениям относятся светлые и темные везикулы, аппарат Гольджи (g) и эндоплазматический ретикулум (er);
(б) — реконструкция внутренней части кристаллической ячейки: митохондрии окружают кристалл. Кристаллический комплекс находится в чаше, образованной ядром; неподалеку — аппарат Гольджи. Светлые и темные фиолетовые пузырьки — вакуоли. Силуэт кристаллической ячейки показан серым цветом. Масштабная линейка — 500 нм.
С эволюционной точки зрения, взаимодействие ДНК с различным спектром света представляет большой интерес. Встречаясь у растений, бактерий и грибов, этот эффект, видимо, имеет длинные эволюционные корни.
Глава 2. Воздействие света на жизненные циклы, экспрессию генов и репарацию ДНК у грибов
В статье «Анатомия грибкового глаза: грибковые фоторецепторы и сигнальные механизмы» рассматривается воздействие света на жизненные циклы грибов [5], регулируя развитие спор. Одной из главных функций фоторецепции грибов является самозащита от вредного воздействия ультрафиолета. Споры грибов плотно упакованы защитными пигментами и осмолитами [5], которые защищают следующее поколение грибов от УФ-поражения и окислительного стресса. Вторая фундаментальная функция фоторецепции, возможно, заключается в нахождении оптимальных условий или времени для распространения спор [5].
Грибы часто живут в почве, которая покрыта органическими веществами, препятствующими распространению спор. До спороношения мицелий грибов проявляет положительный фототропизм, выращивая свои плодовые тела в воздухе, а свет индуцирует образование спороносных структур, что позволяет грибу начать разбрасывать споры в хорошую погоду [5]. Грибы меняют жизненные формы на протяжении всей своей жизни. Часто всё начинается с прорастания споры, которая может быть как бесполой, так и половой, в зависимости от вида гриба (рис. 7).
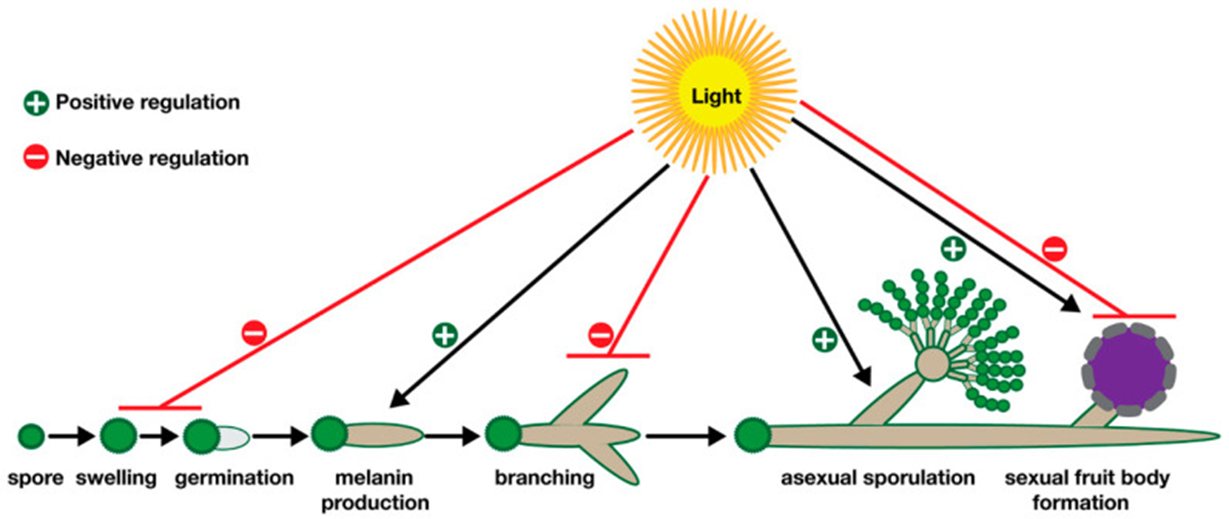
Рисунок 7. Влияние освещенности на разные стадии развития гриба. Споры прорастают, поглощая питательные вещества, и образуют зародышевые трубки. Растущие гифы вырабатывают пигменты (меланин или каротины), которые защищают их от ультрафиолетового облучения. Дальнейший рост гифов приводит либо к бесполым структурам, либо к образованию половых плодовых тел. Свет может действовать и как положительный, и как отрицательный регулятор этого процесса.
Глава 3. Модель светочувствительного механизма у гифа — грибкового глаза
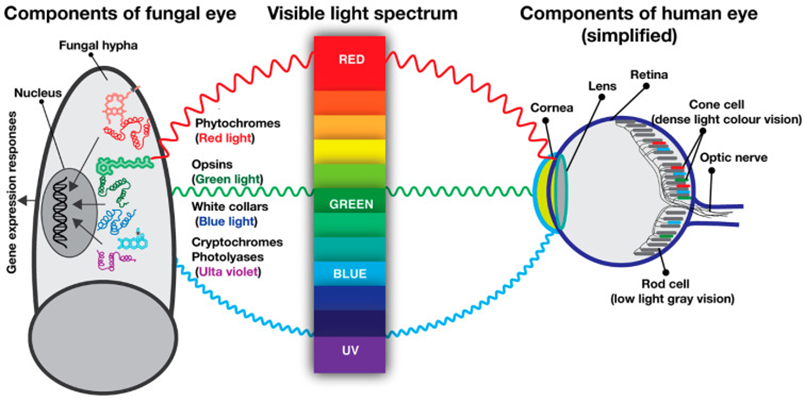
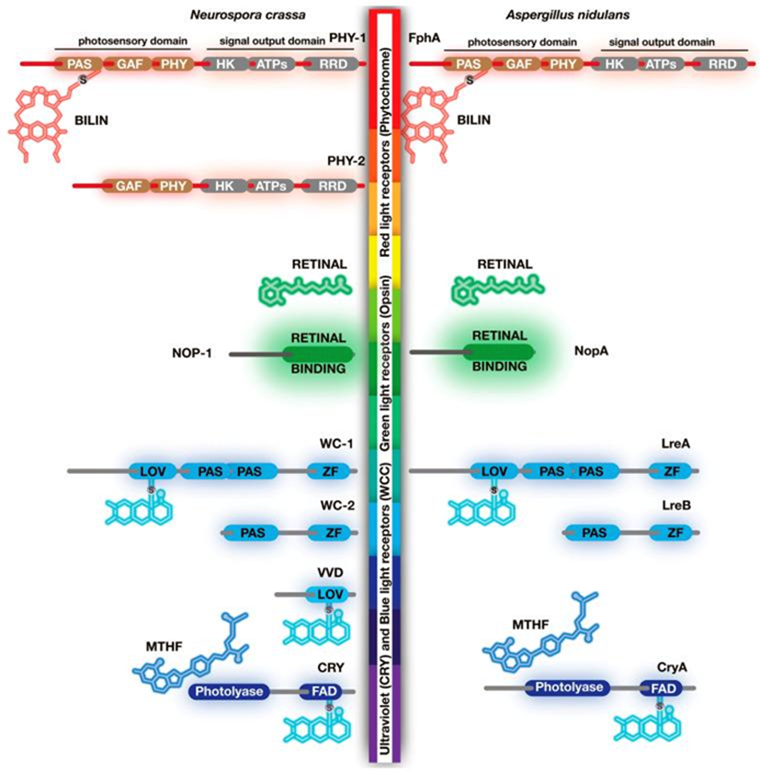
Грибковый глаз (если можно так выразиться) [5] функционирует с помощью трех различных световых рецепторов: синего, зеленого (грибковые опсины) и красного света (фитохромы) (рис. 8А).Свет регулирует развитие грибов, способствует накоплению защитных пигментов и белков, регулирует рост гифов. Комплекс «белых воротничков» (WCC) является фоторецептором и транскрипционным фактором, который отвечает за регуляцию транскрипции после воздействия синего света. У Neurospora crassa свет способствует взаимодействию WCC и их связыванию с промоторами для активации транскрипции. У Aspergillus nidulans WCC и фитохром взаимодействуют, чтобы координировать транскрипцию генов и другие реакции, но вклад этих фоторецепторов в фотобиологию грибов варьируется у разных видов грибов (рис. 8Б). В конечном счете, влияние света на биологию грибов является результатом скоординированной транскрипционной регуляции и активации путей передачи сигнала [5], [18].
Глава 4. Сигнальные системы света Arabidopsis thaliana (кресс-салат)
Arabidopsis thaliana (рис. 9) широко использовался при изучении генетических основ фототропизма и других процессов, происходящих под влиянием синего света. Световая реакция была обнаружена даже у корней, которые ранее считались нечувствительными к свету. Хотя гравитропная реакция корневых органов A. thaliana преобладает, образцы, обработанные мутагенами и отобранные по отсутствию гравитропного действия, показали отрицательную фототропную реакцию на синий или белый свет и положительную реакцию на красный свет [19], [20].

Рисунок 9. Arabidopsis thaliana — самый полезный сорняк на свете. Эта интеллигентная травка как бы говорит вам: прочитай про меня на «Биомолекуле» [21]!
статья «Модельные организмы: арабидопсис» [21] из соответствующего спецпроекта
Свет является главным фактором, определяющим формирование хлоропластов. В процессе эволюции растения приобрели сложную фотосенсорную систему, которая позволяет распознавать качество, интенсивность, продолжительность и направление светового потока в широком спектре излучения 280–750 нм (от УФ до дальнего красного). У A. thaliana излучение в УФ-B улавливает пептид UVR8 (280–320 нм), свет УФ-A/синего излучения воспринимают белки ZEITLUPE, FKF1/LKP2 (Flavin Binding Kelch Repeat F-Box Protein) и фототропины PHOT1/PHOT2 (320–500 нм), к синему свету чувствительны криптохромы CRY1/CRY2 (400–500 нм), а за восприятие красного и дальнего красного света ответственны фитохромы phyА—phyЕ (600–730 нм). По литературным данным, деэтиоляцию проростков в бо́льшей степени опосредуют фитохромы и криптохромы [22].
Глава 5. Значение фиолетового света в репарации ДНК
Современная биология предполагает разработку и создание искусственной ДНК, устойчивой к воздействию УФ-В и УФ-С света за счет механизма восстановления (репарации) ДНК при облучении ультрафиолетом другого диапазона — УФ-А, — поэтому целесообразно рассмотреть, как этот защитный механизм работает в природе.
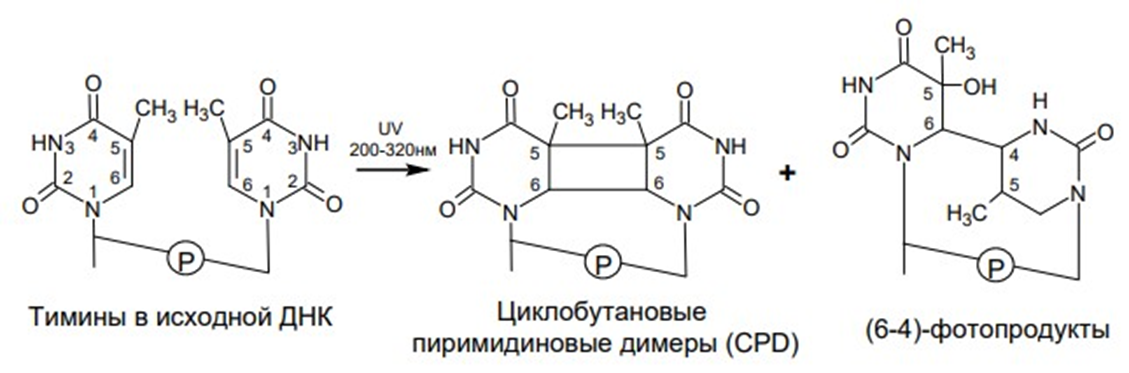
Можно многое предположить о роли красного, зеленого и синего света в жизни растений, бактерий, грибов и многоклеточных животных, но максимальный интерес представляет лучик фиолетового света, на который нанизана вся эволюция живого при солнечном свете. Одна из стратегических целей всего живого — это спасти ДНК клеток от солнечного ультрафиолета УФ-В. Основные продукты такого облучения ДНК — это циклобутановые пиримидиновые димеры (75%) или (6—4)-пиримидиновые аддукты (25%), в которых ковалентно связаны два соседних пиримидина (рис. 10) [23], [24]. Образование таких фотопродуктов повреждает клетки, блокируя репликацию и транскрипцию ДНК, и в редких случаях, когда ДНК-полимераза способна обходить поврежденные участки, вызывает мутации. Клетки способны защитить себя от вредного воздействия УФ-света при помощи одновременного или последующего облучения ближним УФ — видимым светом (λ 320÷500 нм) в процессе фоторепарации с участием фермента ДНК‑фотолиазы или удаляя поврежденные участки ДНК с помощью эндонуклеаз с заменой поврежденных нуклеотидов.
ДНК‑фотолиазы — это, по-видимому, самые древние ферменты репарации ДНК в эволюции. Считается, что один или несколько генов, кодирующих ДНК‑фотолиазы, были у общего универсального предшественника всех современные живых организмов — LUCA (Last Universal Common Ancestor) [25]. Теоретически такой предшественник мог существовать на Земле более 3,8 млрд лет назад в условиях сильного УФ-излучения и восстановительной атмосферы с высоким содержанием метана и водорода [23].
Фотолиазы и криптохромы по последовательности и структуре, но имеют разные физиологические функции. Фотолиазы — эволюционно древние, активируемые светом ферменты, которые восстанавливают повреждения ДНК, вызванные ультрафиолетовым излучением. Большинство криптохромов утратили функцию репарации ДНК и приобрели новые роли в качестве световых рецепторов, регуляторов транскрипции, магниторецепторов [26] и, в частности, в качестве ключевых игроков в циркадных часах [27].
Глава 6. Бактерии и синцитиевые сети грибов и трихоплакса
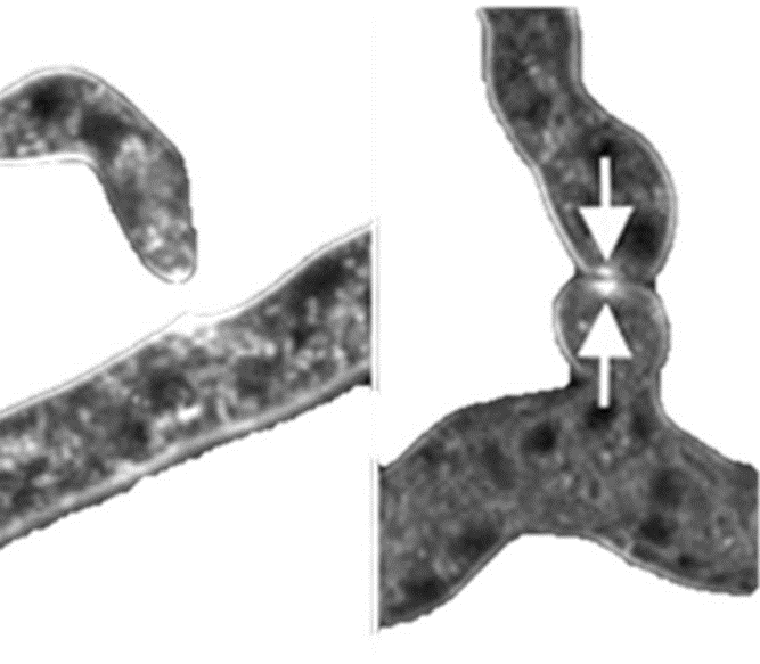
Синцитий или симплазм (от др.-греч. σύν — «вместе» + κύτος «клетка», букв. — «соклетие») — тип ткани у животных, растений и грибов с неполным разграничением клеток, при котором обособленные участки цитоплазмы с ядрами связаны между собой цитоплазматическими мостиками. Синцитиевые сети грибов (рис. 11А) [28] и трихоплаксов представляют собой единую сеть, которую в настоящее время активно изучают и находят новые ее элементы. В этих сетях живут и могут перемещаться бактерии, которые в значительной степени влияют на функционирование этих сетей. После образования контакта спустя время образуется сплошной гиф (рис. 11Б) [28].
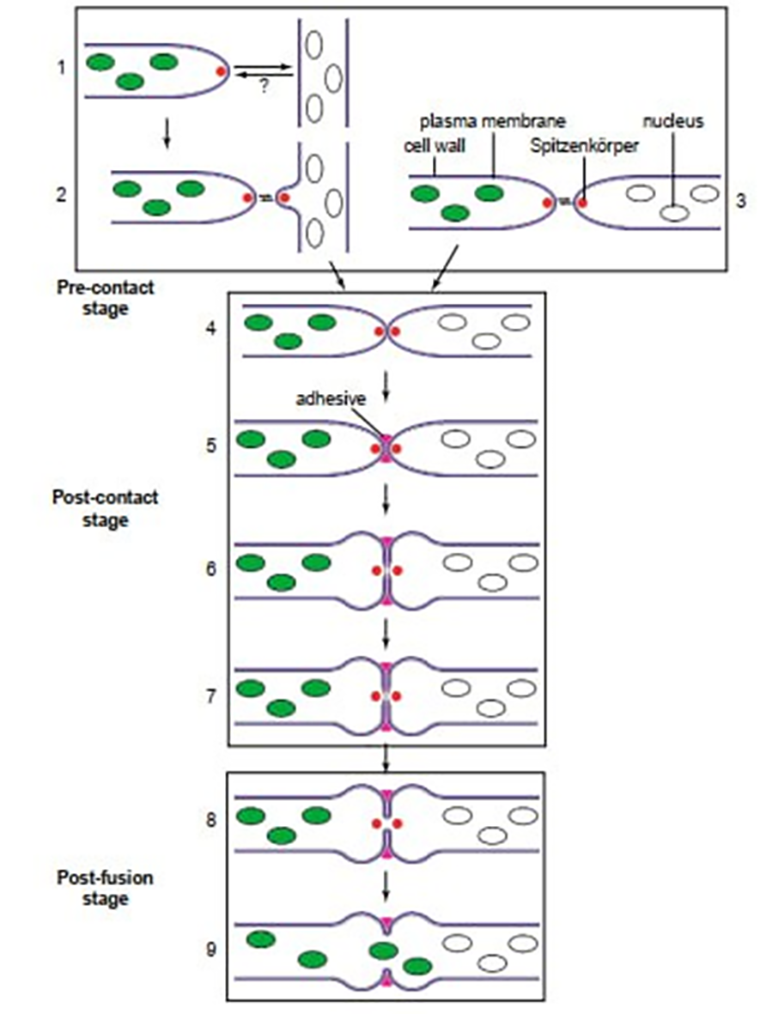
Почвенные бактерии путешествуют по гифам, будто по магистралям! Более того, в этих оживленных местах у них повышаются шансы для встреч и конъюгаций (видео 1). Для оценки степени проницаемости и движения бактерий по гифам был проведен эксперимент. Ученые использовали две линии почвенных бактерий Pseudomonas putida. В одной из линий бактерии светились красным светом и вдобавок содержали в своей хромосоме плазмиду с геном, кодирующим белок для зеленой флуоресценции, правда, продукция этого белка в красной клетке подавлялась. В другой линии бактерии не светились — они должны были стать реципиентами вышеуказанной плазмиды, и в случае ее успешной передачи при конъюгации они сразу бы начали флуоресцировать зеленым светом (рис. 12) [29].
Видео 1. Передвижение бактерий Pseudomonas putida по гифам гриба Cunninghamella elegans.
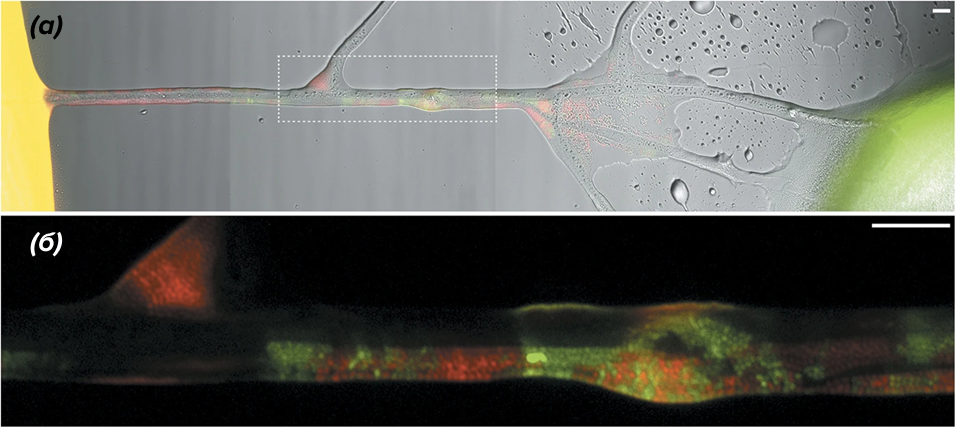
Рисунок 12. Донор Pseudomonas putida и клетки дикого типа пересекают воздушный зазор вдоль мицелия Pythium ultimum.
(а) — комбинированное изображение эпифлуоресценции и трансмиссионного света, показывающее мицелий P. ultimum, выращенный между отдельными кусочками агара, инокулированными клетками донора или дикого типа. Появляющиеся трансконъюганты видны вдоль мицелия;
(б) — комбинированное увеличенное изображение каналов красной и зеленой флуоресценции, показывающее расположение донорских и трансконъюгантных клеток вдоль сегмента мицелия.
Масштабные линейки: 10 мкм
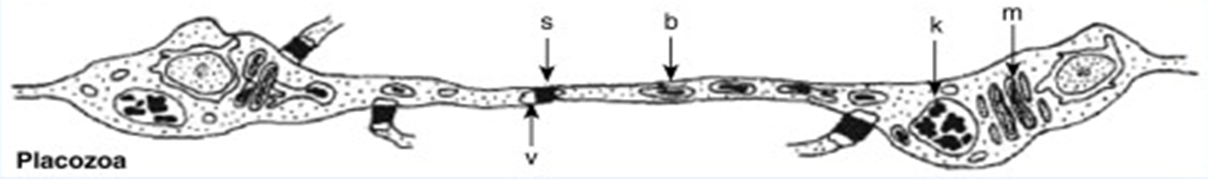
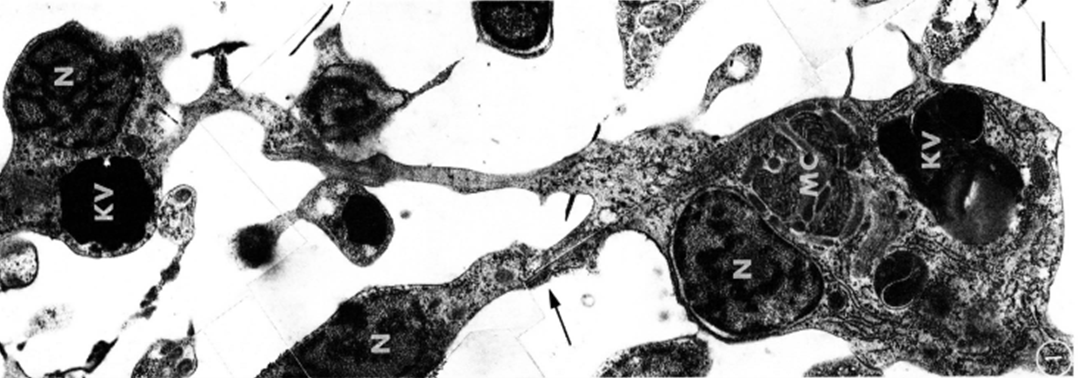
У трихоплакса между двумя слоями клеток (вентральными и дорсальными) находится заполненное жидкостью внутреннее пространство, которое пронизано звездообразным волокнистым синцитием. Аналогичные структуры синцития также обнаружены у губок (Porifera) и многих грибов. На рис. 13А [30] приведен фрагмент соединения двух волокнистых клеток трихоплакса и места присоединения других клеток.
Как и у гифов грибов, в синцитии волокнистых клеток трихоплакса по обе стороны от перегородок находятся заполненные жидкостью капсулы, которые придают перегородкам сходство с синапсами, то есть соединениями нервных клеток, которые встречаются в полностью выраженной форме только у животных с тканями (Eumetazoa). Поразительные скопления ионов кальция, которые могут выполнять функцию, связанную с распространением раздражителей, также предполагают возможную роль протосинапсов. Волокнистый синцитий также содержит молекулы актина и, вероятно, миозина, которые встречаются в грибном гифе. У плакозоевых они обеспечивают расслабление или сжатие отдельных волокон и, таким образом, помогают определить форму животного (рис. 13Б) [31].
Синцитиевые сети грибов и трихоплаксов, как и нейронные сети, образуют контакты между элементами сети. Эти контакты могут быть разной проницаемости для бактерий, везикул, молекул, ионов. В нейронных сетях высших многоклеточных контакты нейронов заканчиваются синапсами, через которые проходят нейромедиаторы, ионы. Анимация работы одного нейрона нейронной сети гиппокампа мыши и его взаимодействие с другим нейроном показывает, как отросток одного нейрона ищет контакт с другим нейроном, в результате происходит образование синапса — так формируются нейронные сети у позвоночных. Аналогичный механизм образования контакта свойственен грибным гифам.
Глава 7. История исследования синцитиевых сетей грибов и трихоплакса
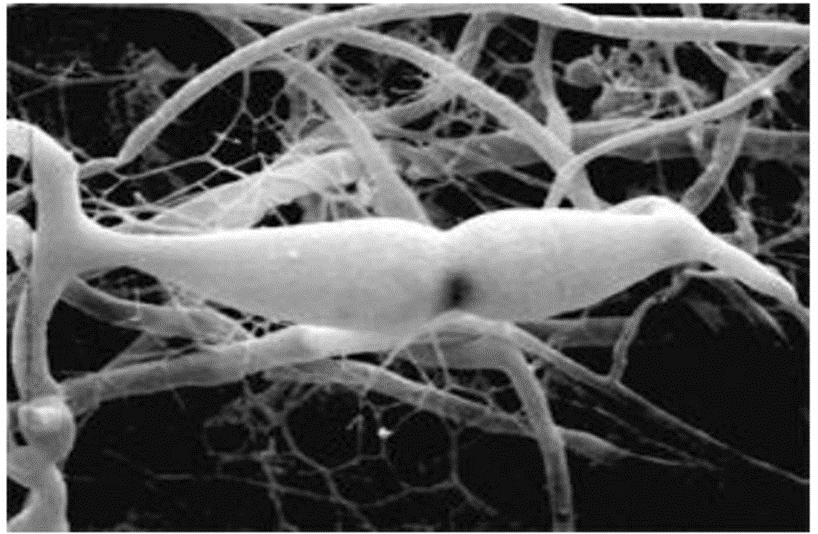
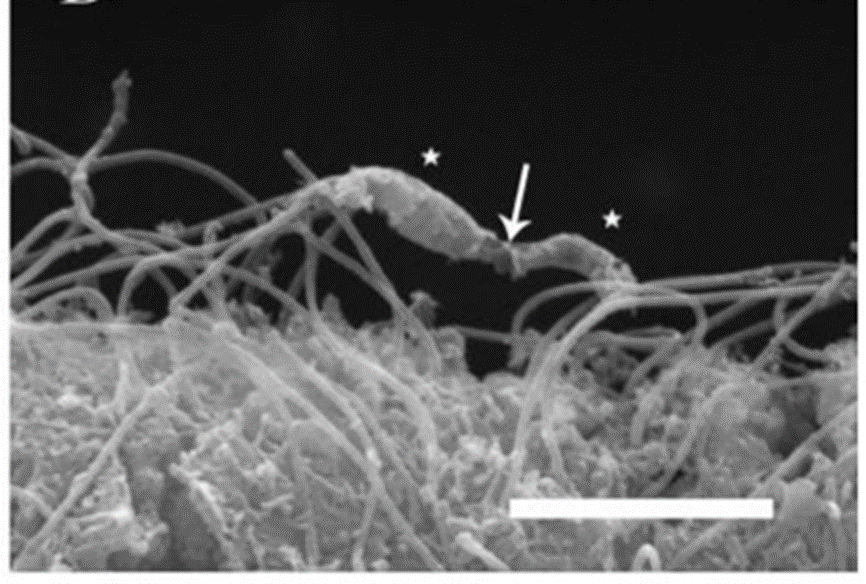
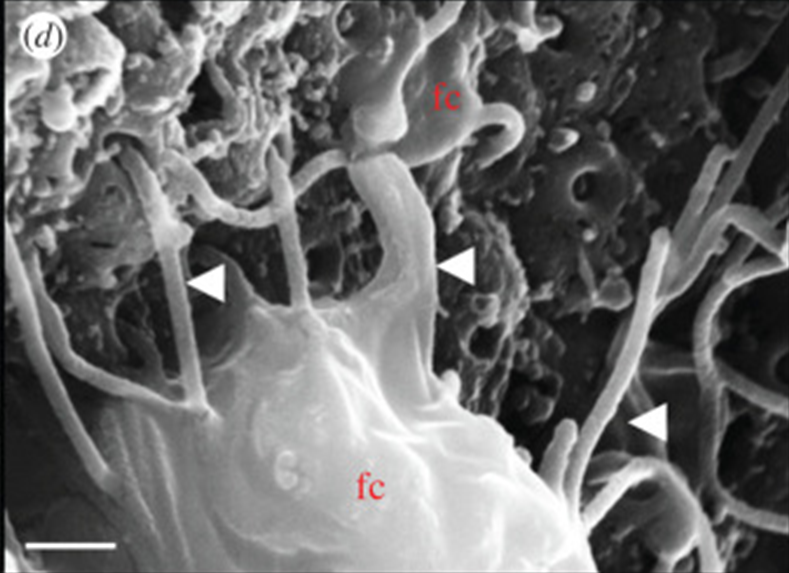
История исследования звездообразного волокнистого синцития трихоплакса полна открытий, ведь это — первое многоклеточное животное без традиционной нервной системы. Для примера, на рис. 14 приведено соединение двух волокнистых клеток и указаны ключевые элементы их соединения, но при этом не классифицированы две круглые клетки с тремя отростками (обозначены стрелками), сопровождающими волокнистые клетки подобно нейроглии, следующей за нейронами в мозгу многоклеточных животных. При описании синцитий у грибов и трихоплаксов хотелось бы иметь больше наглядных фотографий. На рис. 14А приведен синцитий гриба, а на рис. 14Б [32] — контакт двух волоконных клеток трихоплакса. Волокнистые клетки не только контактируют между собой, организуя сеть, но сами имеют большое многообразия по форме. На рис. 14В [33] приведена россыпь различных волокнистых клеток. При рассмотрении волоконно-синтициевой сети внутреннего клеточного строения трихоплакса масштабность линейки имеет значение, потому что можно увидеть более мелкие клетки (рис. 14Г) [34].
В концептуальной работе «Нейронные и альтернативные интегративные системы: молекулярное понимание происхождения нейромедиаторов» [34] приведены фотографии внутренней морфологии Trichoplax adhaerens и, в частности, на рис. 14Г показаны две отличающися по размерам волокнистые клетки. Маленькая округлая клетка с малым числом отростков находится рядом с отростком большой волоконной клетки, у которой большое число отростков разной толщины. Также в этой работе отмечается, что многие другие особенности плакозоев обеспечивают мощную парадигму для будущих исследований электрохимических/эмфатических или химических механизмов поведенческой интеграции без синапсов. Это чисто химический вычислительный интегративный аппарат без нейронов и какого-либо анатомически определенного интегративного центра или ядра [34]. Поиск нового в строении простого многоклеточного животного трихоплакса заставил исследователей присмотреться и к мелким формам клеток в родственной кладе (рис. 15) [35].

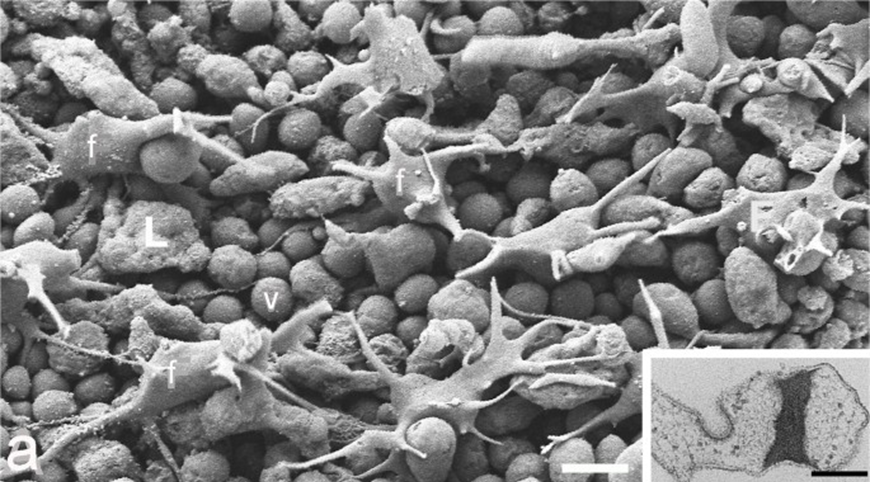
Рисунок 15. Ультраструктура клеток среднего слоя H. hongkongensis.
(а) — на этой сканирующей электронной микрофотографии группа из четырех волоконных клеток (FC) лежит поверх клеток нижнего эпителия. Волокнистые клетки связаны между собой, и их отростки проникают глубоко между эпителиальными клетками;
(б) — неизвестные мелкие клетки (#) с отростками (стрелками) наблюдались в непосредственной близости от волокнистых клеток.
Масштабная линейка: (а) — 5 мкм; (б) — 1,5 мкм
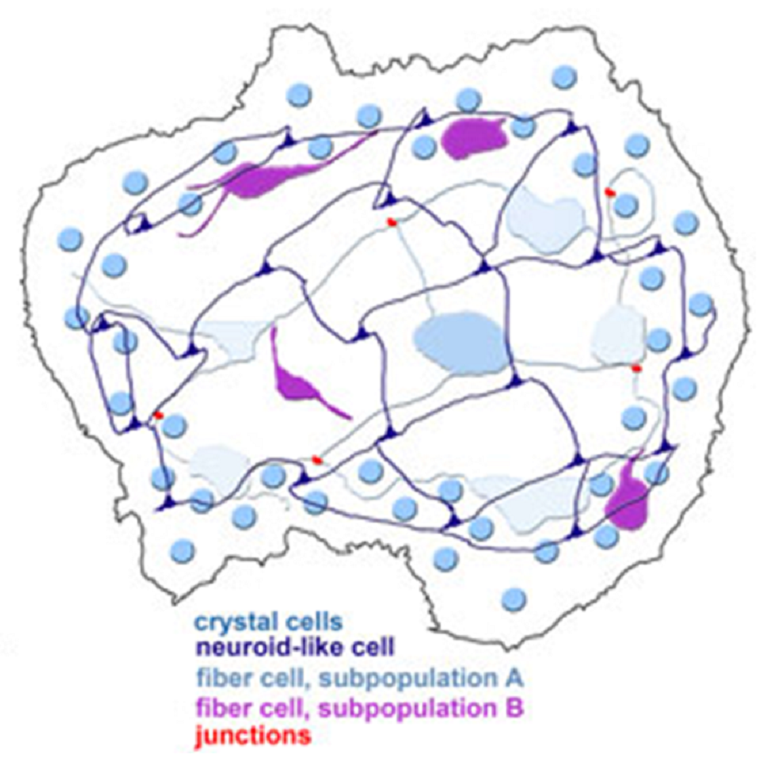
В 2021 году в статье «Сколько глаз у трихоплакса?» [2] я приводил модель зрительного анализатора Трихоплакса и определил Placo Eye и Placo Dorsal Eye и 3D-матрицу волокнистых клеток как протомозг (Placo Brain, мозг пластинчатых). В конце 2022 года в работе «Альтернативные нейронные системы: что такое нейрон? (Гребневики, губки и плакозоаны)» [3] авторы перешли от модели «чисто химический вычислительный интегративный механизм без нейронов...» [34] к новой клеточной модели трихоплакса (рис.14Б), и ввели понятие nlc — нейроидоподобные клетки [3]. Основываясь на результатах инструментальных исследований, а также подтипов волокнистых клеток, мелких (с тремя отростками) нейроидоподобных клеток и размещенных по периметру кристаллических клеток, у которых чашеподобные митохондрии смотрят вовнутрь тела трихоплакса, была построена модель клеточного строения Трихоплакса с учетом плакозоанских нейроидных клеток (рис. 16).
Проведенный анализ строения светочувствительных моделей грибов, трихоплакса, а также синцитиальных структур, в которых находятся бактерии, заставляет задуматься и написать выводы:
- «Почему в Рязани грибы с глазами?» — они обладают светочувствительной системой к красному, синему, фиолетовому свету, которые влияют на ДНК, вызывая экспрессию генов. Это определяет их жизненный цикл. У грибов есть зеленый опсин, но роль его пока неизвестна. Возможно, он достался грибам от бактерий, которые перемещаются в его синцитиальной сети гифов.
- Светочувствительная система грибов родственна таковой у растений, у которых свет также вызывает экспрессию генов ДНК.
- Наиболее древним фрагментом светочувствительной системы является светочувствительность к УФ-А, которая способствует восстановлению ДНК после окислительных стрессов, вызванных повышенной дозой УФ-В и УФ-С.
Благодарности
член-корреспонденту РАН, д.м.н. Капцову Валерию Александровичу; Дейнего Виталию Николаевичу; сотрудникам ФГУП «ВНИИ гигиены транспорта» Роспотребнадзора за поддержку идеи и научное руководство.
Литература
- Разные глаза — разные возможности;
- Сколько глаз у трихоплакса?;
- Leonid L. Moroz, Daria Y. Romanova. (2022). Alternative neural systems: What is a neuron? (Ctenophores, sponges and placozoans). Front. Cell Dev. Biol.. 10;
- Pawel Burkhardt, Jeffrey Colgren, Astrid Medhus, Leonid Digel, Benjamin Naumann, et. al.. (2023). Syncytial nerve net in a ctenophore adds insights on the evolution of nervous systems. Science. 380, 293-297;
- Özlem Sarikaya Bayram, Özgür Bayram. (2023). An Anatomy of Fungal Eye: Fungal Photoreceptors and Signalling Mechanisms. JoF. 9, 591;
- Jack Falcón, Alicia Torriglia, Dina Attia, Françoise Viénot, Claude Gronfier, et. al.. (2020). Exposure to Artificial Light at Night and the Consequences for Flora, Fauna, and Ecosystems. Front. Neurosci.. 14;
- Ignacio Pacheco-Bernal, Fernando Becerril-Pérez, Lorena Aguilar-Arnal. (2019). Circadian rhythms in the three-dimensional genome: implications of chromatin interactions for cyclic transcription. Clin Epigenet. 11;
- Jacques Vanderstraeten, Philippe Gailly, E. Pascal Malkemper. (2020). Light entrainment of retinal biorhythms: cryptochrome 2 as candidate photoreceptor in mammals. Cell. Mol. Life Sci.. 77, 875-884;
- Susie Suh, Elliot H. Choi, Natasha Atanaskova Mesinkovska. (2020). The expression of opsins in the human skin and its implications for photobiomodulation: A Systematic Review. Photoderm Photoimm Photomed. 36, 329-338;
- Lorian E. Schweikert, Laura E. Bagge, Lydia F. Naughton, Jacob R. Bolin, Benjamin R. Wheeler, et. al.. (2023). Dynamic light filtering over dermal opsin as a sensory feedback system in fish color change. Nat Commun. 14;
- Martine E. Maan, Kees D. Hofker, Jacques J. M. van Alphen, Ole Seehausen. (2006). Sensory Drive in Cichlid Speciation. The American Naturalist. 167, 947-954;
- С геномом налегке: минимальный размер бактериального генома — это сколько?;
- Elizabeth Pennisi. (2023). An ancient bacterial gene set the stage for human sight. Science. 380, 119-119;
- Shintaro Sakaki, Reo Ito, Hideki Abe, Masato Kinoshita, Eiichi Hondo, Atsuo Iida. (2023). Electric organ discharge from electric eel facilitates DNA transformation into teleost larvae in laboratory conditions. PeerJ. 11, e16596;
- Козырицкий Д.В. (2021). Митохондриальный датчик света морского животногоTrichoplax H2(Placozoa). Сборник XV Всероссийской научной конференции молодых ученых «Наука. Технологии. Инновации» (НТИ-2021). — С. 146–151;
- Peter Deppisch, Charlotte Helfrich-Förster, Pingkalai R. Senthilan. (2022). The Gain and Loss of Cryptochrome/Photolyase Family Members during Evolution. Genes. 13, 1613;
- Tatiana D. Mayorova, Carolyn L. Smith, Katherine Hammar, Christine A. Winters, Natalia B. Pivovarova, et. al.. (2018). Cells containing aragonite crystals mediate responses to gravity in Trichoplax adhaerens (Placozoa), an animal lacking neurons and synapses. PLoS ONE. 13, e0190905;
- Luis M. Corrochano. (2019). Light in the Fungal World: From Photoreception to Gene Transcription and Beyond. Annu. Rev. Genet.. 53, 149-170;
- Peter Beatrice, Donato Chiatante, Gabriella Stefania Scippa, Antonio Montagnoli. (2022). Photoreceptors’ gene expression of Arabidopsis thaliana grown with biophilic LED-sourced lighting systems. PLoS ONE. 17, e0269868;
- Luigi Gennaro Izzo, Leone Ermes Romano, Lucius Wilhelminus Franciscus Muthert, Maurizio Iovane, Fiore Capozzi, et. al.. (2022). Interaction of gravitropism and phototropism in roots of Brassica oleracea. Environmental and Experimental Botany. 193, 104700;
- Модельные организмы: арабидопсис;
- Дорошенко А.С. Регуляция экспрессии генов хлоропластных белков светом и цитокининами в ходе деэтиоляции Arabidopsis thaliana: дис. ... канд. биол. наук. — Москва, 2022. — 173 с.;
- Вечтомова Ю.Л. , Телегина Т.А., Крицкий М.С. (2020). Эволюция белков семейства ДНК-Фотолиаз/Криптохромов. Успехи биологической химии. 60, 277–316;
- Zheyun Liu, Lijuan Wang, Dongping Zhong. (2015). Dynamics and mechanisms of DNA repair by photolyase. Phys. Chem. Chem. Phys.. 17, 11933-11949;
- В диких условиях: как жил последний всеобщий предок LUCA;
- Нобель vs Шнобель, или Механизмы магниторецепции;
- Молекулярные часы работают не так, как мы думали;
- N Glass. (2004). Hyphal homing, fusion and mycelial interconnectedness. Trends in Microbiology. 12, 135-141;
- Tom Berthold, Florian Centler, Thomas Hübschmann, Rita Remer, Martin Thullner, et. al.. (2016). Mycelia as a focal point for horizontal gene transfer among soil bacteria. Sci Rep. 6;
- Heather Marlow, Detlev Arendt. (2014). Evolution: Ctenophore Genomes and the Origin of Neurons. Current Biology. 24, R757-R761;
- Katja Buchholz, August Ruthmann. (1995). The Mesenchyme-Like Layer of the Fiber Cells of Trichoplax adhaerens (Placozoa), a Syncytium. Zeitschrift für Naturforschung C. 50, 282-285;
- D. Y. Romanova. (2019). Cell types diversity of H4 haplotype Placozoa sp.. mbj. 4, 81-90;
- Carolyn L. Smith, Tatiana D. Mayorova. (2019). Insights into the evolution of digestive systems from studies of Trichoplax adhaerens. Cell Tissue Res. 377, 353-367;
- Leonid L. Moroz, Daria Y. Romanova, Andrea B. Kohn. (2021). Neural versus alternative integrative systems: molecular insights into origins of neurotransmitters. Phil. Trans. R. Soc. B. 376, 20190762;
- Daria Y. Romanova, Frédérique Varoqueaux, Jean Daraspe, Mikhail A. Nikitin, Michael Eitel, et. al.. (2021). Hidden cell diversity in Placozoa: ultrastructural insights from Hoilungia hongkongensis. Cell Tissue Res. 385, 623-637.