Порочный цикл: от рака молочной железы до костных метастазов
17 октября 2018
Порочный цикл: от рака молочной железы до костных метастазов
- 62226
- 1
- 16
Метастазы рака молочной железы в кость. Многие считают рак молочной железы заболеванием, поражающим только женщин. Однако в редких случаях он может развиваться и у мужчин.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Диагностирование рака молочной железы с метастазами в костях — это событие, которое меняет жизнь пациента. Как правило, такую патологию невозможно вылечить, но можно контролировать с помощью постоянного лечения. Что же происходит с костями при метастазировании? Какие методы терапии использует современная медицина?
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В 1889 году британский врач Стивен Педжет описал концепцию «семена и почва». Согласно его теории, опухолевые клетки распространяются по организму не случайным образом, а требуют взаимодействия с микросредой органа-хозяина. Злокачественные клетки, или «семена», атакуют только подходящие для роста органы, то есть «почву». Таким образом, очаги роста опухоли в новых органах (метастазы) будут развиваться только тогда, когда определенные «семена» будут высажены на пригодную для них «почву».
Педжет обнаружил, что у женщин с раком молочной железы (РМЖ) метастазы развивались с гораздо большей вероятностью в костях, чем в любых других органах [1].
Наш обзор посвящен метастазам РМЖ в кость, изменениям, которые вызывают опухолевые клетки в кости, а также современной терапии таких метастазов.
Тема метастазирования опухолей не раз освещалась на «Биомолекуле»: «Во власти опухоли: почему метастазы так сложно остановить?» [2], «Метастазирование опухолей» [3], «МикроРНК участвует в регуляции метастазирования опухолей» [4]. Раку молочной железы посвящена статья «Рак молочной железы с семейной историей» [5].
Рак молочной железы и кость
Рак молочной железы — злокачественная опухоль железистой ткани молочной железы. Это наиболее распространенная злокачественная опухоль у женщин, а по числу заболевших среди мужского и женского населения она занимает второе место после рака легких. В 2018 году было зарегистрировано более двух миллионов новых случаев [6].

Рисунок 1. Очаги возникновения вторичной опухоли при РМЖ. Первоначально опухоль развивается в груди. Однако по мере роста опухоли раковые клетки отрываются и распространяются по соседним тканям или отправляются в отдаленные органы, такие как легкие. Однажды в другой ткани они могут образовать вторичную опухоль.
Современная медицина разработала эффективные способы лечения РМЖ 1–3 стадии, что значительно увеличило выживаемость пациентов [7]. Однако 9 из 10 смертей от РМЖ обусловлены нарушением функций различных органов, вызванным распространением раковых клеток по организму, то есть метастазированием. Как правило, РМЖ может распространяться на кости, головной мозг, легкие, печень и лимфатические узлы (рис. 1). Согласно статистическим исследованиям, самой частой областью метастазирования является кость [8]. Она — преобладающее место развития метастазов люминального и Her2-позитивного типов РМЖ, при этом существенно менее предпочитаемое метастазами трижды негативного типа РМЖ [9].
На ранних стадиях метастазы РМЖ в костях бессимптомны, в результате их трудно выявить. Однако всем пациентам с РМЖ раз в несколько месяцев проводят биохимический анализ крови и биопсию для обнаружения рецидива заболевания. Для диагностирования метастазов в кости необходимо пройти рентгенографию, компьютерную томографию, магнитно-резонансную томографию, сцинтиграфию [8].
Кость — это динамическая ткань, играющая центральную роль в поддержании гомеостаза всего организма. Основными элементами кости считаются остеобласты, которые участвуют в создании и минерализации кости, остеокласты, обеспечивающие разрушение (резорбцию) костной ткани, и остеоциты, поддерживающие структуру (рис. 2). Все эти клетки костной ткани ответственны за «строительные работы»: поглощение старых клеток кости и порождение новых. Они существуют в равновесии и регулируют работу друг друга, что помогает обеспечить гомеостаз кости. Сбалансированный цикл образования и разрушения костной ткани называют добродетельным циклом (от англ. virtuous cycle) ремоделирования костей [10].
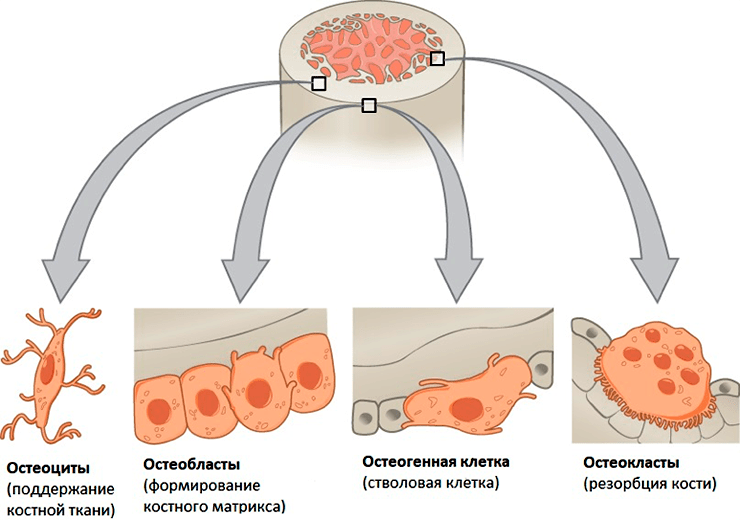
Рисунок 2. Костные клетки. В костной ткани обнаружены четыре типа клеток. Недифференцированные остеогенные клетки могут развиться в остеобласты. Когда остеобласты попадают в кальцинированную матрицу, их структура и функции меняются, и они становятся остеоцитами. Остеокласты по внешнему виду отличаются от других клеток костной ткани.
Кость также содержит красные клетки костного мозга и эндотелиальные клетки, которые образуют капилляры сосудистой системы кости [11].
Все типы клеток разделяют один «дом», следовательно, они взаимодействуют между собой и регулируют функции друг друга. Однако сосудистая система кости направляет метастазирование раковых клеток в эту микросреду [12].
Одиночные клетки могут оторваться от исходной опухоли в груди и распространиться по организму двумя способами: гематогенным (по кровеносным сосудам) и лимфогенным (по лимфатическим сосудам). Лимфогенные метастазы поражают соседние и отдаленные лимфатические узлы, а гематогенные чаще появляются в костном мозге и костях (рис. 3). Более подробно об образовании гематогенных метастазов рассказывает статья «Обнаружены организаторы побега раковых клеток из первичного очага» [13].
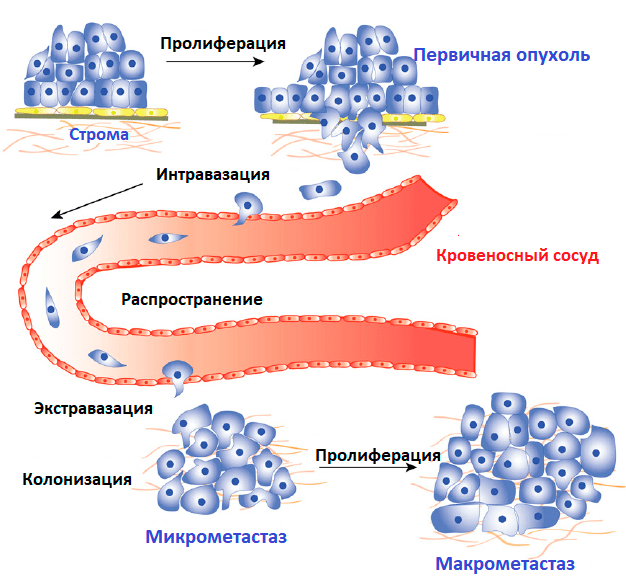
Рисунок 3. Схематическое изображение распространения раковых клеток по кровеносной системе.
Как только клетки РМЖ достигают кости, они создают перекрестные помехи в слаженной работе костных клеток. Раковые клетки врываются в добродетельный цикл и приводят к дисбалансу в сторону резорбции кости. В результате возникает порочный цикл (от англ. vicious cycle).
При определенных условиях раковые клетки отделяются от опухоли и становятся мигрирующими. Они интравазируют в соседние кровеносные сосуды и распространяются по организму, в кровотоке клетки могут попасть в ловушку и экстравазировать. При их выходе в подходящую ткань начинается рост вторичной опухоли.
Даже на ранних этапах РМЖ опухолевые клетки могут мигрировать в костный мозг. Они могут бездействовать долгое время и вызвать рецидив спустя годы .
Про влияние рака на иммунную систему можно прочитать в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [14].
Добродетельный цикл
Процесс ремоделирования костной ткани состоит из пяти основных этапов: покоя, активации, резорбции, реверсии, формирования (рис. 4). В каждом этапе участвуют разные типы клеток кости [15].
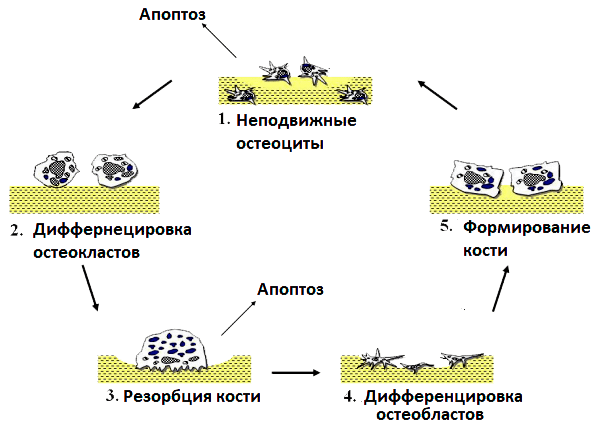
Рисунок 4. Ремоделирование кости. Состоит из пяти фаз: 1) фаза покоя — остеоциты неподвижны; 2) фаза активации — дифференцировка остеокластов из преостеокластов; 3) фаза резорбции — разрушение кости остеокластами; 4) фаза реверсии — дифференцировка остеобластов; 5) фаза формирования — остеобласты создают и минерализуют кость.
Межклеточный матрикс на 85–90% состоит из коллагеновых волокон, которые обеспечивают структурную поддержку минерализации кости. Остальная часть — это протеогликаны, карбоксилированные белки, клеточные адгезивные белки и факторы роста.
Остеобласты образуются из мезенхимных стволовых клеток. Во время своей работы они выделяют в костный матрикс смесь факторов роста и белков, образуя специфическую микросреду. Затем они подвергаются запланированной клеточной гибели или дифференцируются в остеоциты (рис. 5).
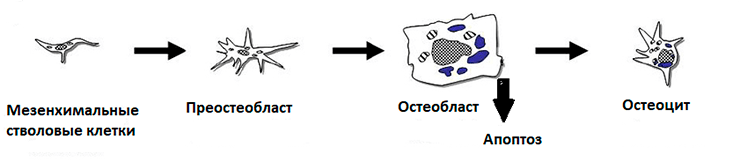
Рисунок 5. Схема дифференцировки остеобластов, остеоцитов. Остеобласты начинают дифференцироваться из мезенхимных стволовых клеток в костном мозге.
Остеобласты выделяют факторы роста кости, включая трансформирующий фактор роста β (TGF-β), инсулиноподобные факторы роста (IGF), факторы роста фибробластов (FGF), интерлейкины, тромбоцитарный фактор роста (PDFG). Эти факторы остаются внутри костного матрикса и высвобождаются после деградации кости. Этот процесс обеспечивает обратную связь между формированием и резорбцией кости [11].
Остеокласты — фагоциты для кости — дифференцируются из линии моноцитов/макрофагов (рис. 6). Активированные остеокласты собираются на поверхности кости и присоединяются к ней через специальные рецепторы. Они подкисляют микроокружение на границе кость—остеокласт и секретируют ферменты, участвующие в деградации: протеазы, коллагеназу и щелочную фосфатазу.
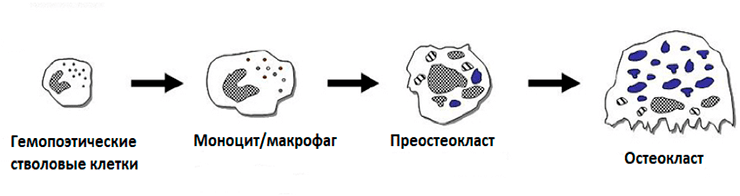
Рисунок 6. Схема дифференцировки остеокластов. Остеокласты — гигантские многоядерные клетки, дифференцируются из гемопоэтических стволовых клеток линии моноцитов/макрофагов костном мозге.
Развитие зрелых остеокластов — это многоступенчатый процесс, который регулируется сложной системой цитокинов и взаимодействием внутри стромы кости. Соседние стромальные клетки и остеобласты продуцируют колониестимулирующий фактор макрофагов (M-CSF), который действует через рецептор колониестимулирующего фактора 1 (c-FMS) на многоядерных предшественниках, и активируют экспрессию рецептора RANK (рис. 7). Его лиганд, RANKL, так же, как M-CSF, синтезируется остеобластами и стромальными клетками в ответ на действие паратиреоидного гормона (PTH). RANKL — цитокин из семейства факторов некроза опухоли. Связываясь со своим рецептором, он активирует ряд важных факторов, которые регулируют экспрессию генов остеокластов. Это создает условия для финальной дифференцировки, слияния предшественников и функционирования возникших многоядерных остеокластов. Активированные остеокласты разрушают кость и высвобождают TGF-β и другие факторы роста кости, усиливающие пролиферацию остеобластов [11].
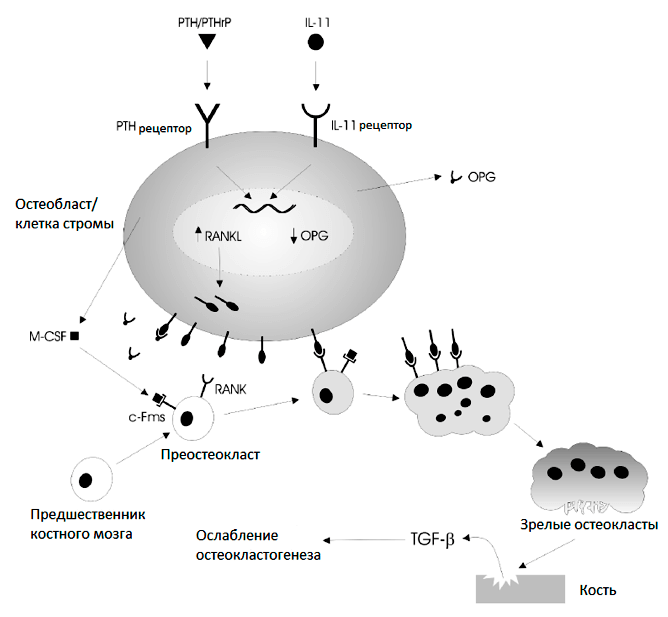
Рисунок 7. Модель нормального костного ремоделирования. Кость постоянно реконструируется. Этот процесс требует взаимодействия костеобразующих остеобластов и костеразрушающих остеокластов. Подробности в тексте.
Остеобласты продуцируют остеопротегерин (OPG) — цитокин из семейства факторов некроза опухоли. Он связывается с RANKL, ингибируя взаимодействие RANK—RANKL, и, следовательно, подавляет остеокластогенез и резорбцию кости. Взаимодействие RANK—RANKL—OPG помогает поддерживать добродетельный цикл.
Что же происходит при метастазировании?
Переключение между добродетельным и порочным циклами связано с деятельностью раковых клеток. Они нарушают баланс костного микроокружения несколькими способами: стимулируют рост и устраняют физический барьер, то есть минерализованную костную матрицу (рис. 8).
О том, как микроокружение влияет на опухоль, можно прочитать в статье «Опухолевые разговоры, или Роль микроокружения в развитии рака» [17].
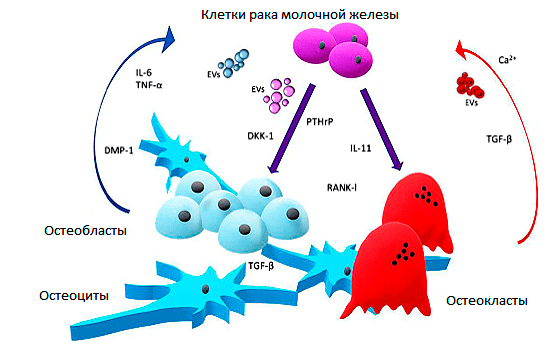
Рисунок 8. Порочный цикл костного метастаза РМЖ. В костях клетки РМЖ секретируют факторы (фиолетовые стрелки), которые нарушают дифференцировку и активность остеобластов, увеличивают продукцию RANKL, усиливая образование остеокластов. На остеокласты они влияют и непосредственно. Зрелые остеокласты разрушают в кость, тем самым высвобождая внедренные в костный матрикс факторы роста. Они, попадая в опухолевое микроокружение, способствуют росту опухоли (красная стрелка). Тот же эффект дают факторы, выделяемые остеобластами и остеоцитами (синяя стрелка).
Традиционно костные метастазы делят на две категории: остеолитические и остеобластные. Остеолитические поражения чаще всего встречаются при РМЖ и характеризуются чрезмерной активацией остеокластов. При этом доминирующий процесс в кости — разрушение. Остеобластные поражения чаще встречаются при раке предстательной железы и характеризуются чрезмерной активацией остеобластов.
Однако в последние годы стало ясно, что разделение костных метастазов на чисто остеолитические или остеобластные неправильно, так как примерно у 20% пациентов с метастазами в кости, возникающими из опухолей молочной железы, поражение смешанное [18].
В этом обзоре мы более подробно рассмотрим механизм остеолитического поражения костной ткани.
В резорбции костной ткани участвуют остеокласты, деятельность которых находится под контролем целого ряда клеток костного мозга. Опухолевым клеткам необходимо препятствовать такому контролю и продуцировать собственные факторы, регулирующие активность остеокластов. Ключевым участником является TGF-β, который активирует рост опухоли и подавляет иммунную систему. TGF-β индуцирует синтез белка, связанного с паратиреоидным гормоном (PTHrP), и интерлейкина 11, которые стимулируют активацию остеокластов. В случае с PTHrP это обусловлено его способностью связываться с рецептором РТН и изменять соотношение RANKL/OPG в пользу RANKL [16].
Опухолевые клетки также продуцируют факторы, ингибирующие дифференцировку остеобластов, а значит, подавляют формирование костей [19].
Роль остеокластов
Таким образом, при метастазировании РМЖ опухолевые клетки усиливают резорбцию кости путем прямого секретирования RANKL, что приводит к высвобождению биоактивных молекул. Эти продукты деградации вовлечены в регуляцию добродетельного цикла и стимулируют рост опухоли в случае развития метастаза в кости. Например, кальций — это первый продукт, выделяющийся при разрушении костного матрикса. Опухолевые клетки экспрессируют на своей поверхности кальций-чувствительные рецепторы, которые реагируют на повышение уровня кальция и стимулируют рост опухоли [20].
При метастазах РМЖ костная ткань резорбируется преимущественно собственными нормальными клетками. Прямая деградация костной ткани опухолью встречается редко. Метастатические клетки РМЖ способны продуцировать коллагеназу и другие ферменты, разрушающие кость [21], [22].
Роль остеобластов
Остеобласты проходят сложный многоступенчатый процесс дифференцировки. Все клетки на разных стадиях дифференцировки играют определенную роль в добродетельном/порочном циклах.
Первый этап дифференцировки представлен преостеобластами, которые находятся в стенках гаверсовых и фолькмановских каналов. Для незрелых остеобластов характерна высокая производительность RANKL. При костных метастазах они могут стимулировать остеолиз [20], [21]. Некоторые источники сообщают, что RANKL может стимулировать пролиферацию вторичной опухоли РМЖ в кости [23], [24].
В присутствии раковых клеток преостеобласты усиливают производство провоспалительных цитокинов, таких как интерлейкин-6, моноцитарный хемотаксический белок, фактор некроза опухоли α, макрофагальный воспалительный белок 2 и др. Эти молекулы помогают поддерживать опухолевые клетки и также являются остеокластогенными.
Зрелые остеобласты, в отличие от преостеобластов, расположены на поверхности эндотелия. Во время формирования кости они выделяют биологически активные вещества, которые проявляют свою функцию только после высвобождения из разрушающейся костной матрицы. Среди этих молекул есть факторы, которые стимулируют рост опухоли и неоангиогенез — формирование новых микрососудов для питания опухоли [11]. В конце концов остеобласты дифференцируются в остеоциты или подвергаются апоптозу .
О том, что такое апоптоз, читайте в другой статье на «Биомолекуле»: «12 методов в картинках: проточная цитофлуориметрия»[25].
Гибель остеобластов — это не случайное событие, а строго регулируемый процесс, необходимый для обеспечения определенного размера и архитектуры кости. Метастазирующая опухоль РМЖ способна вызывать апоптоз остеобластов, продуцируя индукторы апоптоза [11]. Однако влияние апоптотических остеобластов на добродетельный и порочный циклы описано плохо.
Опухолевые клетки также могут выделять вещества, активирующие остеобласты. В настоящее время факторы, ответственные за этот процесс, не совсем ясны. Основная роль отводится эндотелину-1 (ЕТ-1). Этот фактор секретируется клетками РМЖ и рака предстательной железы и стимулирует возникновение остеобластных метастазов. В результате может начаться процесс ненормального костеобразования [26]. Кости быстро растут, становятся утолщенными, жесткими, негибкими.
Роль остеоцитов
Последний этап дифференцировки остеобластов представлен остеоцитами. Они локализованы в костном матриксе, что делает их идеальными регуляторами ремоделирования кости. Однако это же преимущество становится недостатком при развитии костных метастазов, поскольку они способны подпитывать порочный цикл.
Остеоциты — важные продуценты RANKL. Также они могут контролировать метастатический рост, секретируя факторы, некоторые из которых активируют пролиферацию раковых клеток молочной железы [16].
Терапевтические стратегии
Пациент с костными метастазами испытывает мучительную сильную боль, у него повышается риск переломов, качество жизни катастрофически снижается. Терапия метастазов РМЖ в кости включает в себя различные методы, которые могут влиять как на саму опухоль, так и на ее микроокружение [11].
Чаще всего метастатический РМЖ возникает через несколько месяцев или лет после завершения лечения раннего рака. Риск возникновения вторичной опухоли после лечения РМЖ варьирует от человека к человеку. Но это сильно зависит от характеристики раковых клеток, стадии первичной опухоли, способов лечения. Например, в течение 15 лет вторичная опухоль в кости возникает у примерно 30% пациентов с HER2-позитивным и у 15% — с трижды негативным РМЖ [9].
Наиболее агрессивной вторичной опухолью считается метастатический трижды негативный РМЖ. Он часто поражает пациенток молодого возраста. С таким типом метастазов продолжительность жизни пациентов может не превысить и 6 месяцев [27].
В настоящее время метастатический РМЖ нельзя излечить. Однако это не означает, что его нельзя лечить. Терапия метастазов РМЖ в кости направлена на увеличение продолжительности и качества жизни. Современные методы лечения в США позволяют продлить жизнь 35% таких пациентов по меньшей мере на пять лет, а некоторые пациенты могут прожить 10 и более лет после постановки диагноза [27].
До начала лечения врач объясняет, какие поправки нужно внести в диету и образ жизни пациента. Во-первых, необходимо принимать достаточное количество кальция и витамина D, во-вторых, регулярно выполнять физические упражнения. Соблюдение этих правил позволит пациенту сохранить кости крепкими и минимизировать проявления остеопороза [28].
Тактику лечения врач определяет индивидуально для каждого пациента в зависимости от:
- типа и локализации первичной опухоли;
- количества и расположения вторичных опухолей в кости;
- наличия метастазов в других органах;
- возраста и общего состояния больного;
- предыдущего лечения;
- побочных эффектов.
В лечении костных метастазов можно выделить два основных подхода:
- системную терапию, которая направлена на лечение первичной опухоли;
- местную терапию, которая должна облегчить боли пациентов и уничтожить вторичную опухоль [27].
Системная терапия
Системная терапия включает в себя гормональную терапию, химиотерапию и таргетную терапию.
Гормональная терапия
Гормональная, или эндокринная, терапия — основной способ лечения пациентов с метастатическим РМЖ, положительным по эстрогеновым/прогестероновым рецепторам. Такой способ лечения подразумевает, что лекарственный препарат блокирует действие эстрогена или прогестерона либо снижает их концентрацию в организме. Это может замедлить рост и деление опухолевых клеток.
Существуют различные факторы, позволяющие определить, какой вид гормональной терапии подходит пациенту. К ним относится эффективность и безопасность доступных видов лечения, предшествующая терапия (в том числе гормональная), но в первую очередь — нахождение пациентки в пременопаузе или постменопаузе. Для женщин в пременопаузе гормональная терапия начинается с подавления функции яичников, чтобы остановить производство гормонов. В постменопаузе яичники уже не функционируют, и эстроген производится в жировой ткани и надпочечниках; в этом случае используют ингибиторы ароматаз [27].
Если первый препарат гормональной терапии перестает работать, то назначают второй, и т.д. В какой-то момент — может, через несколько месяцев или лет — гормональная терапия перестает вызывать ответ, и тогда рекомендуют переключиться на химиотерапию.
Побочные эффекты эндокринной терапии зависят от вида лечения и могут включать в себя мышечные боли, чувство усталости, легкую тошноту. К серьезным побочным эффектам относят повышение риска инсульта, рак матки, потерю прочности костей [29].
Химиотерапия
Химиотерапия — это первый этап лечения метастазов РМЖ, если первичная опухоль HER2-положительная и не имеет рецепторов к эстрогену/прогестерону. К химиотерапии обращаются и когда гормональная терапия перестает действовать [27].
Химиотерапевтические препараты, например 5-фторурацил, капецитабин или метотрексат, попадая в кровоток, разносятся по всему организму, уничтожая любые быстрорастущие клетки, в том числе и здоровые.
На выбор вида химиотерапии влияют агрессивность и быстрота роста раковых клеток, предшествующие варианты химиотерапии, побочные эффекты и т.д. [28].
Как и при гормональной терапии, если первый препарат или комбинация препаратов перестали действовать, и опухоль начинает расти, переходят на второй, третий и т.д. препараты. С каждым таким переходом шансов на уменьшение размеров опухоли становится всё меньше.
Побочные эффекты зависят от вида лекарства. К наиболее частым относят усталость, анемию, выпадение волос, тошноту и рвоту, а к самым серьезным — поражения сердца, легких, почек, вероятность возникновения другого вида рака. Пациентам могут назначать лекарственные средства, которые предотвращают или уменьшают выраженность побочных эффектов. Например, некоторые химиотерапевтические препараты повреждают ДНК, и для ее репарации и снижения вероятности возникновения устойчивости к химиотерапии назначают поли(AДФ-рибоза)-полимеразы (PARP) [28].
Таргетная терапия
Таргетная, или молекулярно-таргетная, терапия — активно развивающееся направление лечения рака. Она блокирует рост раковых клеток за счет вмешательства в конкретный молекулярный механизм канцерогенеза.
Таргетная терапия используется как системный подход для лечения костных метастазов РМЖ. Она применяется либо в виде монотерапии, либо в сочетании с гормональной или химиотерапией.
Для лечения положительных по эстрогеновым/прогестероновым рецепторам и HER2-негативных метастазов РМЖ используют ингибиторы киназ CDK4 и CDK6. Ингибиторы CDK4/6 предназначены для прерывания роста опухолевых клеток. FDA одобрило три препарата на их основе: рибоциклиб, палбоциклиб, абемациклиб. Первый из них в начале 2018 года одобрил и Минздрав России.
Для увеличения эффективности эндокринной терапии положительных по гормональным рецепторам и HER2-негативных метастатических опухолей используют ингибиторы mTOR [27].
Для лечения HER2-позитивного метастатического рака активно применяют ингибиторы тирозинкиназы, такие как лапатиниб [27].
Многие таргетные методы лечения относятся к иммунотерапии. Иммунотерапия — это новейший, действенный и перспективный метод лечения многих форм рака. В последнее время ее применяют и для лечения костных метастазов.
Есть два способа действия: усиление иммунной системы, чтобы организм сам боролся с раком, и использование белков, уничтожающих раковые клетки. Иммунотерапия рака предполагает введение в организм противоопухолевых биопрепаратов: цитокинов, моноклональных антител или опухолевых вакцин. Ее используют и в системном, и в местном лечении вторичных опухолей при РМЖ.
Про иммунотерапию опухолевых заболеваний «Биомолекула» рассказывала в статьях: «Иммуностимулирующие вакцины» [30], «Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак» [31], «Прямая атака в центр опухоли» [32].
Иммунотерапия в качестве системного подхода применяется в лечении HER2-позитивного РМЖ. Опухолевые клетки этого типа выставляют на своей поверхности большое количество рецепторного белка HER2, который важен для их роста. И для лечения используют антитела, которые блокируют внутриклеточные сигналы синтеза этого белка или вмешиваются в его работу. К таким моноклональным антителам относятся трастузумаб и пертузумаб [27].
Побочные эффекты таргетной терапии зависят от вида лекарственного средства. Однако для всех них типичны тошнота, рвота, диарея и слабость. К серьезным побочным эффектам можно отнести снижение сердечной функции и заболевания печени, например гепатит [28].
Местная терапия
Местную, костно-таргетную терапию в сочетании с системной рекомендуют всем пациентам с костными метастазами РМЖ. К ней относят использование бисфосфонатов и деноcумаба, лучевую терапию и хирургические вмешательства. Выбор между этими видами лечения зависит от размера метастазов, осложнений, предпочтений пациента.
Бисфосфонаты
Бисфосфонаты — это стандартная терапия, используемая для уменьшения боли в костях, снижения темпов метастазирования, предотвращения потери костной массы и значительного улучшения качества жизни пациентов.
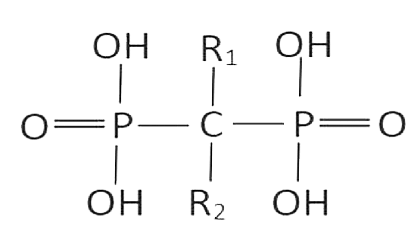
Рисунок 9. Формула бисфосфоната
Бисфосфонаты представляют собой молекулы, состоящие из двух фосфонатных групп, соединенных атомом углерода (рис. 9). Такая химическая конфигурация позволяет им с высокой степенью сродства связываться с гидроксиапатитной составляющей кости. Дополнительные функциональные группы, присоединенные к центральному атому углерода, придают бисфофонатам различные фармакологические свойства [7].
Бисфосфонаты вводят в организм перорально или путем инфузий. Основной механизм их действия заключается в ингибировании резорбции кости, поскольку после эндоцитоза они стимулируют апоптоз остеокластов. Это разрывает порочный круг сигналов между остеокластами и раковыми клетками в кости [16].
Применение бисфосфонатов может сопровождаться гриппоподобными симптомами и гипокальциемией. Эти препараты обладают выраженной нефротоксичностью и противопоказаны при низком клиренсе креатинина. Их применение, в особенности золедроновой кислоты, повышает риск остеонекроза челюстей.
Лучевая терапия
У пациентов с метастатическим РМЖ радиотерапию используют как способ облегчения боли и профилактики осложнений [33].
Машина фокусирует ионизирующее излучение на метастазах в кости. Облучение, длящееся всего несколько минут, уничтожает раковые клетки.
Побочные эффекты зависят от облучаемого места. К наиболее распространенным последствиям лучевой терапии относятся раздражение кожи и чрезмерная утомляемость [28].
Для радиотерапии могут использоваться и так называемые радиофармацевтические препараты. Обычно это радиоизотопы щелочно-земельных металлов (стронций-89, самарий-153). Их можно избирательно доставлять прямо к метастазу. Во-первых, они могут самостоятельно накапливаться в зонах повреждения кости (как «имитаторы» кальция). Во-вторых, радиоизотопы можно конъюгировать с лигандами, обеспечивающими их направленную доставку в кость [29], [34]. В области костных метастазов исходящее от препарата излучение «убивает» рак.
Препарат усиливает местный эффект лучевой терапии, облегчает боль, иногда сокращает потребность в дальнейшей радиационной терапии.
К основным недостаткам использования радиоизотопов относится уменьшение содержания в крови тромбоцитов и лейкоцитов [28].
Хирургия
Хирургическое вмешательство у пациентов с метастазами в кости проводится редко. Основное показание для него — патологический перелом [7]. С помощью хирургии также можно стабилизировать слабую кость путем вставки винтов, стержней и т.д.
Иммунотерапия
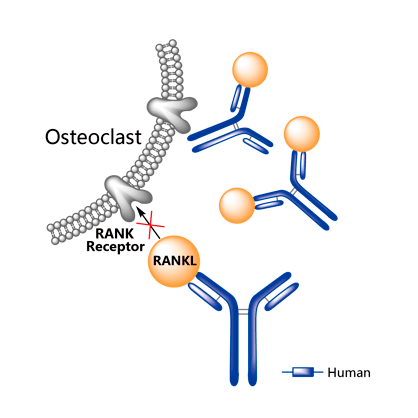
Рисунок 10. Механизм действия деносумаба. Высокоаффинное связывание деносумаба с RANKL ингибирует созревание и активность остеокластов, предотвращая взаимодействие RANKL с рецептором RANK на зрелых и незрелых остеокластах.
Иммунотерапией при местном лечении костных метастазов РМЖ можно назвать применение деноcумаба.
Деноcумаб — человеческое моноклональное антитело (IgG2), которое специфично связывается с RANKL. В результате не образуется связи RANKL—RANK (рис. 10). Лечение денозумабом предотвращает производство остеокластов и, следовательно, останавливает резорбцию кости [7].
На фоне применения деносумаба часто развиваются суставные и мышечные боли, гипокальциемия, инфекционные заболевания [35].
Будущие направления
Сейчас ведется разработка средств для лечения метастатического рака молочной железы, нацеленных на новые мишени. Мишенями могут стать катепсин К, TGF-β, PTHrP, хемокиновые рецепторы и т.д. [30], [34]. Эти молекулы играют важную роль в порочном цикле, следовательно, воздействие на них может остановить рост вторичной опухоли или разрушение кости. Перспективным препаратом остается и деносумаб. Показано, что он улучшает минеральную плотность костей [20]. Однако из-за сложности механизмов костного метастазирования возникает необходимость комбинирования лекарственных препаратов, нацеленных на разные мишени.
Следующая задача состоит в том, чтобы разработать для каждого пациента индивидуальное лечение, предсказывая возможный клинический исход. Геномное и протеомное профилирование имеет прогностический потенциал, коррелирующий с прогрессированием заболевания. Такое профилирование может прогнозировать и исход лечения тем или иным препаратом. В будущем подобные технологии помогут отбирать пациентов, находящихся в группе риска возникновения метастатического РМЖ, и исключать ненужное лечение [20], [21].
Таким образом, РМЖ с метастазами в костях — это уже не приговор. Но, к сожалению, лечение такого рака — сложный, выматывающий процесс. Разумеется, говорить о 100% излечении пока невозможно. Однако использование стандартных терапевтических методов совместно с новыми подходами способно продлить жизнь пациентам и улучшить их состояние, то есть игра всё же стόит свеч.
Важно запомнить, что рак — это не паразит, который колонизирует и разрушает здоровые ткани. Это «умная» группа клеток, которая взаимодействует с нормальными клетками хозяина и использует важные тканевые сигналы ради собственного благополучия.
Литература
- Andrew S. Gdowski, Amalendu Ranjan, Jamboor K. Vishwanatha. (2017). Current concepts in bone metastasis, contemporary therapeutic strategies and ongoing clinical trials. J Exp Clin Cancer Res. 36;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Метастазирование опухолей;
- МикроРНК участвуют в регуляции метастазирования опухолей;
- Рак молочной железы с семейной историей;
- Freddie Bray, Jacques Ferlay, Isabelle Soerjomataram, Rebecca L. Siegel, Lindsey A. Torre, Ahmedin Jemal. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians;
- Kimberly D. Miller, Rebecca L. Siegel, Chun Chieh Lin, Angela B. Mariotto, Joan L. Kramer, et. al.. (2016). Cancer treatment and survivorship statistics, 2016. CA: A Cancer Journal for Clinicians. 66, 271-289;
- Faustine Williams, Stephen Jeanetta, Aimee S. James. (2016). Geographical Location and Stage of Breast Cancer Diagnosis: A Systematic Review of the Literature. Journal of Health Care for the Poor and Underserved. 27, 1357-1383;
- Hagen Kennecke, Rinat Yerushalmi, Ryan Woods, Maggie Chon U. Cheang, David Voduc, et. al.. (2010). Metastatic Behavior of Breast Cancer Subtypes. JCO. 28, 3271-3277;
- Alfredo Cappariello, Mattia Capulli. (2018). The Vicious Cycle of Breast Cancer-Induced Bone Metastases, a Complex Biological and Therapeutic Target. Curr Mol Bio Rep. 4, 123-131;
- «Структура костной ткани и кровообращение». «Лечение асептического некроза»;
- Daniel L Coutu, Konstantinos D Kokkaliaris, Leo Kunz, Timm Schroeder. (2017). Three-dimensional map of nonhematopoietic bone and bone-marrow cells and molecules. Nat Biotechnol. 35, 1202-1210;
- Обнаружены организаторы побега раковых клеток из первичного очага;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- «Ремоделирование костной ткани». «Островок здоровья»;
- Gary G. Meadows Integration/Interaction of Oncologic Growth — Springer Netherlands, 2005;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Link Y., Romano A., Bejar J., Schiff E., Dotan Y. (2016). Widespread osteoblastic metastases and marked elevation of CA19-9 as a presentation of signet ring cell gastric carcinoma. J. Gastrointest. Oncol. 7, E1–5;
- Katherine N. Weilbaecher, Theresa A. Guise, Laurie K. McCauley. (2011). Cancer to bone: a fatal attraction. Nat Rev Cancer. 11, 411-425;
- Alfredo Cappariello, Antonio Maurizi, Vimal Veeriah, Anna Teti. (2014). Reprint of: The Great Beauty of the osteoclast. Archives of Biochemistry and Biophysics. 561, 13-21;
- Garrett R.I. (1993). Bone destruction in cancer. Sem. Oncol. 20 (3 suppl 2), 4–9;
- Wende Kozlow, Theresa A. Guise. (2005). Breast Cancer Metastasis to Bone: Mechanisms of Osteolysis and Implications for Therapy. J Mammary Gland Biol Neoplasia. 10, 169-180;
- Shuan Rao, Shane J.F. Cronin, Verena Sigl, Josef M. Penninger. (2018). RANKL and RANK: From Mammalian Physiology to Cancer Treatment. Trends in Cell Biology. 28, 213-223;
- Schuster C., Mo H., Shen C.L., Gollahon L. (2017). RANK/RANKL/ OPG: The Axis of Breast Cancer Bone Metastasis Evil? Ann. Breast Cancer Res. 2, 1008;
- 12 методов в картинках: проточная цитофлуориметрия;
- JA KANIS, N OROURKE, EV MCCLOSKEY. (1994). CONSEQUENCES OF NEOPLASIA INDUCED BONE-RESORPTION AND THE USE OF CLODRONATE (REVIEW). Int J Oncol;
- Komen S.G. (2018). Recommended treatments for metastatic breast cancer. Susan G Komen;
- «Рассказываем историю о метастатическом раке молочной железы». (2017). AstraZeneca;
- Bob Li, Matthew Wong, Nick Pavlakis. (2014). Treatment and Prevention of Bone Metastases from Breast Cancer: A Comprehensive Review of Evidence for Clinical Practice. JCM. 3, 1-24;
- Иммуностимулирующие вакцины;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- Прямая атака в центр опухоли;
- Darren Brady, Chris C. Parker, Joe M. O’Sullivan. (2013). Bone-Targeting Radiopharmaceuticals Including Radium-223. The Cancer Journal. 19, 71-78;
- Tomifumi Onishi, Naoki Hayashi, Richard L. Theriault, Gabriel N. Hortobagyi, Naoto T. Ueno. (2010). Future directions of bone-targeted therapy for metastatic breast cancer. Nat Rev Clin Oncol. 7, 641-651;
- European public assessment report (EPAR) for Prolia. (2016). European Medicines Agency;
- Meera Saxena, Gerhard Christofori. (2013). Rebuilding cancer metastasis in the mouse. Molecular Oncology. 7, 283-296;
- Marie-Eve Marquis. (2009). Bone cells-biomaterials interactions. Front Biosci. Volume, 1023.