
12 методов в картинках: проточная цитофлуориметрия
27 октября 2017
12 методов в картинках: проточная цитофлуориметрия
- 50274
- 0
- 41
рисунок Ольги Пташник
-
Авторы
-
Редакторы
-
Иллюстратор
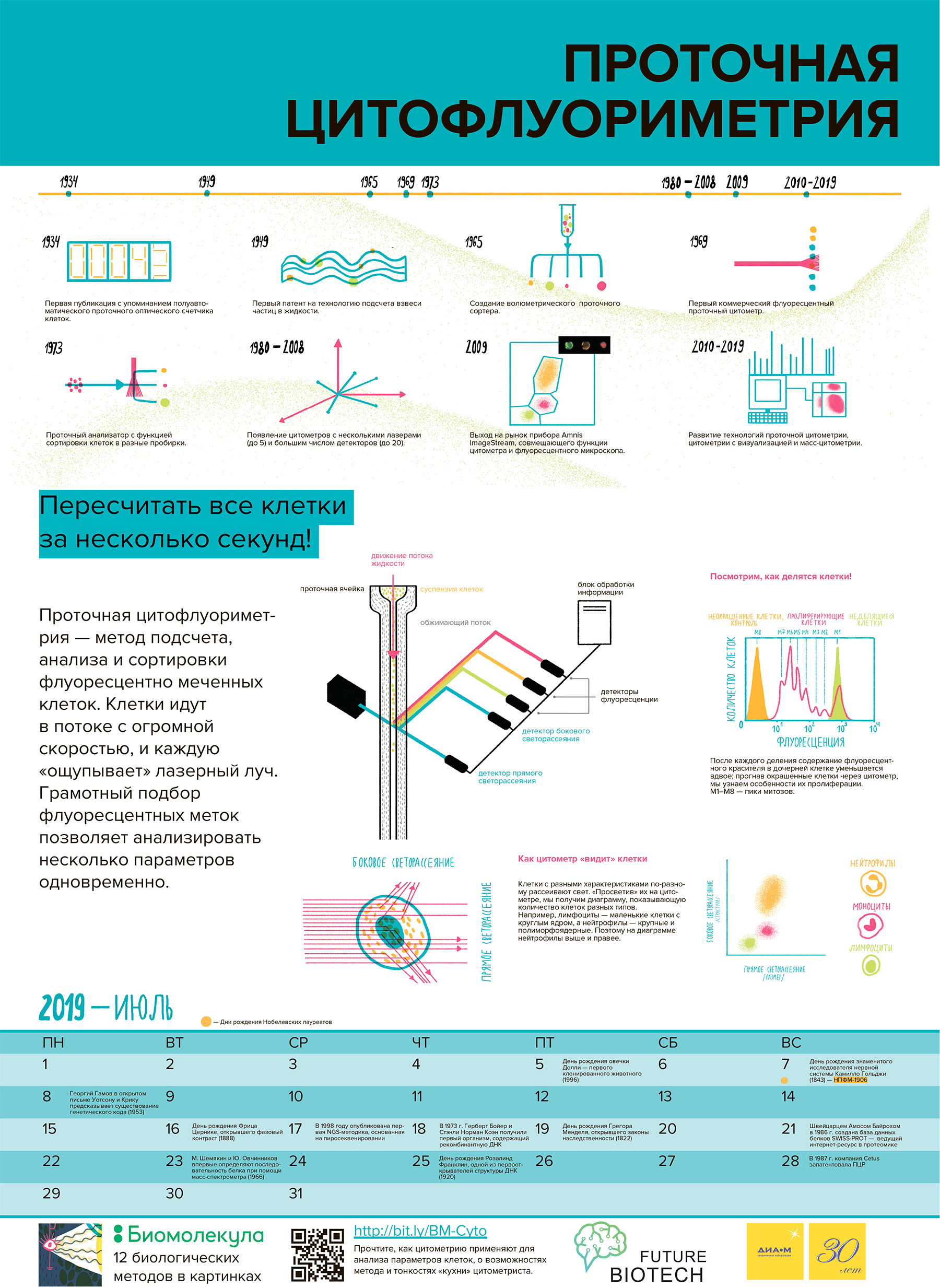
Проточная цитофлуориметрия — необычайно функциональный метод, который позволяет разносторонне анализировать различные популяции клеток, причем не «в среднем», а каждую клетку в отдельности. Метод разработали еще в середине 20 века, а ныне его используют не только ученые, но и врачи-клиницисты. Несмотря на то, что проточную цитофлуориметрию нельзя назвать простой (сложное оборудование, трудности пробоподготовки и интерпретации результатов), она становится всё более и более популярной. В этом обзоре мы расскажем об основных достоинствах метода, его возможностях и, конечно, о необходимых тонкостях «кухни» цитометриста.
12 биологических методов в картинках

Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Основная идея проточной цитометрии — «поштучный» анализ клеток в потоке, проходящий с большой скоростью. Представьте себе суспензию клеток, которую необходимо изучить: это может быть кровь или ее фракции, отдельные популяции лимфоцитов или даже потенциально раковые клетки. Если это клеточная линия, то задача достаточно тривиальная — вы можете считать, что суспензия однородная, то есть все клетки одинаковые просто по определению клеточной культуры . Но что, если вам нужно изучить неоднородную суспензию — например, в вашей клеточной линии наблюдается самопроизвольная дифференцировка? Или же вы хотите исследовать биологические жидкости (например, кровь), где находится несколько (или даже много) типов клеток? А что, если вам нужно отличить раковые клетки от здоровых?
О том, что такое клеточные культуры, а также о технологиях работы с ними, читайте в другой статье этого цикла: «12 методов в картинках: клеточные технологии» [1].
Особенно важно, что иногда отличить разные клетки при помощи микроскопии не представляется возможным: в микроскоп они просто-напросто выглядят одинаково. А ведь нам зачастую нужно не просто отличить одни клетки от других, но и проанализировать те или иные их параметры: выживаемость, экспрессию белков, целостность ДНК и многое другое.
В этом случае на помощь и придет проточная цитометрия. Ее физические принципы весьма просты. Суспензия клеток, предварительно помеченных светящимися молекулами (флуорохромами), помещается в поток жидкости, пропускаемый через проточную ячейку. Получается как бы «поток в потоке», что порождает эффект гидродинамического фокусирования: исследуемые клетки выстраиваются в цепочку и в таком порядке пересекают пучок световых (обычно лазерных) лучей, служащих для анализа каждой отдельно взятой клетки.
Свет, исходящий от флуорохромов, фокусируют при помощи оптической системы, состоящей из нескольких зеркал и линз, а затем раскладывают на определенные компоненты. Полученные световые сигналы преобразуют в электрические импульсы и анализируют при помощи специального программного обеспечения.
Таким образом, результат цитометрического анализа — определение состояния каждой клетки в каждой из популяций образца. Всего за несколько десятков секунд сквозь проточную ячейку проходят тысячи клеток, позволяя исследователю сделать вывод о составе и характеристиках клеточной суспензии. Также при помощи проточного цитометра можно определить абсолютное число клеток в исследуемом образце с использованием калибровочных счетных микросфер или волюметрическим методом — прекрасная, хоть и дорогая, альтернатива камере Горяева!
История одной военной разработки
Метод проточной цитометрии возник на основе опытов по подсчету числа и измерению размеров частиц, проведенных еще в эпоху Второй мировой войны (рис. 1). Первая публикация о возможности подсчета бактерий в капилляре при помощи фотоэлектрических эффектов появилась в 1934 году [2]. За военные и послевоенные годы на основании этого метода разработали счетчик микроорганизмов в аэрозолях, чтобы ускорить идентификацию бактерий и спор в воздухе при использовании биологического оружия [3]. Поток воздуха проходил через освещенное поле в камере анализа, где в качестве источника света использовали лампу от фары автомобиля Ford, а также были установлены детектор с фотоумножителем.
Вторая актуальная практическая задача — подсчет и разделение клеток крови — повлекла за собой дальнейшее развитие технологии, и в 1954 году вышел счетчик клеток Coulter Counter Model A, получивший широкое применение в клинической гематологии.
Первый проточный цитометр, использующий флуоресценцию (ICP11), сконструировал в 1968 году Вольфганг Гёде (Wolfgang Göhde) в университете германского города Мюнстера. Уже год спустя прибор был выпущен на рынок немецкой компанией Partec. Однако в то время методы, основанные на абсорбции, пользовались гораздо большей популярностью, чем применение флуоресцентных меток. Первоначально проточную цитометрию назвали импульсной цитофотометрией. За следующие 10 лет вышло еще несколько коммерческих моделей цитометров: Cytoflourograph (1971) от Bio/Physics Systems Inc, PAS 8000 (1973) от Partec, FACS (1974) от Becton Dickinson, ICP 22 (1975) от Partec/Phywe и Epics от Coulter (1977–1978). Эти приборы уже обладали способностью измерять интенсивность флуоресценции при двух и более длинах волн и определять сразу несколько параметров клеток. В 1978 году на конференции Американского инженерно-технического фонда предложили назвать метод проточной цитометрией. Это название приобрело популярность и используется до сих пор.
Сейчас выпускают два основных типа приборов для проточной цитометрии:
- простые в использовании аппараты, которые могут измерять флуоресценцию при двух и более длинах волн и светорассеяние под углом около 10° (малоугловое прямое рассеяние) и 90°;
- большие клеточные сортеры, которые не только измеряют пять и более клеточных или ядерных параметров, но и автоматически сортируют частицы с заданным набором этих параметров по отдельным фракциям.
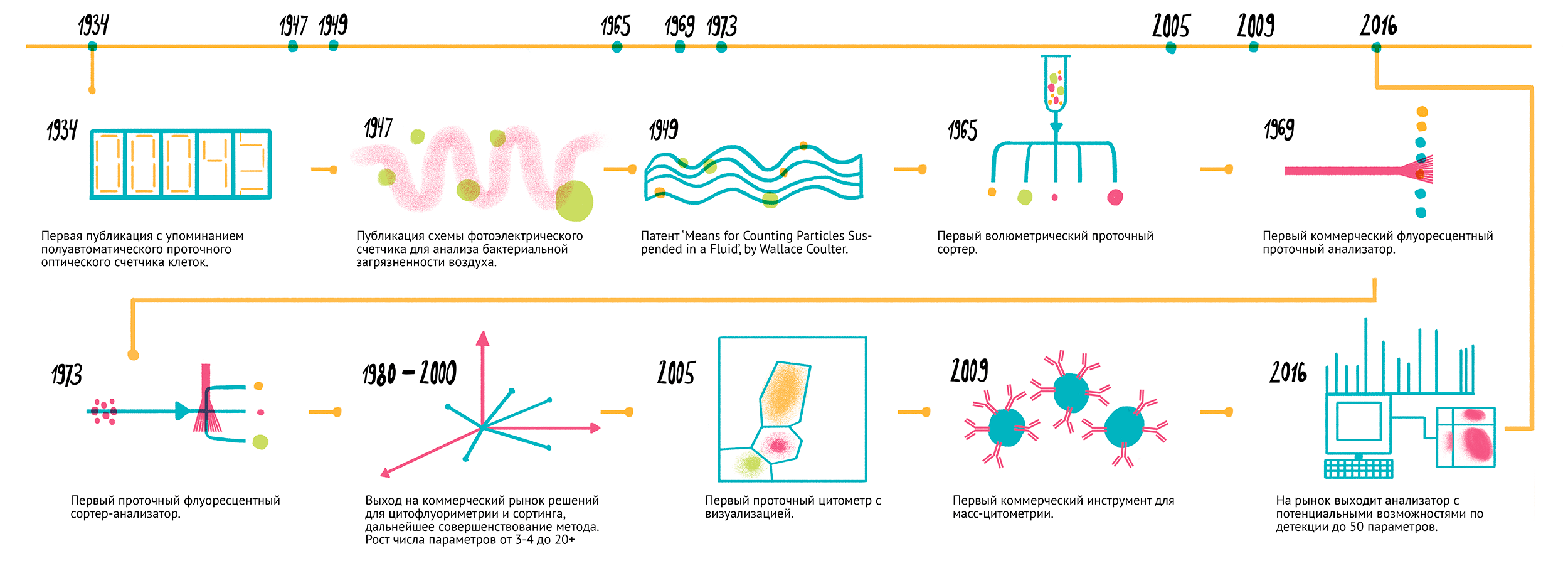
Рисунок 1. Основные исторические вехи на пути развития проточной цитометрии. 1934 г. — Первая публикация с упоминанием полуавтоматического проточного оптического счетчика клеток. 1947 г. — Публикация схемы фотоэлектрического счетчика для анализа бактериальной загрязненности воздуха [3]. 1949 г. — Патент Уолласа Коултера Means for counting particles suspended in a fluid. 1965 г. — Первый волюметрический проточный анализатор [4]. 1969 г. — Первый коммерческий флуоресцентный проточный анализатор (цитометр) (Wolfgang Göhde, ICPII, Partec). 1973 г. — BD FACS-1 — первый проточный флуоресцентный сортер-анализатор [5]. 1980–2000-е гг. — Выход на коммерческий рынок решений для цитофлуориметрии и сортинга, дальнейшее совершенствование метода. Рост числа параметров от 3–4 до 20+ (BD LSR-II, Cytopea Influx). 2005 г. — Первый проточный цитометр с визуализацией Amnis ImageStream 100. 2009 г. — Первый коммерческий инструмент для масс-цитометрии CyTOF 2. 2016 г. — BD выпускает на рынок анализатор BD Symphony с потенциальными возможностями по детекции до 50 параметров.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Основные принципы метода
Суть проточной цитометрии, пожалуй, можно изложить всего одним предложением: поток клеточной суспензии в ячейке сжимается, клетки выстраиваются в очередь и проходят через лазерный луч, регистрация рассеяния от которого позволяет охарактеризовать каждую клетку в потоке индивидуально. Этот процесс изображен на рисунке 2.
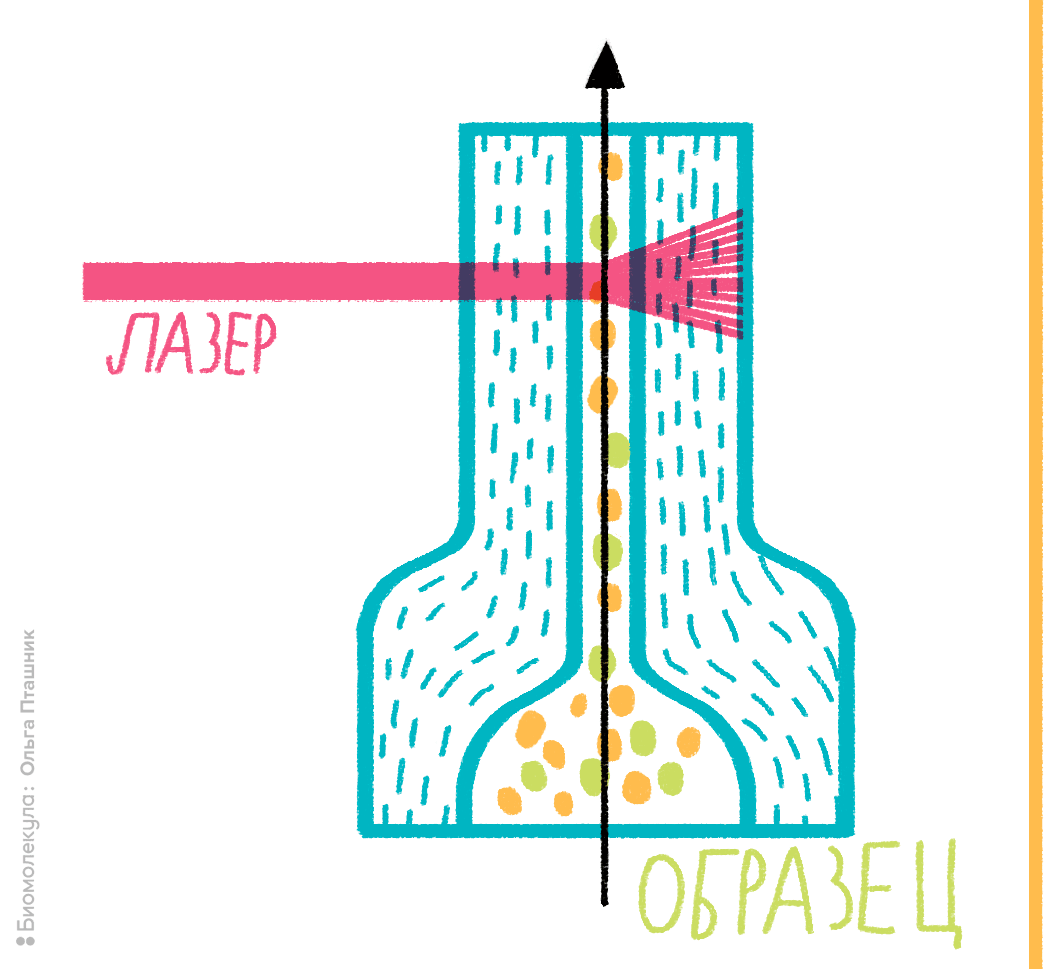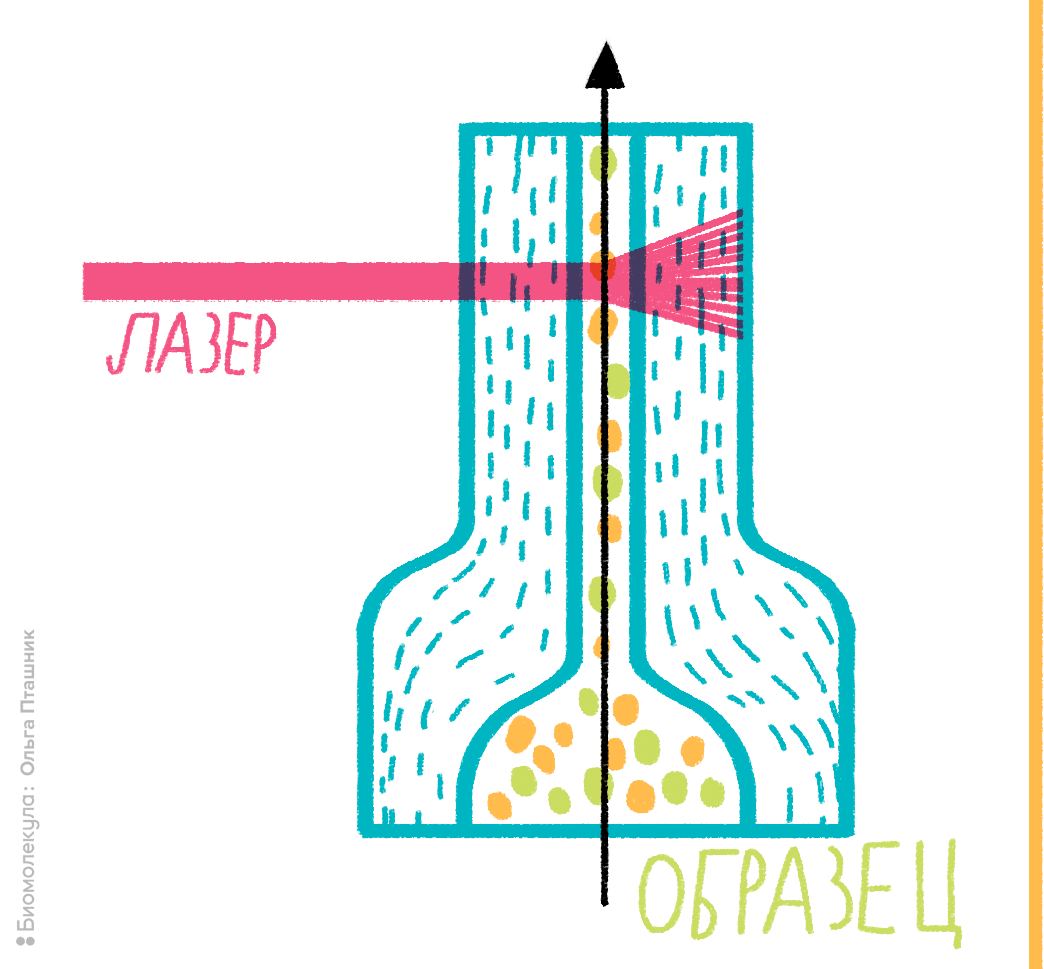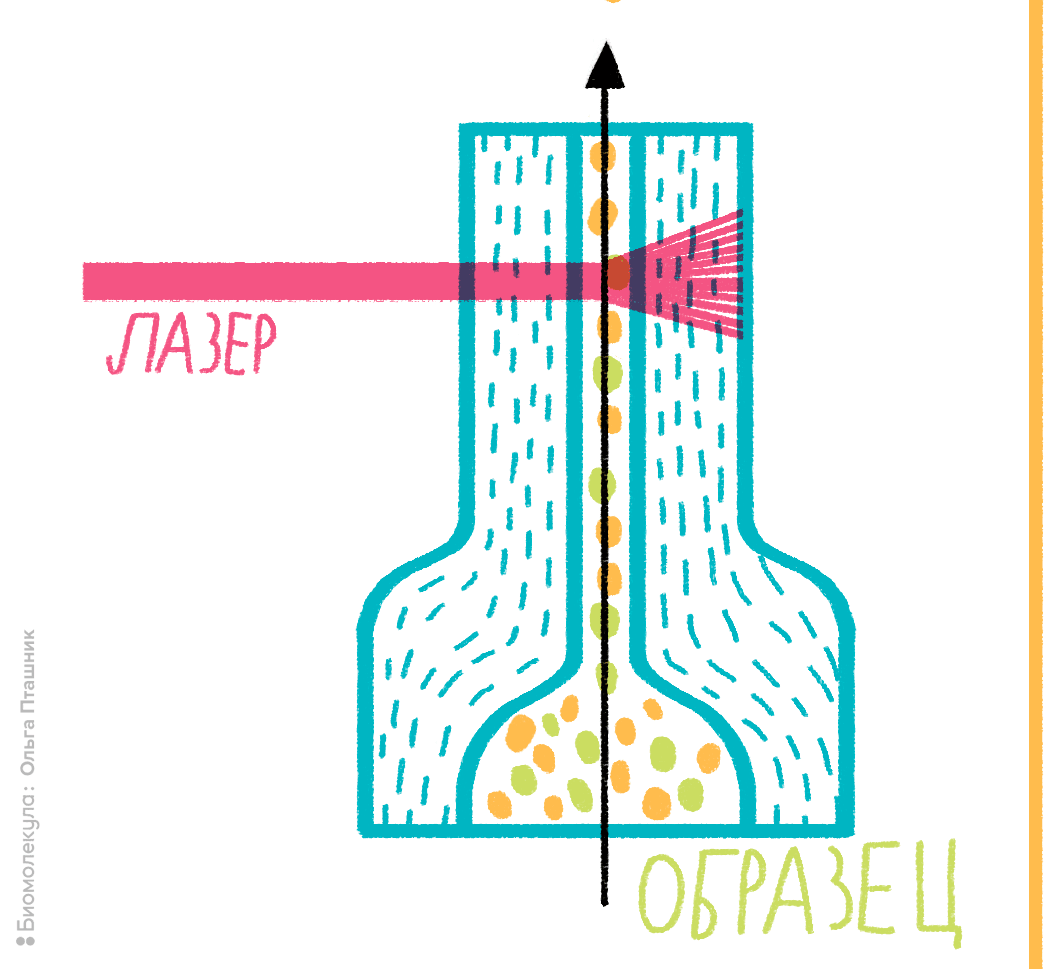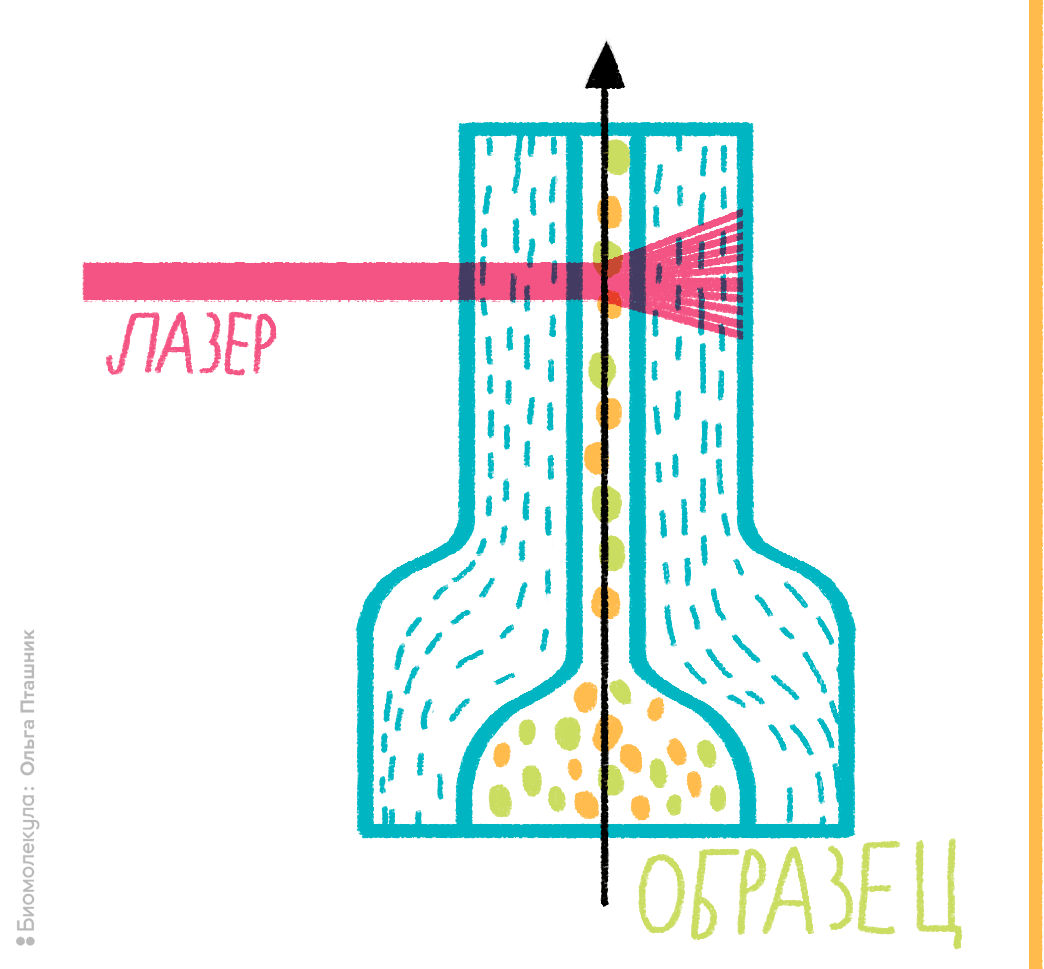
Рисунок 2. Устройство проточной ячейки цитометра. В основе любого проточного цитометра лежит использование системы гидродинамической фокусировки либо микрокапиллярной системы. Гидродинамическим фокусированием называется процесс, при котором суспензия клеток под давлением подается в проточную ячейку, причем образуется как бы «поток в потоке»: поток с клетками «встраивается» внутрь потока обжимающей жидкости. За счет разности давлений между образцом и обжимающей жидкостью поток сужается до диаметра одной клетки, поэтому через ячейку клетки проходят по одной, как это показано на рисунке. Далее происходит лазерное облучение клетки, меченной флуорохромом, и регистрация ответного сигнала.
рисунок Ольги Пташник
Клетки, исследуемые цитометрией, метят флуорохромами, поэтому лазерный луч возбуждает вторичное свечение (флуоресценцию). Затем сигналы флуоресценции и светорассеяния регистрируются различными детекторами (рис. 3). Информация от детекторов используется компьютерным алгоритмом, который позволяет в наглядной форме «посчитать» клетки и разделить их на отдельные популяции, отличающиеся друг от друга по каким-то важным параметрам, интересующим исследователя.
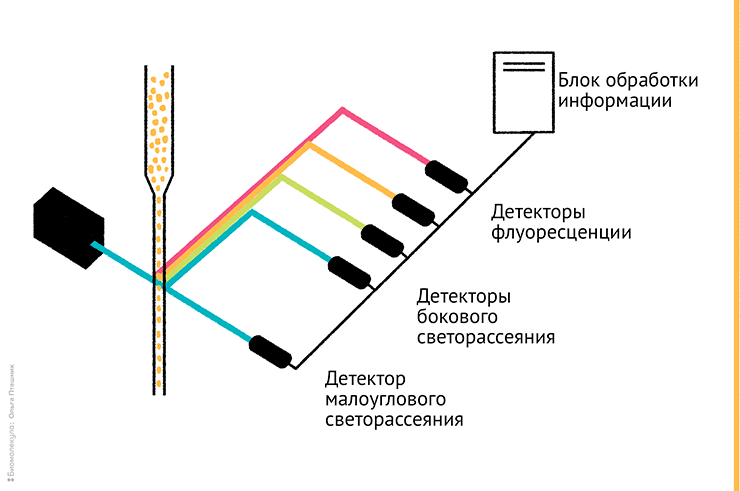
Рисунок 3. Внутреннее устройство проточного цитометра. Типовая схема прибора с одним лазером, двумя детекторами светорассеяния (боковое и малоугловое, то есть прямое) и тремя флуоресцентными детекторами. Принципиальное устройство проточной ячейки отдельно показано на рис. 2.
рисунок Ольги Пташник
В зависимости от используемых флуорохромов требуются разные длины волн для их возбуждения и разные детекторы (фильтры) для анализа испускаемого свечения. В современных приборах (рис. 4) может быть до 7 лазеров и до 30 каналов детекции, но для большинства приложений достаточно 1–3 лазеров и 4–10 каналов. Такие сложные конфигурации позволяют проводить многопараметрический анализ, когда одна клетка связана с несколькими флуорохромами с отличными друг от друга длинами волн испускания, а нередко — и возбуждения. Это позволяет исследовать сразу несколько свойств клеток из одной пробы, что экономит время анализа и расход анализируемого образца. Подробнее этот вопрос рассмотрен в следующих разделах.
Словарик
- CD-маркеры
- поверхностные белки клеток крови, характерактеризующие определенные стадии их дифференцировки. Название происходит от кластеров дифференцировки (англ. Cluster of Differentiation).
- Антитела (иммуноглобулины)
- белковые соединения плазмы крови, образующиеся в организме теплокровных животных в ответ на появление бактерий, вирусов, белковых токсинов и других антигенов. В медицине и технологии получили широкое распространение моноклональные антитела [21].
- Гейт
- выбранная для анализа область на одно- или двумерной диаграмме, полученной в ходе цитометрических измерений.
- Гидродинамическое фокусирование
- перераспределение суспензии клеток в поток, равный размеру одной клетки. За счет разности давлений между образцом и обжимной жидкостью клетки выстраиваются в «колонну по одному».
- Лазер
- монохроматичный когерентный источник света, что означает постоянную длину волны и определенную поляризацию.
- Проточная ячейка
- рабочая емкость проточного цитофлуориметра, в которую подается анализируемая суспензия клеток. Благодаря эффекту гидродинамического фокусирования, в проточной ячейке клетки выстраиваются в цепочку, что делает возможным их индивидуальное облучение лазером и регистрацию рассеянных лучей.
- Светорассеяние
- рассеяние электромагнитных волн видимого диапазона при их взаимодействии с веществом. При этом происходит изменение пространственного распределения, частоты, поляризации оптического излучения и других параметров.
- Флуоресценция
- кратковременное поглощение кванта света флуорохромом с быстрым переизлучением другого кванта, как правило, с большей длиной волны. Регистрация флуоресценции — один из наиболее популярных приемов в микроскопии и молекулярной биологии [22].
- Флуорохром
- флуоресцирующий краситель, который после облучения светом определенной длины волны испускает характерное свечение за счет перехода электронов между различными энергетическими уровнями.
- Цитофлуометрия (проточная цитометрия)
- метод исследования дисперсных сред в режиме поштучного анализа элементов дисперсной фазы по сигналам светорассеяния и флуоресценции.
Что «видит» цитометрия?
Прямое и боковое светорассеяние
Проточный цитометр обладает двумя детекторами светорассеяния, позволяющими делать выводы о размерах и структуре клеток (рис. 5):
- Детектор прямого (малоуглового) светорассеяния (forward scatter, FS) располагается по ходу лазерного луча за проточной ячейкой. Интенсивность рассеянного под малым углом света пропорциональна размеру клетки.
- Детектор бокового светорассеяния (side scatter, SS). Внутреннее содержимое клеток оптически неоднородно. Луч лазера, проходя сквозь клетку, многократно преломляется и рассеивается во все стороны. Регистрация этого бокового светорассеяния позволяет судить о сложности внутреннего строения клетки (соотношение ядро/цитоплазма, наличие гранул, других внутриклеточных включений).

Рисунок 5. Прямое и боковое светорассеяния регистрируются каждое своим детектором , что позволяет измерить базовые параметры клеток (размер и внутреннее строение). Детектор прямого светорассеяния находится прямо по ходу лазерного луча за проточной ячейкой и улавливает свет, углы рассеяния которого не превышают 9–12 градусов. Прямое светорассеяние дает исследователю информацию о размере клетки. Боковое светорассеяние позволяет судить о наличии в клетке гранул, соотношении ядро/цитоплазма и других параметрах — за счет того, что проходящий сквозь клетку луч преломляется и рассеивается во все стороны.
рисунок Ольги Пташник
Комбинация бокового и прямого светорассеяний позволяет судить о морфологии клетки в целом и выделять различные популяции клеток для дальнейшего анализа. Например, использование только двух перечисленных выше детекторов позволяет провести первичный анализ популяций лейкоцитов с помощью диаграммы бокового—прямого (SS—FS) светорассеяния (рис. 6).
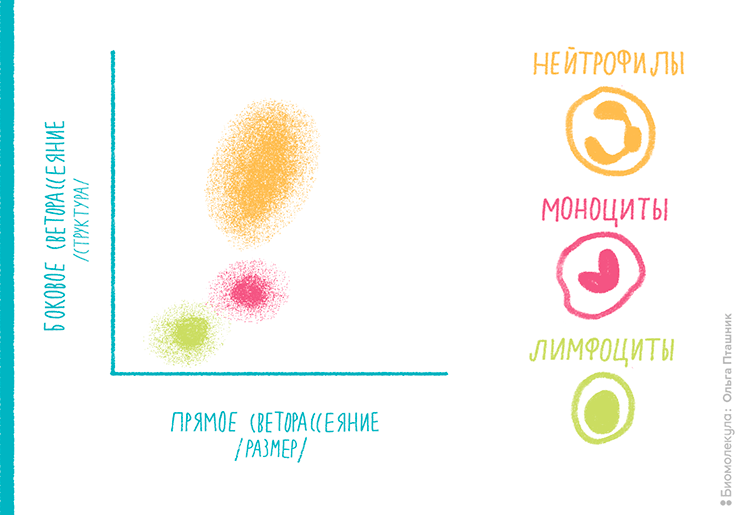
Рисунок 6. Диаграмма бокового—прямого (SS—FS) светорассеяния для суспензии белых клеток крови. Лимфоциты являются самыми маленькими клетками с круглым ядром, тогда как для нейтрофилов характерен не только бóльший размер, но и полиморфоядерность, а потому на этой диаграмме они располагаются выше и правее.
рисунок Ольги Пташник
Детекторы флуоресценции
Система для регистрации свечения флуоресцентных меток (детектор флуоресценции, канал флуоресценции) состоит из комплекса светофильтров, зеркал и фотоумножителей, каждый из которых регистрирует излучение в определенном диапазоне длин волн, соответствующем измеряемому флуорохрому.
Основное преимущество цитофлуориметрии заключается в том, что клетка может быть окрашена несколькими флуоресцентными метками одновременно, что позволяет проводить мгновенный многопараметрический анализ. Например, из одной пробы можно получить информацию о содержащихся в ней разных популяциях клеток, а также для каждой популяции из пробы измерить уровень апоптоза, пролиферации, экспрессии клеточных рецепторов и иные показатели.
Эта особенность хорошо иллюстрируется старой притчей о семи слепцах, ощупывающих слона. Только сложив то, что говорил о своих впечатлениях каждый из них, можно получить более-менее полное представление о том, как на самом деле выглядит слон. На рисунке 7 изображена схема дифференцировки Т-клеток в восемь различных популяций и CD-маркеры, характерные для каждой из них. Проточная цитометрия позволяет получить данные обо всех популяциях в образце Т-клеток и выявить интересующие свойства каждой из них.
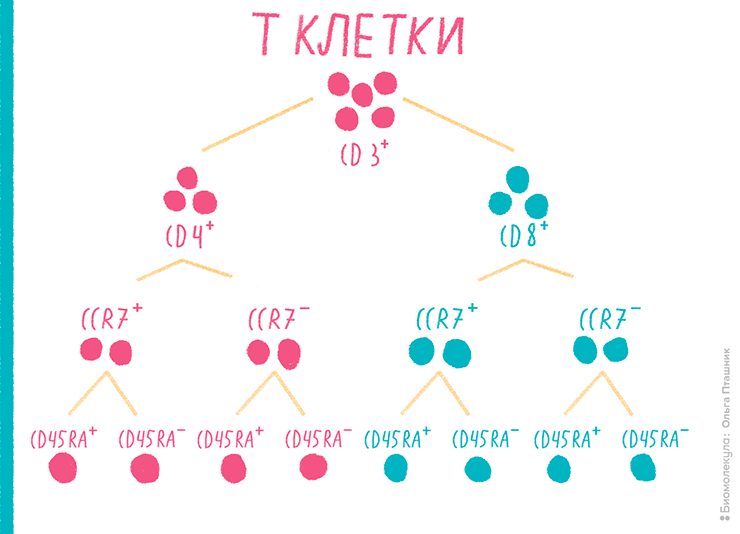
Рисунок 7. Схема дифференцировки Т-клеток в крови пациента на основании содержания CD-маркеров. Дифференцировка Т-лимфоцитов похожа на дерево, каждая ветвь в котором обладает своими свойствами и своими поверхностными маркерами. Цитометрический анализ CD-маркеров позволяет обнаружить ошибки дифференцировки, приводящие, например, к аномально высокому содержанию клеток минорных популяций или, напротив, отсутствию конечно дифференцированных клеток. Подобные исследования часто применяют для оценки состояния и иммунного статуса пациента при проведении химиотерапии. Результат анализа представляет собой множество двумерных диаграмм, по виду и логике подобных тем, что изображены и описаны на рис. 14.
рисунок Ольги Пташник
Полученные с цитометра данные обрабатываются компьютером и отображаются в виде одномерных гистограмм или дву- и трехмерных диаграмм. Анализ этих данных позволяет определить количество клеток, отвечающих тем или иным условиям, оценивая интенсивность флуоресценции (то есть количество того или иного маркера в клетке).
Основные типы красителей
Главное свойство красителей для проточной цитометрии — флуоресценция. Их можно разделить на три группы по принципу связывания с клеткой или ее фрагментами:
- Низкомолекулярные флуоресцентные соединения, способные связываться с определенными компонентами клетки. Например, пропидий йодид (PI) и 7-аминоактиномицин D (7-AAD), способные интеркалировать в ДНК, и красители типа ZombieRed, связывающиеся с аминогруппами белков. Применяются для анализа клеточного цикла и клеточной смерти.
- Белки, связанные с флуорохромами,— например, любые флуоресцентно меченные антитела. О типах флуорохромов будет рассказано чуть ниже.
- Флуоресцентные белки (например, знаменитый GFP [6]), синтезирующиеся прямо в клетке при помощи трансфекции.
Флуорохромы, используемые самостоятельно или же как метки для антител, можно разделить на несколько групп в зависимости от принципа флуоресценции и их химического состава.
Флуорохромы
Флуорохромы (флуоресцентные красители) — вещества, которые способны связываться с объектом и при освещении светом флуоресцировать, то есть поглощать энергию света и переизлучать ее с бóльшей длиной волны (см. рис. 8).
Известные «классические» красители — FITC (флуоресцеина изотиоцианат), PE (фикоэритрин), APC (аллофикоцианин) и PerCP (перидининхлорофилл протеин). Современные коммерческие красители марки Alexa Fluor более стабильны и ярче флуоресцируют, так как являются сульфитными производными кумарина, родамина, флуоресцеина и т.д. Также в последние годы активно набирают популярность красители, возбуждаемые лазерами 355 и 405 нм, которые используются в новых моделях цитометров (табл. 1).
| Флуорофор | Цвет флуоресценции | Длина волны возбуждения, нм | Длина волны испускания, нм | Относительная яркость свечения |
|---|---|---|---|---|
| DyLight 405 | 400 | 420 | 3 | |
| Alexa Fluor 405 | 401 | 421 | 3 | |
| Pacific Blue | 410 | 455 | 1 | |
| Alexa Fluor 488 | 495 | 519 | 3 | |
| FITC | 490 | 525 | 3 | |
| DyLight 550 | 562 | 576 | 4 | |
| PE | 490; 565 | 578 | 5 | |
| APC | 650 | 661 | 4 | |
| Alexa Fluor 647 | 650 | 665 | 4 | |
| DyLight 650 | 654 | 673 | 4 | |
| PerCP | 490 | 675 | 2 | |
| Alexa Fluor 700 | Infrared | 702 | 723 | 2 |
Тандемные красители
Что делать, если цитофлуориметр оснащен всего одним лазером, а экспериментатору необходимо измерить три или четыре параметра с минимальным «засветом» друг на друга? Есть хорошее решение — использовать так называемые тандемные красители (рис. 8): это два флуорохрома, ковалентно соединенные между собой через «мостик» (спейсер). Когда первый краситель возбуждается и переходит в синглетное состояние, его энергия передается на второй краситель. Это активирует второй флуорохром, флуоресценцию которого и регистрирует цитометр. Этот процесс называется флуоресцентным резонансным переносом энергии (FRET) [7]. Такие красители разработали для увеличения количества флуоресцентных каналов, которые могут быть использованы при наличии одного возбуждающего лазера (табл. 2).
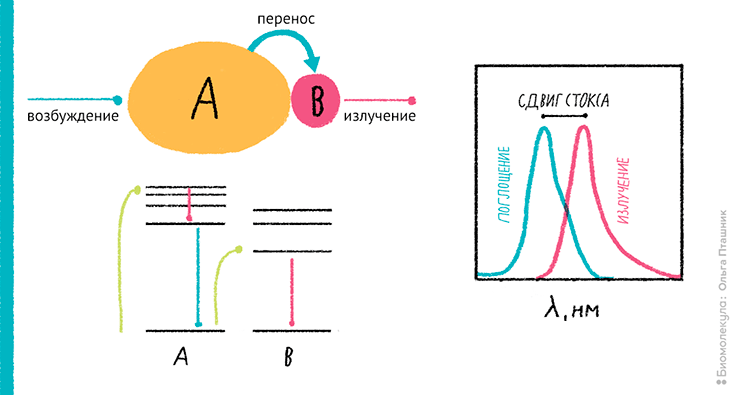
Рисунок 8. Тандемные красители: когда одного флуорохрома недостаточно. Слева: упрощенная схема тандемного красителя (без спейсеров), состоящего из двух молекул — донора (A) и акцептора (B). Показаны также энергетические уровни возбуждения и испускания флуоресценции. Справа: сдвиг Стокса, лежащий в основе действия тандемных красителей. Благодаря этому эффекту цвет флуоресценции всегда «более красный», нежели возбуждающий свет.
рисунок Ольги Пташник
| Флуорофор | Цвет флуоресценции | Длина волны возбуждения, нм | Длина волны испускания, нм | Относительная яркость свечения |
|---|---|---|---|---|
| PE-Alexa Fluor 647 | 496; 546 | 667 | 4 | |
| PE-Cy5 | 496; 546 | 667 | 5 | |
| PE-Cy5.5 | 496; 546 | 695 | 4 | |
| PE-Alexa Fluor 750 | Infrared | 496; 546 | 779 | 4 |
| PE-Cy7 | Infrared | 496; 546 | 785 | 2 |
Большинство тандемных красителей рассчитано на наиболее распространенные лазеры с длинами волн 488 (синий) и 640 (красный) нм. Тандемные красители применяют для многоцветного анализа, особенно в комбинации с одиночными. Например, комбинация из четырех красителей — два одиночных (FITC и PE) и два тандемных (PE-TexasRed и PE-Сy7) — возбуждается одним 488-нанометровым лазером, и при этом испускает в зеленом, желтом, красном и инфракрасном каналах соответственно, то есть позволяет проводить параллельную регистрацию четырех различных параметров, имея всего один лазер вместо двух или даже трех. В настоящее время разработаны также полимерные «квазитандемы» для лазеров 355 и 405 нм.
Флуоресцентные белки
Флуоресцентные белки [8], такие как знаменитый GFP (зеленый флуоресцентный белок, за исследование и применение которого вручили Нобелевскую премию по химии 2008 года [6]), стали неотъемлемым инструментом исследований во многих научных дисциплинах. Другие флуоресцентные белки, такие как красный mCherry и желтый YFP, также широко используются в проточной цитометрии и сортировке клеток (табл. 3). Флуоресцентные белки генно-инженерными методами «заставляют» экспрессироваться вместе с интересующим исследователя белком для оценки успешности проведенной модификации генома. Основным цитометрическим преимуществом флуоресцентных белков является то, что их можно доставлять в клетку в форме гена (а не уже готового белка) «заодно» с другими генами, интересующими исследователей, а это избавляет от трудоемкой задачи — «протащить» краситель через мембрану клетки и заставить его связаться с нужной молекулой.
| Флуорофор | Цвет флуоресценции | Длина волны возбуждения, нм | Длина волны испускания, нм | Относительная яркость свечения |
|---|---|---|---|---|
| CFP | 439 | 476 | 2 | |
| EGFP | 484 | 509 | 4 | |
| YFP | 514 | 527 | 5 | |
| RFP | 558 | 583 | 4 | |
| mCHERRY | 587 | 610 | 3 |
Анионные и катионные красители
Не удивительно, что для определения внутриклеточных ионов применяют ионные же (катионные и анионные) красители: как правило, это сложные органические заряженные молекулы. Наличие в клетке определенных ионов (например, Ca2+, Cl−, H+, ·O2−) приводит к изменению структуры красителя и сдвигу длины волны или изменению интенсивности его флуоресценции.
Пример использования катионного красителя — определение трансмембранного потенциала митохондрий (ΔΨm) (рис. 9). Это важный параметр клеточного «здоровья», поскольку митохондрии являются «энергетическими станциями» клетки — если у них что-то не в порядке, то и на всей клетке это непременно отразится. Изменение трансмембранного потенциала также является ранним маркером апоптотических процессов.
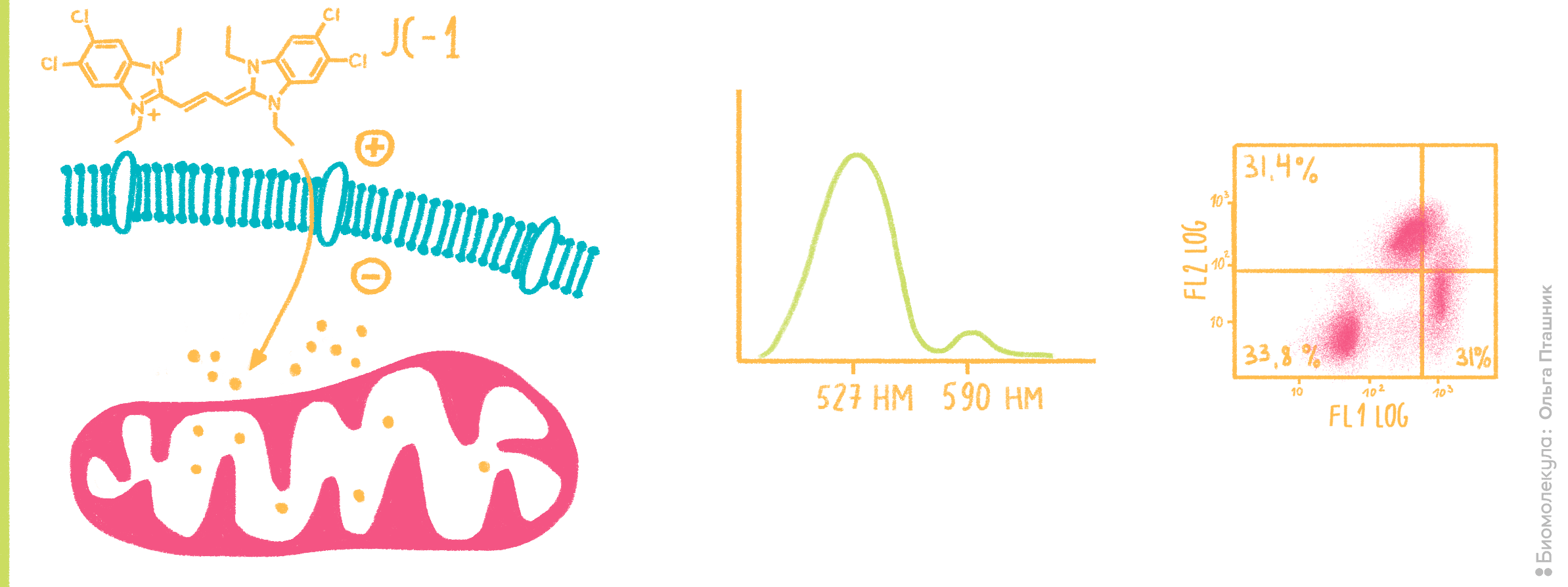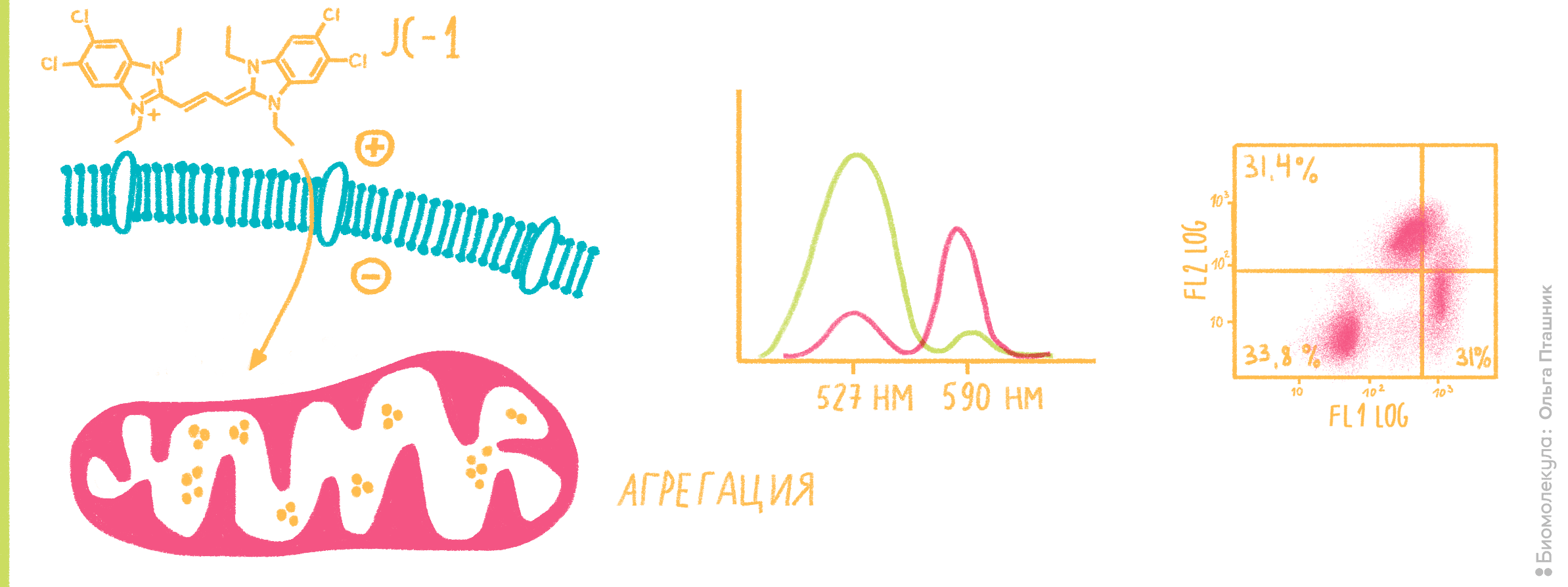
Рисунок 9. Определение трансмембранного потенциала (ΔΨm) митохондрий с анионным красителем JC-1 (5,5’,6,6’-тетрахлоро-1,1’,3,3’-тетраэтилбензимидазолилкарбоцианин йодид). Благодаря своим липофильным свойствам молекулы JC-1 проникают через мембрану в цитоплазму клеток, а благодаря катионным свойствам накапливаются в местах с повышенным содержанием протонов (то есть в митохондриях), формируя скопления — J-агрегаты (слева). Эти J-агрегаты флуоресцируют уже немного иначе, более красным светом с длиной волны 590 нм (в центре). Однако при деполяризации митохондриальной мембраны — снижении ΔΨm — J-агрегаты вновь распадаются, и JC-1 выходит в цитоплазму с соответствующим спектральным сдвигом. На правой части рисунка представлена двумерная диаграмма с проточного цитометра, по осям которой — флуоресценция в каналах FL-1 (зеленая, соответствует мономерным формам JC-1) и FL-2 (красная, J-агрегаты). Из этой диаграммы можно сделать вывод, что около трети исследуемых клеток не содержит красителя вообще, а клетки, в которых он есть, равновероятно содержат мономерную и агрегированную формы JC-1 (тоже около 1/3). Этот факт говорит нам, что популяции апоптотических и здоровых клеток примерно равны.
рисунок Ольги Пташник по материалам lcbim.epfl.ch и biotek.com
Полимерные флуорохромы нового поколения
В 2000 году Нобелевскую премию присудили за проводящие органические полимеры, которые нашли свое применение и в биоисследованиях. На основе этого открытия были созданы полимерные флуорохромы нового поколения (например, краски серии Brilliant Violet [9]). Фактически, к антителам присоединили органические полимеры, которые хорошо поглощают свет и эффективно высвечивают его в форме флуоресценции (рис. 10). Именно совокупность этих двух параметров делает полимерные флуорохромы столь удобными для применения в проточной цитометрии. Для сравнения — коэффициент экстинкции у популярного красителя Pacific Blue в 80 раз меньше, чем у линейки Brilliant Violet.
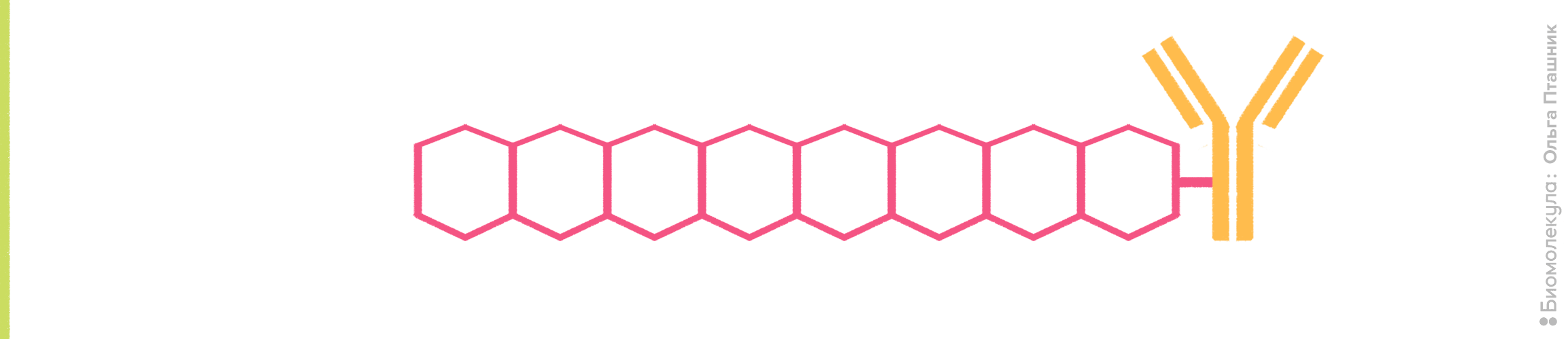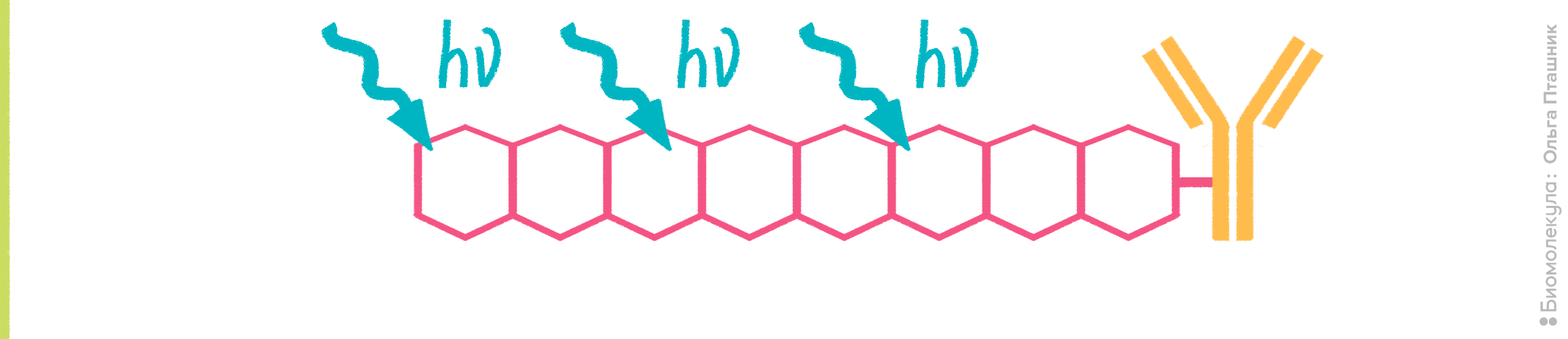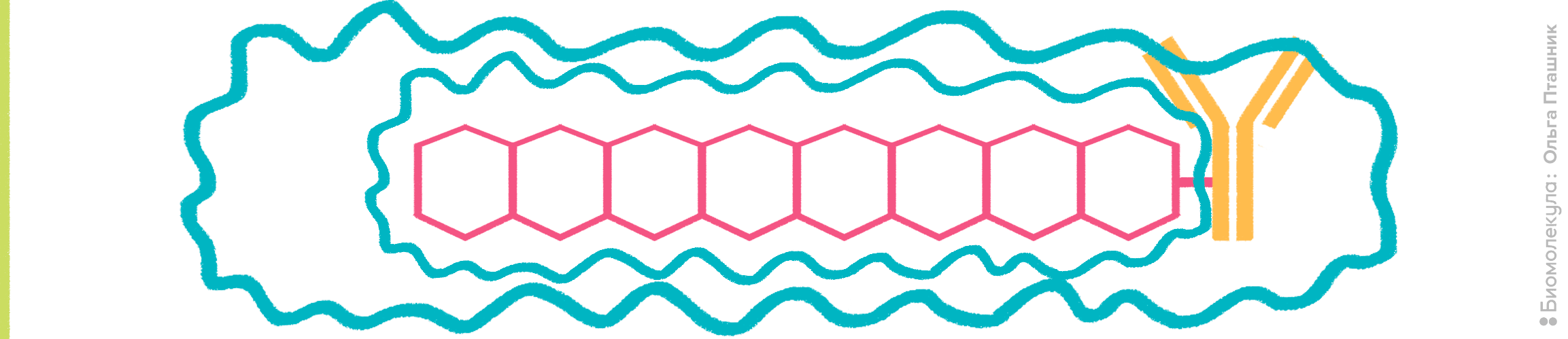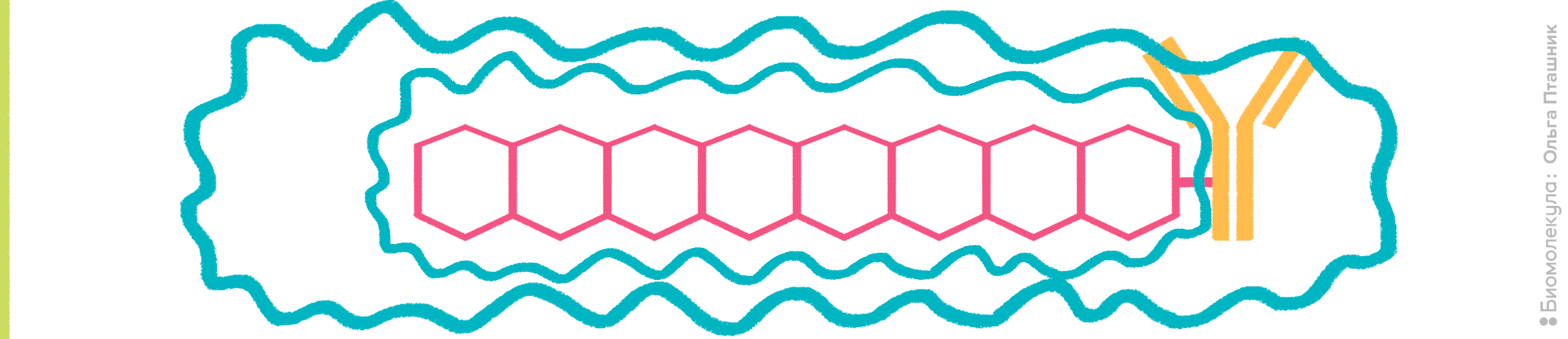
Рисунок 10. Принцип действия полимерных красителей. К антителу присоединены органические полимеры, содержащие сопряженные ароматические фрагменты. В результате образуется π-орбитальная система, для которой характерна большая делокализация электронов. За счет этого полимерные красители обладают высоким коэффициентом экстинкции (>106 M−1см−1) и очень высоким квантовым выходом (около 65% поглощенной энергии превращается в испускаемый свет), что объясняет привлекательность их использования во флуоресцентной микроскопии и проточной цитометрии, так как становится возможной регистрация даже очень слабых сигналов.
рисунок Ольги Пташник
Квантовые точки
Квантовые точки — флуоресцентные полупроводниковые нанокристаллы, о которых уже подробно рассказывала «Биомолекула» [10], весьма перспективные для проточной цитометрии. Все дело в их уникальных особенностях: узкий симметричный пик флуоресценции, широкая полоса возбуждения, высокая яркость флуоресценции и уникально высокая фотостабильность (рис. 11).
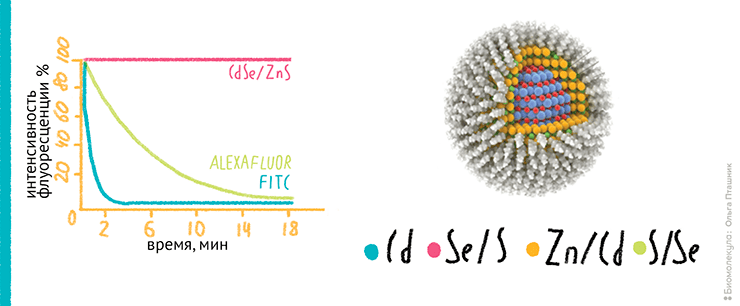
Рисунок 11. Квантовые точки: мельче, ярче, стабильнее. Слева: сравнение интенсивности флуоресценции разных флуорохромов — FITC, AlexaFluor и квантовых точек на основе нанокристаллов CdSe/ZnS. Квантовые точки обладают необычайно высокой интенсивностью флуоресценции и временем полураспада, которое в 135 раз больше, чем у популярного флуорохрома AlexaFluor! Справа: трехмерная модель квантовой точки. Разноцветными сферами изображены отдельные атомы.
рисунок Ольги Пташник по материалам researchgate.net
Какие исследования возможны на проточном цитометре?
Область применения проточной цитометрии действительно обширна, потому что этот удивительный метод позволяет в буквальном смысле найти «иголку в стоге сена». Исследователь может за считанные минуты изучить десятки и даже сотни тысяч клеток и обнаружить любую минорную популяцию, отвечающую заданным параметрам. Самое важное, что результатом будет не «средняя температура по больнице», а данные по каждой конкретной клетке. Далее приведены список процессов, которые могут быть изучены при помощи проточной цитометрии, и краткая методологическая справка.
Апоптоз и некроз
Клетки, как и люди, покидают этот мир разными способами.
Апопто́з — это «программируемая» гибель, когда клетка, как если бы она нарушила самурайский кодекс чести, кончает с собой, а ее фрагменты быстро и аккуратно фагоцитируются («съедаются») макрофагами либо соседними клетками, минуя развитие воспалительной реакции. Одной из основных функций апоптоза является уничтожение дефектных (повреждённых, мутантных, инфицированных) клеток. В эмбриогенезе апоптоз тоже играет важную роль — например, таким образом у лягушат отпадает хвост, характерный для головастиков. Известны люди, имевшие два и более сросшихся пальцев на ногах или руках — это результат нарушений апоптотических процессов при развитии плода. Анализ апоптотических популяций клеток важен не только в клинических исследованиях, но и для оценки воздействия того или иного соединения на клеточную культуру или организм, включая исследования потенциальных антираковых или противовоспалительных препаратов.
Некроз же, напротив, представляет собой «грязную смерть», при которой содержимое погибшей клетки «вываливается» в окружающие ткани, что приводит к воспалительным процессам и другим нежелательным последствиям.
Однако «на первый взгляд» отличить эти процессы крайне сложно, и тут-то на помощь и приходит проточная цитометрия. Существует несколько возможных алгоритмов, и для надежности рекомендуется использовать параллельно минимум два из них.
- Один из первейших признаков апоптоза —нарушение работы митохондрий, которые выбрасывают в цитоплазму проапоптотические факторы (такие как цитохром c) и меняют свой трансмембранный потенциал (ΔΨm). Это изменение можно зафиксировать при помощи флуоресцентных катионных красителей, что и используется как индикатор апоптоза. Об этом мы уже рассказали выше (рис. 9);
- Другим маркером раннего апоптоза являются превращение прокаспаз в каспазы, которые, особенно каспазы 3 и 9, запускают каскад «биохимического самоубийства», и активная экспрессия белков-регуляторов (например, PARP). Цитометрия позволяет выявить клетки, в которых это уже началось, по связыванию антител и ингибиторов каспаз.
- При апоптозе начинает распадаться ядро (образуются так называемые апоптотические тельца), что сопровождается деградацией ядерной оболочки и фрагментацией хроматина. Красители типа YO-PRO, Hoechst и PI (по отдельности или в комбинации) проникают в клетки при нарушении целостности клеточной мембраны и позволяют судить о наличии апоптотических и некротических клеток.
- Окраску PI (йодидом пропидия) можно использовать отдельно как самостоятельный метод, потому что он хорошо визуализирует характерную для апоптоза «нарезку» ДНК на мелкие фрагменты (около 200 п.н.)— так называемую «sub-G1 фракцию».
- Апоптоз затрагивает не только внутренности клетки, но и ее поверхность. В ходе апоптоза фосфолипид фосфатидилсерин , в норме находящийся на внутренней поверхности клеточной мембраны, мигрирует на ее наружную поверхность. Регистрация фосфатидилсерина при помощи белка аннексина V, конъюгированного с флуорохромами, является одним из наиболее популярных методов анализа апоптоза, особенно в комбинации с ДНК-связывающим красителем типа PI (рис. 12).
Подробнее о строении и логике работы биомембран смотрите в статье «Липидный фундамент жизни» [11].
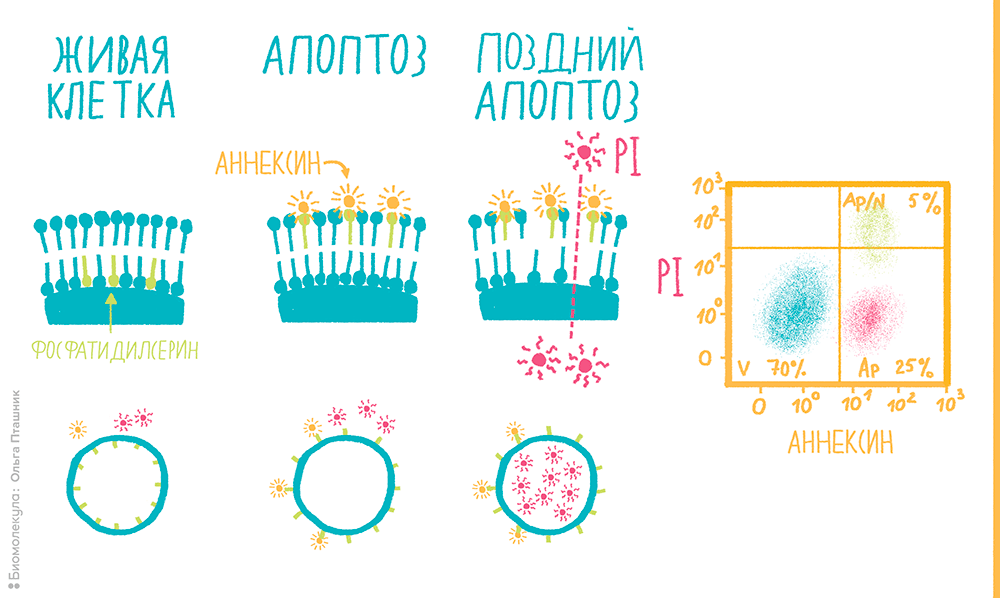
Рисунок 12. Детекция апоптоза в нейтрофилах человека. Нейтрофилы обработали реагентом, стимулирующим апоптоз, а далее окрасили последовательно ДНК-связывающим красителем (здесь использовали PI, но можно взять и любой другой, интеркалирующий с ДНК), не способным проникать через мембрану живой клетки, и флуоресцентно-меченым белком аннексином, связывающимся с фосфатидилсерином на внешней мембране: схематично процесс показан слева. Справа изображена двумерная диаграмма с флуоресценцией аннексина и PI по осям, где мы видим три разные популяции: V — живые клетки; Ap — клетки на ранней стадии апоптоза (появление фосфатидилсерина во внешнем липидном слое); Ap/N — на поздней стадии апоптоза и во время некроза (нарушена асимметрия липидов и целостность поверхностной мембраны клеток).
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Фагоцитоз
Фагоцитоз — это захват и уничтожение чужеродных микроорганизмов или клеток. Изучение фагоцитоза особенно актуально для иммунологов: например, нейтрофилы способны к фагоцитозу бактерий, осуществляя тем самым неспецифический иммунный ответ, и важно знать, не потеряли ли они эту способность.
Идея оценки фагоцитоза при помощи проточной цитометрии достаточно проста: бактерии необходимо флуоресцентно пометить (например, при помощи FITC), после чего инкубировать их с фагоцитами. Клетки, захватившие меченые бактерии, будут светиться и по результатам проточной цитометрии. Чем ярче светится фагоцит, тем больше бактерий ему удалось захватить. Неспецифическое связывание бактерии с поверхностью фагоцита (без захвата) отсекается при помощи окрашивания трипановым синим (trypan blue) [12]. Также фагоцитоз можно наблюдать при помощи световой и флуоресцентной микроскопии [13].
Анализ фитопланктона
Цитометрия позволяет померить не только те клетки, что внутри нас, но и те, что населяют окружающие нас водоемы и входят в различные экологические цепочки — например, фитопланктон (рис. 13). Его количество и биомасса используются при биологическом анализе водных сред и оценке их экологического состояния. Проточная цитометрия приобретает большую популярность в экспресс-мониторинге водоемов, потому что в клетках фитопланктона уже содержится какой-либо флуоресцентный пигмент — например, фикоэритрин или хлорофилл.
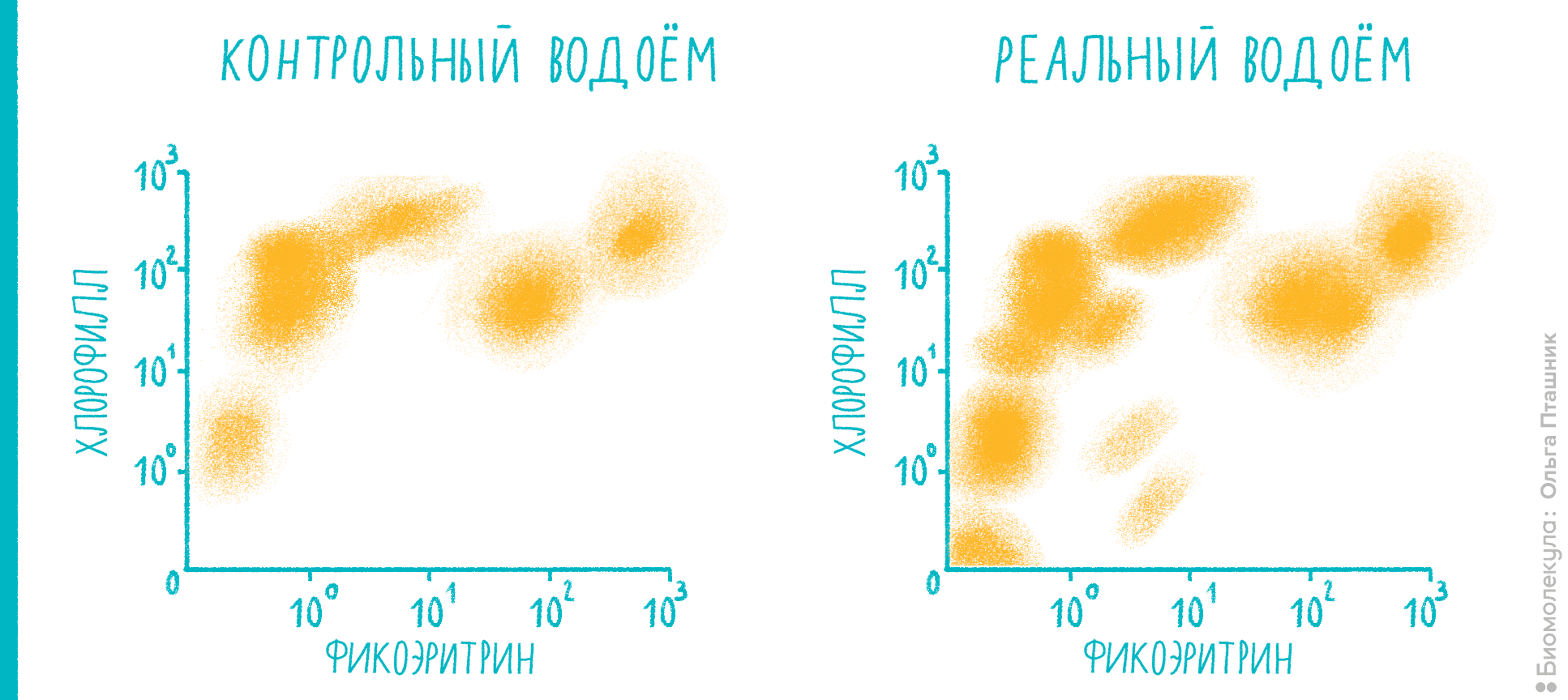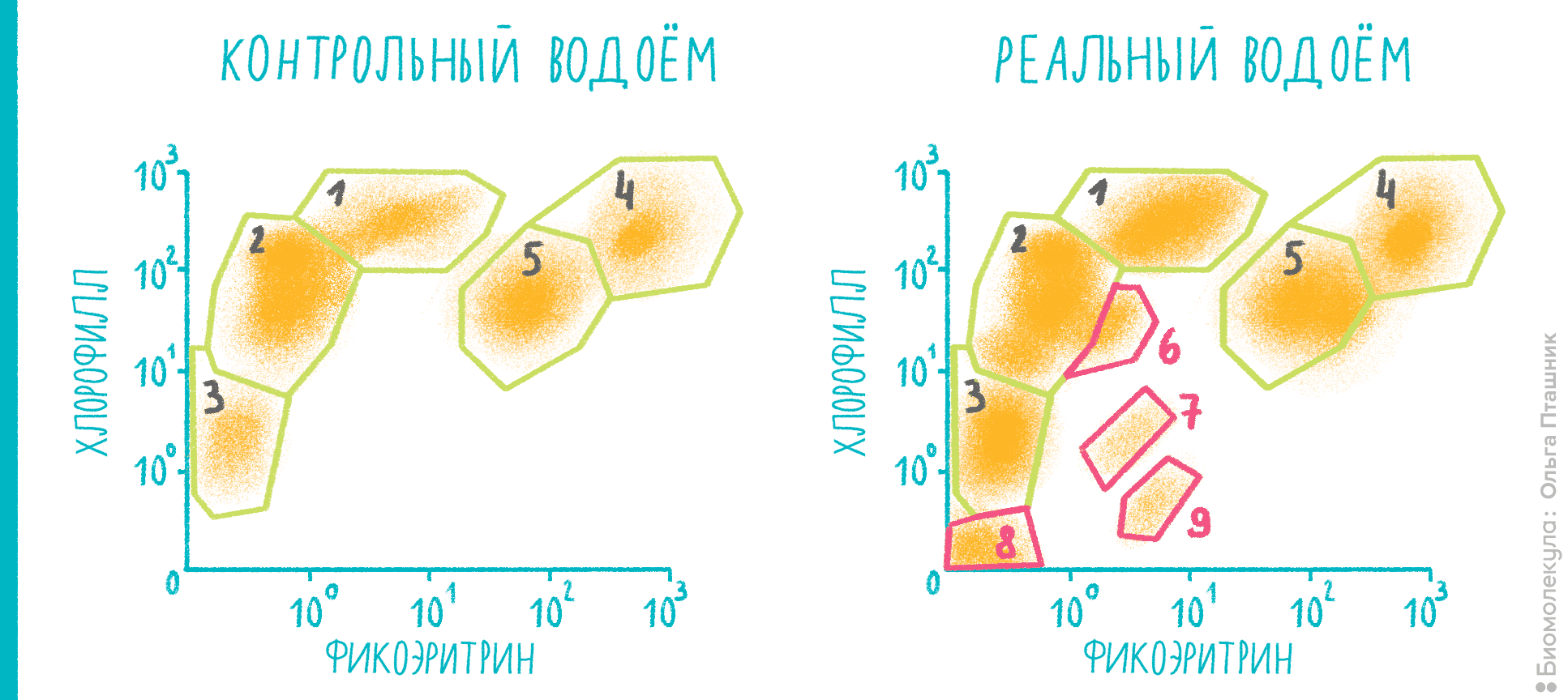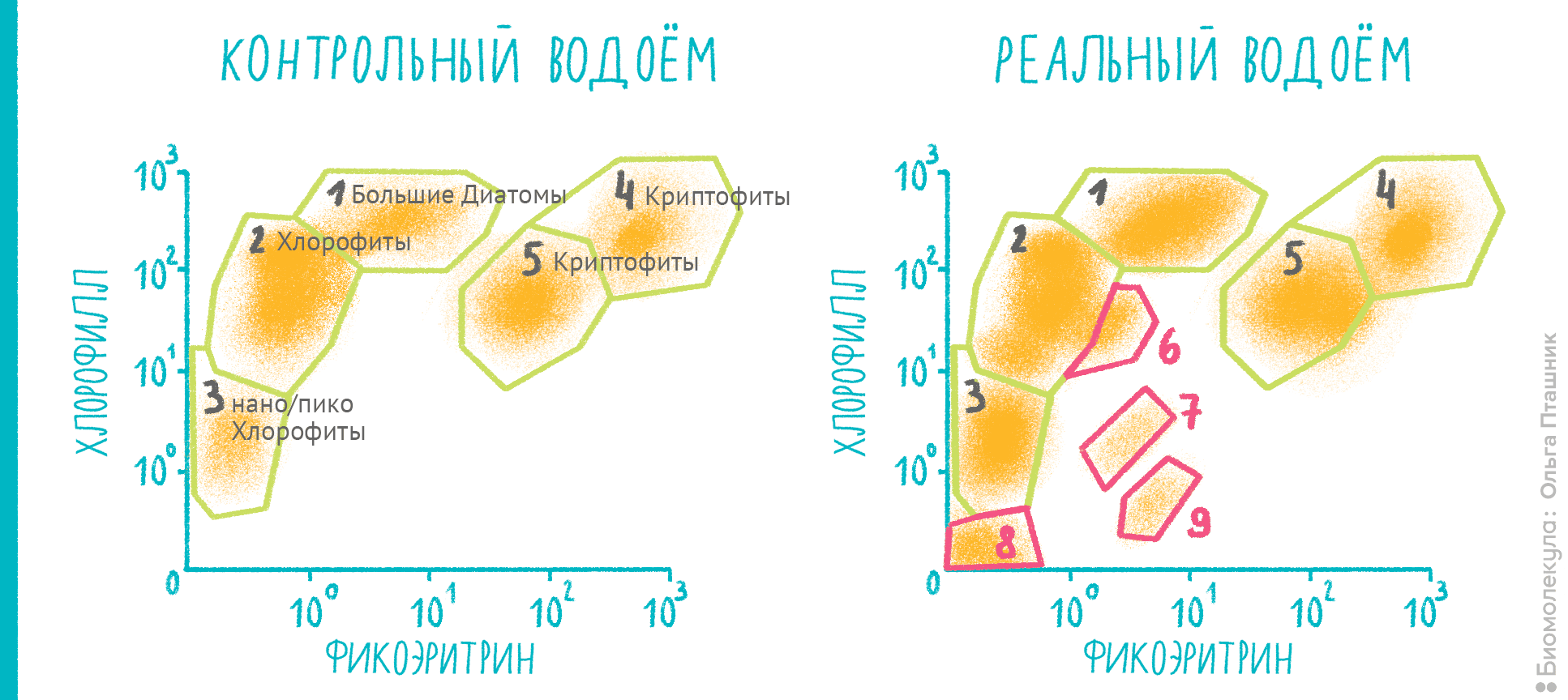
Рисунок 13. Экологический анализ водоемов: наблюдаем за фитопланктоном. Цитометрические диаграммы позволяют разделять клетки фитопланктона за счет различного содержания фикоэритрина и хлорофилла и, соответственно, разницы в их флуоресценции. По осям — интенсивность флуоресценции в каналах FL2 (575 нм, фикоэритрин) и FL4 (695 нм, хлорофилл). Слева — различные культуры фитопланктона в «контрольном» водоеме. Справа — эксперимент, который при сравнении с контролем показывает, что в анализируемом водоеме присутствуют не только ожидаемые группы 1–5 (криптофиты, хлорофиты), но и несколько новых популяций: они отмечены цифрами 6–9. Дальнейший анализ по наличию фикоцианина, размера и сравнению с контрольными образцами микроорганизмов позволяет определить конкретный состав фитопланктона с очень большой точностью.
рисунок Ольги Пташник по материалам pubs.rsc.org
«Перепись населения» среди клеток крови
Многие клетки — например, лимфоциты — совершенно неотличимы не только «на глазок», но и для более тщательных методов анализа. Но, тем не менее, они выполняют очень разную работу и все-таки могут быть разделены на субпопуляции — по различным молекулам, которые они синтезируют на своей поверхности. Чаще всего это рецепторы, называемые маркерами, и их можно распознавать при помощи флуоресцентно меченных антител, которые уже регистрируются цитометрией.
Например, по наличию различных CD-маркеров можно провести «перепись» Т-лимфоцитов в цельной крови, что активно применяют в клинических исследованиях для выявления хронических инфекционных и аутоиммунных заболеваний, диагностики первичных иммунодефицитов, а также оценки эффективности проводимого лечения.
На рисунке 14 изображена схема эксперимента по анализу дифференцировки тимоцитов мыши и приведены первичные данные с проточного цитометра по оценке популяций и апоптоза. Все Т-клетки берут начало от гемопоэтических стволовых клеток красного костного мозга, которые мигрируют в тимус и дифференцируются в незрелые тимоциты. За их дифференцировкой можно следить по экспрессии поверхностных маркеров (см. рис. 7). Несмотря на кажущуюся сложность рисунка, на этом примере явственно прослеживается основная логика постановки любого многопараметрического измерения.
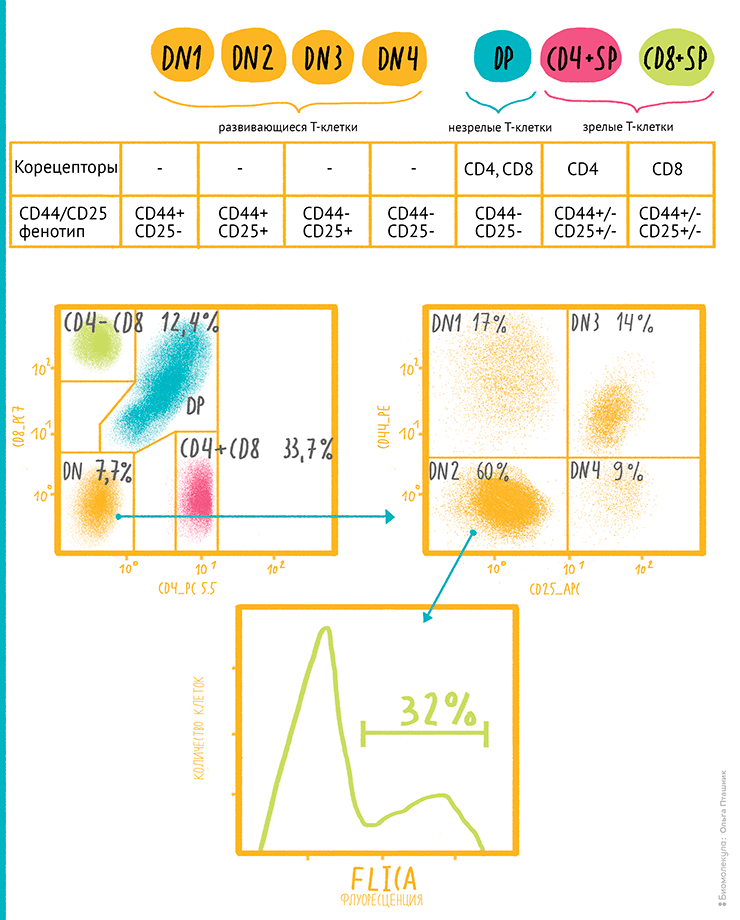
Рисунок 14. Пример использования многоцветного цитометрического анализа для анализа дифференцировки и жизнеспособности тимоцитов мыши — подробная схема анализа результатов. Сверху: схема дифференцировки тимоцитов мыши, некоторые характеристики рецепторов и типичных поверхностных маркеров. Снизу: схема анализа популяции тимоцитов в образце.
- Разделение тимоцитов мыши на 4 типа: по наличию или отсутствию у них CD4 и CD8 маркеров. Принятые обозначения стадий развития Т-клеток определяются экспрессией корецепторов: DN (от Double-Negative, CD4−CD8−) — двойные отрицательные;DP (от Double-Positive, CD4+CD8+) — двойные положительные;SP (от Single-Positive, CD4+CD8− и CD4−CD8+) — одинарно положительные. Проценты на рисунке — количество клеток данного типа по отношению к общему количеству. Используемые метки: PC5.5 и PC7.
- Разделение популяции DN-тимоцитов, которые находятся в начале пути дифференцировки, еще на четыре субпопуляции по содержанию в них маркеров CD25 и CD44 (см. таблицу вверхней части рисунка): DN1, DN2, DN3, DN4. Используемые метки: APC и PE.
- Определение для субпопуляции DN4 уровня апоптоза, составляющего 32%, по окрашиванию меченным FAM панкаспазным ингибитором (FAM-FLICA poly caspase).
рисунок Ольги Пташник по материалам dvfu.pure.elsevier.com
Хромосомный анализ
Многие врожденные заболевания и аномалии вызваны нарушениями в числе (анеуплоидия) и структуре хромосом, выявить которые помогает в том числе и цитометрия (рис. 15) . Хромосомный анализ назначают при трудностях с зачатием ребенка или же для подтверждения диагноза пациента. Например, можно быстро выявить случаи трисомии 21-й хромосомы (когда присутствуют три, а не две копии этой хромосомы), что является признаком синдрома Дауна. Также часто обнаруживают трисомии половых хромосом, возникающие при синдромах Клайнфельтера, Эдвардса и Патау. Количественные аномалии аутосом (хромосом 1–22) являются причиной 0,5–1% всех аномалий строения и встречаются с частотой 1:700.
Правда, существует сложность: на цитометре невозможно разделение 9–12 хромосом (хотя некоторые исследователи эту проблему решают, прибегая к разным ухищрениям [14]).
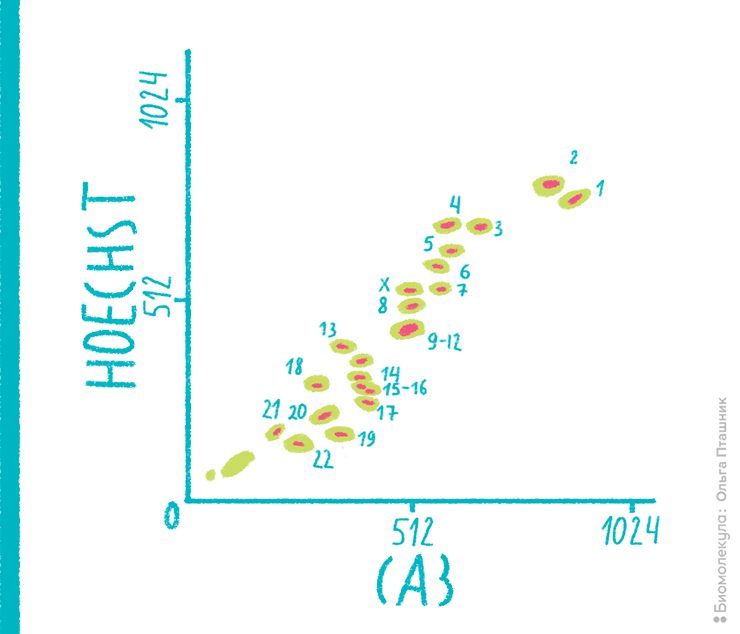
Рисунок 15. Кариотип здорового человека (женщины). Хромосомы окрашены красителями Hoechst 33258 и хромомицином A3 (CA3). Двойное окрашивание необходимо, чтобы достичь лучшего разрешения данных — Hoechst 33258 связывается с AT-богатыми областями, а хромомицин А3 указывает на GC-богатые участки. Полученные данные свидетельствуют о том, что пациент — женщина без хромосомных аномалий.
рисунок Ольги Пташник по материалам flowbook.denovosoftware.com
Для получения максимально корректных результатов при цитометрическом анализе хромосом, анализ проводят в клетках, находящихся в экспоненциальной фазе роста. Клетки премеабилизуют и окрашившивают двумя ДНК-связывающими красителями. Например, хромомицином А3 (СА3), который связывается с CG-богатыми регионами и Hoechst 33258, окрашивающим АТ-богатые части ДНК. Хромосомы разделяют по количеству содержащейся ДНК и соотношению пар оснований.
Пролиферация и клеточный цикл
Клетки постоянно развиваются, делятся и часто превращаются в клетки других типов. Для аккуратной работы с ними всё это необходимо принимать во внимание. Анализ пролиферации и клеточного цикла позволяет сделать выводы о состоянии клеточной культуры, оценить ее жизнеспособность, а также пригождается при разработке новых соединений и оценке их «полезности» для клеток. Есть несколько подходов, многие из которых уже знакомы читателю по разделу «Апоптоз»:
- Поскольку в процессе клеточного цикла происходит удвоение ДНК, эти изменения сравнительно легко уловить в измерениях на цитометре. ДНК-связывающие флуоресцентные красители (например, йодистый пропидий, 7-AAD) позволяют выявить клетки в G1/G0, S и G2/M фазах клеточного цикла. Методически этот подход не отличается от анализа subG1 фракции при исследовании апоптоза.
- Число пролиферирующих клеток можно определить по включению меченого урацила (BrdU) в ДНК в S-фазе клеточного цикла [15]. А соответствующее свечение затем можно измерить при помощи специфических к BrdU антител.
- Активная пролиферация характеризуется повышением уровня экспрессии циклинов, и это тоже можно увидеть при помощи проточной цитометрии — необходимо иметь конъюгированные с флуорохромами моноклональные антитела к циклинам D, E, A или B. Для получения точных результатов рекомендуется параллельно провести окраску красителем типа PI.
- Для изучения динамики пролиферации клетки предварительно обрабатывают флуоресцентным красителем, который связывается с белками цитоплазмы. После каждого последующего митоза его содержание в дочерней клетке становится вдвое меньше, чем в родительской. Как следствие, в два раза снижается интенсивность флуоресценции клеток (рис. 16).
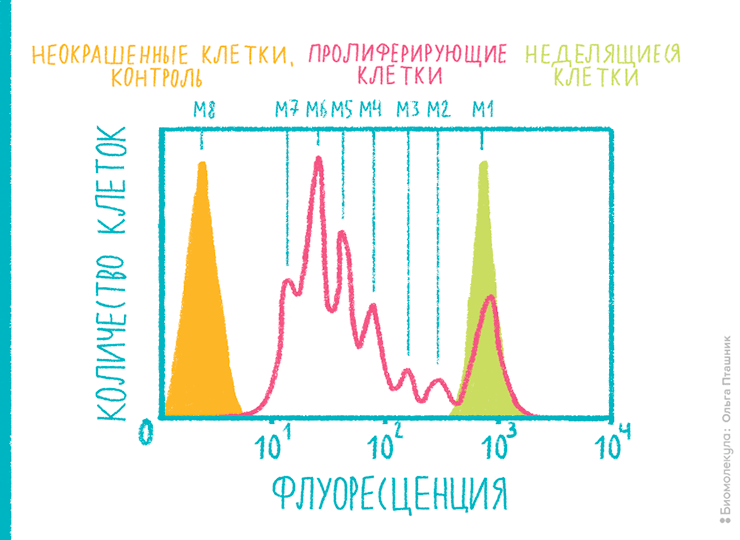
Рисунок 16. Анализ циклов пролиферации клеток. К клеточной культуре добавлен краситель на основе эфира карбоксифлуоресцеина (CFSE), который ковалентно связывается с белками цитоплазмы делящихся клеток. На диаграмме видны хорошо отделимые пики митозов — M1, M2, ..., M8. Каждый следующий пик находится левее предыдущего, поскольку соответствует вдвое снижающейся интенсивности флуоресценции при каждом митозе.
рисунок Ольги Пташник
Внутриклеточные медиаторы и белки
Каждая клетка является впечатляющей по своей сложности смесью белков, нуклеиновых кислот, метаболитов и других веществ. Проточная цитометрия позволяет анализировать экспрессию и локализацию внутриклеточных белков, фактически заменяя вестерн-блоттинг. Выше мы рассматривали определение популяций клеток по поверхностным маркерам и анализ клеточных делений по экспрессии циклинов внутри клетки. Эти два эксперимента можно объединить! Например, определять количество клеток, которые не только содержат целевой белок, но и относятся к определенной подгруппе. Грамотный подбор антител позволяет анализировать несколько внутриклеточных белков за раз.
Однако анализ внутриклеточных белков трудоемок из-за пробоподготовки: клетки необходимо окрасить на поверхностные маркеры, фиксировать, пермеабилизировать (изменить проницаемость клеточной мембраны, чтобы доставить первичные антитела внутрь клетки), заблокировать неспецифическое связывание и далее провести окрашивание флуоресцентно меченными вторичными антителами к целевому белку.
В качестве примера можно рассмотреть анализ экспрессии фосфокиназ в клетке (рис. 17). Фосфокиназы переносят фосфатную группу с АТФ на белок, что часто является «активатором» передачи сигналов в биохимических каскадах, поэтому на основе этого анализа можно изучать множество процессов: трансдукцию сигнала внутрь клетки, наличие лейкозов и иммунодефицитов (активацию или изменение некоторых сигнальных путей), факторы патогенности микроорганизмов.
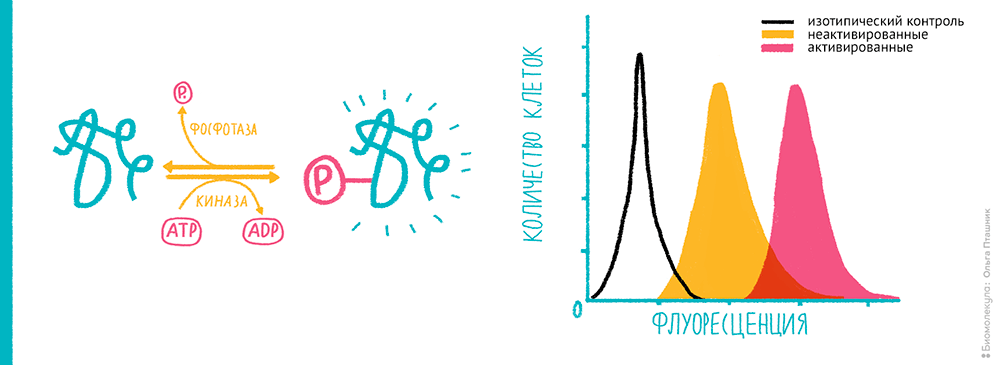
Рисунок 17. Анализ экспрессии фосфокиназ в Т-клетках. Фосфокиназы осуществляют перенос фосфатной группы с АТФ на белок, который в результате часто оказывается «активированным». Слева — схема переноса фосфатной группы при помощи фосфокиназы. Справа — сравнение экспрессии фосфокиназы (ERK 1/2) в активированных Т-клетках с контрольными Т-клетками, а также с изотипическим контролем (неспецифическим связыванием вторичных меченных антител в отсутствии первичных).
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Проницаемость мембраны
Мембрана клетки — одна из главных составляющих частей живых организмов [11]; ее проницаемость тщательно регулируется. Для большинства веществ она непроницаема, но за счет многочисленных рецепторов и каналов эта проницаемость может выборочно меняться для конкретных веществ или в целом. Например, проницаемость мембраны часто служит маркером начавшихся некротических процессов. А иногда исследователь специально «дырявит» мембрану в ходе трансфекции, чтобы доставить генетический материал внутрь клетки. Чтобы оценить состояние мембраны, к клеткам необходимо добавить краситель, в норме не способный проникать внутрь здоровой клетки. Обычно для этих целей применяют красители типа 7-AAD или PI (интеркалируют в ДНК) или краски типа ZombieRed (связываются с белками) (рис. 18).
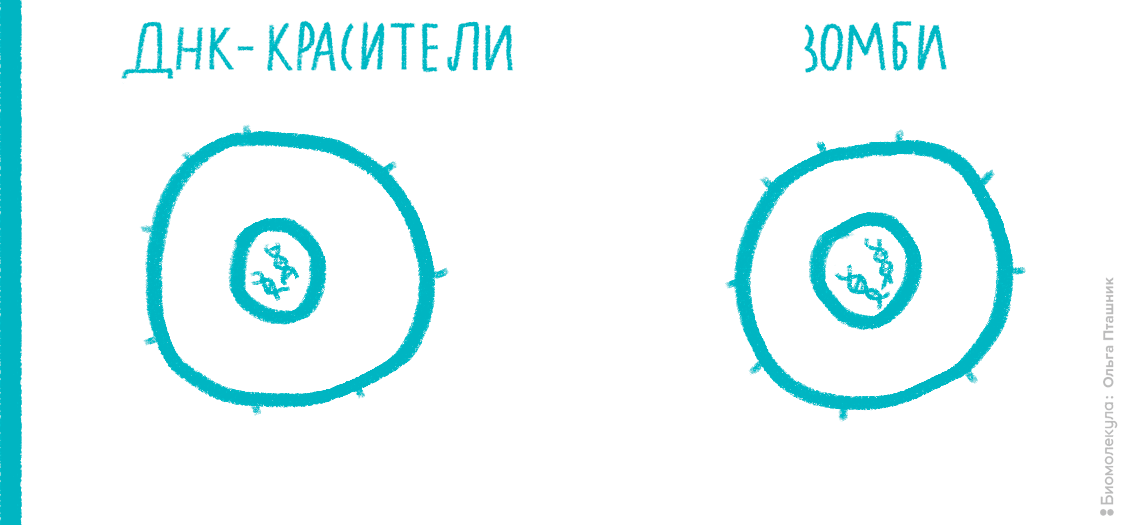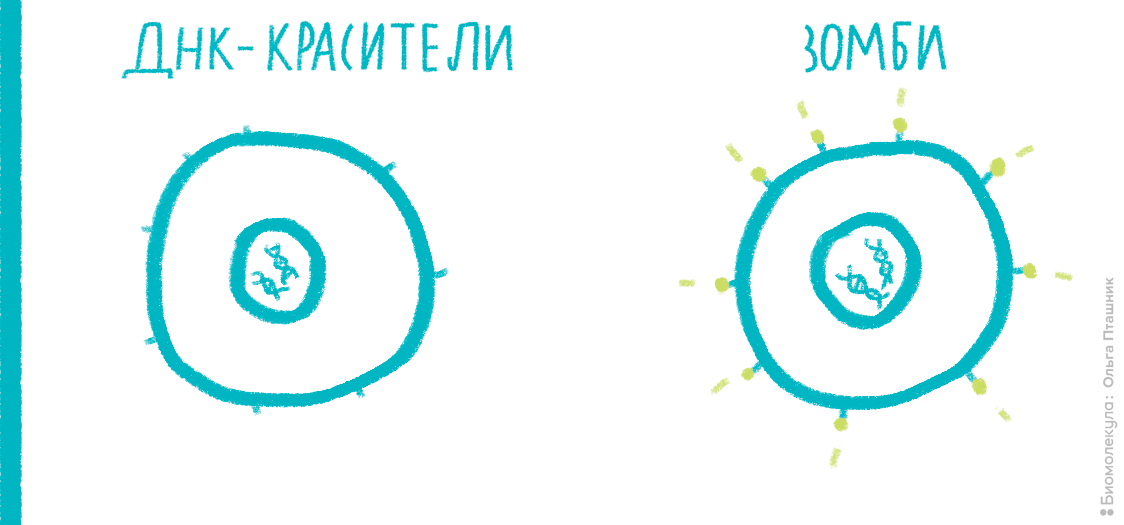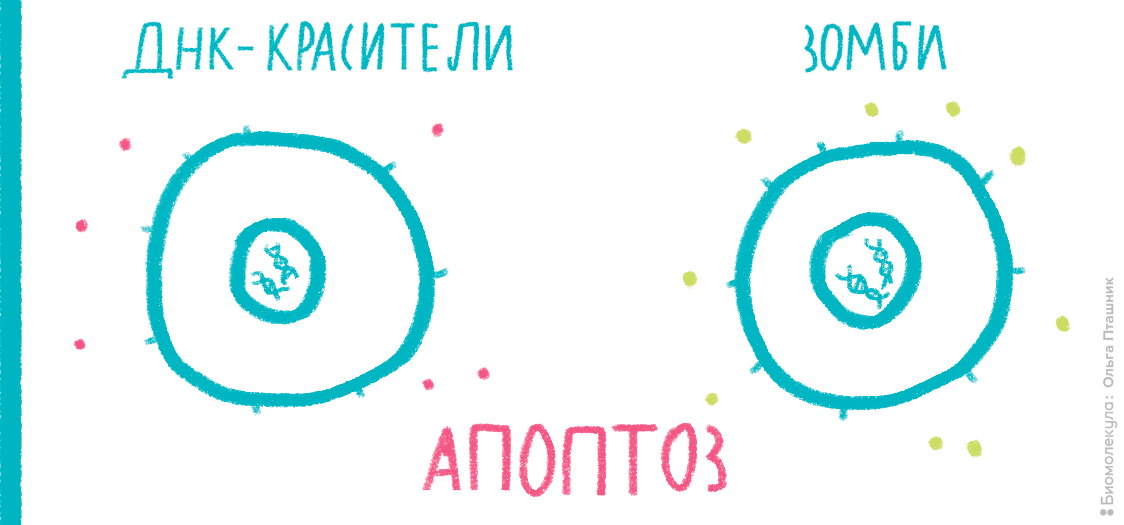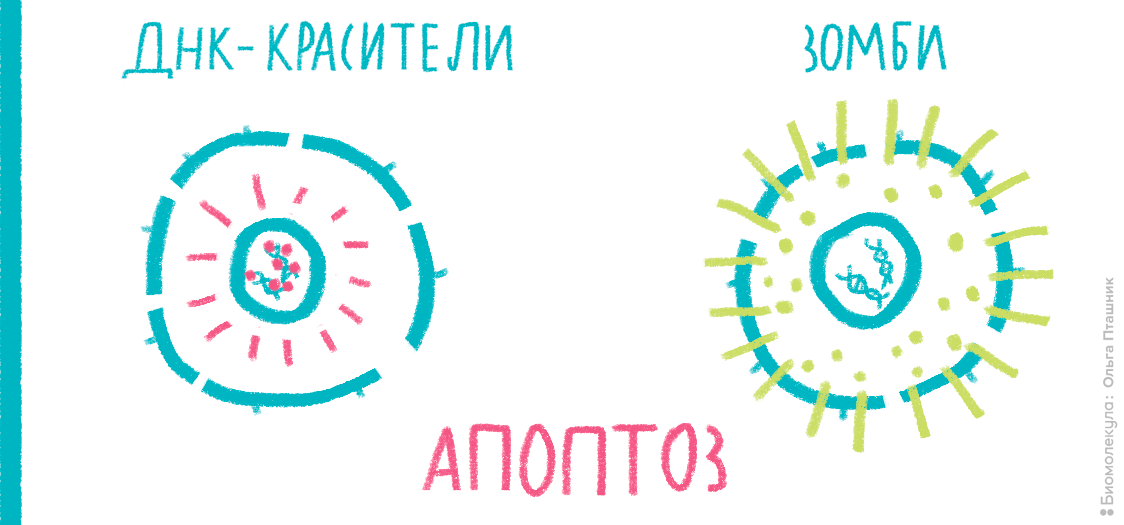
Рисунок 18. Принцип действия красителей типа PI, 7-AAD и Zombie. Интеркалирующие красители проникают внутрь клетки только в случае, если целостность мембраны нарушена (например, это характерно для поздних стадий апоптоза и некроза), и связываются с ДНК. Красители серии Zombie взаимодействуют с первичными аминогруппами белков. Мембрана живых клеток непроницаема для этих красок, поэтому они связываются только с белками на поверхности, и сигнал при измерении на цитометре получается слабый. Мембрана некротических клеток проницаема, поэтому Zombie связывается и с внутриклеточными белками, что делает флуоресценцию гораздо ярче.
рисунок Ольги Пташник
Измерение pH
pH, или показатель кислотности, важен не только в химии, но и в биохимии. А значит, и внутри живой клетки изменение кислотности может много о чем рассказать исследователю. Например, по этим изменениям можно отследить процессы передачи сигналов, начало клеточного деления и многое другое. Цитофлуориметрический анализ этого процесса заключается в использовании красителей, у которых спектр испускания зависит от pH (например, красители на основе бензоксантенов, сarboxy-SNARF-1): по изменению светимости нетрудно сделать выводы и об изменении pH.
Анализ трансгенных популяций
Все мы знаем о генно-модифицированных организмах (ГМО) и широких возможностях их применения [16–18]. Создавая новую модификацию, исследователь должен убедиться, что трансформация прошла успешно, и организм содержит новые гены. Для такого контроля при создании трансгенных популяций в клетку, как правило, вводят не только целевой ген, но и ген GFP. Трансгенные клетки начинают светиться в «зеленом» канале, что может быть обнаружено при помощи флуоресцентного микроскопа и проточного цитометра (который определит количественные характеристики — какой процент популяции содержит GFP, какие изменения происходят с течением времени).
Измерение РНК
У эритроцитов — красных клеток крови, лишенных ядра, — есть предшественники: ретикулоциты. Они еще содержат остатки рибонуклеиновых кислот, митохондрий и других органелл, лишаясь которых, трансформируются в зрелый эритроцит. В норме в крови всегда содержится некоторое их количество. Пониженное содержание ретикулоцитов зачастую свидетельствует о нарушениях работы костного мозга или почек, а резкое падение их количества говорит об анемии. Также к этому приводит наличие метастазов в костном мозге. Анализ крови на содержание ретикулоцитов обычно назначают для контроля лечения анемических состояний, восстановления костного мозга после трансплантации и для оценки эффективности кроветворения (рис. 19).
Цитометрически разделить эритроциты и ретикулоциты можно за счет высокого содержания РНК в последних. Существует несколько красителей, используемых для анализа количества РНК, но в случае с ретикулоцитами чаще всего применяется тиазол оранжевый (thiazole orange) [19].
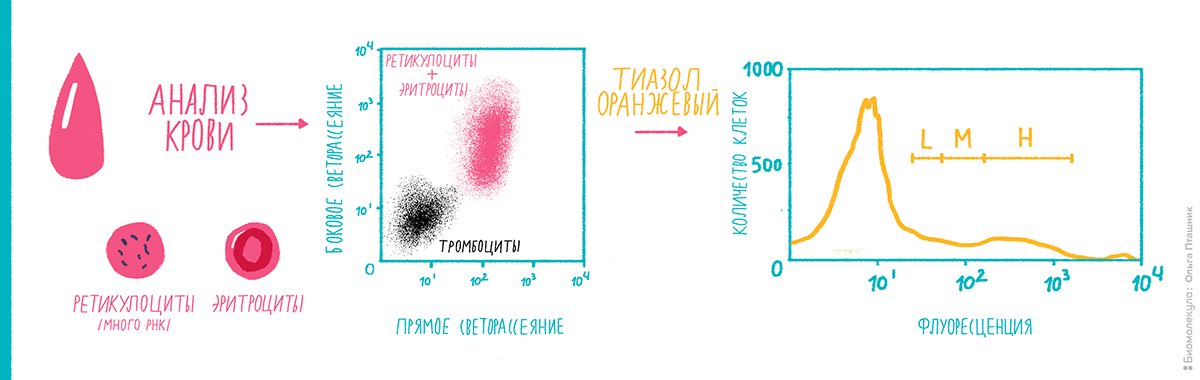
Рисунок 19. Цитофлуориметрическая диагностика гематопоэтических болезней на примере анализа фракции ретикулоцитов. Разделение эритроцитов и их предшественников ретикулоцитов проводят при помощи окрашивания содержащейся в ретикулоцитах РНК тиазолом оранжевым. На левой диаграмме видны тромбоциты (черные) и эритроцитарная фракция (красные). Анализ связывания РНК с тиазолом в эритроцитарной фракции позволяет отметить регионы с разным уровнем флуоресценции: high (H), medium (M) и low (L), соответствующие стадиям созревания ретикулоцитов.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник по материалам ncbi.nlm.nih.gov
Особенности и «кухня» проточной цитометрии
Всем ученым хорошо известно — во многом успех эксперимента зависит не только от прямых рук и качественных реактивов, но и от грамотного плана работы. Любую цитометрическую методику, прежде чем приступать к измерениям, необходимо проверить и отладить именно на вашей экспериментальной модели. Пренебрежение основными правилами и необходимыми контрольными измерениями очень рискованно, ведь в этом случае собранные за недели упорной работы данные могут отправиться не в престижный журнал, а в корзину! Итак, что необходимо учесть?
Ложные результаты
К сожалению, на проточном цитометре можно получить ложноположительные или ложноотрицательные результаты эксперимента, если забыть про два важных факта — аутофлуоресценцию клеток и неспецифическое связывание антител.
- Аутофлуоресценция. Некоторые клетки обладают собственной (ауто-) флуоресценцией. Перед проведением любых экспериментов обязательно проверьте на цитометре, не «светятся» ли ваши клетки, а также как выглядит проба, обработанная полностью в соответствии с планируемым протоколом, но в которую не были добавлены красители. Если вы видите аутофлуоресценцию, необходимо принимать за ноль именно ее!
- Неспецифическое связывание. При использовании антител необходимо помнить, что они могут не только распознавать целевой белок, но и неспецифически связываться с чем-то еще. Уберечься от ошибок можно с помощью изотипических контролей — антител, содержащих такую же Fc-часть, что и целевое антитело, окрашенных той же меткой, но при этом не специфичных к целевому белку.
Вывод: Для настройки чувствительности прибора к флуоресценции необходимо использовать соответствующие изотипические контроли или образцы, окрашенные по отдельности каждым антителом, калибровочные микросферы, а также не забывать проверять аутофлуоресценцию образцов перед началом работы.
Контрольные измерения
В начале работы необходимо подумать об отрицательных и положительных контролях, которые вы будете использовать для определения области измерений, а также для проверки корректной работы прибора. Предположим, вы изучаете реакцию клеток на ваше соединение, которое может стать новым лекарственным препаратом, и хотите оценить количество апоптотических клеток в пробе (см. раздел «Апоптоз»). Вам потребуется взять (−)-контроль, в котором абсолютное большинство клеток живые. Также пригодится (+)-контроль, где большая часть клеток находится в апоптозе под действием любого известного апоптогенного агента. Таким образом вы сможете выставить область измерения, чтобы детектировать значимые изменения.
Вывод: Критически важно правильно настроить области, изменения в которых вы планируете наблюдать (гейты). Однако эту часть работы можно сделать и после того, как вы измерите все пробы, поскольку программное обеспечение всех цитометров позволяет анализировать данные после эксперимента. Главное — сделать пробы с правильными положительными и отрицательными контролями, чтобы было с чем сравнивать.
Многоцветный анализ
Компенсация
При проведении многоцветного анализа вы неизбежно столкнетесь с тем, что некоторые флуорохромы светят не только в своем, но и в соседних каналах (хоть и слабее, чем в основном). Эта особенность может значительно исказить ваши данные, если вы примете «засветку» в другой канал за значимый результат эксперимента (рис. 20).
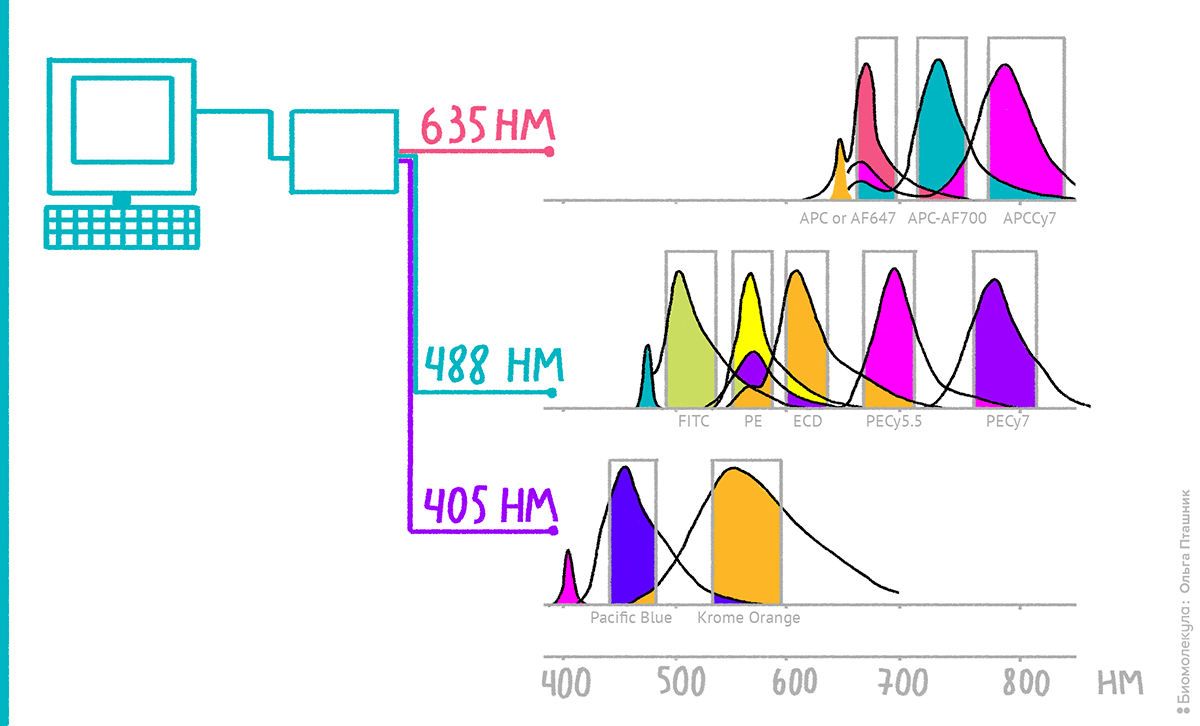
Рисунок 20. Схема «засветки» флуорохромов в соседние каналы при использовании прибора с 3 лазерами и 10 детекторами.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Компенсация может быть настроена автоматически (новые приборы и специальные утилиты измеряют и рассчитывают матрицу компенсации по заданным флуорохромам) или самостоятельно (используя образцы, связанные с каждым флуорохромом по отдельности и «убирая» его свечение в нецелевом канале при помощи ПО).
Для проверки результата рекомендуется использовать способ FMO (Fluorescence Minus One) контроля, когда в пробе присутствуют все планируемые флуорохромы кроме одного (рис. 21).
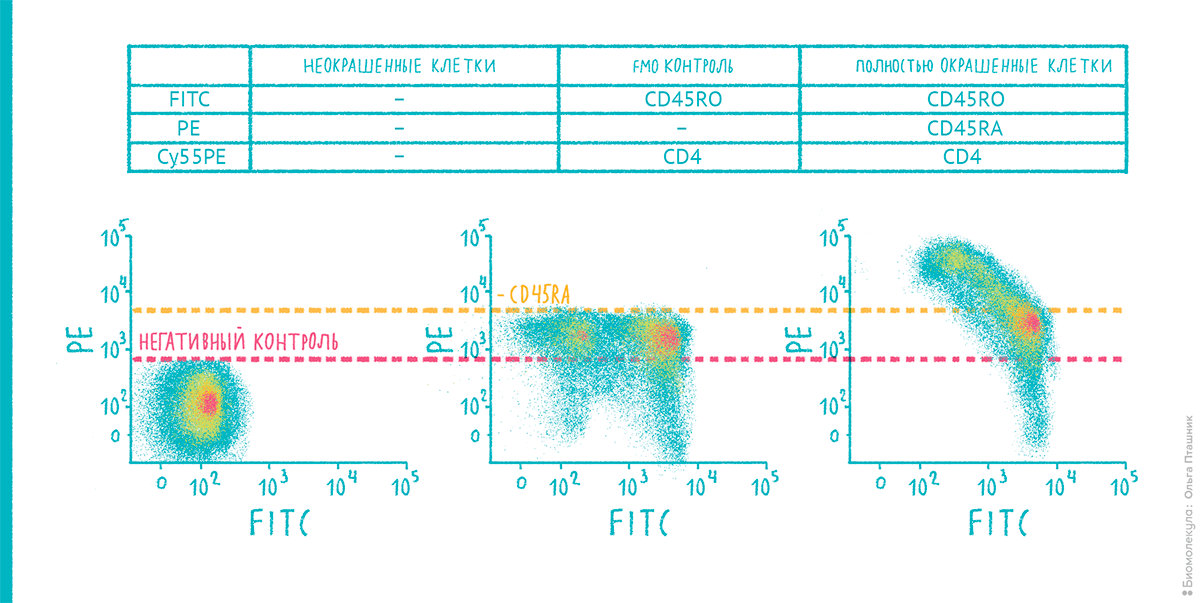
Рисунок 21. Принцип FMO (Fluorescence Minus One) контроля. Предположим, что мы хотим проанализировать Т-клетки одновременно на три поверхностных маркера: два типа CD45 (RO и RA формы) и CD4. У нас есть к ним антитела с метками, которые указаны в табличке. На двумерной диаграмме PE-FITC слева изображены полностью неокрашенные клетки; красная линия соответствует «базовому» уровню — нулю). В центре представлена диаграмма для случая, когда добавлены два красителя из трех: CD45RO и CD4, имеющие небольшую засветку в PE-канал. Таким образом, клетки, содержащие CD45RA-маркер, должны оказаться выше желтой линии. Справа — диаграмма для клеток, обработанных антителами уже ко всем исследуемым маркерам, подтверждающая, что результатам можно будет верить! Но сначала аналогичным образом необходимо будет выполнить FMO-проверку и для двух других меток.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник по материалам expertcytometry.com
Выбор флуорохромов
Для детекции антигенов с низким уровнем экспрессии необходимо использовать яркие флуорохромы. Для одновременного исследования антигенов со слабым и сильным уровнями экспрессии категорически не следует брать соседние каналы, так как «сильный» антиген почти наверняка засветит весь небольшой эффект от «слабого».
Для сильных антигенов лучше выбирать каналы, которые оказывают минимальное влияние на соседние. Планирование эксперимента могут упростить утилиты типа fluorofinder.com.
Вывод: Самое важное в многоцветном анализе — настройка компенсации. Компенсацию (даже если ПО прибора позволяет настроить ее постфактум) предпочтительно все же делать перед началом работы. Это позволит вам сразу правильно оценивать получаемые результаты и грамотно планировать дальнейшие эксперименты. Пренебрегая процедурой компенсации или оставляя ее «на потом», можно в конце работы обнаружить, что полученные данные не являются сколь-либо значимыми. Настраивать и проверять компенсацию лучше всеми перечисленными выше методами. После настройки и проверки значения компенсации необходимо сохранить, и все (!) эксперименты, которые планируете сравнивать между собой, проводить, не внося изменений.
Пермеабилизация
Для измерения внутриклеточных белков и анализа нуклеиновых кислот (например, для исследования клеточного цикла и пролиферации) клеточную мембрану нужно сделать проницаемой для данного красителя — провести пермеабилизацию при помощи специальных веществ.
Реагенты для пермеабилизации
Глобально реагенты для пермеабилизации деляется на два типа [20]:
- Органические растворители (метанол, этанол, ацетон), которые одновременно фиксируют и пермеабилизуют мембрану, растворяя липиды и коагулируя белки. (Впрочем, в большинстве случаев стадию фиксации лучше провести отдельно, используя 2–4% раствор параформальдегида.) Как правило, используются в концентрации 70–90%; к основным преимуществам относится возможность длительного хранения клеток на −20 °С, а также лучшее разделение пиков при подборе оптимальных условий
- Детергенты, которые создают пóры в клеточной мембране, — сапонин (saponin), Trition-X-100, Tween-20 и другие. Сапонин используют в случаях, когда необходимо изучать внутриклеточные белки одновременно с поверхностными маркерами. Его действие обратимо, поэтому сапонин должен также содержаться во всех растворах и буферах для окрашивания, применяемых после стадии пермеабилизации. «Тритон X-100» часто добавляют одновременно с красителями, что уменьшает длительность эксперимента. Как именно работают эти детергенты? Сапонин селективно «извлекает» из мембраны молекулы холестерина и за счет этого формирует поры. Triton-X и Tween-20 являются неселективными детергентами и способствуют образованию пор в мембранах за счет связывания и удаления мембранных липидов и белков.
В настоящее время предлагается также большое количество коммерческих реагентов для фиксации и пермеабилизации. Несмотря на то, что такие наборы зачастую позиционируются как ready-to-use, не будет лишним все же сделать сравнение различных доступных вариантов фиксации и пермеабилизации в применении к вашему эксперименту перед выбором оптимального.
Вывод: Использование того или иного пермеабилизующего агента зависит исключительно от ваших задач. Как правило, если вы берете опубликованную методику, но собираетесь использовать ее для анализа других клеток, стоит приготовиться к необходимости провести ряд дополнительных экспериментов по подбору оптимальной концентрации реагента, а также условий пермеабилизации.
Благодарности
Автор статьи благодарит Дениса Баева за ценные комментарии, правки и предложения; Галину Судьину за научное руководство и совместную работу; Игоря Кудрявцева, Анну-Полину Шурыгину и Эллу Старикову за прекрасные лекции и научно-практические задачи по проточной цитометрии; Ивана Галкина, Константина Лямзаева и Дмитрия Кнорре за оборудование и консультации; Константина Рубцова за сервисные работы и ремонт оборудования; Виктора Татарского и Мурада Вагиду за рекомендации и антитела.
Часть приведенных в этой статье данных получена при поддержке грантов РФФИ 16-34-00531 и 17-04-01491.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет июль.
Литература
- 12 методов в картинках: клеточные технологии;
- A. Moldavan. (1934). PHOTO-ELECTRIC TECHNIQUE FOR THE COUNTING OF MICROSCOPICAL CELLS. Science. 80, 188-189;
- Frank T. Gucker, Hugh B. Pickard, Chester T. O'Konski. (1947). A Photoelectric Instrument for Comparing the Concentrations of Very Dilute Aerosols, and Measuring Low Light Intensities1. J. Am. Chem. Soc.. 69, 429-438;
- M. J. Fulwyler. (1965). Electronic Separation of Biological Cells by Volume. Science. 150, 910-911;
- W. A. Bonner, H. R. Hulett, R. G. Sweet, L. A. Herzenberg. (1972). Fluorescence Activated Cell Sorting. Review of Scientific Instruments. 43, 404-409;
- Флуоресцирующая Нобелевская премия по химии;
- Рулетка для спектроскописта;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Pratip K. Chattopadhyay, Brent Gaylord, Adrian Palmer, Nan Jiang, Mary A. Raven, et. al.. (2012). Brilliant violet fluorophores: A new class of ultrabright fluorescent compounds for immunofluorescence experiments. Cytometry. 81A, 456-466;
- Квантовые точки — наноразмерные сенсоры для медицины и биологии;
- Липидный фундамент жизни;
- Robinson J.P., Carter W.O., Narayanan P. Functional assays by flow cytometry (chapter 26). In: Manual of clinical laboratory immunology (5th ed.) / ed. by Rose N.R., de Marcario E., Folds J.D., Lane H.C., Nakumura R. Am. Soc. Microbiology, 1997. P. 245–254;
- 12 методов в картинках: микроскопия;
- Yu-Yan Jia, Hou-Nan Wu, Liang Fang, Yun Liu, Li Cheng, et. al.. (2016). Sorting of chromosomes on FACSAriaTMSORP for the preparation of painting probes. Cytometry. 89, 844-851;
- Ormerod M.G. (2008). Flow cytometry — a basic introduction. De Novo Software;
- ГМО: бояться нельзя питаться. Биологи знают, где поставить запятую!;
- Еще раз про ГМО;
- Трансгенные растения — спасители планеты или бомбы замедленного действия?;
- L. HOVE, W. GOOSSENS, V. DUPPEN, R. L. VERWILGHEN. (2008). Reticulocyte count using thiazole orange. A flow cytometry method. Unknown journal title.. 12, 287-299;
- Mary Johnson. (2013). Детергенты: Тритон Х-100 Твин-20 и другие. MATER METHODS. ru3;
- Моноклональные антитела;
- Флуоресцентные репортеры и их молекулярные репортажи.













