Путешествие во времени: как судьба первых клеток эмбриона влияет на его дальнейшее развитие и риск заболеваний
23 апреля 2021
Путешествие во времени: как судьба первых клеток эмбриона влияет на его дальнейшее развитие и риск заболеваний
- 2085
- 0
- 10
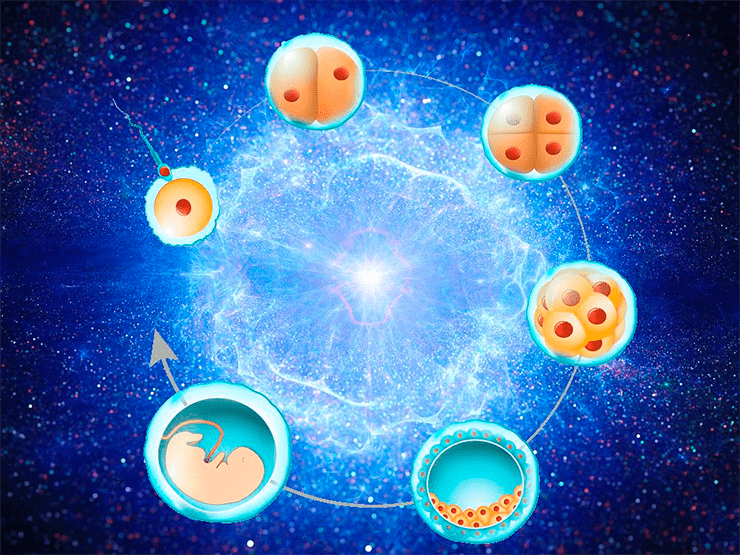
Ранний эмбриогенез не менее загадочен, чем Большой взрыв, положивший начало нашей Вселенной. Космос возник из бесконечно малой точки, а 37 триллионов клеток, из которых состоит тело человека — всего из одной оплодотворенной яйцеклетки. Оба явления очень сложно изучать — и очень интересно.
коллаж автора на основе изображений с сайта depositphotos.com
-
Автор
-
Редакторы
-
Рецензент
Темы
19 марта 2021 года в научном журнале Science были опубликованы две научные статьи о самых ранних эмбриональных мутациях человека. 15 исследователей из американских Клиники Мэйо и Йельского университета под совместным руководством профессоров Алексея Абызова и Флоры Ваккарино разработали неинвазивный метод воссоздания клеточной родословной для каждого живущего человека и применили его для анализа иерархических деревьев клеточных клонов у двух живых людей и одного погибшего плода. Этот анализ помог приблизиться к моменту, когда оплодотворенная яйцеклетка разделилась на два первых бластомера, и сделать несколько важных выводов. Мы расспросили Алексея Абызова о том, что нового им удалось узнать.
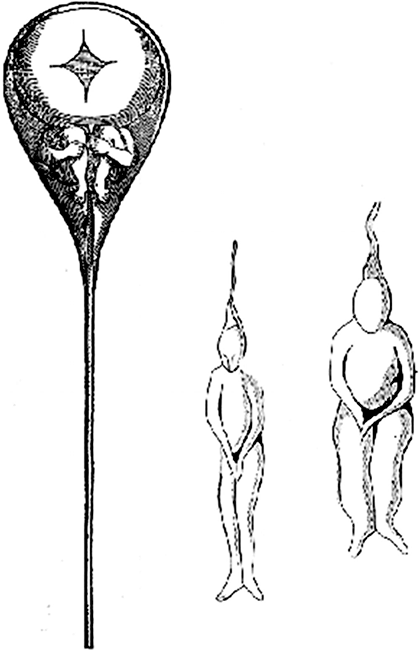
Рисунок 1. Так, по мнению преформистов, выглядел маленький гомункул в мужских сперматозоидах. Рисунок голландского математика и физика Николаса Хартсокера, 1695 г.
Несколько столетий назад в биологии господствовало учение о преформизме. Лучшие умы человечества ничего не знали о генах, а потому считали, что в половых клетках изначально находится гомункул — маленький человечек (рис. 1). И тут мнения сразу разделились. Овисты поместили гомункул в ооцит, а анималькулисты — в сперматозоид, отведя женским половым клеткам скромную роль питательной среды [1].
По мере развития эмбриологии идеи преформизма были признаны ошибочными. В XIX веке российский естествоиспытатель Карл Бэр (рис. 2) установил, что зародыши человека на ранних этапах развития похожи вовсе не на гомункулов, а на червячков и рыбок. С открытием генов стало понятно, что в половых клетках содержится не зачаток готового организма, а «рецепт» по его «приготовлению», записанный в ДНК. Но это породило массу новых вопросов. Как этот «рецепт» определяет судьбу разных клеток? Какие факторы могут вмешиваться, помимо генетического кода? Могут ли особенности развития организма, склонности к тем или иным заболеваниям закладываться уже на уровне самых первых бластомеров?

Рисунок 2. Карл Бэр — российский естествоиспытатель, сформулировавший законы зародышевого сходства («законы Бэра»).
Этим темам посвящено немало научных исследований. Но судьба первых бластомеров и ее влияние на дальнейшее формирование организма по-прежнему во многом остаются terra incognita.
Человек асимметричный
Человек относится к живым организмам с двусторонней симметрией. Однако в реальности наше тело далеко не так симметрично, как может показаться на первый взгляд. В первую очередь это касается некоторых органов: все знают, что сердце и желудок находятся слева, а печень справа. Многие парные органы тоже неодинаковы: правое легкое у людей состоит из трех долей, а левое — всего из двух, верхний полюс правой почки обычно находится на уровне 12 межреберья, а левой — на уровне 11 ребра. У мужчин левое яичко зачастую находится ниже правого, а размеры его меньше [2], [3]. У женщин немного различаются размеры правой и левой молочных желез. Правое и левое полушария головного мозга выглядят одинаково, но работают немного по-разному, различается объем правой и левой лобных и затылочных областей [4].
Некоторые заболевания тоже «выбирают» определенную половину тела. Например, так происходит с двигательными симптомами при болезни Паркинсона, при гемимегалоэнцефалии (патология, при которой сильно увеличивается одно из полушарий головного мозга, и в нем происходят патологические изменения) [5]. Исследования в некоторых популяциях показали, что у женщин рак молочной железы чаще возникает слева, но при правосторонней локализации зачастую хуже прогноз и раньше возникают метастазы [6], [7].
Можно привести еще много примеров асимметрии в теле человека, связанных как с нормой, так и с патологией. Это очень интересная сфера для научных исследований, и зачастую она уводит на клеточный уровень, заставляя разбираться в изменениях, которые происходили в клетках, начиная с самых ранних этапов эмбриогенеза.
Формирование организма происходит иерархично, в нем прослеживается несколько уровней клеточной организации. Еще до прикрепления к стенке матки зародыш разделяется на две части. Трофобласт (рис. 3) представляет собой пузырек диаметром 0,1 мм и является предшественником плаценты. Внутри него находится эмбриобласт — скопление клеток, из которого затем образуется эмбрион. Постепенно эмбриобласт принимает форму диска — становится так называемым зародышевым диском. Он ориентируется в пространстве, в нем выделяются передняя и задняя, правая и левая части, появляются три зародышевых листка — эктодерма, энтодерма и мезодерма (рис. 4), — дающие начало разным тканям [8]. Каждая клетка занимает отведенное ей место и передает своим потомкам инструкцию о том, что делать дальше. Конечно же, интересно отследить эти процессы, разобраться в «родословной» каждой клетки в организме человека.
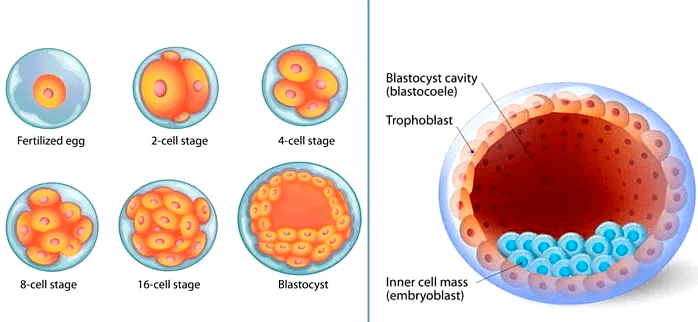
Рисунок 3. Самые ранние стадии эмбриогенеза. На изображении справа трофобласт выглядит как полая сфера. Внутри, у одного из ее полюсов, находится скопление клеток голубого цвета — это эмбриобласт.
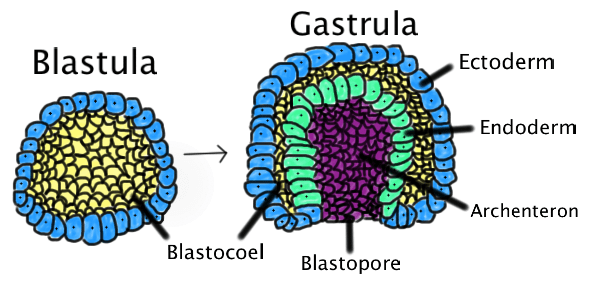
Рисунок 4. Три зародышевых листка: энтодерма, эктодерма и мезодерма. Из эктодермы образуются наружные покровные ткани и нервные структуры; из мезодермы — мышцы, органы кровеносной, выделительной и половой систем; из энтодермы — пищеварительная система и другие внутренние органы.
Пытаясь исследовать развитие эмбрионов человека, ученые сталкиваются с массой сложностей, как технического, так и этического характера. Эксперименты над людьми и эмбрионами проводить запрещено, поэтому приходится исследовать клеточные линии ретроспективно. Постфактум это можно сделать, только если остаются определенные «следы», мáркеры. К счастью, такие маркеры есть. Это соматические мутации.
Маяки для путешествия в прошлое
Мутагенез — двигатель эволюции, и он постоянно происходит во всех живых клетках. Наследственные мутации присутствуют в ооцитах и сперматозоидах и передаются от родителей детям. Они обнаруживаются во всех клетках тел детей. Соматические мутации возникают в соматических клетках, из которых состоит тело человека, и которые не участвуют в половом размножении. Они присутствуют не во всем теле, а только в потомках той клетки, в которой изначально произошло изменение. Например, пигментный невус (родинка) представляет собой скопление таких клеток. К распространенным мутациям в пигментных невусах относится мутация V600E в гене BRAF — он кодирует фермент киназу, способствующую пролиферации (размножению) клеток (эта мутация встречается и в клетках злокачественной опухоли — меланомы).
В настоящее время широко применяется термин «послезиготные (постзиготические) мутации» — они появляются после слияния половых клеток и начинают возникать буквально с первых минут эмбриогенеза. Исследования показывают, что на каждое из пяти первых делений после оплодотворения яйцеклетки приходится по 1–2 новых соматических мутации, а в дальнейшем этот показатель увеличивается [9]. Большинство из этих мутаций — нейтральные: они не приносят ни вреда, ни пользы. Но некоторые влияют на важные процессы в клетках и, накапливаясь, со временем приводят к заболеваниям. Например, в 2018 году было установлено, что у здоровых людей старшего возраста на одну клетку слизистой оболочки пищевода приходится от 20 до более чем 2000 мутаций, и некоторые из них связаны с онкологическими заболеваниями [10].
В первую очередь мутации изучают для того, чтобы разобраться в последствиях, к которым они приводят в организме — например, вызывают те или иные заболевания или повышают предрасположенность к их развитию. Но также ученые придумали, как с помощью анализа изменений в генах отслеживать клеточные линии. Если одна и та же соматическая мутация встречается во многих клетках, то можно с высокой степенью достоверности утверждать, что у этих клеток был общий предок. Изучив генетические изменения в разных клетках и тканях организма с помощью технологий секвенирования [11], можно судить о времени возникновения этих изменений — вплоть до первых делений зиготы (оплодотворенной яйцеклетки с диплоидным набором хромосом). Тут работает принцип: чем больше клеток являются носителями мутации, тем у более ранней клетки-предшественницы она возникла, и наоборот. Это дает возможность выстраивать иерархические деревья (рис. 5, 6), которые помогают ученым понять, как события на самых ранних этапах эмбриогенеза влияют на дальнейшее развитие организма, и какой вклад вносят разные клеточные клоны в формирование тканей.
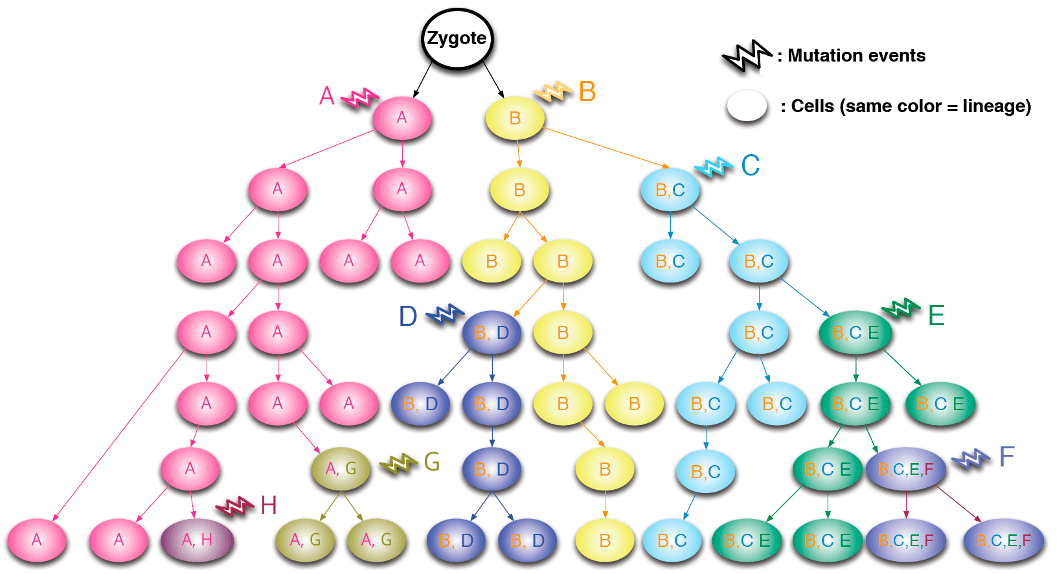
Рисунок 5. Как можно отследить родословную клеточных клонов, изучая соматические мутации? Разными буквами и цветами обозначены новые мутации, которые возникают в материнских клетках и передаются их потомкам. Видно, как изменения в генах накапливаются с каждым новым поколением.
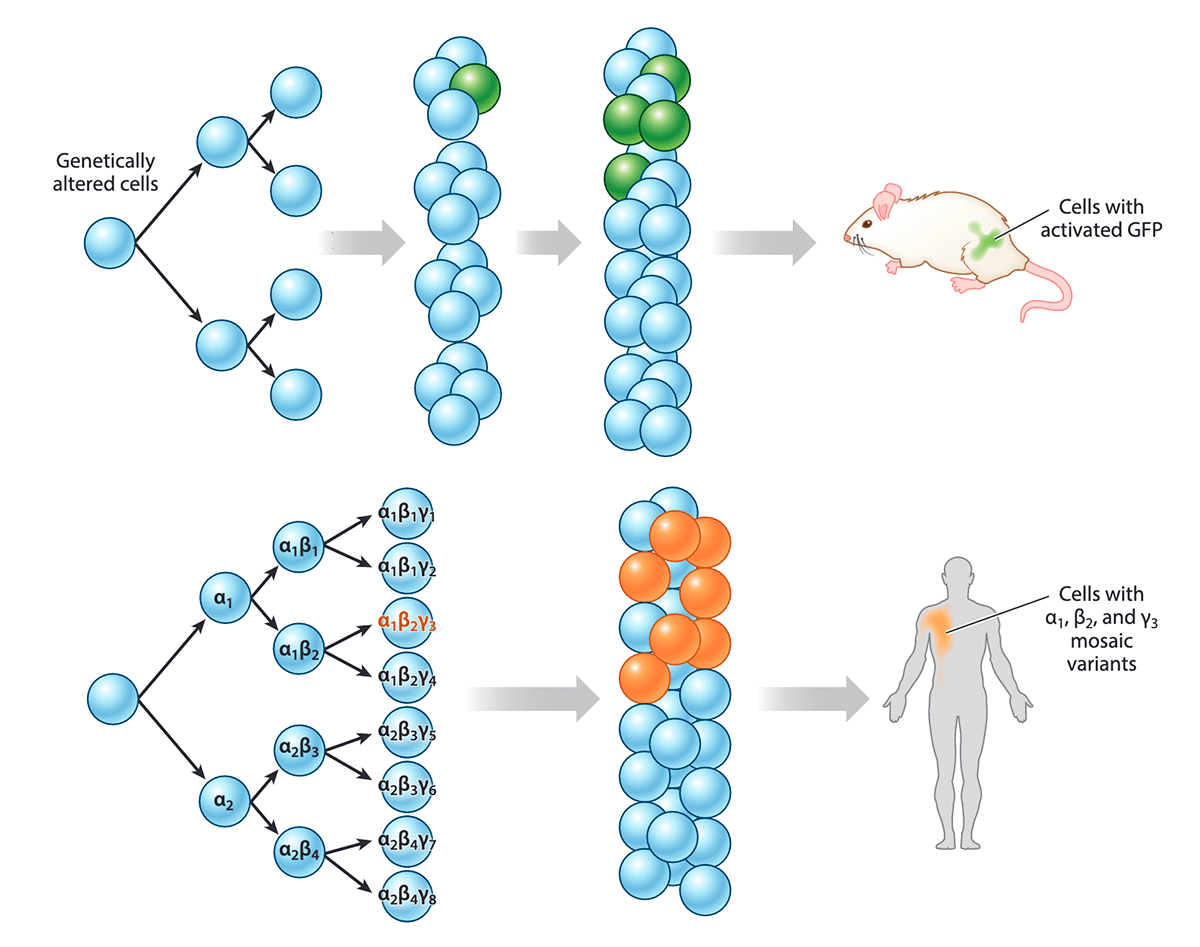
Рисунок 6. Соматические мутации и мозаицизм. Голубым цветом обозначены клетки без мутаций. Видно, как в одной из клеток возникает новая мутация. У мыши клетка с изменением в генах (активация GFP — зеленого флуоресцентного белка) отмечена зеленым цветом — ее создали искусственно с помощью генной инженерии. Ниже представлен пример похожего (но возникшего естественным путем) мозаицизма у человека: клетки с мутациями обозначены оранжевым цветом. Например, большое оранжевое пятно на теле человека на рисунке может быть огромным врожденным невусом. А может быть (и чаще всего так бывает), эта мутация нейтральная и никак себя не проявляет — ее можно обнаружить только с помощью генетического анализа.
Ранее уже проводили исследования родословных клеток с помощью анализа послезиготных мутаций. Например, удалось оценить скорость мутагенеза на ранних стадиях развития эмбриона, установить, что два первых бластомера вносят неодинаковый вклад в развитие тела человека — асимметрия возникает уже после первого дробления зиготы. Авторы одной научной работы, опубликованной в 2017 году, указывают соотношение вклада ранних эмбриональных клеток в формирование популяции клеток крови 2:1 [10]. Соотношение потомков разных клеточных клонов может различаться в разных тканях, оно коррелирует с пространственной организацией органов. Ученые продолжают разбираться в причинах и закономерностях этих процессов. Возможно, это поможет не только лучше изучить ранние этапы эмбриогенеза, но и разработать новые методы профилактики, диагностики, лечения некоторых заболеваний.
Что нового удалось выяснить?
Ученые под руководством Алексея Абызова (рис. 7) использовали для реконструкции событий, происходящих на ранних этапах эмбриогенеза, клетки, полученные от двух живых людей (здоровая 66-летняя женщина и 29-летний мужчина, страдающий синдромом Туретта [12]) и погибшего плода. У живых людей взяли образцы кожи рук и ног, выделили фибробласты и получили из них несколько десятков клонов искусственных стволовых клеток, а затем секвенировали их ДНК. Также для исследования были взяты образцы мочи, крови и слюны. У погибшего плода использовали клетки головного мозга, фибробласты твердой мозговой оболочки, ткань селезенки [8], [13].
То, как из одной зиготы образуется 37 триллионов клеток, из которых состоит человеческое тело, является одной из величайших загадок биологии. Мы разработали метод воссоздания личной клеточной родословной в самом раннем, послезиготном развитии по клеткам живущего человека, которые могут быть неинвазивно собраны и проанализированы в любом возрасте. Описанная методология обладает потенциалом к дальнейшему развитию, но уже сейчас может применяться для воссоздания клеточной родословной на более поздних стадиях развития, а также в других многоклеточных организмах помимо человека.
Изучение соматических мутаций в ДНК образцов тканей и реконструкция событий, происходивших на ранних этапах эмбриогенеза, показали, что первые бластомеры вносят неравномерный вклад в формирование тканей тела. Уже после первого дробления яйцеклетки выделяется доминантная клеточная линия, представленная в тканях на 70–90%, и рецессивная, которой достается только 10–30%. Самая большая разница была обнаружена в крови — 90:10. В моче соотношение доминантного и рецессивного клонов составило 70:30 — 80:20, а в слюне оно было либо как в крови, либо в промежутке между показателями крови и мочи.
Ученые обнаружили, что в клетках, относящихся к рецессивной линии, чаще встречаются однонуклеотидные варианты (SNV, замены одной «буквы» генетического кода) [16] и индéли (небольшие вставки или утраты участков генетического кода). Причина SNV обычно — дезаминирование 5-метилцитозина , превращающее его в тимин, а индели, вероятно, возникали из-за проскальзывания фермента ДНК-полимеразы во время восстановления поврежденной ДНК.
Приставка метил- означает, что произошла реакция метилирования, и к молекуле прикрепилась метильная группа. Если это происходит с основаниями ДНК, то последовательность гена не меняется, а вот его работа может измениться, и довольно сильно. Такие трансформации относятся к сфере эпигенетики. Кстати, на «Биомолекуле» есть статья «Неканоническая ДНК» [17], из которой читатель, ориентирующийся в «языке» генетического кода, может узнать, чем на самом деле отличается цитозин от 5-метилцитозина, а еще — чем тимин отличается от урацила. Рекомендуем также обратиться к статье «Молекулы и эпигеном» [18] из спецпроекта по эпигенетике.
Отсюда напрашивается предположение: возможно, рецессивный клон потому и становится рецессивным, что в его клетках хуже восстанавливается ДНК, и им на это требуется больше времени. Есть и альтернативная гипотеза: возможно, рецессивный клон предназначен в первую очередь для формирования трофобласта и плаценты. Разобраться поможет изучение ткани плаценты — это тема для будущих научных работ. Вот как об этом говорит сам Алексей:
Главным открытием оказалось то, что ветви в воссозданных генеалогических древах оказались разнопредставленными, то есть асимметричными, по количеству клеток в органах каждого человека. В частности, одна из двух клеток после первого дробления зиготы является прародителем абсолютного большинства (70–90%) клеток в каждом исследуемом человеке. Возможным объяснением может быть то, что эта клетка предназначена в первую очередь для формирования организма взрослого человека, в то время как вторая клетка предназначена для создания плаценты, которая будет питать растущий эмбрион. Исследователи также высказали альтернативную гипотезу, что разнопредставленность может быть результатом разной скорости роста клеток и/или разной способности справляться с повреждением ДНК.
Изучая ткани погибшего плода, ученые обнаружили, что клеточные клоны в некоторых областях мозга упорядоченно распределяются вдоль переднезадней оси. Такой характер распределения говорит, что оно предопределяется событиями, которые происходят в клетках-прародительницах этих клонов. Судьба их потомков запрограммирована с самого начала.
Еще одно интересное наблюдение: ранние мутации нередко в точности совпадают с геномными вариациями, которые встречаются в популяции в целом. Иными словами, одни и те же изменения в генах независимо друг от друга, случайным образом, происходят у разных людей. Это наталкивает на мысль, что в геноме есть области, особенно чувствительные к мутагенезу. Именно в них чаще всего и происходят «поломки» [8], [13].
Это исследование стало важным шагом на пути изучения событий раннего эмбриогенеза. Ученые разработали неинвазивный метод воссоздания клеточной родословной для каждого живущего человека, и в будущем его можно использовать для анализа родословных клеток на разных стадиях развития у разных многоклеточных организмов. Помимо фибробластов кожи, крови, слюны и мочи, можно взять любой другой биоматериал, полученный от живого человека: например, стул, мазки из половых путей женщины, мужскую семенную жидкость. Это открывает возможности для дальнейших исследований.
Выявить болезнь до того, как она началась
Анализ клеточных родословных может иметь огромное практическое значение в медицине. Набор наследственных и соматических мутаций, которые человек носит в своем теле, — это бомба замедленного действия, однажды способная привести к смертельно опасному заболеванию. И здесь представляет интерес еще одно недавнее исследование американский ученых из Гарвардской медицинской школы и Института онкологии им. Дана-Фарбер, результаты которого были опубликованы в феврале 2021 года [19].
В исследовании приняли участие два пациента с миелопролиферативными заболеваниями (редким типом злокачественных заболеваний крови) в возрасте 63 и 34 лет. Ученые провели у них биопсию красного костного мозга, секвенировали геном здоровых и злокачественных клеток, а затем составили их родословную. Исследователи пытались выяснить, когда у этих больных возникла мутация JAK2, вызвавшая заболевание. Оказалось, что у 63-летнего больного это произошло примерно в 19 лет, а у 34-летнего — в 9 лет [19].
Из-за того, что мутации возникают, начиная с самых ранних этапов эмбриогенеза и на протяжении всей жизни, организм человека напоминает мозаику из клеток, в которых различаются некоторые гены, и с возрастом она становится только сложнее и разнообразнее. Это явление в биологии так и называется — «мозаицизм» . И ряд данных свидетельствует, что он может повышать вероятность развития некоторых заболеваний. Например, в 2012 году было опубликовано исследование, в котором проанализировали гены более 50 тысяч испытуемых с помощью микрочипов для исследования SNP (однонуклеотидных полиморфизмов) и метода выявления больших (от 50 т.п.н. до всей хромосомы) аномалий ДНК. Авторы работы обнаружили, что частота клонального мозаицизма в клетках периферической крови у людей младше 50 лет невысока и составляет менее 0,5%, а вот у пожилых достигает 2–3%. Причем, многие из этих мозаичных генетических нарушений аналогичны тем, что обнаруживаются при злокачественных заболеваниях крови [20].
О мозаицизме, его связи с заболеваниями и посвященной этой теме научной работе, которую ранее опубликовала группа Алексея Абызова, мы подробно рассказывали в статье «Геномная головоломка: открой в себе мозаика» [14].
В другом исследовании 2012 года оказалось, что клональный мозаицизм у людей с сóлидными опухолями встречается чаще, чем у здоровых, причем связь оказалась сильнее, когда материал для анализа брали до постановки диагноза и начала лечения. Клональный мозаицизм был более распространен среди людей, у которых анализ ДНК проводили за год до того, как им диагностировали лейкемию [21].
Эти исследования показывают, что первые мутации, приводящие к онкологическим и другим заболеваниям, могут возникать задолго до того, как появляются симптомы, изменения в лабораторных анализах или патологические изменения, которые можно рассмотреть на снимках.
А могут ли некоторые из этих мутаций возникать еще во время внутриутробного развития? Играют ли роль в их возникновении события, происходящие на ранних этапах эмбриогенеза? И может ли быть так, что из-за «слабости» генома клетки из рецессивного клона становятся «уязвимыми точками» для развития ряда заболеваний, и их можно идентифицировать заранее? Это очень сложные вопросы, и вероятно, в будущем ученые найдут ответы и на них.
Литература
- Epigenesis and preformationism. (2005). Stanford Encyclopedia of Philosophy;
- Athina C Tsili, Alexandra Ntorkou, Dimitrios Giannakis, Nikolaos Sofikitis, Maria I Argyropoulou. (2017). Normal testes asymmetry evaluated by apparent diffusion coefficient and magnetization transfer ratio. Acta Radiol. 58, 883-889;
- Donald Vaganée, Frederik Daems, William Aerts, Rosina Dewaide, Tinne van den Keybus, et. al.. (2018). Testicular asymmetry in healthy adolescent boys. BJU Int. 122, 654-666;
- Daniel R. Weinberger, Daniel J. Luchins, John Morihisa, Richard Jed Wyatt. (1982). Asymmetrical volumes of the right and left frontal and occipital regions of the human brain. Ann Neurol.. 11, 97-100;
- Куликова С.Л., Талабаев М.В., Свинковская Т.В., Лихачев С.А. (2020). Гемимегалэнцефалия как причина фармакорезистентной эпилепсии у детей: обзор литературы и описание двух клинических случаев. «Неврология и нейрохирургия. Восточная Европа». 2, 296–311;
- J P Robichaux, R M Hallett, J W Fuseler, J A Hassell, A F Ramsdell. (2015). Mammary glands exhibit molecular laterality and undergo left–right asymmetric ductal epithelial growth in MMTV-cNeu mice*. Oncogene. 34, 2003-2010;
- Nosheen Fatima, Maseeh Uz Zaman, Aamir Maqbool, Shaista H. Khan, Nazia Riaz. (2013). Lower Incidence but More Aggressive Behavior of Right Sided Breast Cancer in Pakistani Women: Does Right Deserve More Respect?. Asian Pacific Journal of Cancer Prevention. 14, 43-45;
- Liana Fasching, Yeongjun Jang, Simone Tomasi, Jeremy Schreiner, Livia Tomasini, et. al.. (2021). Early developmental asymmetries in cell lineage trees in living individuals. Science. 371, 1245-1248;
- Taejeong Bae, Livia Tomasini, Jessica Mariani, Bo Zhou, Tanmoy Roychowdhury, et. al.. (2018). Different mutational rates and mechanisms in human cells at pregastrulation and neurogenesis. Science. 359, 550-555;
- Iñigo Martincorena, Joanna C. Fowler, Agnieszka Wabik, Andrew R. J. Lawson, Federico Abascal, et. al.. (2018). Somatic mutant clones colonize the human esophagus with age. Science. 362, 911-917;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Варианты Туретта;
- Sara Bizzotto, Yanmei Dou, Javier Ganz, Ryan N. Doan, Minseok Kwon, et. al.. (2021). Landmarks of human embryonic development inscribed in somatic mutations. Science. 371, 1249-1253;
- Геномная головоломка: открой в себе мозаика;
- Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом;
- David H. Spencer, Bin Zhang, John Pfeifer. (2015). Single Nucleotide Variant Detection Using Next Generation Sequencing. Clinical Genomics. 109-127;
- Неканоническая ДНК;
- Молекулы и эпигеном ;
- Debra Van Egeren, Javier Escabi, Maximilian Nguyen, Shichen Liu, Christopher R. Reilly, et. al.. (2021). Reconstructing the Lineage Histories and Differentiation Trajectories of Individual Cancer Cells in Myeloproliferative Neoplasms. Cell Stem Cell. 28, 514-523.e9;
- Cathy C Laurie, Cecelia A Laurie, Kenneth Rice, Kimberly F Doheny, Leila R Zelnick, et. al.. (2012). Detectable clonal mosaicism from birth to old age and its relationship to cancer. Nat Genet. 44, 642-650;
- Kevin B Jacobs, Meredith Yeager, Weiyin Zhou, Sholom Wacholder, Zhaoming Wang, et. al.. (2012). Detectable clonal mosaicism and its relationship to aging and cancer. Nat Genet. 44, 651-658;
- Упреки в нарциссомике;
- Basith Amjad. (2019). A Brief History of Embryology: Historical Vignettes in Embryology. Clinical Embryology. 1-9;
- Ji Won Oh, Alexej Abyzov. (2020). Analysis of Cell and Nucleus Genome by Next-Generation Sequencing. Human Interphase Chromosomes. 35-65;
- Alexej Abyzov, Flora M. Vaccarino. (2020). Cell Lineage Tracing and Cellular Diversity in Humans. Annu. Rev. Genom. Hum. Genet.. 21, 101-116.