Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом
29 января 2019
Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом
- 911
- 0
- 2
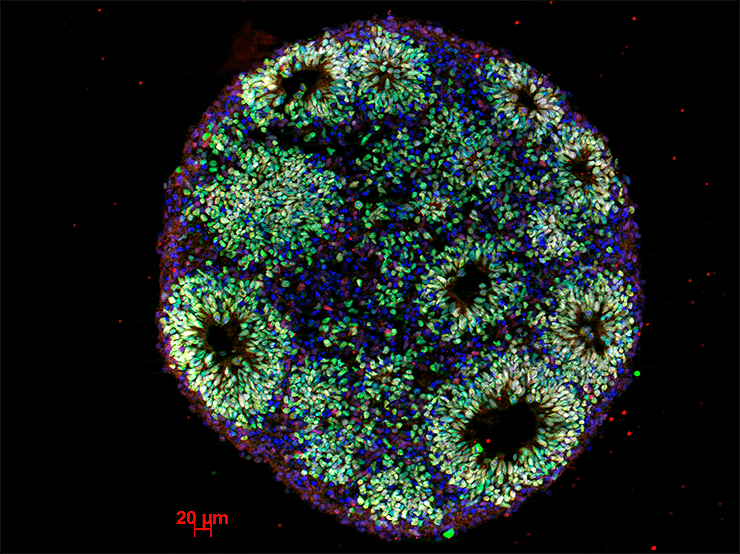
Гистологический срез органоида, окрашенный антителами к нейронам, пролиферирующим клеткам и клеткам-предшественникам
фото любезно предоставили Алексей Абызов и Flora Vaccarino
-
Автор
-
Редакторы
-
Рецензент
О развитии головного мозга человека, в особенности его коры, мы и по сей день знаем сравнительно немного. Оно и понятно: единственный доступный ученым материал — мертвые зародыши на разных стадиях развития, а наблюдать процесс в «прямом эфире» в утробе матери по понятным причинам невозможно. Вместе с тем основы многих психических расстройств, таких как аутизм и шизофрения, могут крыться именно в сбоях, происходящих на самых ранних этапах развития мозга. Однако не всё так безнадежно: на помощь могут прийти искусственно выращенные модели головного мозга — так называемые органоиды. Совсем недавно Science опубликовал сравнение профиля экспрессии генов искусственно выращенной модели головного мозга и «настоящего» мозга человека на разных стадиях развития. Мы поговорили об этой работе с одним из руководителей исследования — Алексеем Абызовым.
На животных моделях, таких как мыши и даже обезьяны, можно изучать многие аспекты физиологии человека. Но с нервной системой и головным мозгом в частности всё не так-то просто: никто не станет отрицать, что мозг человека отличается даже от самых близких к нему животных. Эксперименты на людях проводят разве что в социологии и психологии, и, разумеется, изучать детали функционирования живого мозга человеческого эмбриона очень непросто. Особенно — его развитие. Как понять, как из отдельных клеток в мозге эмбриона развиваются структуры, ответственные за высшую нервную деятельность и когда возникают «поломки», приводящие к заболеваниям нервной системы? Долгое время казалось, что к этой важнейшей и интереснейшей задаче невозможно подступиться.
Однако сейчас на вооружении у биологов есть метод индуцированных стволовых клеток : воздействуя на дифференцированные клетки взрослого организма определенными транскрипционными факторами, можно вернуть их в предковое «стволовое» состояние, в котором они вновь становятся способными дифференцироваться в клетки разных типов. Кстати, за этот удивительный метод в 2012 году присудили Нобелевскую премию [1].
«Биомолекула» много и подробно писала о том, что такое индуцированные стволовые клетки и каково их значение для науки и медицины [1–4].
Исследователи из клиники Майо, Йельского университета и Университета Дьюка использовали эту технологию для получения миниатюрных моделей мозга человека — органоидов . Результаты их исследования были опубликованы 14 декабря 2018 года в журнале Science [5]. Один из руководителей этой команды из 17 ученых — наш соотечественник Алексей Абызов — любезно согласился дать комментарии по столь яркой работе.
Кстати, идея смоделировать органы человека при помощи индуцированных стволовых клеток и получить модельные «органы» не нова. О том, какие предлагались способы получения искусственных органов, можно прочесть в статье «Органы из лаборатории» [6].
И эта статья не одна: о содержимом спецвыпуска Science кратко уже рассказал портал N+1: «Консорциум PsychEncode завалил журнал Science статьями про шизофрению» [7].
Возможно, некоторые наши читателя помнят Алексея по статье «Геномная головоломка: открой в себе мозаика», посвященной явлению мозаицизма у многоклеточных организмов [8].
Итак, авторы исследования «перепрограммировали» зародышевые фибробласты и «заставили» их стать клетками переднего мозга. В результате получились органоиды, у которых, как и у переднего мозга, должно было происходить развитие коры. Действительно, у органоидов образовалась кора, но было необходимо выяснить, какой стадии развития мозга она соответствует.
Для ответа на этот вопрос исследователи провели комплексное исследование транскриптомов клеток органоидов. Кроме того, в анализ включили и исследование эпигеномов указанных клеток, то есть особых меток в их хроматине (обзорно о том, что такое эпигенетика, можно прочесть в статье [9]). Транскриптомика и эпигеномика относятся к числу так называемых омиксных технологий, которые используются для качественного и количественного описания молекул определенного типа в биологическом образце. Транскриптомика занимается изучением всех РНК-транскриптов клетки, а эпигеномика — всех эпигенетических модификаций ее генетического материала. Полученные данные сравнивали с данными по экспрессии генов в мозговой ткани разного возраста, взятыми из PsychENCODE, BrainSpan и некоторых других баз данных.
Как и ожидалось, в клетках мозга взрослого человека, плода в перинатальном периоде (с 22 недели беременности по 7 день после рождения) и плода до 22 недели беременности экспрессируются разные гены. Однако совершенно неожиданно оказалось, что клетки органоидов не вошли ни в одну из перечисленных групп, а образовали свой собственный кластер. Хотя, транскриптомы клеток органоидов были наиболее близки к транскриптомам клеток мозга через 8–16 недель после зачатия. Таким образом, органоид по профилю экспрессии генов соответствует мозгу человеческого плода на строго определенном раннем этапе развития. На это указывает также сравнение активных промоторов, энхансеров и хроматиновых меток в клетках органоидов и мертвых зародышей на разных стадиях развития.
Выяснилось также, что при дифференцировке нейронов имеются два решающих момента. Сначала в пролиферирующих предшественниках подавляются гены, ответственные за клеточное деление и репарацию ДНК. На втором этапе подавляется синтез ряда транскрипционных факторов. Вместе с тем по мере дифференцировки клеток в них начинали работать гены, специфичные для нейронов, например, гены синаптической передачи, экспрессия которых повышалась в обеих критических точках; а также гены всевозможных белков, необходимых для формирования синапсов; гены рецепторов, кальциевых и калиевых каналов. Именно поэтому в клетках органоидов и коры мозга зародышей на поздних стадиях развития так сильно отличаются профили экспрессии генов.
В связи с перечисленными различиями между клетками органоидов и мозга зародышей возникает справедливый вопрос: а можно ли вообще использовать органоиды как модель мозга человека для изучения его развития? Активность 85,3% энхансеров различалась у плода и органоидов, что свидетельствуют об их очень динамичном функционировании. По мере дифференцировки клеток органоидов почти все ранее описанные энхансеры, связанные с ранними этапами развития мозга, перестают быть активными.
Ученые смогли связать группы совместно экспрессирующихся генов (модули), которые, вероятно, задействованы в определенных биологических процессах, и соответствующие им регуляторные последовательности так, что уровень экспрессии генов одного модуля совпадает с активностью регуляторных элементов. Примечательно, что в некоторые модули вошли гены, связанные с аутизмом.
Однако на данный момент органоиды имеют только кору, подкорковые структуры у них отсутствуют. По словам Алексея, «в отдаленной перспективе мы займемся моделированием целого мозга на органоидах, но это очень долгое и непростое дело: на получение и изучение органоидов, соответствующих только коре, ушло 10 лет. Рецензенты, кстати, тоже указывали на то, что наша модель включает только кору. Мы займемся получением органоидов, соответствующих всему мозгу, непонятно только, как быстро и как успешно...»
По-видимому, нарушения в регуляции экспрессии генов на ранних этапах формирования мозга лежат в основе аутизма и других психических расстройств. «Органоиды моделируют самые ранние этапы развития мозга, поэтому если есть подозрение, что какая-то болезнь связана с нарушениями развития мозга именно на этих стадиях, его можно проверить с помощью органоидов. Кроме того, на органоидах можно изучать влияние химических веществ, в частности лекарств, на раннее развитие мозга. Кстати, один наш проект связан с изучением влияния алкоголя на раннее развитие мозга», — рассказывает Алексей.
Абызов также пояснил, почему в качестве исследуемого психического отклонения был выбран именно аутизм: «В ряде исследований показано, что аутизм — это болезнь развития, то есть он начинается не после рождения, а во время формирования нервной системы еще до рождения. Органоиды в этом плане хорошо подходят для изучения раннего развития мозга и отклонений от него. Наконец, сейчас по крайней мере в США аутизм активно исследуют: в частности, секвенируют геномы детей, страдающих аутизмом, и их родителей, поэтому появляется все больше данных для анализа».
А могут ли органоиды помочь в изучении ранних опухолей головного мозга? Пока на этот счет есть только догадки. Алексей признается: «Честно говоря, мы об этом не думали. Интуитивно мне кажется, что можно. Органоиды не имеют иммунной системы, поэтому, наверное, можно подсаживать в них раковые клетки и смотреть, как они будут взаимодействовать. Еще можно отключить в органоидах гены-супрессоры опухолей и таким образом спровоцировать появление в органоиде опухоли».
Будем надеяться, что дальнейшее исследование развития мозга на органоидах прольет свет на молекулярные основы различных отклонений в нервной системе.
Литература
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Ствол и ветки: стволовые клетки;
- Была клетка простая, стала стволовая;
- В поисках клеток для ИПСК — шаг за шагом к медицине будущего;
- Anahita Amiri, Gianfilippo Coppola, Soraya Scuderi, Feinan Wu, Tanmoy Roychowdhury, et. al.. (2018). Transcriptome and epigenome landscape of human cortical development modeled in organoids. Science. 362, eaat6720;
- Органы из лаборатории;
- Мухина В. (2018). Консорциум PsychEncode завалил журнал Science статьями про шизофрению. N+1;
- Геномная головоломка: открой в себе мозаика;
- Эпигенетика: невидимый командир генома;
- Сколько сора в нашей ДНК;
- Геном человека: как это было и как это будет.