Синтетические эмбрионы человека: новое направление в исследованиях развития жизни
13 февраля 2024
Синтетические эмбрионы человека: новое направление в исследованиях развития жизни
- 1182
- 0
- 9
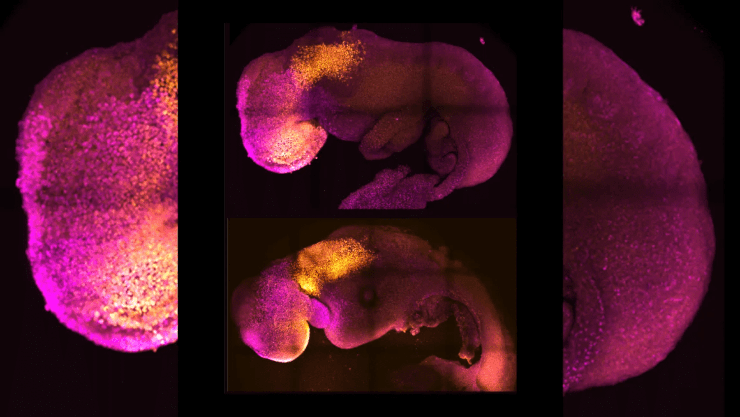
На пути к синтетическим эмбрионам… Сверху: натуральный эмбрион мыши на восьмом дне развития — уже сформировались зачатки мозга, сердца и других органов. Снизу: синтетическая модель эмбриона мыши, полученная путем выращивания стволовых клеток (вместо использования оплодотворенной яйцеклетки). Неопровержимое сходство подчеркивает значимость и интерес к технологиям моделирования эмбрионов.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: С каждым годом научный прогресс неудержимо рвется вперед. Однако, наряду с нашумевшими открытиями, призванными чуть ли не изменить «саму структуру человека», довольно иронично выглядит факт, что наша собственная эволюция все еще остается загадкой. Кажется, как будто мы — люди — значительно менее изучены, чем скромная лабораторная мышь. Но недавние открытия в области биологии развития ознаменовали новую эру, отмеченную созданием моделей in vivo, воспроизводящих раннее развитие млекопитающих, а именно — человека, — предоставляя беспрецедентные возможности для новых исследований в области эмбриогенеза.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Синтетическая биология» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
С самых давних времен люди исследовали эмбрионы живых существ, наблюдали и описывали их структуру при помощи доступных методов. В то время арсенал их был невелик, и фундаментальные работы древнегреческого философа Аристотеля, также как и зарисовки великого итальянского анатома Леонардо да Винчи, чьи работы долгое время являлись опорными в понимании устройства эмбрионального развития, были выполнены по изучению плода внутри трупа. Но древние времена остались позади, ученые заменили свои лупы и скальпели на микроскопы и компьютеры, благодаря чему сегодня мы имеем возможность не просто изучать абортивный материал, а даже воссоздавать жизнеспособные модели, достоверно повторяющие все этапы развития человеческого организма.
Безусловно, великие открытия не происходят спонтанно. Изучая любую научную область, мы так или иначе наткнемся на истоки ее развития — как правило, такие исследования спустя годы отмечаются престижными премиями. Например — Нобелевская премия по физиологии и медицине, присужденная в 1995 году Эдварду Льюису, Христиане Нюслайн-Фольхард и Эрику Вишаусу «за открытия, касающиеся генетического контроля раннего эмбрионального развития» [2]. Именно этот момент можно считать началом новой эры в исследованиях, направленных на подробное изучение молекулярных процессов, отвечающих за формирование организма. Забегая вперед, скажем, что изучение генетического материала in vitro не будет удовлетворять любопытство исследователей и приведет к созданию моделей, полностью и частично имитирующих эмбриональное развитие в лабораторных условиях.
С 1995 года прошло почти три десятилетия, и для поставленной цели были использованы разные модельные животные. Однако человека — виновника торжества — в этом перечне найти нам не удастся. За счет небольшого срока развития и доступности генетического материала, сегодня мы подробно знаем, как на ранних этапах развиваются плодовая мушка (Drosophila melanogaster) или лабораторная мышь (Mus musculus), однако манипуляции, приемлемые для модельных организмов [3–5], считаются неэтичными и попросту недопустимыми на человеческих эмбрионах — просто задумайтесь на секунду над вопросами «является ли развивающийся эмбрион человеком?» и если да, то «имеются ли у него права и свободы, которые нельзя нарушать?»
Но все же прогресс не стоит на месте, и если возникает проблема, оптимистично предположить, что рано или поздно найдется ее решение. Так и произошло. Правда прогресс этот состоял из нескольких весьма интересных ступеней, начиная с получения первых бластоидов, моделирующих образование бластоцисты; через гаструлоиды, воспроизводящие формирование трех зародышевых листков. Вся эта лестница привела нас к полноценным моделям ранних эмбрионов человека, призванных обойти все вышеуказанные запреты при помощи своего «синтетического» происхождения.
В этой статье представлен прогресс исследований, позволивший создать ранние эмбриональные модели, включая получение первых бластоидов и гаструлоидов; рассматривается корректность использования термина «синтетический эмбрион»; а также обсуждаются биоэтические нормы и запреты, действующие на сегодняшний день в отношении получения и изучения представленных моделей. Надеюсь, что подробное обсуждение этих технологий вдохновит на дальнейшие исследования и достижения в этой области.
Строительные блоки синтетических эмбрионов
Прежде чем добраться до вершины, необходимо ступить на самую первую ступеньку лестницы и разобраться, что же лежит в основе этих достижений. Подобно естественным системам, синтетические эмбрионы и их предшественники имеют мельчайшую единицу, с формирования которой и начинается целостный организм. В эмбриональном развитии это эмбриональные стволовые клетки (ЭСК), имеющие способность дифференцироваться в самые разнообразные типы клеток взрослого организма [6].
О разновидностях, важности и предпосылках использования ЭСК и не только уже подробно рассказывалось в цикле работ, опубликованных на «Биомолекуле»: «Такие разные стволовые клетки» [7], «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [8], «Ствол и ветки: стволовые клетки» [9], «Эндометрий как альтернативный источник стволовых клеток» [10], однако для наиболее глубокого понимания дальнейших процессов кратко обозначим основные сведения, непосредственно влияющие на формирование эмбрионов в естественных и искусственных условиях.
Отметим, что ЭСК обладают рядом важных физиологических функций, к которым относится плюрипотентность — свойство клеток дифференцироваться в производные всех трех первичных зародышевых листков, а также тотипотентность — способность клетки реализовывать генетическую информацию, обеспечивающую ее дифференцировку и развитие до целого организма [11].
Обратим внимание на то, что ЭСК млекопитающих имеют два плюрипотентных состояния: наивное и первичное [12], различающиеся между собой молекулярными и функциональными характеристиками. Наивные ЭСК, по сравнению с первичными, соответствуют более ранней стадии развития плюрипотентных клеток; они неограниченны в потенциале дифференцировки; и имеют возможность дифференцироваться как в эмбриональную (эпибласт), так и во внеэмбриональную ткань (гипобласт).
Напротив, первичные ЭСК, получаемые на более поздней стадии развития, обладают относительно ограниченным потенциалом дифференцировки и в основном вносят вклад в эмбриональные компоненты, в отличие от их наивных аналогов [13].
Существуют разные методики получения плюрипотентных клеток в лабораторных условиях. Они могут быть выделены из внутренней клеточной массы (ICM) бластоцисты с использованием различных методов, включая перенос ядер соматических клеток (SCNT) и специальные протоколы индукции плюрипотентных стволовых клеток (ИПСК) с использованием абортивного материала зародыша. Однако метода отделения клеток и получения только наивных ЭСК до недавнего времени не существовало. Для этого потребовалось определение специфических условий культивирования, которые бы поддерживали наивное состояние клеток, при этом подавляя первичное.
После многих лет упорных исследований Гафни и его коллегам в 2013 году удалось достигнуть желаемого результата (рис. 1). Они воссоздали наивные ЭСК человека, используя комбинацию малых молекул с факторами роста [14]. И пусть это открытие было совершено относительно недавно, сегодня уже существуют протоколы и питательные среды, восстанавливающие праймированные плюрипотентные стволовые клетки и поддерживающие их в наивном состоянии. Полученные наивные ЭСК сохраняют ключевые особенности наивной плюрипотентности, а также молекулярные характеристики и функциональные свойства естественных аналогов [15], без чего сегодня было бы немыслимо создавать модельные системы, способные самоорганизовываться и образовывать ткани и органы.
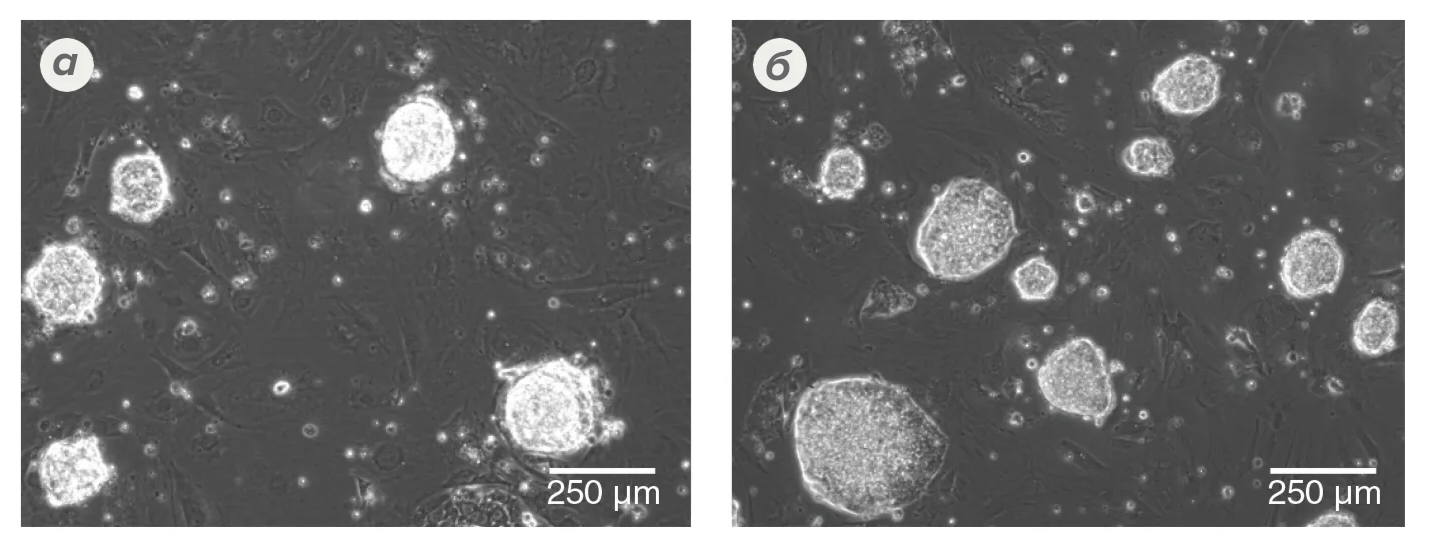
Рисунок 1. Клетки ЭСК и ИСК могут быть возвращены в наивное состояние. Репрезентативные изображения человеческих (а) ЭСК-клеток (H1) и (б) ИСК-клеток (STiPS-F016), которые вернулись в наивноподобное состояние после культивирования в специализированной среде RSeT™ в течение 6 и 10 пассажей, соответственно. Во время реверсии колонии изменили плоскую морфологию на куполообразную, характерную для плюрипотентных стволовых клеток в наивном состоянии.
Бластоиды, моделирующие раннее развитие эмбрионов
Вернемся непосредственно к моделированию процессов раннего развития. Ранние стадии эмбриогенеза у млекопитающих включают в себя несколько этапов: овуляцию — выход яйцеклетки из яичника; оплодотворение — соединение яйцеклетки со сперматозоидом; расщепление — последовательное деление эмбриона; и, наконец, имплантацию — прикрепление эмбриона к стенке матки. Срок протекания описанных процессов крайне невелик: всего неделя понадобится эмбриону, чтобы пройти от стадии оплодотворения до имплантации в матку. Однако для этого необходимо сформировать бластоцисту — структуру с внутренней клеточной массой (ICM), также известной как эмбриобласт, из которого в впоследствии сформируется эмбрион с внешним слоем клеток трофобласта, называемым трофэктодермой [17].
Формирование жизнеспособной бластоцисты — невообразимо важный этап в правильном развитии млекопитающих. Всевозможные изменения и генетические нарушения целостности формирующихся структур могут привести к неправильной дифференцировке клеток и как результат — выкидышу или нарушению строения организма. Однако изучение этого процесса ограничивается небольшим сроком его формирования, отсутствием возможности изъятия, а также рядом этических соображений.
Первые бластоцистоподобные структуры — модели клеток, повторяющих развитие бластоцисты от стадии оплодотворения до гаструляции, — были получены с использованием различных плюрипотентных стволовых клеток и экстраэмбриональных (внезародышевых) стволовых клеток мыши. Эти структуры формируются путем самоорганизации при соответствующих условиях культивирования и повторяют события раннего развития для изучения механизмов, происходящих на данных этапах формирования эмбриона [18].
Однако, как оказалось, использование лабораторных моделей животных для сопоставимости данных с человеком не представляется возможным из-за отличий в стадийности протекания процессов (рис. 2). Таким образом, расширяя стратегии, используемые при создании бластоидов мыши, исследователи успешно создали бластоиды человека, пользуясь уникальными свойствами полученных плюрипотентных стволовых клеток.
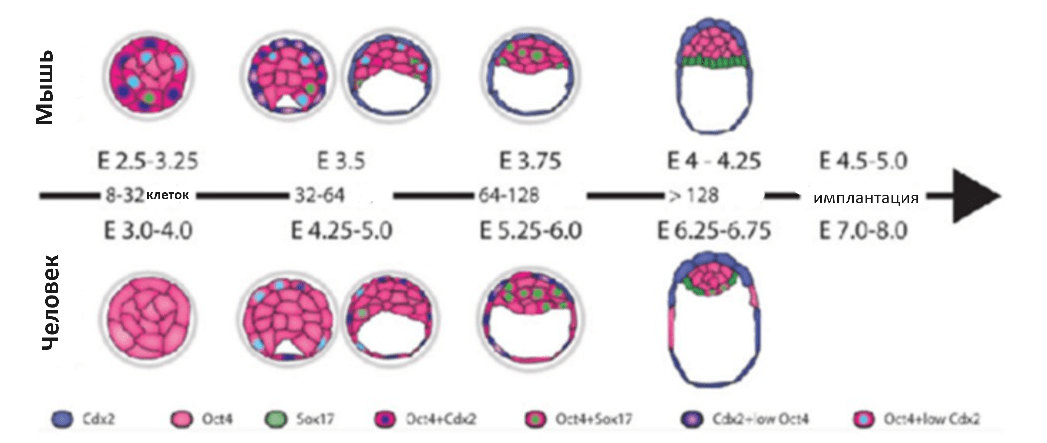
Рисунок 2. Ориентиры развития эмбрионов человека и мыши. Эмбрионы человека и мыши имеют схожие морфологические характеристики, хотя сроки развития и характер экспрессии специфичных для линии маркеров у этих двух видов значительно различаются. Временная шкала указывает на последующие деления, отраженные в количестве клеток в эмбрионе. E — дни эмбрионального развития. Цвета представляют экспрессию трансформированных клеток, специфичных для каждого этапа развития.
Сегодня имеется несколько методов получения бластоидов человека. Одним из них является объединение наивных стволовых клеток в округлые микроэлементы с помощью центрифугирования [20]; также аналогичные результаты могут быть достигнуты со стандартными микроэлементами или пирамидальными лунками (рис. 3).
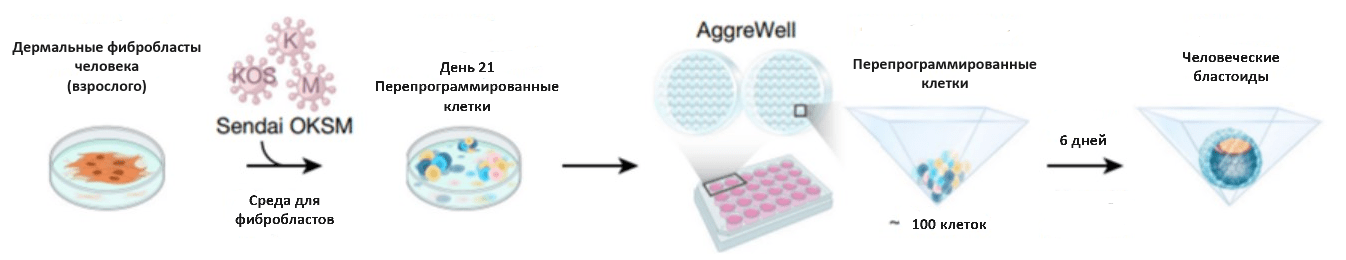
Рисунок 3. Генерация человеческих бластоидов с использованием пирамидальных лунок. В недавнем исследовании Сяодуна Лю и соавторов для получения бластоидов использовали дермальные фибробласты взрослых доноров: они перепрограммировали их в стволовые с помощью «коктейля» транскрипционных факторов (OCT4, KLF4, SOX2 и c-MYC). Полученную гетерогенную популяцию, содержащую три линии клеток, они поместили в AggreWell — планшеты с пирамидальными лунками, где клетки самоорганизовывались в бластоиды. Эффективность образования бластоидов составляла примерно 10–20%.
Еще одним прорывом стало прямое перепрограммирование соматических клеток человека, достигнутое заражением фибробластов кожи человека вирусом, индуцирующим экспрессию определенных генов [22]. Такие бластоиды имеют сходство с бластоцистами человека и некоторые из них даже могут инициировать события, схожие с имплантацией.
Хотя некоторые бластоиды имеют состав, сходный с бластоцистами человека, необходимы дополнительные исследования, чтобы определить, насколько точно они повторяют состояние in vivo. Случается, что клетки, образующиеся в бластоидах, соответствуют не клеткам ранних бластоцист человека, но скорее клеткам более поздних фаз развития. Поэтому требуется проведение дальнейшего анализа для определения точности отражения в моделях in vitro контекста in vivo, и сосредоточиться на повышении их сходства.
Гаструлоиды, воспроизводящие формирование трех зародышевых листков и моделирующие сомитогенез и органогенез
Гаструляция — следующий важнейший процесс в развитии эмбриона млекопитающих — включает несколько комбинаций движений клеточной ткани для формирования трех зародышевых слоев: эктодермы, мезодермы и энтодермы. Благодаря правильному расположению слоев эмбриональной ткани и организации осей эмбрион подготавливается к органогенезу и морфогенезу конечностей, которые приводят к формированию более сложных эмбриональных структур [6].
Воспроизведение трех зародышевых листков
Обращаясь к эксперименту по получению бластоидов, первые работы по повторению аспектов гаструляции также проводились с использованием стволовых клеток мыши. Первый 3D-гаструлоид был создан ван ден Бринком и его коллегами в 2014 году [23]. Он состоял всего из 300 мышиных ЭСК, способных самоорганизоваться в поляризованные структуры, демонстрирующие коллективное поведение, в точности копирующее ранние этапы формирования эмбриона мыши (рис. 4).
Благодаря прогрессу в создании эмбриональных моделей мышей и последующей корректировке условий культивирования этих моделей стало возможным создание более совершенных структур — сначала на мышиных моделях, а вскоре и человека.

Рисунок 4. Обзор доступных в настоящее время протоколов 3D-гаструлоидирования мыши и человека. (а) Мышиные гаструлоиды образуются путем посева небольшого количества (150–600 на лунку) эмбриональных стволовых клеток мыши в 96-луночные планшеты с U-образным дном с низким прикреплением в среде нейронной дифференцировки (N2B27) [24]. В течение двух дней после посева клетки опускаются на дно лунки, где они прикрепляются друг к другу, образуя сферический агрегат. При активации Wnt-агонистом Chiron агрегаты в течение 4–5 дней нарушают свою симметрию и удлиняются. Культивирование гаструлоидов мыши может быть продлено до 168 ч путем переноса гаструлоидов в шейкер через 120 ч [25], а формирование морфологически правильного бьющегося сердца, развивающегося в непосредственной близости от структуры, подобной кишечной трубке, от которой оно отделено эндокардоподобным слоем, может быть индуцировано добавлением кардиогенных факторов (bFGF, аскорбиновой кислоты и VEGF165) через 96 ч [26]. Эмбриональную архитектуру (формирование сомитоподобных структур и нервной трубки) можно индуцировать добавлением 5–10% матригеля через 96 ч [27]. (б) Человеческие гаструлоиды образуются путем агрегации человеческих ЭСК (которые предварительно обрабатывают в 2D-культуре препаратом Chiron в течение 24 часов) в присутствии ингибиторов Chiron и ROCKi [28]. Фаза агрегации (зеленая) гаструлоидов человека намного короче (1 час), чем у мыши (48 часов). Синие цифры указывают предполагаемую эмбриональную стадию, которая моделируется. Сокращения: A — передний; dpf — дни после оплодотворения; E — эмбриональный день; h — часы после агрегации; LIF — фактор, ингибирующий лейкоз; P — задний.
Гаструляция у человеческих эмбрионов происходит примерно через 16 дней после оплодотворения, и модели in vitro, воспроизводящие эту стадию, также достижимы за счет использования загрунтованных ЭСК и ИСК, что позволяет формировать человеческие гаструлоиды без нарушения основных этических норм. Как и в случае с исходными моделями мышиных гаструлоидов, гаструлоиды человека также были разработаны сначала в 2D условиях, которые отображали аспекты гаструляции, такие как развитие примитивных полосатчатых структур и трех доменов зародышевого слоя [30]. Разработка 3D человеческих гаструлоидов облегчила изучение развития человека, поскольку они более точно отображают процесс гаструляции in vivo, чем предшествующие 2D модели (таблица 1).
| Характеристики | 2D гаструлоид | 3D гаструлоид |
|---|---|---|
| Форма/геометрия |  Форма фиксированная. Размеры могут варьироваться |
 Форма переменная. Размеры могут варьироваться |
| Сформированные типы клеток | Эмбриональный и экстраэмбриональный | Только эмбриональный |
| Начальный номер ячейки | Несколько тысяч | ~200–300 (m), 400 (h) |
| Сигнальные пути |  Внешние и внутренние источники сигнализации |
 Только внутренние |
| Время культивирования | 48 h | 120–168 h (m), 72–96 h (h) |
| Масштабируемость | Средняя-высокая производительность | Высокий потенциал скрининга. Низкая производительность |
Добавление экстраэмбриональных компартментов привело к созданию моделей, которые больше напоминали гаструлирующий эмбрион in vivo за счет имитации прикрепления и нарушения симметрии и дальнейшего экспонирования клеток, специфичных для человеческой гаструлы. Благодаря разработке технологии получения человеческих гаструлоидов были созданы специфические гаструлоиды, которые затрагивали часть ранних стадий постимплантационного эмбрионального развития человека, такие как формирование примитивных полосок, нейруляции и сомитогенез.
Сомитогенез и органогенез
В дополнение, недавно были разработаны модели, имитирующие процессы сомитогенеза и органогенеза у человеческого эмбриона. В этих моделях гаструлоидов были созданы структуры, напоминающие кишечную трубку с формированием передней и дорсально-вентральной осей [32]. Конкретно, в гаструлоиде были сформированы передняя, средняя и задняя кишки путем создания зачатка, который покрывает всю область структуры. Кроме того, некоторые модели гаструлоидов, такие как гаструлоиды с хоблоподобной структурой и удлиненные многолинейные организованные гаструлоиды, также показывают структуры, подобные кишечным трубкам.
Такие модели имеют важное значение для исследования различных аспектов развития эмбриона (рис. 5), становясь мощным инструментом для моделирования различных аспектов самоорганизации и эмбрионального развития. Модели на основе гаструлоидов широко используются в исследованиях клеточной дифференцировки, морфогенеза тканей и сигнальных градиентов, устанавливая основные правила тканевой инженерии и регенеративной медицины. Недавние исследования также подчеркнули их использование как способ разгадки консервативных механизмов взаимодействия видов в процессе развития [33]. Использование гаструлоидов также было предложено в качестве метода скрининга лекарственных соединений на (потенциально видоспецифичную) тератогенность и исследования функции генов или патогенных мутаций, что подчеркивает их потенциал для моделирования заболеваний.
Разработка синтетических целых эмбрионов
Наконец-то мы добрались до того, ради чего все и затевалось — целостный организм, достоверно повторяющий человеческий эмбрион! Разумеется, разработка бластоидов и гаструлоидов не была всецело направлена только лишь на создание полной эмбриональной модели, однако именно на методиках и принципах создания более узкоспециализированных моделей и базируются сегодняшние грандиозные открытия.
Попытки создать синтетические цельные эмбрионы человека начинались с бластоидов, в настоящее время являющихся наиболее совершенным инструментом, имитирующим всю предимплантационную стадию человеческого эмбриона. Хотя исследователи предпринимали попытки продвинуть эти бластоиды к постимплантационным стадиям in vitro, им долгое время не удавалось сопоставить их с развитием бластоцист in vivo. Однако недавно были достигнуты успехи в создании цельного синтетического эмбриона человека, который может моделировать более продвинутые постимплантационные стадии развития, сохраняя при этом морфологическую целостность естественного эмбриона.
Две группы ученых первыми сообщили о своих попытках создать постимплантационные модели эмбрионов человека. Они использовали стратегии, ранее применявшиеся для создания цельного синтетического эмбриона мыши, включавшие дифференцировку эмбриональных и экстраэмбриональных клеток по отдельности.
Обе группы сообщили о моделях синтетических целых эмбрионов человека (видео 1), которые воспроизводили признаки человеческих эмбрионов с 13–14 дня после оплодотворения. Модель Уэзерби и др. состояла из таких структур как амнион, экстраэмбриональная мезенхима и примордиальные клетки, подобные зародышевым [34]. Олдак и др. сообщили о формировании двуслойного диска, просветлении эпибластов, амниогенезе; описали примордиальных зародышевые клетки, формирование желточного мешка и расширение экстраэмбриональной мезодермы.
Видео 1. Описание метода получения синтетического человеческого эмбриона группой Бернардо Олдака. Репортаж, взятый у профессора научного института Вейцмана (Израиль) Джейкоба Ханна, входящего в исследовательскую группу Олдака.
Ожидается, что создание синтетических моделей цельных эмбрионов человека продолжит активно развиваться, однако важно внимательно следить не только за новыми разработками, но также за развитием этических соображений и международных соглашений, которые в настоящее время активно меняются в связи с нашумевшими открытиями. Но перед тем как подробно окунуться в мир ограничений и запретов, ответим на достаточно философский вопрос, возникающий к точности термина «синтетический эмбрион».
Корректно ли называть полученные модели синтетическими?
Справедливо заметить, что описанные модели нельзя уверенно назвать синтетическими. И действительно: термин «синтетический эмбрион» несколько вводит в заблуждение, поскольку структуры, о которых идет речь, на самом деле таковыми не являются (по крайней мере, в привычном нам понимании) и несколько отличаются от естественных эмбрионов человека. Нечасто в литературе упоминается более конкретный термин — «синтетические человеческие образования с эмбрионоподобными признаками», однако первые работы в этой области использовали именно эту формулировку и ввиду множественного цитирования запустили термин в массы.
Что же подразумевается под словом «синтетический»?
Все довольно просто: как уже упоминалось, модельные эмбрионы образуются не в результате оплодотворения — их развитие происходит из плюрипотентных стволовых клеток, что позволяет создавать структуры без участия яйцеклетки и сперматозоида; они также не нуждаются в матке (даже в синтетической!), что все же не защищает их «естественное» развитие.
Полностью синтетическое происхождение эмбрионов ставится под сомнение, поскольку стволовые клетки могут быть получены из абортивного материала или перепрограммированы из клеток взрослого человека, таких как кожа или клетки крови.
Несмотря на размытость термина, нет сомнений в том, что образование эмбрионоподобных структур, изучение и их дальнейшее развитие принадлежит совсем молодой, только что отпраздновавшей свое десятилетие науки — синтетической эмбриологии.
- Синтетическая эмбриология
- новое научное направление, которое изучает и воссоздает различные аспекты развития человеческого эмбриона в искусственных условиях. Она является частью синтетической биологии [35] — науки, которая переходит от изучения живого к конструированию [36].
Однако процессы получения модельных структур все же используют генетические методы клонирования, индуцированного дифференцирования или других методов синтеза тканей и органов в лабораторных условиях. При этом, как уже говорилось, избегая естественного процесса оплодотворения. Справедливости ради стоит отметить, что часто термин «синтетические эмбрионы» ставится в кавычки — однако ряд работ, включающих его первое упоминание, не грешат этим.
Политика в отношении использования человеческого материала
Биоэтический аспект в использовании человеческого материала крайне важен, т.к., сколько бы мы не говорили об открытии новых методов и важности работы непосредственно с человеком, — все это сводится на нет при существовании закона, запрещающего их разработку и изучение. В рамках описания синтетических моделей эмбрионов интересно разобрать этическую причину их возникновения, как менялось законодательство в разных странах и что мы имеем в итоге.
Начнем с первого выделения ЭСК из клеточной культуры, произошедшего в 1998 году [37]. На тот момент единственным известным способом получения эмбриональных клеток было уничтожение человеческого эмбриона. Такие действия стали приравниваться к убийству, и довольно скоро общественность заговорила о несовместимости использования «человеческого материала» с привитыми в обществе взглядами на ценность человеческой жизни, а также сохранения ее достоинства.
Впервые с негативной оценкой использования человеческих эмбрионов в 2000 году выступил Папа Римский Иоанн Павел II. В рамках обращения к мировому Обществу трансплантации он резко негативно высказался об использовании человеческого материала, объясняя свое отношение моральной недопустимостью подобной жестокости. Что повлекло за собой череду мер пресечений исследований.
В частности, 9 августа 2001 года Президент США Буш выступил с речью, в которой заявил, что федеральные средства не будут использоваться для поддержки экспериментов, которые уничтожают человеческие эмбрионы. Однако ввиду значимости эмбриологических исследований был предложен компромисс. Так, с 9 августа 2001 года в исследовательских целях могли быть использованы только линии стволовых клеток человека, выделенные до этой даты. Несмотря на масштабность закона, в нем было множество лазеек, не запрещающих частным компаниям совершать исследования и выводить новые клеточные линии. На частные средства были получены другие линий ЭСК, а также создано множество банков стволовых клеток и коммерческих реестров [38]. К примеру, существующий и поныне международный реестр стволовых клеток Массачусетского университета, Европейский реестр эмбриональных стволовых клеток, Банк стволовых клеток Великобритании, а также КриоЦентр в России.
Такие бреши в законе позволяли проводить опыты только на клеточных линиях in vitro, но вопрос манипуляций с живым эмбрионом не был решен так однозначно. В рамках заседания комитета Европейского парламента было предложено ввести полный запрет на использование и уничтожение человеческих эмбрионов в научных исследованиях. Комитет также предложил, чтобы замороженные эмбрионы, которые не использовались для ЭКО, не уничтожались, а предлагались для усыновления другим парам [38]. Подавляющее большинство проголосовало против доклада, но все же во многих европейских странах исследования человеческих эмбрионов были запрещены. Европейская конвенция о биомедицине и правах человека содержит особый пункт об обеспечении «адекватной защиты» эмбриона, которая запрещала получение человеческих эмбрионов для проведения исследований.
В рамках международного этического стандарта вплоть до 2021 года ученым разрешалось изучать человеческие эмбрионы только в течение двух недель после оплодотворения — это так называемое «правило 14 дней», действующее по международному соглашению, сподвигло исследователей разрабатывать собственные «синтетические» системы в обход сложивших биоэтических норм.
26 июля 2021 года Международное общество исследований стволовых клеток (ISSCR) поддержало эксперименты с эмбриональными моделями. Сегодня исследования с эмбрионами человека могут проводиться в соответствии с законодательством каждой страны, однако ограничения все же соблюдаются в области редактирования генома (речь идет о нашумевшем деле китайского ученого Хэ Цзянькуя и его работах по редактированию генома младенцев) до тех пор, пока не будет доказана безопасность таких манипуляций.
Законы и правила, действующие в отношении исследований синтетических эмбрионов сегодня
Как обсуждалось ранее, законы об исследованиях человеческих эмбрионов и национальные руководства разработаны с учетом внутренних интересов и целей каждой страны. Эти интересы часто связаны с особой культурой, историей, политикой и религией. Например, некоторые страны, такие как Великобритания и Китай, продвигают синтетические технологии как средство экономического развития. Другие, включая США и Австрию, считают, что исследования человеческих эмбрионов бросают вызов прочно укоренившимся религиозным верованиям, и в случае США это делает принятие любого национального законодательства политически несостоятельным [39].
История страны повлияла и на другие законы. Так было с законами Германии об использовании стволовых клеток человека и исследованиях эмбрионов, на которые повлияло желание страны быть поборником этики в результате неэтичной работы, проведенной во время Второй мировой войны [39]. В результате национальные законы и руководящие принципы в области исследований человеческих эмбрионов различаются. В отношении наличия 14-дневного ограничения страны можно разделить на четыре группы: отсутствие ограничения, запрет, альтернативное ограничение или наличие 14-дневного ограничения.
- Полный запрет на любые формы исследований человеческих эмбрионов действует в таких странах как: Германия, Италия, Ирландия, Польша и Словакия.
- Семь стран — Австралия, Австрия, Бельгия, Германия, Япония, Россия и США — имеют ограничения на исследования эмбриоидных систем.
- Разрешены исследования в: Канаде, Франции, Сингапуре, Южной Корее, Швеции, Великобритании, однако ни в одной из них эмбриоидные исследования не рассматриваются напрямую.
Какие международные соглашения связаны с разработкой и исследованием синтетических эмбрионов?
Сегодня, на международном уровне не существует ни одного обязательного договора или конвенции, напрямую регулирующих исследования синтетических человеческих эмбрионов. Однако есть некоторые не обязывающие декларации — рекомендации и стандарты:
- Всеобщая декларация о геноме человека и правах человека (ЮНЕСКО), 1997. В ней говорится, что «практика, противоречащая человеческому достоинству, такая как клонирование человека в целях воспроизводства, не должна быть разрешена» и что «вмешательства в геном человека должны проводиться только в профилактических, диагностических или терапевтических целях и только с информированного согласия соответствующего лица».
- Всеобщая декларация о биоэтике и правах человека (ЮНЕСКО), 2005 г.: «Человеческое достоинство, права человека и основные свободы должны полностью уважаться» в любых научных исследованиях с участием людей и что «интересы и благополучие личности должны иметь приоритет над исключительными интересами науки или общества».
- Конвенция Совета Европы о правах человека и биомедицине, вступившая в силу в 1999 году и в настоящее время ратифицированная 30 европейскими государствами, указывает в статье 18:
- В тех случаях, когда закон разрешает исследования эмбрионов in vitro, это должно обеспечивать надлежащую защиту эмбриона.
- Создание человеческих эмбрионов в исследовательских целях запрещено.
- Рекомендации Международного общества исследований стволовых клеток. Выпущены для Stem Cell Research and Clinical Translation в 2021 году; содержат подробные рекомендации по проведению этичных и ответственных исследований стволовых клеток с участием человеческих эмбрионов, стволовых клеток, органоидов и других моделей.
Насколько полезны эти исследования?
Разобравшись во всех тонкостях биоэтического вопроса, возникает вполне очевидный вопрос: если создание эмбриоидов настолько сложный и порицаемый процесс в обществе, стоит ли вообще этим заниматься?
На протяжении всего обзора мы говорили об использовании моделей для получения ценной информации о процессах, управляющих эмбриогенезом, не упоминая и доли перспектив, открывающихся с развитием данной технологии. Исправляемся:
- Во-первых, изучение имплантации, что позволит лучше понять причины самопроизвольных абортов (выкидышей). Кроме того, они предоставляют возможность тестирования лекарств в этот период беременности, что законодательство многих стран запрещает проводить на естественных человеческих эмбрионах.
- Во-вторых, разработка модельных систем может снизить зависимость от донорских эмбрионов при ЭКО, которых часто не хватает или они недоступны, и избежать некоторых этических проблем, связанных с их использованием или уничтожением.
- Синтетические человеческие эмбрионы найдут применение в регенеративной медицине и биотехнологии. Например, они могут быть использованы для создания определенных типов клеток или тканей для трансплантации или терапии, таких как клетки крови, нервные клетки, клетки сердца, клетки печени и т.д.
Перспективы
Исторически, исследования развития человека были занятием, имеющим значительные ограничения. Сложность процесса, недоступность прижизненного материала, отсутствие соответствующих моделей и этические соображения сильно тормозили неминуемый прогресс. Однако сегодня мы описываем модели, достоверно повторяющие раннее эмбриональное развитие млекопитающих и возлагаем надежды на их дальнейшее развитие.
Синтетические модели не просто воспроизводят развитие эмбриона — они открывают путь для изучения различных заболеваний и понимания механизмов, лежащих в их основе. Поскольку эти ранние модели эмбрионов могут надежно воспроизводить состояние эмбриона на определенных этапах развития, конкретные заболевания, возникающие в определенные моменты времени, могут быть исследованы путем воссоздания сходной с развитием эмбриональной структуры с временной точностью. Например, бластоиды позволяют продолжить изучение механизмов имплантации, что затем может указывать на возможные факторы, связанные с нарушениями в механизме имплантации, а гаструлоиды — моделировать врожденные заболевания, включая, но вовсе не ограничиваясь ими.
Общим преимуществом структур in vitro является возможность массового производства синтетических моделей эмбрионов, что обеспечивает совместимость с системами, требующими большого количества образцов, такими как скрининг лекарств и токсикологические анализы. Таким образом, развитие моделей на основе стволовых клеток открывает беспрецедентные возможности для исследований и биомедицины будущего.
Литература
- Gianluca Amadei, Charlotte E. Handford, Chengxiang Qiu, Joachim De Jonghe, Hannah Greenfeld, et. al. (2022). Embryo model completes gastrulation to neurulation and organogenesis. Nature. 610, 143-153;
- The Nobel Prize in Physiology or Medicine 1995. (1995). Сайт Нобелевского комитета;
- Кто такие модельные организмы?;
- Модельные организмы: дрозофила;
- Модельные организмы: грызуны;
- Yunhee Kim, Inha Kim, Kunyoo Shin. (2023). A new era of stem cell and developmental biology: from blastoids to synthetic embryos and beyond. Exp Mol Med. 55, 2127-2137;
- Такие разные стволовые клетки;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Ствол и ветки: стволовые клетки;
- Эндометрий как альтернативный источник стволовых клеток;
- Медведев С.П., Покушалов Е.А., & Закиян С.М. (2012). Эпигенетика плюрипотентных клеток. Acta Naturae. 4, 28–47;
- Leehee Weinberger, Muneef Ayyash, Noa Novershtern, Jacob H. Hanna. (2016). Dynamic stem cell states: naive to primed pluripotency in rodents and humans. Nat Rev Mol Cell Biol. 17, 155-169;
- I. Gabrielle M. Brons, Lucy E. Smithers, Matthew W. B. Trotter, Peter Rugg-Gunn, Bowen Sun, et. al. (2007). Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195;
- Ohad Gafni, Leehee Weinberger, Abed AlFatah Mansour, Yair S. Manor, Elad Chomsky, et. al. (2013). Derivation of novel human ground state naive pluripotent stem cells. Nature. 504, 282-286;
- Thorold W. Theunissen, Marc Friedli, Yupeng He, Evarist Planet, Ryan C. O’Neil, et. al. (2016). Molecular Criteria for Defining the Naive Human Pluripotent State. Cell Stem Cell. 19, 502-515;
- Defined Medium for Naïve-Like Human Pluripotent Stem Cells. (2024). STEMCELL Technologies;
- Harunobu Kagawa, Alok Javali, Heidar Heidari Khoei, Theresa Maria Sommer, Giovanni Sestini, et. al. (2022). Human blastoids model blastocyst development and implantation. Nature. 601, 600-605;
- Xiukun Wang, Guang Hu. (2022). Human embryos in a dish – modeling early embryonic development with pluripotent stem cells. Cell Regen. 11;
- Anna Piliszek, Joanna B. Grabarek, Stephen R. Frankenberg, Berenika Plusa. (2016). Cell fate in animal and human blastocysts and the determination of viability. Mol. Hum. Reprod. 22, 681-690;
- Harunobu Kagawa, Alok Javali, Heidar Heidari Khoei, Theresa Maria Sommer, Giovanni Sestini, et. al. (2022). Human blastoids model blastocyst development and implantation. Nature. 601, 600-605;
- Xiaodong Liu, Jia Ping Tan, Jan Schröder, Asma Aberkane, John F. Ouyang, et. al. (2021). Modelling human blastocysts by reprogramming fibroblasts into iBlastoids. Nature. 591, 627-632;
- Nidhi Subbaraman. (2021). Lab-grown structures mimic human embryo's earliest stage yet. Nature. 591, 510-511;
- Susanne C. van den Brink, Peter Baillie-Johnson, Tina Balayo, Anna-Katerina Hadjantonakis, Sonja Nowotschin, et. al. (2014). Symmetry breaking, germ layer specification and axial organisation in aggregates of mouse embryonic stem cells. Development. 141, 4231-4242;
- I. Martyn, E. D. Siggia, A. H. Brivanlou. (2019). Mapping cell migrations and fates in a gastruloid model to the human primitive streak. Development;
- Leonardo Beccari, Naomi Moris, Mehmet Girgin, David A. Turner, Peter Baillie-Johnson, et. al. (2018). Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids. Nature. 562, 272-276;
- Giuliana Rossi, Nicolas Broguiere, Matthew Miyamoto, Andrea Boni, Romain Guiet, et. al. (2021). Capturing Cardiogenesis in Gastruloids. Cell Stem Cell. 28, 230-240.e6;
- D. A. Turner, M. Girgin, L. Alonso-Crisostomo, V. Trivedi, P. Baillie-Johnson, et. al. (2017). Anteroposterior polarity and elongation in the absence of extraembryonic tissues and spatially localised signalling in Gastruloids, mammalian embryonic organoids. Development;
- Naomi Moris, Kerim Anlas, Susanne C. van den Brink, Anna Alemany, Julia Schröder, et. al. (2020). An in vitro model of early anteroposterior organization during human development. Nature. 582, 410-415;
- Susanne C. van den Brink, Alexander van Oudenaarden. (2021). 3D gastruloids: a novel frontier in stem cell-based in vitro modeling of mammalian gastrulation. Trends in Cell Biology. 31, 747-759;
- Xiukun Wang, Guang Hu. (2022). Human embryos in a dish – modeling early embryonic development with pluripotent stem cells. Cell Regen. 11;
- Adrienne E Sullivan, Silvia DM Santos. (2023). The ever-growing world of gastruloids: autogenous models of mammalian embryogenesis. Current Opinion in Genetics & Development. 82, 102102;
- Yoshihiro Yamanaka, Sofiane Hamidi, Kumiko Yoshioka-Kobayashi, Sirajam Munira, Kazunori Sunadome, et. al. (2023). Reconstituting human somitogenesis in vitro. Nature. 614, 509-520;
- Janet Rossant, Patrick P.L. Tam. (2021). Opportunities and challenges with stem cell-based embryo models. Stem Cell Reports. 16, 1031-1038;
- Bailey A. T. Weatherbee, Carlos W. Gantner, Lisa K. Iwamoto-Stohl, Riza M. Daza, Nobuhiko Hamazaki, et. al. (2023). Pluripotent stem cell-derived model of the post-implantation human embryo. Nature. 622, 584-593;
- Синтетическая биология: от наблюдения к вмешательству;
- Синтетическая эмбриология. Васильев А.В. (2022). Alexander Velikanov @ YouTube;
- Irina Klimanskaya, Robert Lanza. (2020). Principles of Tissue Engineering (Fifth Edition). Academic Press;
- J. A. Thomson. (1998). Embryonic Stem Cell Lines Derived from Human Blastocysts. Science. 282, 1145-1147;
- Kirstin RW Matthews, Daniel Moralí. (2020). National human embryo and embryoid research policies: a survey of 22 top research-intensive countries. Regenerative Medicine. 15, 1905-1917.