Скрытая угроза: описан новый механизм активации протоонкогенов
26 апреля 2016
Скрытая угроза: описан новый механизм активации протоонкогенов
- 1167
- 0
- 8
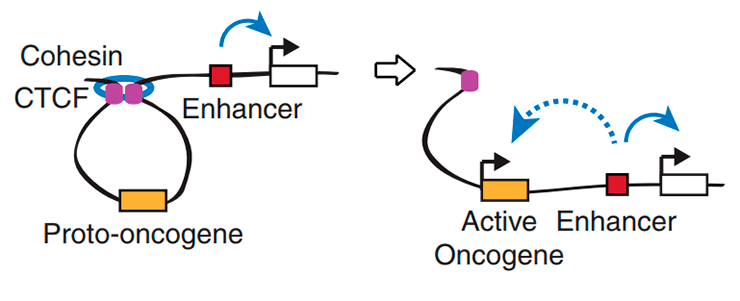
Новый механизм активации протоонкогенов: мутация в сайте связывания транскрипционного репрессора CTCF приводит к попаданию промотора протоонкогена под действие энхансера.
-
Автор
-
Редакторы
На генетическом уровне опухолевое перерождение сопровождается превращением протоонкогенов в активные онкогены. В исследовании, опубликованном в журнале Science, описан новый механизм активации протоонкогенов, индуцируемый небольшим нарушением организации хроматина. Открытие дополняет наши знания о процессах, ведущих к возникновению раковых клеток.
Геном человека содержит значительное количество потенциально опасных протоонкогенов, которые в результате небольших перестроек ДНК в соматических клетках могут превращаться в онкогены. Часто они кодируют белки, участвующие в регуляции клеточного деления. Что неудивительно, ведь раковые клетки отличаются от нормальных именно способностью к постоянному росту и делению. Это сближает их со стволовыми клетками, в том числе и с надеждой регенеративной медицины — индуцированными плюрипотентными стволовыми клетками (ИПСК): самым простым и действенным способом их получения является повышение экспрессии определенного набора генов, включающего протоонкогены c-Myc и Klf4 . Для того чтобы безобидный и нужный организму протоонкоген превратился в зловредный онкоген, повышающий вероятность опухолевого перерождения, порой бывает достаточно всего одного события, называемого активацией протоонкогена. Чаще всего активация состоит в резком повышении уровня экспрессии гена. Достоверно установлены следующие механизмы активации протоонкогенов (рис. 1):
- нуклеотидная замена в протоонкогене;
- слияние протоонкогена с каким-то активно экспрессирующимся геном;
- увеличение числа копий протоонкогена в ДНК;
- захват энхансера — помещение участка ДНК, повышающего уровень транскрипции с определенных промоторов, в такую позицию, откуда он начинает контролировать промотор протоонкогена.
«Биомолекула» уже не раз публиковала материалы об ИПСК и способах их получения: «Была клетка простая, стала стволовая» [1], «Снежный ком проблем с плюрипотентностью» [2] и «Предохранитель ИПСК» [3]. — Ред.
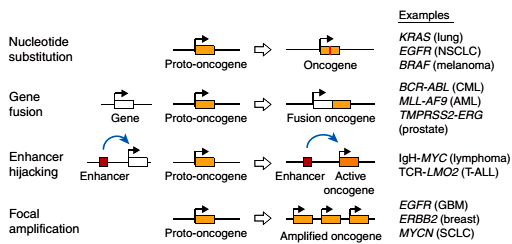
Рисунок 1. Известные механизмы активации протоонкогенов. Сверху вниз: нуклеотидная замена, слияние генов, захват энхансера, амплификация гена. Справа приведены примеры опухолей, в которых зарегистрирован тот или иной механизм активации протоонкогена.
Если с первыми тремя механизмами всё более-менее понятно, то в вопросе взаимодействия энхансеров с промоторами остается много неясного. Например, далеко не всегда очевидно, в какой такой специальной позиции должен оказаться энхансер, чтобы регулировать определенный промотор. (И вообще, сами определения понятий «промотор» и «энхансер» в настоящее время обсуждаются — в частности из-за того, что между ними обнаруживается всё больше сходств, чем представлялось изначально [4].) Тем не менее известно, что существуют особые участки ДНК, называемые инсуляторами, которые препятствуют взаимодействию энхансеров с промоторами, если оказываются между ними.
Инсуляторные последовательности узнает специальный белок CTCF — важнейший фактор пространственной организации хроматина. Две молекулы CTCF способны связываться друг с другом, образуя таким образом петлю ДНК, ограниченную инсуляторами. Если энхансер и промотор располагаются в пределах одной такой петли, они взаимодействуют, если же они разделены сайтом связывания CTCF, энхансер теряет способность активировать данный промотор. Эти петли по-английски называются insulated neighborhoods («изолированные районы») [5], и в их состав суммарно может входить половина всей ДНК клетки (см. заглавный рисунок и рис. 2)! Получается, что именно от CTCF зависит, какие энхансеры с какими промоторами взаимодействуют. Роль CTCF в организации хроматина настолько важна, что инверсия (разворот на 180 градусов) участка ДНК, с которым он связывается, ведет к изменению топологии петель и нарушениям регуляции экспрессии генов [6].
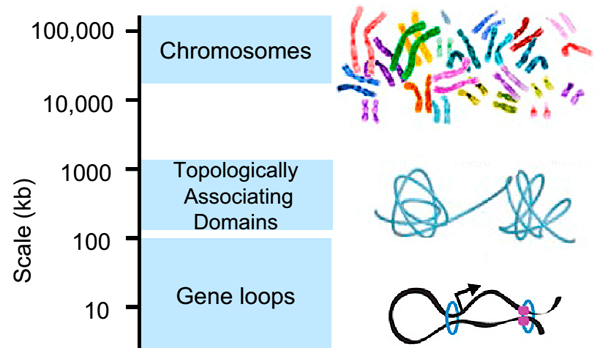
Рисунок 2. Современные представления об уровнях организации хроматина. Хромосомы составлены из так называемых топологически ассоциированных доменов (клубков хроматина), в состав которых входят петли. Видно, что крупная петля (insulated neighborhood), образованная белками CTCF (показан фиолетовым) и когезином (голубое кольцо), включает в себя петлю, образованную только когезином.
Следует отметить, что insulated neighborhoods — далеко не единственный вид петель в хроматине. Существуют, например, петли между энхансерами и промоторами, которые необходимы для взаимодействия этих геномных элементов. В их образовании CTCF не принимает никакого участия. Единственное, что объединяет все виды петель — это белковый комплекс когезин. Когезин состоит из четырех белков, которые сближают удаленные участки хроматина, образуя вокруг них кольцо. Когезин также способствует гомологической рекомбинации и удерживает две хроматиды в составе одной хромосомы [7].
Молекулярные биологи из нескольких лабораторий США решили выяснить, могут ли мутации в сайтах связывания CTCF приводить к активации протоонкогенов [8]. Для этого они проанализировали относительное расположение петель, образованных CTCF и когезином, и активированных онкогенов в хроматине клеток, происходящих из Т-клеточной лимфомы. Оказалось, что большинство изученных онкогенов (40 из 55) находились в пределах этих петель. 27 таких онкогенов активно экспрессировались, а из них 13 располагались в петлях, содержащих суперэнхансеры — группы близко расположенных друг к другу энхансеров. Сравнив геномы раковых и нормальных клеток, ученые выяснили, что в ряде случаев повышение экспрессии протоонкогена сопровождается делецией фрагмента ДНК, содержащего ближайший сайт связывания CTCF. Вероятно, в этих случаях граница петли перемещается, и в ее составе оказывается энхансер, что и приводит к активации протоонкогена.
Чтобы подтвердить свою гипотезу, исследователи решили не искать уже существующие делеции, а получить их самостоятельно в ДНК Т-лимфоцитов. Любой приличный молекулярный биолог, решивший в наши дни получить геномную делецию, первым делом подумает про систему CRISPR/CAS9 . Авторы обсуждаемой статьи так и сделали: с помощью CRISPR/CAS9 они удаляли отдельные сайты связывания CTCF, раздвигая тем самым границы петель, и затем с удовольствием наблюдали за повышением уровня экспрессии протоонкогенов (рис. 3). Оказалось, что интенсивность контактов между участками ДНК, в норме находящимися в петле и за ее пределами, возросла. Эти данные свидетельствуют о том, что белок CTCF, изолируя протоонкогены от энхансеров, защищает их от активации.
Об этой системе и ее применении можно прочитать в статьях «CRISPR-системы: иммунизация прокариот» [9] и «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [10]. — Ред.
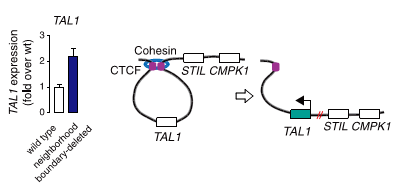
Рисунок 3. Активация протоонкогена TAL1 в результате делеции сайта связывания CTCF. В результате делеции, внесенной в геном с помощью CRISPR/CAS9 (показана красным), экспрессия протоонкогена TAL1 усилилась более чем в два раза (уровень экспрессии показан на гистограмме слева).
Эти безусловно важные для фундаментальной науки результаты так и остались бы интересным фактом, если бы ученые не провели анализ широкого спектра линий раковых клеток человека на предмет мутаций в областях границ петель. Авторы использовали доступные онлайн гигантские массивы данных о мутациях в сайтах связывания CTCF. Оказалось, что в раковых клетках гораздо больше таких мутаций. Интересно, что сайт узнавания CTCF — это не всегда граница петли, и мутациями обогащены именно те сайты, которые отграничивают insulated neighborhoods. Это еще одно подтверждение модели, а главное — доказательство ее применимости к различным опухолям.
Таким образом, новые данные дополнили наши представления о механизмах активации протоонкогенов. Эта информация может пригодиться как ученым, работающим над вопросами структурно-функциональной организации хроматина, так и онкологам. Последним, в частности, может быть интересна подмеченная авторами статьи особенность: описанный ими механизм активации протоонкогенов особенно активно используют клетки карцином пищевода и печени.
В настоящее время ведутся дискуссии о возможностях терапии путем редактирования генома. «Биомолекула» сообщала о первых успешных опытах в этом направлении [11], но пока что использовался только метод относительно безопасного модифицирования клеток крови, которые затем удалялись из организма. Вмешиваться в геном клеток, которые останутся в организме пациента, — гораздо более рискованная задача. Тем не менее уже не за горами то время, когда редактирование ДНК будет введено в медицинскую практику. Чем больше мы к тому моменту узнаем о том, что именно нужно редактировать (например, устранять повреждения сайтов связывания CTCF в некоторых случаях рака), тем лучше.
Литература
- Была клетка простая, стала стволовая;
- Снежный ком проблем с плюрипотентностью;
- Предохранитель ИПСК;
- Kim T.K. and Shiekhattar R. (2015). Architectural and functional commonalities between enhancers and promoters. Cell. 162, 948–959;
- Dowen J.M., Fan Z.P., Hnisz D., Ren G., Abraham B.J., Zhang L.N. et al. (2014). Control of cell identity genes occurs in insulated neighborhoods in mammalian chromosomes. Cell. 159, 374–387;
- Guo Y., Xu Q., Canzio D., Shou J., Li J., Gorkin D.U. et al. (2015). CRISPR inversion of CTCF sites alters genome topology and enhancer/promoter function. Cell. 162, 900–910;
- Remeseiro S. and Losada A. (2013). Cohesin, a chromatin engagement ring. Curr. Opin. Cell Biol. 25, 63–71;
- Hnisz D., Weintraub A.S., Day D.S., Valton A.L., Bak R.O., Li C.H. et al. (2016). Activation of proto-oncogenes by disruption of chromosome neighborhoods. Science. 351, 1454–1458;
- CRISPR-системы: иммунизация прокариот;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Успех в борьбе с лейкозом: на шаг ближе к клиническому применению геномного редактирования.