Служба заботы о рибосомах. Как клетка следит за качеством своих молекулярных машин
01 декабря 2025
Служба заботы о рибосомах. Как клетка следит за качеством своих молекулярных машин
- 162
- 0
- 1
Рибосома — сложно устроенная молекулярная машина, и у клетки есть большой набор инструментов, позволяющих следить за ее качеством.
Рисунок в полном размере.
GigaChat
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Пожалуй, нет ни одного клеточного процесса, в котором не задействованы белки, а значит, нарушение их синтеза может приводить к самым опасным последствиям. Поэтому клетке нужно очень тщательно следить за состоянием рибосом, чтобы не допустить нарушения белкового гомеостаза. Этим занимается специальная система контроля качества рибосом. Эта система играет в клетке очень важную роль, и сбои в ее работе приводят к рибосомопатиям и другим тяжелым заболеваниям. О том, как эта система решает проблемы, с которыми сталкиваются рибосомы, и пойдет речь в данной статье.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
На схемах рибосомы обычно изображают в виде двух слитых овалов, но в реальности они устроены гораздо сложнее. Большая субъединица эукариотической рибосомы состоит из трех молекул рРНК (28S, 5.8S, 5S) и 49 белков, а малая — из одной рРНК (18S) и 33 белков [1]. Разумеется, правильно собрать воедино такое количество деталей — совсем не тривиальная задача. Поэтому существует целая армия ферментов, рибозимов и прочих молекул, осуществляющих сборку этих молекулярных машин и следящих за тем, чтобы неправильно собранные рибосомы не допускались к работе. И даже после того, как рибосома оказывается полностью собранной и приступает к работе, система контроля качества не оставляет ее в покое. Если с рибосомой что-то случается, клетка либо устраняет эту проблему, либо устраняет саму рибосому. Наконец, даже при самых благоприятных условиях рибосома не может работать вечно. Период полужизни рибосомы составляет порядка нескольких дней. Состарившиеся рибосомы начинают хуже работать, и клетка утилизирует их, чтобы полученные в результате их расщепления компоненты использовать для чего-то еще [2]. Далее речь пойдет о том, какие механизмы обеспечивают контроль качества рибосомы на разных этапах ее жизни.
Сборка рибосомы
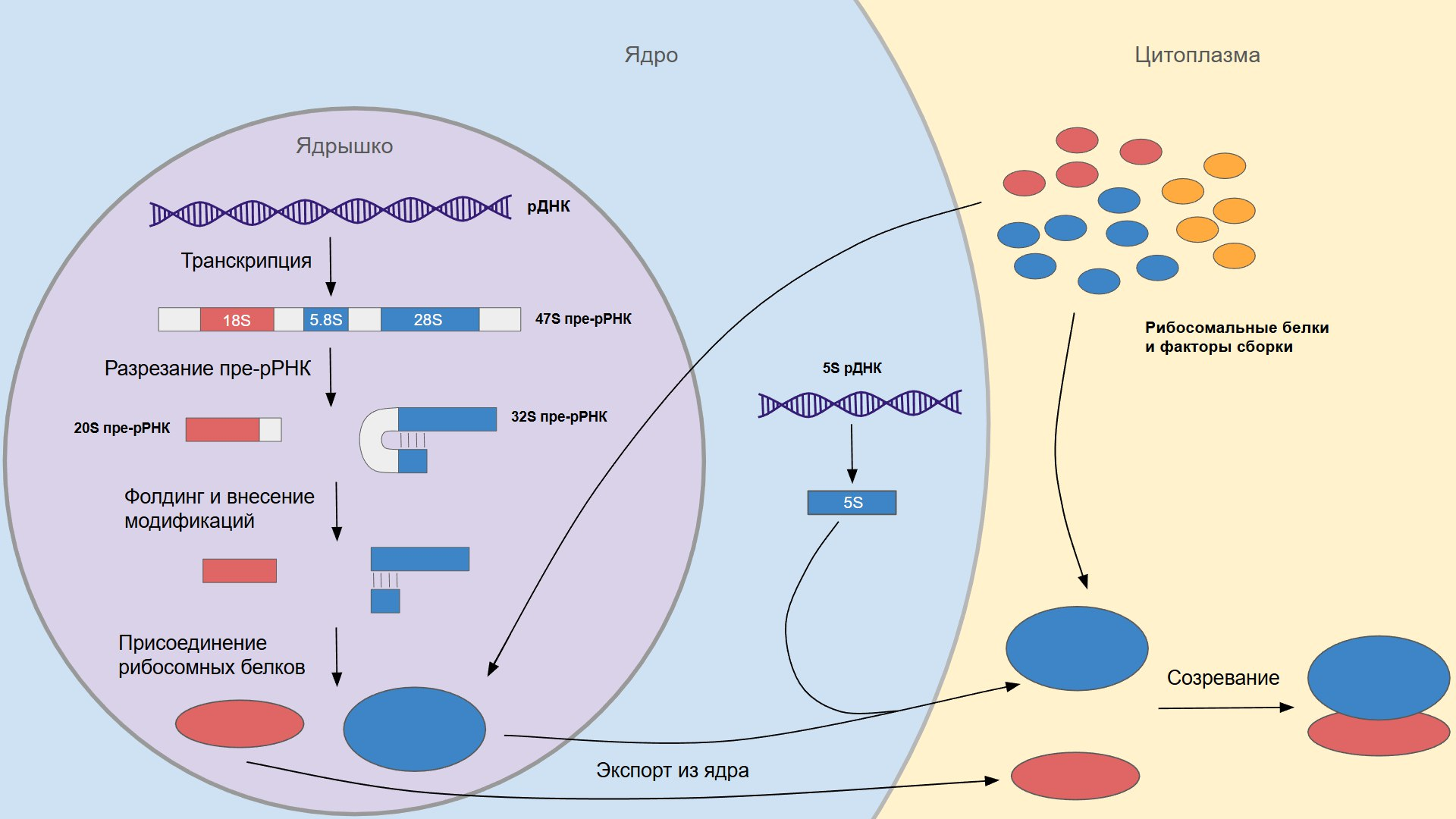
Сборка рибосом происходит в ядрышке. Все начинается с того, что туда доставляются необходимые компоненты рибосомы. Из ядра туда поступает 47S пре-рРНК — длинный транскрипт, включающий в себя будущие 18S, 5.8S и 28S рРНК, а из цитоплазмы приходят рибосомальные и другие белки, участвующие в сборке и созревании рибосомы. В ядрышке пре-рРНК разрезается в определенных местах, и получаются фрагменты нужной длины. В этом процессе участвуют малая ядрышковая РНК U3 и большое количество связанных с ней белков U3. Далее будущие рРНК под действием других малых ядрышковых РНК подвергаются многочисленным химическим модификациям: 2’-O-метилированию рибозы и псевдоуридилированию [3].
Метилирование рибозы нужно для того, чтобы увеличить стабильность рРНК, а псевдоуридилирование необходимо для придания ей функциональной структуры. Дело в том, что обычный уридин может образовывать всего две водородные связи, а его изомер псевдоуридин — три. Поэтому псевдоуридин может одновременно формировать комплементарную пару с аденином и взаимодействовать с еще каким-нибудь нуклеотидом, чаще всего расположенном на большом расстоянии. Благодаря этому рРНК изгибается и принимает правильную форму [4].
Готовые рРНК объединяются с рибосомальными белками и покидают ядрышко. В ядре в состав будущей рибосомы включается 5S- рРНК, которая синтезируется отдельно и не подвергается модификациям в ядрышке. Затем предшественники малой и большой субъединицы транспортируются в цитоплазму, где в их состав включается еще несколько рибосомальных белков, а вспомогательные белки, участвовавшие в сборке, отваливаются. На этом процесс созревания субъединиц завершается, и они, наконец, становятся готовыми к тому, чтобы соединиться на какой-нибудь мРНК и начать синтезировать с нее белок [3].
Сборка рибосомы требует слаженной работы огромного количества шаперонов и других вспомогательных белков. Суммарно в этом грандиозном действе участвуют более двухсот факторов сборки. Они следят за тем, чтобы все детали в правильной последовательности встали на свое место и приняли нужную конформацию. Если же что-то идет не так, специальные белки останавливают сборку бракованной рибосомы.
Контроль сборки рибосомы — энергозатратный процесс. Более 40 факторов сборки для своей работы нуждаются в гидролизе АТФ или ГТФ. Например, придание рРНК правильной структуры — это энергетически невыгодный процесс, и осуществляющие его РНК-хеликазы работают за счет гидролиза АТФ [5].
Поимимо этого, расщепление АТФ или ГТФ может играть регуляторную роль. Многие факторы сборки являются ГТФазами или АТФазами, то есть ферментами, которые связывают и гидролизуют ГТФ до ГДФ (АТФ до АДФ). В результате гидролиза конформация белка изменяется, и он приобретает другие свойства. Например, по такому механизму работает один из важнейших факторов сборки рибосомы — ГТФаза Nog1. Когда в его активном центре находится молекула ГТФ, этот белок связан с рибосомой, а когда она гидролизуется до ГДФ, конформация белка изменяется, и он отсоединяется от рибосомы, уступая место другим факторам сборки [5].
Nog1 участвует в сборке трех важных участков рибосомы: туннеля для выхода полипептида, пептидилтрансферазного центра и рибосомного стебелька — выступа, который нужен для взаимодействия с факторами трансляции. Он оплетает собой будущую большую субъединицу рибосомы и взаимодействует с многими другими факторами сборки, регулируя и координируя их работу [5]. Его структура в комплексе с рибосомой изображена на рисунке 2.
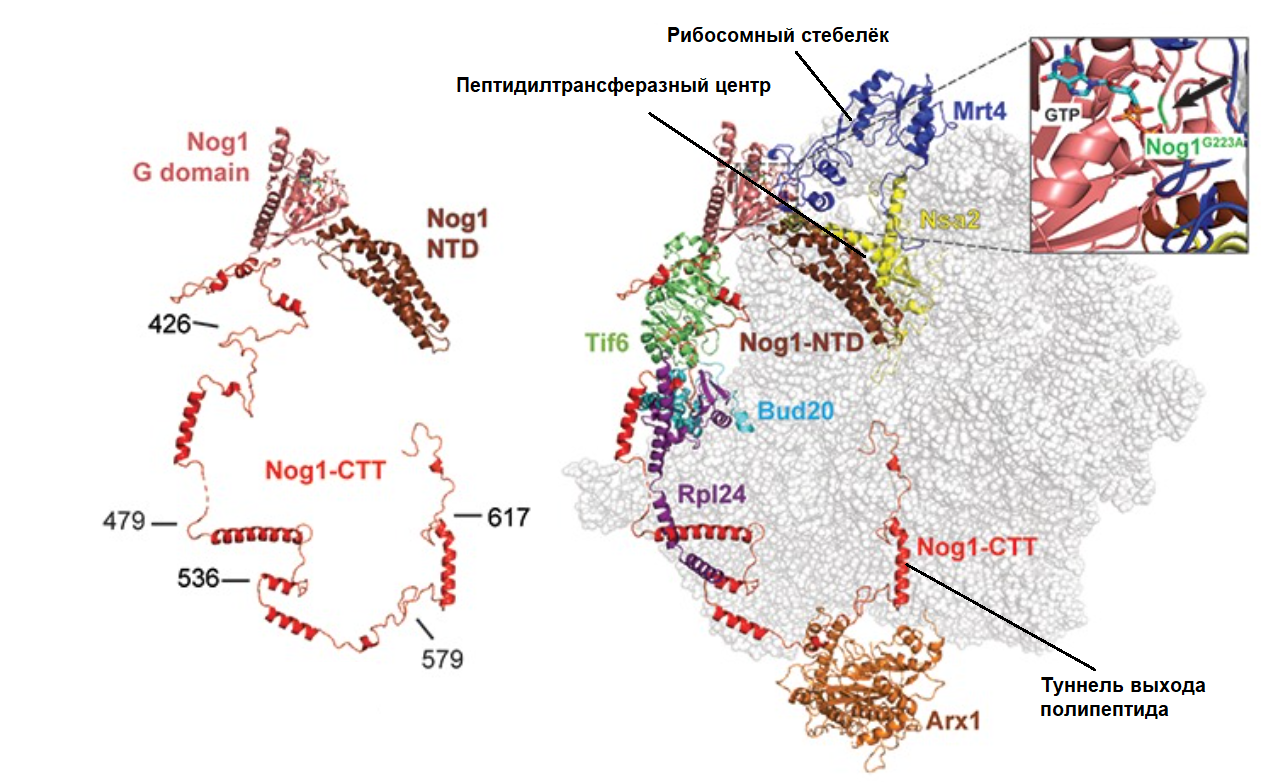
Рисунок 2. Nog1 отдельно и в комплексе с рибосомой. G domain — ГТФазный домен, CTT — С-концевой хвост, NTD — N-концевой домен. На правой картинке помимо Nog1 с рибосомой связаны еще несколько факторов сборки, с которыми взаимодействует Nog1.
Лишние детали
Компоненты рибосомы должны синтезироваться в правильном соотношении, чтобы в клетке не накапливались непригодившиеся белки и рРНК. С избыточными и нефункциональными рибосомальными белками клетка разбирается классическим способом: они убиквитинилируются и подвергаются протеасомной деградации [2].
Для рРНК и их предшественников на разных стадиях созревания тоже есть система утилизации. Их расщепляет ядерная экзосома — белковый комплекс, по своей сути похожий на протеасому. Экзосома состоит из нескольких субъединиц, расположенных кольцом, так что в центре образуется канал. РНК проходит через этот канал и подвергается расщеплению нуклеазами. Экзосомы расщепляют не только рибосомальные, но и другие ненужные РНК. Они также есть в цитоплазме, где их главным субстратом являются мРНК [6].
Как рибосомы общаются с клеточными системами
Даже после того, как рибосома успешно проходит все проверки и оказывается в цитоплазме, система контроля качества продолжает бдительно за ней следить. Для этого у нее есть очень удобный инструмент — убиквитиновый код.
Убиквитин — это небольшой сигнальный белок, который ковалентно пришивается к другим белкам по остаткам лизина и может образовывать цепочки . Этот белок играет важнейшую регуляторную роль в очень многих процессах. Рибосомные белки тоже активно убиквитинилируются, и это позволяет клетке тонко регулировать работу рибосом.
Подробнее об убиквитиновой системе читайте в статье «Биомолекулы»: «Танец знамений: убиквитин и протеасома в судьбе внутриклеточных белков» [7].
По своим свойствам убиквитины напоминают детали конструктора: они могут соединяться по-разному и за счет этого передавать большой спектр сигналов (см. рис. 3). Одни убиквитиновые метки навешиваются на рибосомы для регуляции трансляции. Другие присоединяются, когда у рибосомы возникают проблемы, и нужны, чтобы привлечь ферменты, которые ей помогут. А есть и такие метки, которые обрекают рибосому на деградацию. Клеточные системы прекрасно умеют различать эти сигналы, поэтому рибосомы могут смело разговаривать на убиквитиновом языке, не боясь, что их неправильно поймут [8].
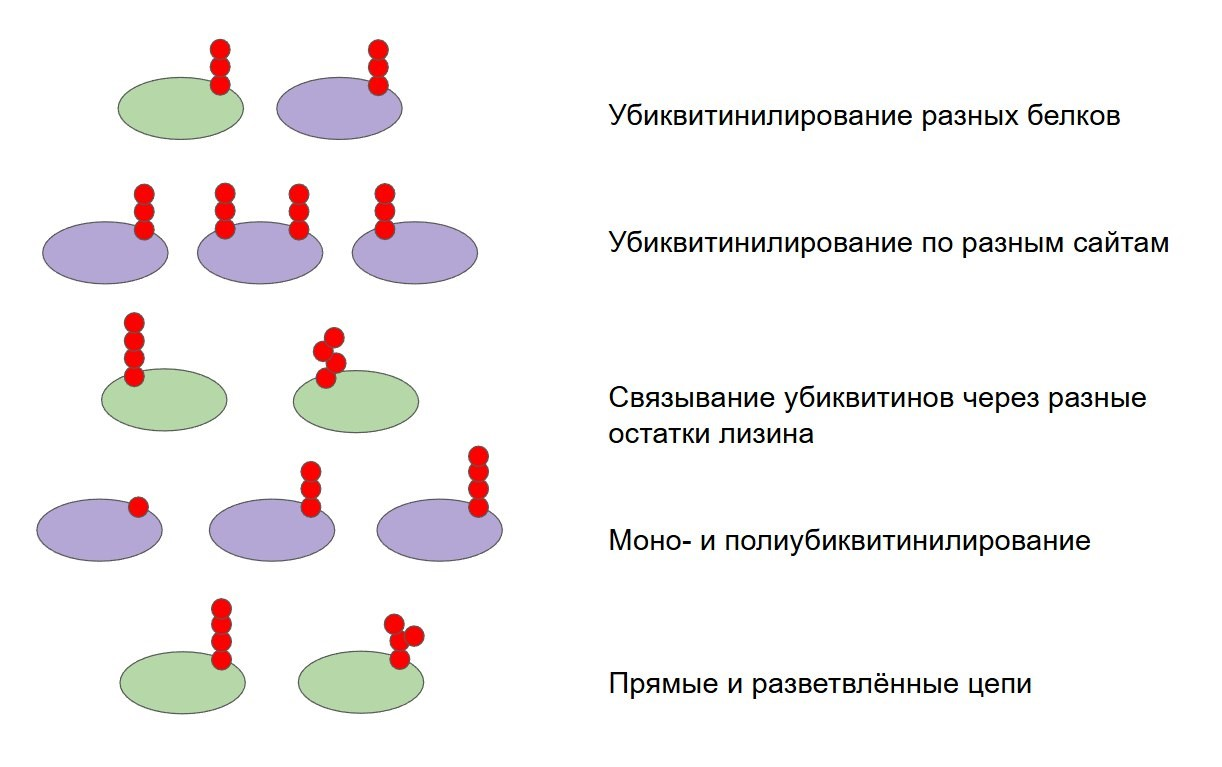
Рисунок 3. Разнообразие убиквитиновых меток на рибосомах.
рисунок автора на основе [8]
Аварии на мРНК
На первый взгляд может показаться, что в работе рибосомы нет ничего сложного: знай себе ползет по матричной РНК и присоединяет к растущему пептиду аминокислоты, которые ей приносят тРНК. Но на самом деле во время этого процесса многое может пойти не так.
Работе рибосомы могут помешать самые разные факторы, но, как правило, все они приводят к одному результату: рибосома застревает на мРНК. А если на эту же мРНК садится еще одна рибосома, она врезается в первую и тоже застревает. Происходит так называемая рибосомная коллизия. Потом в ту же ловушку может попасть третья, а затем и четвертая рибосома. Выбраться без посторонней помощи они не смогут, поэтому все новые и новые рибосомы будут сталкиваться и застревать, пока клетка с этим что-нибудь не сделает [9].
Причины рибосомных коллизий могут быть самые разные. Во-первых, рибосоме может попасться какая-то неправильная мРНК, например, содержащая поврежденные нуклеотиды или образующая прочную вторичную структуру. Во-вторых, рибосома может столкнуться с нехваткой какой-нибудь аминокислоты. Тогда ей просто нечего будет навешивать на растущий пептид. В-третьих, рибосоме может попасться редкий кодон в мРНК. Как известно, одна и та же аминокислота в большинстве случаев кодируется несколькими кодонами. В геноме разные кодоны встречаются с разной частотой, и количество разных тРНК в клетке подстраивается под их соотношение. Пока рибосома будет ждать подходящую тРНК, в нее может врезаться следующая. Наконец, различные стрессовые факторы могут привести к повреждению рибосомы, ведь такая сложно устроенная машина не может не быть чувствительной к неблагоприятным воздействиям [9].
Для того, чтобы справиться с аварией на мРНК, ее для начала нужно распознать. Этим в клетке занимаются специальные убиквитинлигазы. Они могут специфично связываться с дисомами (то есть столкнувшимися рибосомами) и навешивать на рибосомные белки убиквитины. В данном случае убиквитинилирование запускает ряд сигнальных каскадов, которые приводят к высвобождению застрявших рибосом и ликвидации причины их застревания. После того, как рибосомы оказываются на свободе, ненужные более убиквитины отщепляются с помощью деубиквитиназ [10].
Для того, чтобы справиться с рибосомными коллизиями, клетка запускает несколько механизмов. Во-первых, к мРНК, на которой произошла авария, привлекаются белки-репрессоры трансляции. Он связываются с мРНК и не дают новым рибосомам на нее садиться. Во-вторых, активируется no-go-деградация мРНК. Специальные эндонуклеазы расщепляют ее недалеко от места, где застряла рибосома, после чего ее куски направляются к экзосоме. Наконец, запускаются сигнальные каскады, которые приводят к повышению уровня экспрессии генов, участвующих в борьбе с рибосомными коллизиями [9].
По-видимому, форма дисом может слегка различаться в зависимости от того, какая причина вызвала коллизию. Вероятно, некоторые убиквитинлигазы способны распознавать дисомы разных типов и навешивать на них определенные убиквитиновые метки. Благодаря этому клетка может более прицельно реагировать на причины возникновения коллизий [10].
Утилизация рибосом
Подобно большинству других клеточных органелл, рибосома рано или поздно заканчивает свой жизненный путь внутри аутофагосомы, где она расщепляется до низкомолекулярных компонентов. Разновидность аутофагии, в ходе которой утилизируются рибосомы, называется рибофагией. Этот процесс постоянно протекает в клетке, но при определенных условиях его активность может значительно повышаться.
Самая очевидная ситуация, когда клетке разумно избавиться от некоторой части своих рибосом — голодание. На рибосомы приходится около 50% всех клеточных белков и около 90% всей РНК, так что из них можно получить очень много питательных веществ. К тому же, если ресурсов недостаточно, разумнее сократить синтез белка [11].
Стимуляция рибофагии в ответ на голодание достигается благодаря белку NUFIP1. В нормальных условиях он в основном локализуется в ядре, но в условиях голода транспортируется в цитоплазму, где связывается одновременно с рибосомой и белком LC3, который располагается на мембране аутофагосомы и обеспечивает ее замыкание вокруг цели. Нокаут NUFIP1 приводит к тому, что уровень рибофагии в условиях голода не увеличивается, и выживаемость клеток падает [11].
NUFIP1 был первым обнаруженным рецептором рибофагии, и нашли его в клетках млекопитающих. Однако позже выяснилось, что у дрожжей и червя C. elegans гомолог этого белка отсутствует, то есть механизм активации рибофагии через NUFIP1 не консервативен среди эукариот и даже среди животных. Существует более универсальный механизм запуска рибофагии. В нем участвует один из рибосомных белков — Rpl12. Он может взаимодействовать с несколькими белками, участвующими в образовании аутофагосомы, и его роль в активации аутофагии была показана в нескольких модельных организмах из разных таксономических групп [12].
Усиленная деградация рибосом может происходить не только в условиях клеточного голодания. Рибофагия играет важную роль в онкоген-индуцированном старении — явлении, которое приводит к остановке клеточного цикла при угрозе возникновения опухоли. В случае онкоген-индуцированного старения клетка претерпевает ряд изменений, в том числе переходит к секреторному фенотипу, ассоциированному со старением (SASP ) — состоянию, при котором клетка активно секретирует различные сигнальные молекулы, в основном связанные с воспалением. По-видимому, усиленная деградация рибосом нужна, чтобы получить сырье для синтеза этих сигнальных молекул.
Про секреторный фенотип, ассоциированный с клеточным старением, мы уже писали на «Биомолекуле»: «Клеточный SASPенс: как стареющие клетки общаются через SMS с молодыми и к чему это может привести?» [13].
В условиях онкоген-индуцированного старения происходит отсоединение связанной с рибосомами деубиквитиназы USP10. Из-за этого усиливается убиквитинилирование рибосом, после чего рецептор аутофагии p62 (он же секвестосома 1) распознает их и отправляет на деградацию (см. рис. 4) [14]. При этом в первую очередь утилизируются малоактивные рибосомы, так что общий уровень трансляции изменяется слабо.
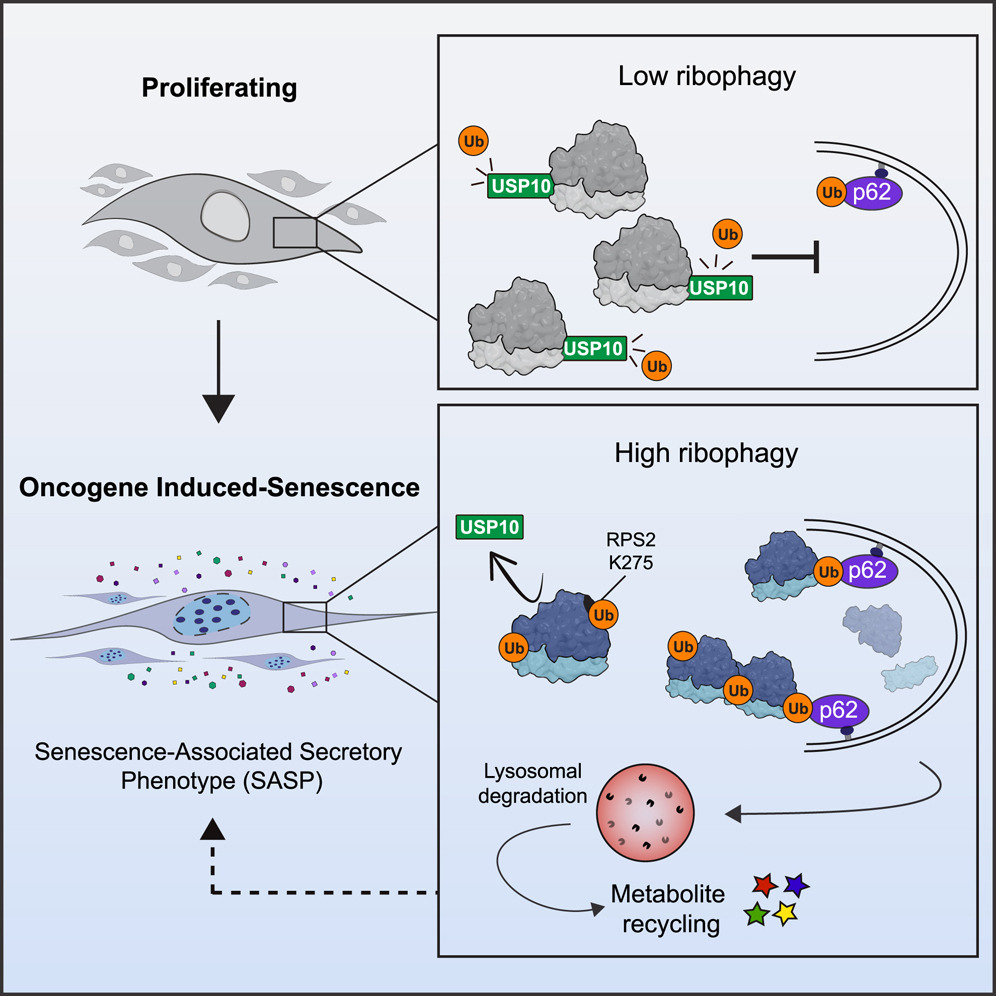
Рисунок 4. Механизм активации рибофагии в условиях онкоген-индуцированного старения.
Таким образом, рибофагия позволяет эффективно получать сырье для синтеза соединений, неоходимых для того, чтобы перейти к секреторному фенотипу, ассоциированному со старением, и предотвратить образование опухоли [14].
Заключение
Система контроля качества рибосом — достаточно новая и активно исследуемая область биологии. По поводу ее работы есть много вопросов, так как это очень сложный процесс. Однако совершенно ясно, что эта система имеет огромное значение в регуляции белкового гомеостаза и выступает в роли связующего звена между разнообразными клеточными процессами. Ееточно нельзя недооценивать, ведь если рибосомы выйдут из строя, очень скоро сломается и все остальное.
Литература
- Garrett, R. H. Biochemistry. Australia ; United Kingdom : Brooks/Cole ; Cengage Learning, 2010. — 1194 p.;
- Peng-yue Zhao, Ren-qi Yao, Zi-cheng Zhang, Sheng-yu Zhu, Yu-xuan Li, et. al.. (2022). Eukaryotic ribosome quality control system: a potential therapeutic target for human diseases. Int. J. Biol. Sci.. 18, 2497-2514;
- Wei Luo, Jing Zhou, Yongmin Yan, Xuezhong Xu. (2025). Ribosome biogenesis: A central player in liver diseases. Genes & Diseases. 12, 101512;
- B. Edward H. Maden, John M. X. Hughes. (1997). Eukaryotic ribosomal RNA: the recent excitement in the nucleotide modification problem. Chromosoma. 105, 391-400;
- Purnima Klingauf-Nerurkar, Ludovic C Gillet, Daniela Portugal-Calisto, Michaela Oborská-Oplová, Martin Jäger, et. al.. (2020). The GTPase Nog1 co-ordinates the assembly, maturation and quality control of distant ribosomal functional centers. eLife. 9;
- Aleksander Chlebowski, Andrzej Dziembowski. (2012). Exosome Complex. Encyclopedia of Life Sciences;
- Танец знамений: убиквитин и протеасома в судьбе внутриклеточных белков;
- Haleigh C. Wooters, Neil C. Nimmagadda, Alicia M. Darnell, Gustavo M. Silva. (2025). The ribosome ubiquitination code: fine-tuning translation under stress. Trends in Biochemical Sciences. 50, 766-778;
- Niladri K Sinha, Alban Ordureau, Katharina Best, James A Saba, Boris Zinshteyn, et. al.. (2020). EDF1 coordinates cellular responses to ribosome collisions. eLife. 9;
- Parissa C. Monem, Joshua A. Arribere. (2024). A ubiquitin language communicates ribosomal distress. Seminars in Cell & Developmental Biology. 154, 131-137;
- Gregory A. Wyant, Monther Abu-Remaileh, Evgeni M. Frenkel, Nouf N. Laqtom, Vimisha Dharamdasani, et. al.. (2018). NUFIP1 is a ribosome receptor for starvation-induced ribophagy. Science. 360, 751-758;
- Yuting Chen, Jiaxin Hu, Pengwei Zhao, Jie Fang, Yingqi Kuang, et. al.. (2025). Rpl12 is a conserved ribophagy receptor. Nat Cell Biol. 27, 477-492;
- Клеточный SASPенс: как стареющие клетки общаются через SMS с молодыми и к чему это может привести?;
- Aida Rodríguez López, Maria H. Jørgensen, Jesper F. Havelund, Frederic S. Arendrup, Srinivasa Prasad Kolapalli, et. al.. (2023). Autophagy-mediated control of ribosome homeostasis in oncogene-induced senescence. Cell Reports. 42, 113381.