Спецагенты по борьбе с аутоиммунным воспалением: место моноклональных антител в современной ревматологии
24 ноября 2017
Спецагенты по борьбе с аутоиммунным воспалением: место моноклональных антител в современной ревматологии
- 35653
- 0
- 10
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Вам когда-нибудь снились кошмары о том, как организм разъедает себя изнутри? А что если это становится реальностью? Именно процессы аутофагии лежат в основе развития ревматических заболеваний. В борьбе с аутоиммунным воспалением медицина слишком часто проигрывала... пока не появились они. Моноклональные антитела.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Системные ревматические заболевания — это патологии, которые возникают из-за агрессивного воздействия иммунитета на собственные ткани. В основе их развития лежит ошибка иммунной системы , которая неправильно распознает нормальные составляющие человеческого тела — аутоантигены. Иммунные клетки принимают их за чужеродные агенты, в которых видят угрозу для организма. Активируется защитная функция, и начинается «бомбардировка» здоровых клеток факторами иммунной системы — аутоантителами (рис. 1).
Основы нормального иммунитета и аутоиммунного процесса в доступной форме изложены на «Биомолекуле» в статье «Иммунитет: борьба с чужими и... своими» [1].
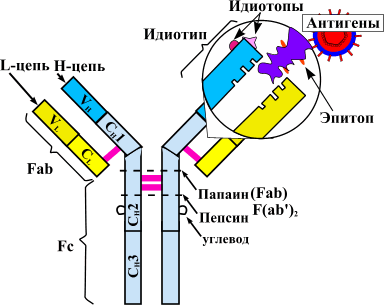
Рисунок 1. Схема строения антител. Антитела представляют собой белки-иммуноглобулины, имеющие две H-цепи (тяжелые) и две L-цепи (легкие). В каждой молекуле белка есть специфические Fab-фрагменты. Эти области отвечают за связывание с антигеном — «мишенью», на которую воздействует антитело. Структура Fab-фрагмента очень вариабельна, что позволяет ей подстраиваться под активные центры антигена — эпитопы. Между антителом и антигеном формируются химические связи (ионные, водородные, гидрофобные). Другой конец молекулы — Fc-фрагмент — отвечает за связывание образовавшихся иммунных комплексов с Fc-рецептором, расположенным на мембранах иммунных клеток (нейтрофилов, макрофагов, тучных клеток). Активация компонентов иммунитета запускает «реакцию уничтожения» по отношению к чужеродному антигену. Таким путем осуществляется антителозависимая цитотоксичность.
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Подробнее о механизмах развития некоторых ревматических заболеваний можно почитать в статьях: «Системная красная волчанка: болезнь с тысячью лиц» [2] и «Ревматоидный артрит: изменить состав суставов» [3].
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
В 2017 году «Биомолекула» опубликовала спецпроект, посвященный аутоиммунным заболеваниям.
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Разберемся, почему нужны новые лекарства. В качестве примера можно рассмотреть классическую терапию одного из самых распространенных аутоиммунных заболеваний — ревматоидного артрита [3]. Современные стратегии борьбы с этой патологией должны соответствовать концепции Treat to target — «лечение до достижения поставленной цели». Она направлена на ремиссию (исчезновение симптомов) заболевания или резкое снижение активности артрита [5], [6].
«Золотым стандартом» в терапии заболевания является метотрексат (рис. 2). Препарат входит в группу базисных противовоспалительных средств.
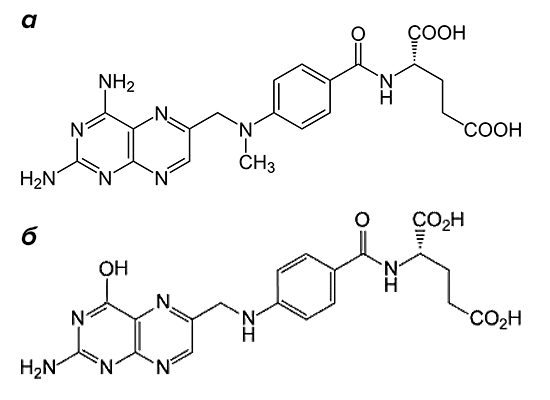
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
«Википедия»
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
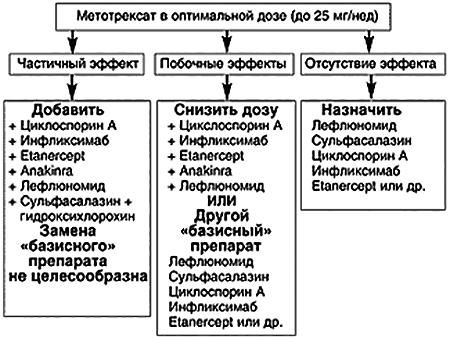
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
Иммунная система — это сложный механизм, состоящий из множества «винтиков» — иммунных клеток. Каждая из них имеет свои функции и занимает определенное место в общей структуре защитной системы. В ответ на поступление «вражеского» агента (антигена) включаются компоненты врожденного иммунитета — неспецифические факторы защиты. Это нейтрофилы, эозинофилы и базофилы, которые первыми стоят на пути у вредного воздействия.
Винтики крутятся — активируются новые компоненты иммунной системы. В борьбу с патогеном вступают Т- и В-лимфоциты. Они включают более тонкие механизмы защиты — специфическую цитотоксичность. Вырабатываются антитела, ищут себе «жертву» Т-киллеры... Тонкая регуляция процесса с помощью цитокинов позволяет быстро достигнуть поставленной цели. Согласованное действие всех компонентов иммунитета приводит к выполнению программы — уничтожению патологического агента.
Во время подбора подходящих «деталей» для механизма — при селекции лимфоцитов — неизбежно возникают ошибки. Иммунная система производит аутореактивные клоны — клетки, которые специфичны к антигенам тканей организма. В норме они отсеиваются в «мастерских» — тимусе и лимфатических узлах. Те клоны лимфоцитов, которые не различают собственные и чужеродные антигены, сразу же уничтожаются еще до того, как они приступят к выполнению своей функции. Но что происходит, если «винтики» выпадают из машины иммунитета? Поломка возникает в специфической части механизма — в работе Т- и В-лимфоцитов. При нарушении процесса селекции аутореактивные клетки выходят в кровь. Они ищут своих «жертв» и находят их в нормальных элементах собственных тканей.
В зависимости от типа реакции отличается патофизиологический процесс, лежащий в основе аутоиммунной агрессии. Т-лимфоциты могут самостоятельно убивать клетки тела, а могут и работать «чужими руками» — активировать выработку аутоантител В-лимфоцитами. При поражении В-клеточного иммунитета аутофагия реализуется через систему комплемента, а также путем формирования цитотоксических иммунных комплексов [13], [14]. Подробнее о механизмах нормального и измененного иммунного ответа можно почитать на «Биомолекуле» [1], а также в статьях [15], [16].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
Биологические агенты воздействуют на отдельные «винтики» механизма иммунной защиты. Их мишенями могут быть цитокины и их рецепторы, мембранные молекулы лимфоцитов. В зависимости от точки приложения препарата моноклональные антитела делятся на группы (рис. 4):
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
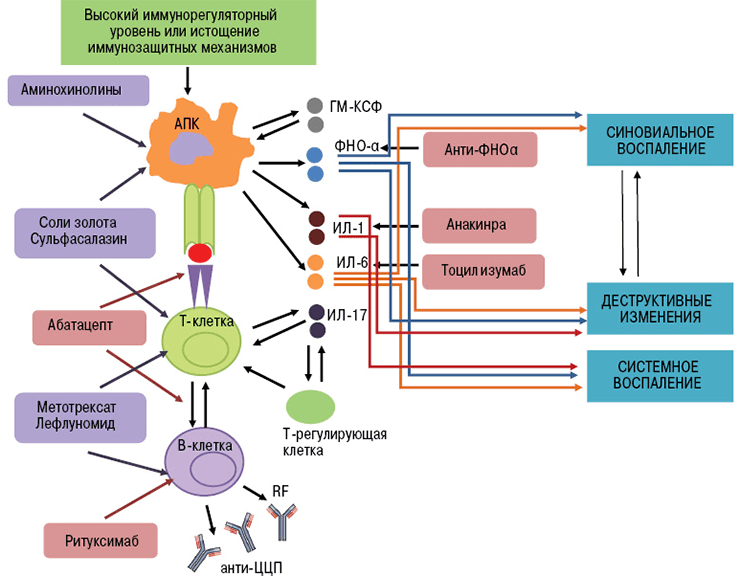
Рисунок 4. Патофизиологические «жертвы» моноклональных антител — интерлейкины, ФНО, поверхностные белки лимфоцитов.
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
Однако влияние ФНО на суставы при ревматических заболеваниях нельзя назвать положительным. Так, при ревматоидном артрите цитокин стимулирует размножение синовиальных фибробластов — клеток оболочки сустава. Это приводит к формированию паннусов — разрастаний агрессивной ткани. С течением заболевания процесс воспаления и деструкции распространяется на суставный хрящ и подлежащие кости (рис. 5). Ткани сустава заполняются иммунными клетками — макрофагами, Т- и В-лимфоцитами, нейтрофилами. Эти механизмы лежат в основе развития хронического воспаления. Освежить знания о патогенезе ревматоидного артрита можно в статье «Ревматоидный артрит: изменить состав суставов» [3].
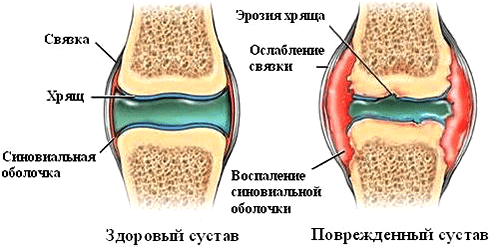
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
сайт krovetvorenie.ru
Одним из ингибиторов ФНО является препарат инфликсимаб. Он имеет «человеческую» и «мышиную» области. Примерно 25% всех аминокислот в составе моноклонального антитела получены из организма мышей. Это Fab-фрагмент — специфический участок, отвечающий за связывание с ФНО. Fc-фрагмент белка образуется из IgG1 — антитела человека.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
Механизм действия инфликсимаба понятен из его строения. Fab-фрагмент молекулы связывает фактор некроза опухолей, образуя с ним устойчивый комплекс. Такое взаимодействие полностью блокирует активность цитокина, препятствуя его соединению с мембранными рецепторами p55 и p57. Инфликсимаб «обезвреживает» как растворимую, так и мембраноассоциированную формы ФНО (рис. 6). В клетках суставов снижается содержание и других провоспалительных факторов — ИЛ-1, ИЛ-6, монооксида азота.
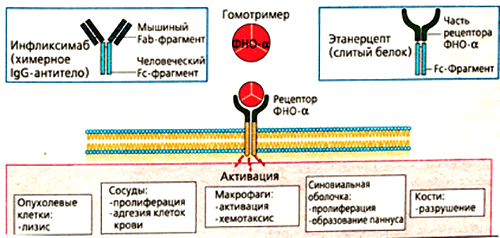
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
сайт sportwiki.to
Немного другую структуру имеет еще один эффективный препарат из группы ингибиторов ФНО — этанерцепт. В его состав входит внеклеточная часть рецептора к фактору некроза опухолей. Она «подсоединяется» к человеческому IgG1. Гибридная молекула вступает в жесткую конкуренцию за свободный ФНО и обезвреживает его до того, как цитокин успевает связаться с рецепторами и запустить воспалительную реакцию. Дополнительное действие этанерцепта, которого нет у других ингибиторов ФНО, — это нейтрализация лимфотоксина. Это вещество тоже относится к провоспалительным цитокинам. Выработка лимфотоксина стимулирует пролиферативные процессы в суставах. Соответственно, блокировка его действия снижает активность воспаления при ревматологических заболеваниях [18].
Ингибиторы ФНО хорошо показали себя не только при лечении ревматоидного артрита, но и при других аутоиммунных патологиях. Например, у пациентов с болезнью Бехтерева широко используют новые препараты. Замедление прогрессирования патологии в этом случае очень важно, так как аутоагрессия направлена на суставные и костные образования позвоночника. С течением времени болезнь превращает позвоночный столб в «бамбуковую палку» — монолитное негнущееся образование. Анкилоз развивается постепенно, но неотвратимо. С каждым годом двигательные возможности больных становятся все более ограниченными. Применение биологических препаратов позволяет снизить активность воспаления в позвоночнике. Это замедляет процесс формирования анкилоза [19].
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
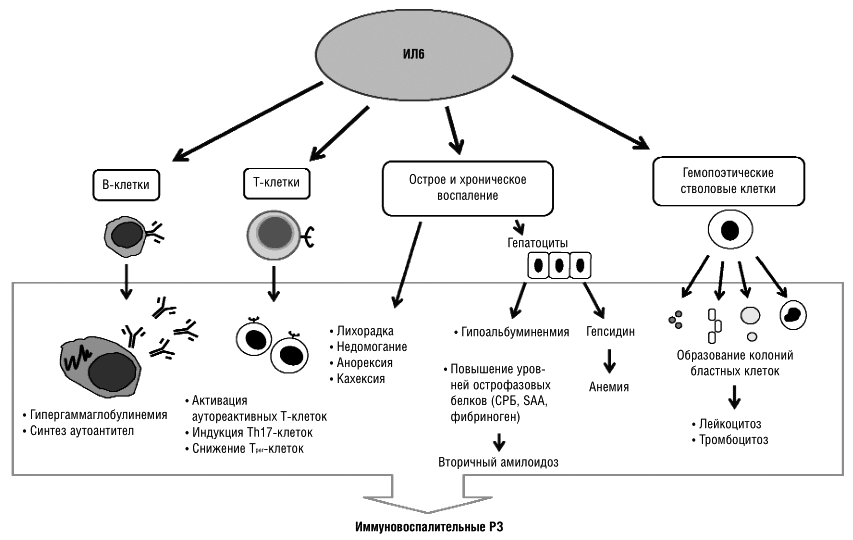
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Влияние интерлейкинов — один из «спусковых крючков» воспалительного процесса. Поэтому блокировка их активности улучшает состояние пациентов с аутоиммунными заболеваниями. Приостановить работу интерлейкинов можно, если связать их рецепторы — молекулы, передающие сигнал иммунным клеткам. На этом основан механизм действия моноклональных антител из группы ингибиторов интерлейкиновых рецепторов.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
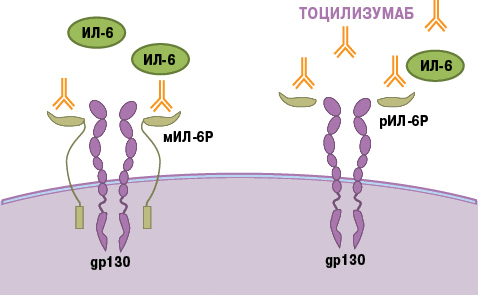
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Одними из главных элементов, участвующих в аутоиммунном воспалении, являются В-лимфоциты. Именно они вырабатывают аутоантитела, которые связываются со здоровыми клетками организма. Образовавшийся комплекс антитела и аутоантигена атакует система комплемента или цитотоксические лимфоциты. Этот процесс лежит в основе воспалительной реакции при таком ревматическом заболевании, как системная красная волчанка. Ей на «Биомолекуле» посвящена отдельная статья: «Системная красная волчанка: болезнь с тысячью лиц» [2].
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
Благодаря этой особенности белок CD20 является идеальной «жертвой» для биологических препаратов. При «выключении» его активности не нарушается ни образование новых лимфоцитов, ни выработка нормальных антител. Одним из лекарств с таким механизмом действия является ритуксимаб. Моноклональное антитело связывается с молекулой CD20. Это приводит к запуску иммунологических реакций по отношению к B-лимфоцитам, которые обеспечивают разрушение (лизис) этих клеток (рис. 9).
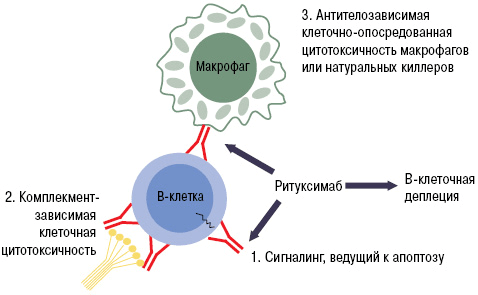
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
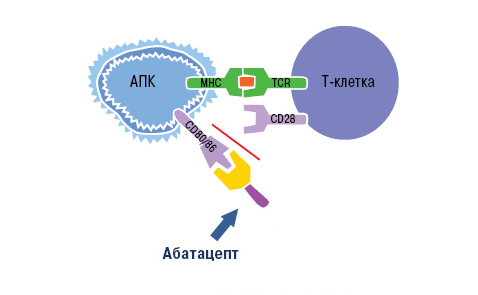
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Препараты моноклональных антител уже довольно долго используют в ревматологической практике. Однако назначают их далеко не всем — не каждому первому и даже не каждому второму пациенту. Главным ограничением, с которым сталкиваются врачи и больные, является действительно «заоблачная» стоимость препаратов этой группы. Ревматические заболевания нельзя вылечить за неделю или месяц — они требуют многолетнего (или даже пожизненного) использования терапии. Поэтому при подборе лекарственного средства важна не только его эффективность, но и цена.
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Поэтому лечение ревматических заболеваний проводят по строгим алгоритмам. При выявлении патологии пациенту назначают базисный препарат. К примеру, при ревматоидном артрите основным лекарством, вероятнее всего, станет метотрексат. Добавлять моноклональные антитела к стандартной схеме лечения врачи будут только в исключительных случаях. В России их считают препаратами резерва — дополнительными средствами, которые стоит «оставить на потом», даже несмотря на высокую эффективность. Так, если выраженность симптомов не снижается долгое время (как минимум 6 месяцев!), к метотрексату могут добавить биологический препарат. Базисная терапия при этом не отменяется.
Если заболевание изначально имеет высокую активность, быстро прогрессирует и сопровождается внесуставными осложнениями, то больному сразу могут назначить комбинированное лечение базисными средствами и моноклональными антителами. Это связано с тем, что лучше всего биологические препараты работают именно в «остром периоде», когда выраженность симптомов максимальная. Кроме того, эффект от их использования наблюдается быстрее. Лечение инфликсимабом дает результаты уже через 2–4 недели, тогда как метотрексат «включается в работу» только через несколько месяцев.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Назначение и реализация биологических препаратов контролируется государством. Многие средства из группы моноклональных антител (инфликсимаб, этанерцепт, тоцилизумаб, голимумаб) входят в «Перечень жизненно необходимых и важнейших лекарственных средств». В соответствии с ним формируется список лекарств, которые поступают в стационары по всей России. Конечно, биологические препараты сегодня есть далеко не в каждой больнице. Обычно их используют в региональных центрах или специализированных стационарах.
При неспособности обеспечить себя лекарствами пациенты получают инвалидность и проходят терапию за счет государства. Это право закреплено в действующей «Программе государственных гарантий оказания бесплатной медицинской помощи». Лечение биологическими препаратами предоставляется при ревматоидном артрите, болезни Бехтерева, СКВ, дерматополимиозите, ювенильном артрите и других заболеваниях. При этом врачи должны определить четкие показания к назначению того или иного средства. Получить дорогостоящее лечение довольно сложно — нужно пройти полное обследование, собрать документы. Однако предоставление государственной квоты для многих пациентов является последним шансом на полноценную жизнь.
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Аутоиммунные синдромы, спровоцированные введением лекарства, обычно представлены васкулитами, СКВ, антифосфолипидным синдромом, псориазом [25]. Высокой иммуногенностью обладает инфликсимаб, в составе которого есть чужеродные мышиные фрагменты. Менее активно провоцируют иммунитет полностью «человеческие» препараты. Но даже при их применении есть высокий риск развития побочных аутоиммунных реакций. Чтобы устранить эти нарушения, необходимо скорректировать схему лечения больного. В нее включают дополнительные иммуносупрессоры, которые будут подавлять осложнения. Возможно, поэтому комбинации биологических препаратов с базисными лекарствами часто более эффективны, чем изолированная терапия, пусть даже и самыми новыми средствами [24].
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Литература
- Иммунитет: борьба с чужими и… своими;
- Системная красная волчанка: болезнь с тысячью лиц;
- Ревматоидный артрит: изменить состав суставов;
- Насонов Е.Л., Александрова Е.Н., Новиков А.А. (2015). Аутоиммунные ревматические заболевания — проблемы иммунопатологии и персонифицированной терапии. Вестник РАМН. 2, 169–182;
- Бабаева А.Р., Калинина Е.В., Звоноренко М.С. (2016). Новые возможности повышения эффективности и безопасности лечения ревматоидного артрита. Медицинский алфавит. 22, 5–12;
- Josef S Smolen, Robert Landewé, Ferdinand C Breedveld, Maya Buch, Gerd Burmester, et. al.. (2014). EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis. 73, 492-509;
- Насонов Е.Л. (2015). Метотрексат при ревматоидном артрите — 2015: новые факты и идеи. Научно-практическая ревматология. 4, 421–433;
- Каневская М.З. и Гурская С.В. (2013). Метотрексат в лечении ревматических заболеваний. Современная ревматология. 4, 47–53;
- D. T. Felson, J. S. Smolen, G. Wells, B. Zhang, L. H. D. van Tuyl, et. al.. (2011). American College of Rheumatology/European League Against Rheumatism Provisional Definition of Remission in Rheumatoid Arthritis for Clinical Trials. Annals of the Rheumatic Diseases. 70, 404-413;
- Patrick Durez, Jacques Malghem, Adrien Nzeusseu Toukap, Geneviève Depresseux, Bernard R. Lauwerys, et. al.. (2007). Treatment of early rheumatoid arthritis: A randomized magnetic resonance imaging study comparing the effects of methotrexate alone, methotrexate in combination with infliximab, and methotrexate in combination with intravenous pulse methylprednisolone. Arthritis Rheum. 56, 3919-3927;
- Моноклональные антитела;
- 12 методов в картинках: иммунологические технологии;
- Аутофагия, протофагия и остальные;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Зайчик А.М., Полетаев А.Б., Чурилов Л.П. (2013). Распознавание «Своего» и взаимодействие со «Своим» как основная форма активности адаптивной иммунной системы. Вестник СПбГУ. Серия 11. Медицина. 1;
- Аутоиммунитет. Современные взгляды на физиологические и патологические аспекты аутоиммунитета. Электронный архив НГУ;
- Впервые за полвека появилось новое лекарство от волчанки;
- Насонов Е.Л. и Каратеев Д.Е. (2013). Применение генно-инженерных биологических препаратов для лечения ревматоидного артрита: общая характеристика (лекция). Научно-практическая ревматология. 2, 163–169;
- Логвиненко С.И., Щербань Э.А., Придачина Л.С., Придачина А.Н., Маслова Ю.Ю., Кашичкина А.А. (2016). Генная инженерия в лечении анкилозирующего спондилита (болезни Бехтерева). Научные ведомости БелГУ. Серия: Медицина. Фармация. 19, 179–182;
- Masahiko Mihara, Misato Hashizume, Hiroto Yoshida, Miho Suzuki, Masashi Shiina. (2012). IL-6/IL-6 receptor system and its role in physiological and pathological conditions. Clin. Sci.. 122, 143-159;
- Насонов Е.Л., Александрова Е.Н., Авдеева А.С., Панасюк Е.Ю. (2013). Ингибиция интерлейкина 6 — новые возможности фармакотерапии иммуновоспалительных ревматических заболеваний. Научно-практическая ревматология. 4, 416–427;
- Супоницкая Е.В., Александрова Е.Н., Алексанкин А.П., Насонов Е.Л. (2015). Влияние терапии генно-инженерными биологическими препаратами на субпопуляции В-лимфоцитов при ревматических заболеваниях: новые данные. Научно-практическая ревматология. 1, 78–83;
- Бабаева А.Р., Черевкова Е.В., Гальченко О.Е., Солоденкова К.С. (2012). Биологические агенты в базисной терапии ревматоидного артрита. Лекарственный вестник. 7, 3–9;
- Муравьев Ю.В. и Муравьева Л.А. (2016). Несвоевременные мысли о применении генно-инженерных биологических препаратов при ревматических болезнях. Научно-практическая ревматология. 3, 361–366;
- Псориаз: на войне с собственной кожей.