
Свет, камера, … нервный импульс!
17 октября 2017
Свет, камера, … нервный импульс!
- 1497
- 2
- 8
Представление нейрона, который можно запускать и выключать с помощью света.
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Исследователи лаборатории перспективных исследований мембранных белков МФТИ открыли дополнительную возможность возбуждать нервные клетки с помощью света, и я расскажу вам об этом как соавтор. Я опишу, как работают белки, способные запускать и блокировать нервный импульс. Я объясню, каким образом можно целенаправленно изменять белок, чтобы он приобрел новые свойства, которых не имел в природном виде.
Конкурс «био/мол/текст»-2017
 Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2017.
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Как управлять мозгом с помощью света?
Человеку всегда было любопытно, как устроен и как работает мозг. Вплоть до недавнего времени исследования мозга могли обрисовать его работу лишь «крупными мазками». Современные технологии, такие как томография [1], позволяют «разглядывать» мозг с высоким пространственным разрешением, причем происходит это неинвазивно, нетравматично. Недавно был сделан еще один шаг, позволяющий уже не только наблюдать, но и управлять нервными импульсами, — разработаны оптогенетические технологии.
Оптогенетика — это способ управления определенными клетками с помощью света. Чаще всего речь идет о нейронах и мышечных клетках — так называемых электровозбудимых клетках. Как это работает? Для нормального существования клетка старается поддерживать определенные условия внутри и снаружи себя. По разные стороны мембраны клетки находятся ионы, но в различных концентрациях. В частности, внутри клетки преобладают ионы калия, а снаружи — ионы натрия и хлора. Причем, соотношение заряженных ионов таково, что клетка внутри заряжена более отрицательно (имеет отрицательный мембранный потенциал [2], равный примерно −70 мВ). Теперь, если мы каким-либо образом извне направим положительные заряды внутрь клетки, произойдет ее деполяризация, и клетка возбудится (возникнет потенциал действия). У нейронов в мембране находятся свои белки, которые реагируют на изменение потенциала. Именно они отвечают за распространение нервного импульса по цепочке нейронов.
В природе есть различные организмы, жизнь которых зависит от наличия света. Поглощая фотоны, естественные белки в этих организмах могут переносить различные ионы через мембрану клеток (например, протоны или ионы натрия). Если в нейрон или мышечную клетку внедрить такой белок, переносящий положительные ионы внутрь, и посветить на эту клетку, то мы искусственно запустим нервный импульс. Мы также можем и заблокировать прохождение импульса: для этого нужно, напротив, еще сильнее уменьшить мембранный потенциал — так, чтобы собственные клеточные белки не справились с повышением потенциала до нужного порога. Такое уменьшение называется гиперполяризацией. Этого можно добиться, выкачивая положительные ионы из клетки или закачивая в нее отрицательные.
Обобщая, можно сказать, что оптогенетика находит белки-транспортёры, реагирующие на свет, пытается доставить эти белки в нужные клетки и создает решения, как же посветить на эти клетки светом (это особенно сложно, когда хочется светить на клетки глубоко в мозге). Причем, это система модульная, ее составные компоненты можно заменять.
Скальпель, зажим, родопсин
Белки-транспортёры в этом случае называются оптогенетическими инструментами. Разнообразие белков такого типа в природе действительно широко. Различные представители бактерий, архей, простейших и даже вирусов обзавелись такими белками. Кому-то эти белки нужны, чтобы вырабатывать энергию. Белок бактериородопсин одной из архей под действием света выкачивает протоны наружу клетки. Созданная таким образом разность потенциалов на мембране используется клеткой для синтеза АТФ. Буквально, клетка пользуется мембраной как батарейкой. Или же организмам не повезло, и они вынуждены жить в очень щелочном водоеме. Чтобы как-то существовать, такие археи завели у себя белок ксенородопсин, который при поглощении фотона закачивает внутрь клетки протон, поддерживая кислотно-щелочной баланс в цитоплазме. В ряде простейших такие белки «настроены» на синий/фиолетовый свет. Каскадом химических реакций они связаны с работой жгутиков клеток. Это позволяет организмам уплывать от губительного действия коротковолнового (фиолетового-ультрафиолетового) излучения. У человека тоже есть светочувствительные белки, они находятся в клетках-«палочках» сетчатки глаза [4] и отвечают за восприятие света. Конечно же, это тоже родопсины.
Классические оптогенетические инструменты — галородопсин, археародопсин и канальный родопсин (рис. 1) [5]. Галородопсин и археародопсин используются для деактивации нейронов, они блокируют передачу нервного импульса. Под действием света галородопсин переносит отрицательно заряженные ионы хлора внутрь клетки, тем самым вызывая гиперполяризацию нейрона. Археародопсин выкачивает протоны (положительные заряды) из клетки, это, естественно, также гиперполяризует нейрон. И галородопсин, и археародопсин — это так называемые насосы, помпы. Если вокруг есть нужный им ион (а он есть почти всегда), то, поглотив квант света, эти белки активно перенесут ион с одной стороны мембраны на другую.
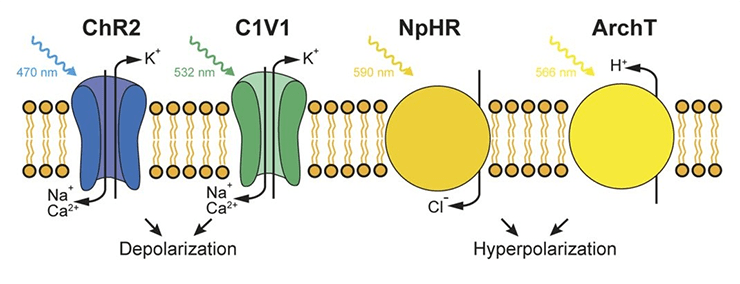
Рисунок 1. Принципы работы классических оптогенетических инструментов: канального родопсина, галородопсина и протонного насоса (археародопсина). Перенос ионов натрия внутрь клетки, обусловленный канальным родопсином 2, приводит к деполяризации, а перенос ионов хлора галородопсином или протонов археародопсином приводят к гиперполяризации клетки.
Канальный родопсин в настоящее время широко используют для активации электровозбудимых клеток. Он долгое время оставался единственным белком, способным на это. Канальный родопсин позволяет положительным ионам перетекать из области с их большей концентрацией в область с меньшей. Из внеклеточного пространства внутрь клетки идет поток ионов натрия, и нейрон возбуждается.
Несмотря на то, что три классических белка-транспортёра в принципе решают задачи активации и деактивации электровозбудимых клеток, у каждого из них есть свои преимущества и недостатки. Например, галородопсин с недостаточно высокой скоростью переносит ионы хлора, а археародопсин в своей работе использует протоны и меняет кислотность среды вокруг нейрона, отчего клетка может начать чувствовать себя неважно. Канальный родопсин — замечательный инструмент, но переносит ионы только пассивно: ему нужна разность концентраций ионов, чтобы все работало. Кроме этого, канальный родопсин не избирателен к ионам и эффективен, только если его освещать синим или фиолетовым светом, а такое коротковолноое излучение очень неглубоко проникает в ткани (рис. 2). Это ограничивает возможность применения белка, если интересующий нас участок мозга или мышцы находится глубоко.
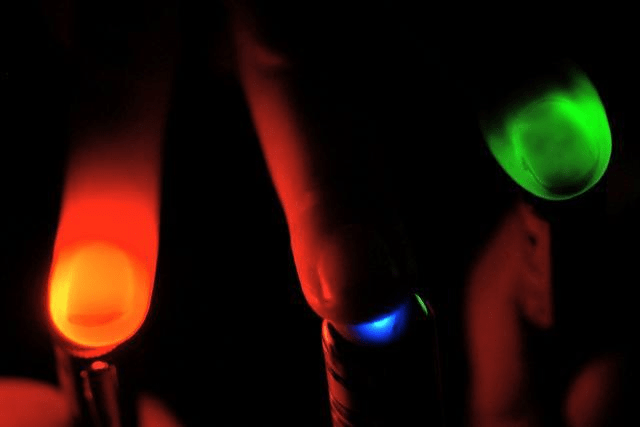
Рисунок 2. В практических применениях оптогенетики важно иметь возможность облучать клетки в глубине тканей. На рисунке видно, что красный свет может просветить ткани глубоко, в то время как синий свет не может проникнуть даже на толщину пальца.
сайт www.sos.siena.edu
Оптогенетические инструменты будущего
Именно поэтому не прекращается поиск, разработка и оптимизация оптогенетических инструментов нового поколения. В последнее время существенно изменили и подстроили параметры работы популярного канального родопсина: с помощью направленного введения мутаций можно получить его аналоги, более быстрые и специфичные к ионам кальция, с оптимумом работы, сдвинутым в более длинноволновую часть спектра.
Исследование баз данных белков и организмов позволяет отыскивать новые белки-транспортёры, пригодные для нужд оптогенетики. Каждая из этих находок ценна по-своему. Открытые анионные канальные родопсины [6] позволяют деактивировать нейроны, создавая поток отрицательных зарядов внутрь клетки. Химерный белок, состоящий из фоточувствительной части и вирусного калиевого канала [7], может деактивировать нейроны, пропуская ионы калия из цитоплазмы во внеклеточное пространство.
Мы с коллегами из лаборатории перспективных исследований мембранных белков МФТИ [8] внесли свой вклад в открытие и рациональный инжиниринг новых оптогенетических инструментов.
В 2013 году японские ученые открыли натриевый насос KR2 [9], выкачивающие натрий из клетки. Нам с коллегами в 2015 году удалось закристаллизовать белок и решить его структуру в различных функциональных состояниях. Полученные результаты мы опубликовали в журнале Nature Structural and Molecular Biology [10]. Анализируя структуры (рис. 3), мы разобрались в механизмах и условиях работы белка KR2. Оказалось, что у него есть полость, отвечающая за избирательность иона, который будет перенесен. И внеся в белок мутации, затрагивающие эту полость, нам удалось получить модификацию белка, которая прокачивает ионы калия [9], [10]. А ведь именно на паре ионов натрия/калия работают собственные клеточные белки, ответственные за прохождение нервного импульса. Таким образом, на основе полученных данных мы смогли создать более естественный, физиологический оптогенетический инструмент. Хотелось бы отметить, что это пример того, как человек, используя свои знания и воображение, может подстраивать под собственные нужды то, что придумала природа.
Наша группа включает в себя тех, кто может произвести белок в большом количестве, кто имеет большой опыт в кристаллизации мембранных белков (а это очень непростая задача!) и кто умеет решить структуру белка, получив данные рентгеновской дифракции. Затем мы анализируем полученную информацию и проводим дальнейшие эксперименты с модификациями белка. Новые функции мутантных форм исследуем электрофизиологически, методом локальной фиксации потенциала [1]. Финальным аккордом мы стараемся продемонстрировать применимость изученного белка в нервных клетках.
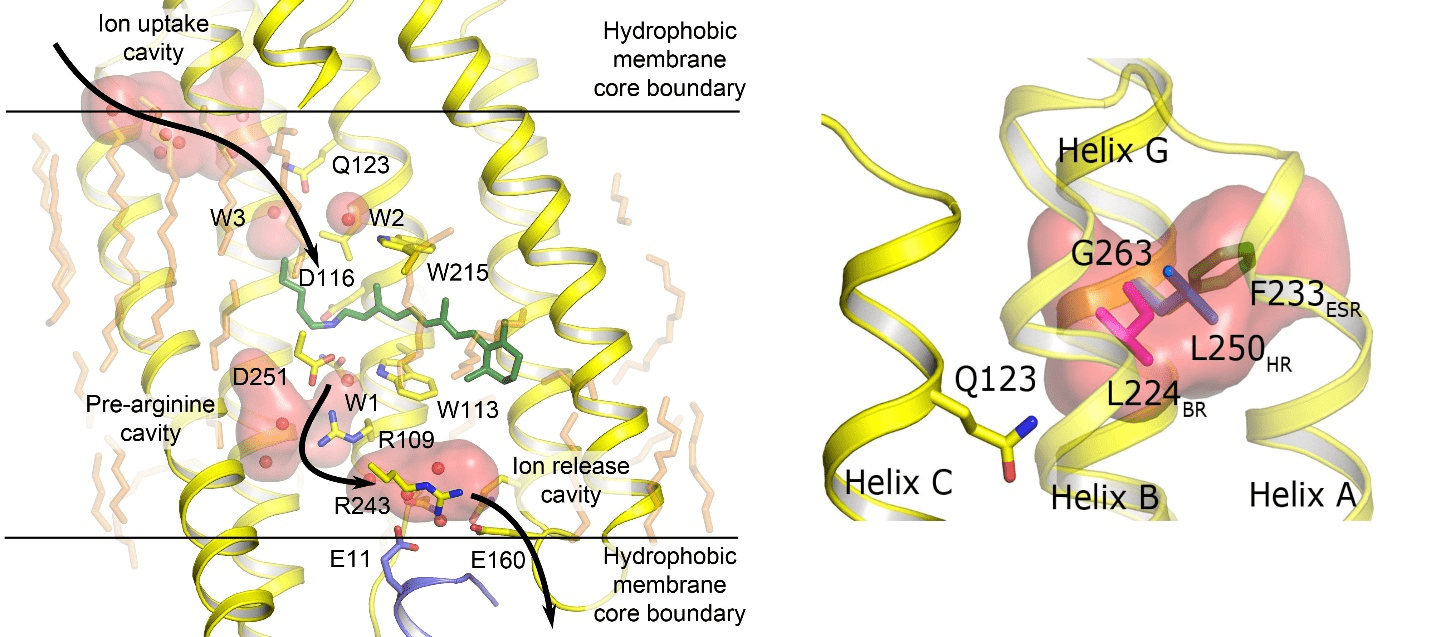
Рисунок 3. Решенная структура натриевого насоса KR2. Слева показана структура KR2, стрелками указан путь иона натрия при прокачивании. Слева сверху на структуре показана полость, где захватывается ион. Полость исполняет роль селективного фильтра. Справа эта полость показана крупно. Разными цветами показаны перепробованные нами мутации, чтобы превратить натриевый насос в калиевый.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Наконец, буквально две недели назад мы опубликовали статью в журнале Science Advances [11], где фактически брошен вызов монополисту — канальному родопсину. Мы открыли протонный насос, переносящий протоны внутрь клетки. Чтобы его найти, мы исследовали широкое множество родопсинов — таких, чья функция была еще неизвестна. Буквально, мы изучали разные микроорганизмы, старались найти те, которые живут в каких-то экзотических условиях. Мы перебрали с десяток кандидатов, прежде чем нашли тот, который давал бы надежду на дальнейшее практическое применение. Ксенородопсины — так называется семейство таких насосов — обнаружены в крошечных археях (наногалоархеях), которые обитают в щелочных водоемах. Мы считаем, что эти организмы используют такой белок для поддержания гомеостаза, преодолевая негативное действие окружающей среды. Ксенородопсины эффективно работают, поглощая красный свет, что позволяет использовать их глубоко в тканях. Поэтому мы смело утверждаем, что открытые белки могут составить достойную конкуренцию канальному родопсину (рис. 4).

Рисунок 4. У исследователей, которым нужно активировать нервные клетки, теперь есть выбор: ксенородопсин (оптимум активности в красном диапазоне) или канальный родопсин (оптимум — в синем диапазоне).
Ксенородопсины переносят протон достаточно быстро, и уже через 2,5 миллисекунды готовы перенести следующий протон. Фактически, это означает, что белок может возбуждать человеческие нейроны с максимальной скоростью. Ксенородопсины способны занять нишу работы с мышечными клетками. Дело в том, что мышечные клетки очень чувствительны к транспорту кальция. Поэтому, при работе с мышцами хотелось бы избежать переноса кальция, чего не может обеспечить канальный родопсин, потому что он неселективен (рис. 1). А ксенородопсины могут.
Как и в случае с натриевым насосом, нам удалось решить структуру ксенородопсина (рис. 5, слева) и понять механизм переноса протона. Многие исследователи, которые работают в области фотоактивных белков, были очень удивлены тому, что такой белок мог найтись в природе. Широко распространено мнение, что перенос протонов через мембрану подобных микроорганизмов в первую очередь обеспечивает клетку энергией. А поведение ксенородопосина не вписывалось в эту картину. Поэтому мы специально показывали на модельных клетках HEK293, что есть ток внутрь (рис. 5, справа сверху). Причем направление тока оставалось тем же, даже если к клетке приложить удерживающее напряжение. Ксенородопсины способны насильно вкачивать протоны в цитоплазму. В этой же работе мы поставили восклицательный знак: на деле показав, что белок может возбуждать нейроны с высокой частотой (рис. 5, справа снизу).
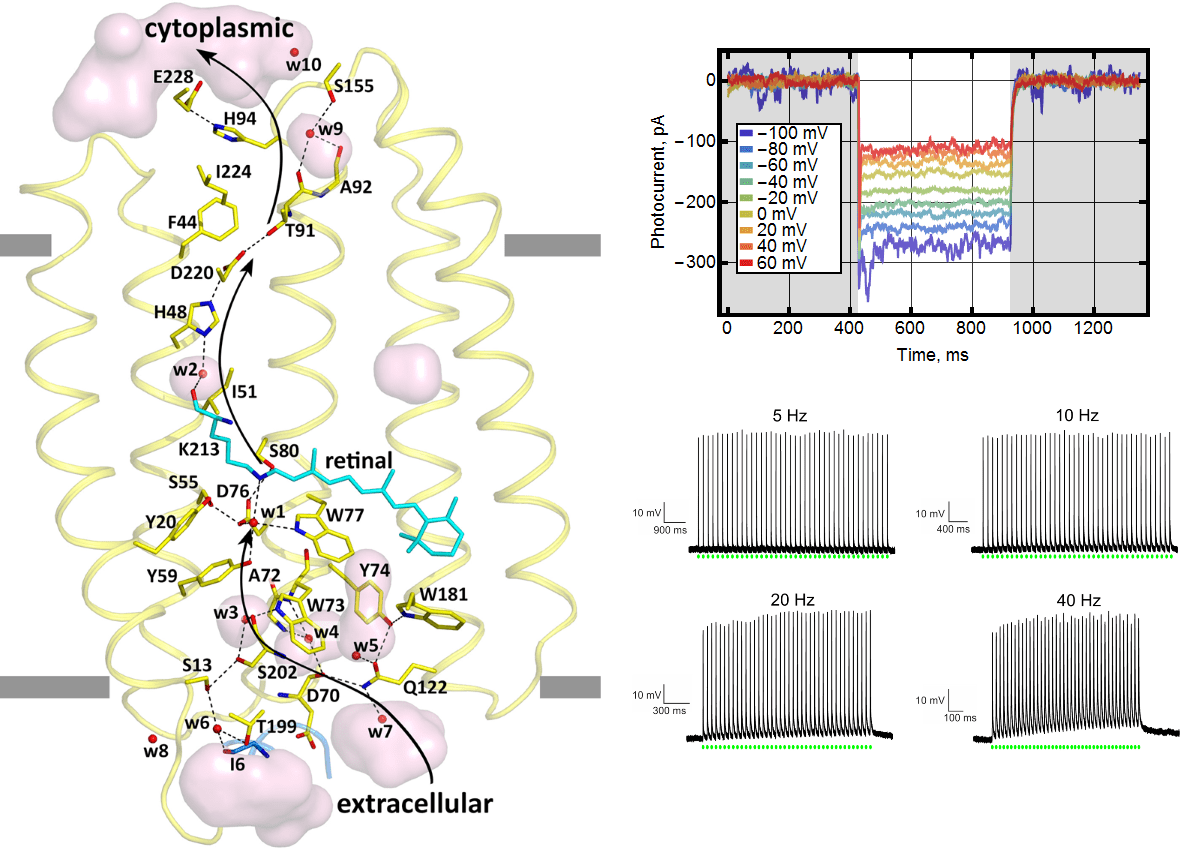
Рисунок 5. Ксенородопсин и его работа. Слева показана кристаллическая структура обратного протонного насоса — ксенородопсина. Справа сверху — наличие тока внутрь клеток HEK293 при различных напряжениях, приложенных к клетке. Справа снизу — возбуждаемые потенциалы действия при облучении нейронов световыми импульсами, повторяющимися с разной частотой.
Чтобы увидеть рисунок в полном размере, нажмите на него.
В заключение
Исследования мозга и минимально инвазивная терапия заболеваний, связанных с нервной системой, продолжают и продолжат быть актуальными в течение XXI века. Оптогенетика и ее инструменты — молекулярные машины и белки-транспортёры — дадут возможность улучшить качество жизни людей с перманентными болевыми синдромами, нейродегенеративными возрастными заболеваниями, помогут частично восстановить зрение и слух [12], [13], а возможно, и мышечные дисфункции. Фундаментальные исследования, поиск и рациональная модификация белков будут лежать в основе успеха оптогенетических подходов в терапии.
Литература
- 12 методов в картинках: нейробиология;
- Формирование мембранного потенциала покоя;
- Светлая голова;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Rachel J. Sizemore, Sonja Seeger-Armbruster, Stephanie M. Hughes, Louise C. Parr-Brownlie. (2016). Viral vector-based tools advance knowledge of basal ganglia anatomy and physiology. J Neurophysiol. 115, 2124-2146;
- Обнаружены управляемые светом анионные каналы;
- Создан управляемый светом калиевый канал;
- Лаборатория перспективных исследований мембранных белков: от гена к ангстрему;
- Hideaki E. Kato, Keiichi Inoue, Rei Abe-Yoshizumi, Yoshitaka Kato, Hikaru Ono, et. al.. (2015). Structural basis for Na+ transport mechanism by a light-driven Na+ pump. Nature. 521, 48-53;
- Ivan Gushchin, Vitaly Shevchenko, Vitaly Polovinkin, Kirill Kovalev, Alexey Alekseev, et. al.. (2015). Crystal structure of a light-driven sodium pump. Nat Struct Mol Biol;
- Vitaly Shevchenko, Thomas Mager, Kirill Kovalev, Vitaly Polovinkin, Alexey Alekseev, et. al.. (2017). Inward H + pump xenorhodopsin: Mechanism and alternative optogenetic approach . Sci. Adv.. 3, e1603187;
- Когда ослепшие прозреют?;
- Оптогенетика + голография = прозрение?.







