
Лаборатория перспективных исследований мембранных белков: от гена к ангстрему
04 сентября 2016
Лаборатория перспективных исследований мембранных белков: от гена к ангстрему
- 3711
- 0
- 13
рисунок Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Статья на конкурс «био/мол/текст»: Лаборатория перспективных исследований мембранных белков МФТИ существует с 2011 года. За прошедшие пять лет она сильно расширила направления исследований, приютила несколько редчайших установок, объединила совершенно неповторимых людей и обзавелась собственной учебной базой. Интерес лаборатории — в исследовании (как вы уже догадались) мембранных белков: их структуры, функций и взаимосвязи между структурой и функциями. О том, как построить полноценный «конвейер» по исследованию белка, и в какие страны ездят студенты лаборатории в период обучения — читайте в этом материале.
Биология в Московском физтехе
XXI век называют «веком живых систем», изучение которых возможно только на стыке наук — математики, физики, химии и биологии. «Биомолекула» представляет серию материалов о том, как занимаются биологией в Московском физико-техническом институте (МФТИ).
 Эта работа заняла первое место в номинации «Места» конкурса «био/мол/текст»-2016.
Эта работа заняла первое место в номинации «Места» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Александр Коваленко.
Стереотипный «север»: короткий световой день, сильный ветер, бросающий в лицо путникам мелкий колючий снег, скудная еда и неулыбчивые люди. В этом смысле кампус МФТИ в Долгопрудном совсем на север не похож: высокие здания ограждают территорию от ветра, снег не всегда бывает даже к Новому году, есть солидный ресторан и несколько тысяч веселых студентов. Здесь, на территории кампуса, расположена лаборатория перспективных исследований мембранных белков. С десяток комнат в двух корпусах с первого этажа по пятый. От совсем новых, с запахом краски и свежей мебели, до уже видавших виды, пропахших реактивами и клеточной культурой. От комнат, где на столе не найти ничего сложнее центрифуги, до отдельных комнат с уникальными установками. Именно здесь постоянно решают важные вопросы (рис. 1), и не так часто — новые структуры белков.

Рисунок 1. Лаборатория в неполном составе. Всех, пожалуй, невозможно собрать, но мы очень старались.
фотография Евгения Пелевина (пресс-служба МФТИ)
Структура определяет функцию
Знать, как устроен исследуемый объект изнутри, всегда чрезвычайно круто — по структуре можно догадываться о том, на что он способен и какую имеет функцию. Особенно интересны в этом плане биологические полимеры: белки и нуклеиновые кислоты. Их функция критически важна как для нашего здоровья, так и для фундаментального понимания биологических процессов. Самый, пожалуй, значимый прорыв связан со структурой молекулы ДНК, которая объяснила механизм передачи генетической информации [1]. Так же и структура белков определяет, на что они способны: так, например, расположение специфичных групп на поверхности β2-адренорецептора [2] определяет его чувствительность только к адреналину (ну, почти).
Наверное, несложно догадаться, чем занимается лаборатория перспективных исследований мембранных белков? Тут весь ответ содержится в вопросе. Ответ на другой вопрос — «зачем она этим занимается?» — гораздо интереснее.
Во-первых, большинство мишеней для современных лекарств [3], [4] — мембранные белки (рис. 2), многие из которых, кстати, рецепторы, сопряженные с G-белком, прямо как уже упоминавшийся адренорецептор. Структура рецептора определяет его функцию: с какой молекулой он будет связываться и что делать дальше, передавая сигнал внутрь клетки, зачастую с помощью сигнального G-белка — посланника. Если мы знаем структуру рецептора (положение каждой аминокислоты в пространстве) и болезнь, с которой он ассоциирован, мы можем сильно уменьшить область экспериментального поиска для молекулы, влияющей на работу белков. А значит, искать лекарства от всех болезней конкретного заболевания — причем гораздо дешевле, имея в виду ошеломляющую стоимость в миллиарды долларов [5]. И это круто.
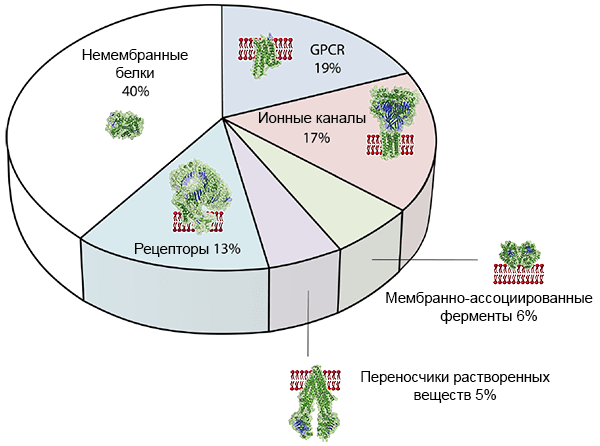
Рисунок 2. Человеческие мембранные белки как мишени для лекарств. GPCR — рецепторы, сопряженные с G-белком (G-protein coupled receptors).
[4], рисунок адаптирован
Во-вторых, среди мембранных белков встречаются весьма интересные «наноинструменты». Есть большой класс светочувствительных белков, умеющих перекачивать ионы с одной стороны мембраны на другую под действием света. Структура такого белка определяет его функцию: длину волны света, к которой чувствителен белок, и то, какой ион он переносит под действием света. Если мы знаем структуру светочувствительного белка, мы можем очень тонко подстроить, во-первых, длину волны, необходимую для работы белка, во-вторых, тип перекачиваемых ионов (рис. 3). Можно встроить несколько белков, отличающихся типом ионов и длиной волны активирующего света, в мембрану нервной клетки и лазерными лучами определенной длины контролировать проход сигнала вдоль мембраны. Именно этим, в общих чертах, занимается оптогенетика [6], которая в последнее время очень громко заявляет о себе (и даже получила метод года от Nature в 2010 и прорыв десятилетия от Science в 2010, а также Breakthrough Prize в 2016 году). А еще методами оптогенетики можно частично восстанавливать зрение [7], [8], слух, возможно, утерянную память, исследовать эпилепсию, болезни Паркинсона и Альцгеймера.
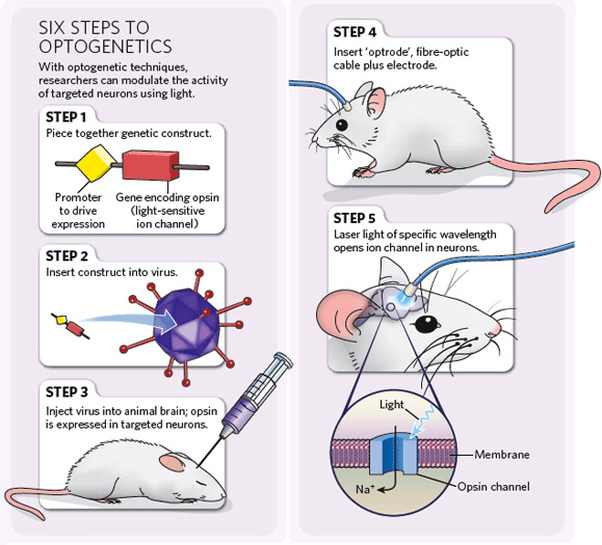
Рисунок 3. Схематичное изображение эксперимента по контролю отдельных нейронов в животном.
сайт etudogentemorta.com
Однако давайте посмотрим на человеческий геном. Там зашифровано около 25 000 генов [9] (значит, белков не меньше — один ген может кодировать несколько белков), и человечеству известна структура примерно 50% их продуктов. Среди всех белков около 7000 — мембранных, и человечеству известна структура примерно 3% из них. Сравнив 50% и 3%, делаем простой вывод: задача получения структуры мембранного белка очень сложная (200 известных структур против 14 000). И именно поэтому — интересная.
О чем молчат кристаллы
Рентгеновская кристаллография — пожалуй, самый «качественный» и распространенный на данный момент метод получения структуры белка. Качественный — по разрешению , которого он позволяет достигнуть. Распространенный — по количеству структур в Protein Data Bank (PDB) , полученных этим методом (почти 90%). Однако для получения структуры сначала требуется тщательным образом подготовить образец, а это обычно та еще морока (особенно с мембранными белками).
Разрешение — параметр «качества» экспериментальной структуры белка. Чем оно меньше, тем подробнее можно видеть структуру: разрешение в 10 ангстрем позволяет лишь рассмотреть четвертичную структуру, а разрешение меньше ангстрема на некоторых структурах позволяет рассмотреть различные конформации, которые принимают подвижные части молекулы (рис. 4).
Банк данных всех известных структур биомолекул, большинство из которых белки.
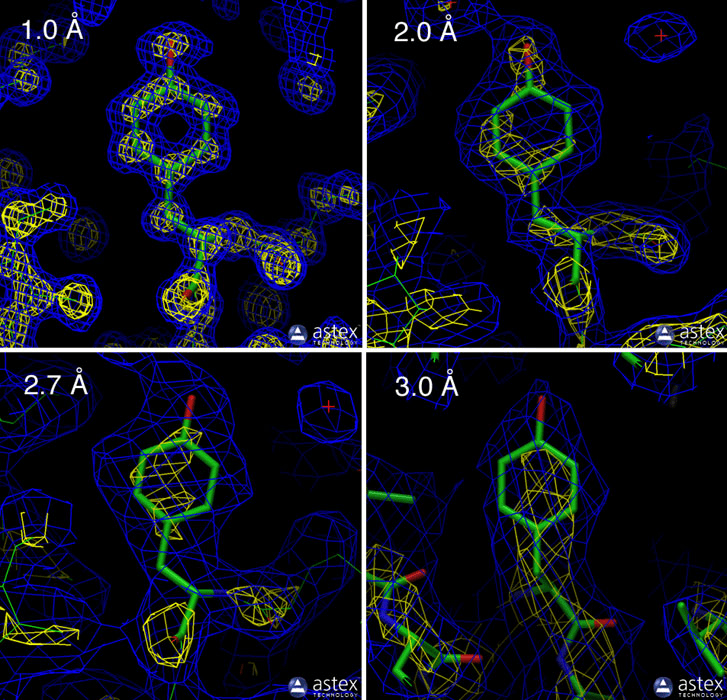
Рисунок 4. Карты электронной плотности для разного разрешения. При плохом разрешении (3 Å) мы можем только приблизительно «видеть» форму аминокислоты, и чаще всего в белке удается «отследить» только вторичную структуру. При среднем разрешении (2 Å) получается идентифицировать почти все аминокислоты. При высоком (1 Å) разрешении можно увидеть атомы водорода в наиболее полярных связях.
сайт slideplayer.com.br
Описанная ниже последовательность действий от наработки белка до получения кристалла и решения структуры — довольно общая для немногочисленных «мембранных» исследований в мире. За тем лишь исключением, что у нас в пределах одной лаборатории можно сделать всю последовательность, в то время как многие концентрируются только на нескольких его частях, теряя из виду всю картину и не имея возможности отойти от «конвейера». Однако в то же время не стоит думать, что работа рутинная, — исследование каждого нового белка рождает уникальные сложности, которые не решаются в штатном режиме и требуют творческого подхода.
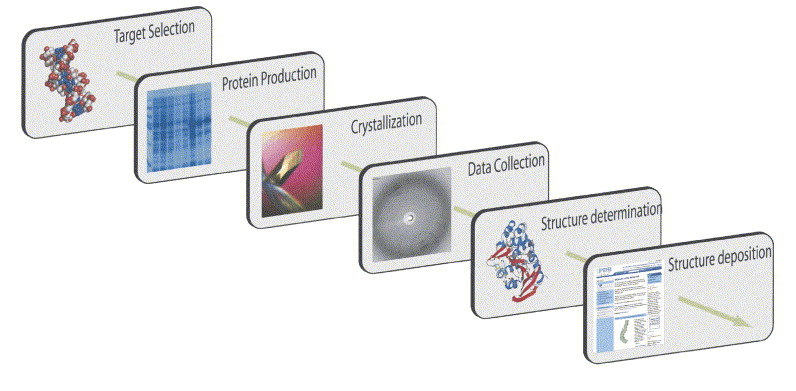
Рисунок 5. Схематичное изображение «конвейера» по получению структуры белка.
Мутанты на службе у кристаллографии
Для начала надо ввести ген нужного нам белка в удобный для наработки белка (микро)организм (неприхотливый, быстро размножающийся и не требующий особенных условий) и заставить его работать на нас, выделяя исследуемый белок в огромных количествах (до нескольких миллиграммов). Последнее получается далеко не сразу — экспрессия белка может банально не пойти в «чужом» организме (если мы, например, хотим наработать человеческий белок в кишечной палочке E. coli — она как раз-таки не требует особенных условий) или пойти с очень маленькой эффективностью, и тогда можно надолго застрять на этом чисто биотехнологическом этапе. Приходится исхитряться и видоизменять сами белки, чтобы экспрессия шла максимально продуктивно (рис. 6). Можно, например, делать белок максимально похожим на гомологичный белок, хорошо экспрессирующийся в E. coli, как мы недавно научились делать (подробнее про такой подход можно прочитать в пресс-релизе МФТИ [10], посвященном этому исследованию, или в оригинальной статье [11]).

Рисунок 6. Александра Лугинина. Официально она сотрудница лаборатории структурной биологии рецепторов, сопряженных с G-белком, но мы вообще не делим, кто из какой лаборатории, раз у нас общее рабочее пространство. В основном, Саша работает на этапе модификации белков, их выделения и кристаллизации, причем в более сложных — эукариотических системах.
фотография Евгения Пелевина (пресс-служба МФТИ)
Наработанный белок нужно аккуратно выделить из мутанта для дальнейшей кристаллизации. Тут снова проблемы: мембранные белки — большие неженки. Они устроены так, что часть белка, находящаяся внутри мембраны, гидрофобная, а все, что выставляется наружу — гидрофильное (если вам незнакомы эти слова, пожалуйста, прочитайте статью «Физическая водобоязнь» [12] на «биомолекуле»).
Если взять и вытащить белок из мембраны в раствор, он просто слипнется с другими гидрофобными частями белков, образуя ни на что не пригодные бесформенные комки. Поэтому необходимо вытащить его из клеточной мембраны (рис. 8) в какую-либо среду, похожую на нее по своим свойствам (по каким именно — читайте в статье «Липидный фундамент жизни» [13] на «биомолекуле»).

Рисунок 8. Типичные мембранные белки в своей родной среде обитания — липидном бислое, за пределами которого они теряют свою конформацию.
сайт исследовательской группы SimBac
«Порядочные» структуры
Тут следует пояснить, зачем мы вообще так упорно хотим получить кристалл и какие требования следует к нему предъявлять (если вы устали читать или любите схемы, стилизованные под карандашный эскиз, советуем отвлечься на введение в основы рентгеновской кристаллографии, изложенное в видео ниже).
Видео. Основы рентгеновской кристаллографии. Как рентгеновская кристаллография работает и почему мы ее используем.
Кристалл белка ничем не отличается от любого другого кристалла: в нем тоже есть элементарная ячейка (простейший элемент решетки кристалла, обычно состоящий из одной молекулы белка или небольшого комплекса из нескольких белков), которая затем при помощи параллельных переносов транслируется на все пространство (точнее, на весь кристалл, который имеет конечные размеры).
Держится кристалл обычно за счет водородных и ионных связей (освежить память по которым можно в статье «Роль слабых взаимодействий в биополимерах» [14]). Эти связи довольно слабые, что добавляет особой пикантности при работе с белковым кристаллом — часто есть риск неловким движением руки развалить то, что росло на протяжении нескольких месяцев.
То, что молекулы расположены в пространстве единообразно, многократно усиливает сигнал рассеяния рентгеновских лучей от одной элементарной ячейки, позволяя нам зарегистрировать сигнал, исходящий как будто бы от одной молекулы (получается некая «средняя по больнице» картина, на которой часто не видны наиболее гибкие и подвижные участки белка, зато большая часть молекулы хорошо различима). Чем упорядоченнее и больше кристалл, тем выше качество картины рассеяния, и тем точнее мы затем можем установить содержимое элементарной ячейки и искомую структуру белка.
Высокое искусство
Давайте допустим, что выделение белка прошло успешно, несколько пробирок с ним дожидаются эксперимента по кристаллизации. Тут, пожалуй, начинается самое интересное, ибо кристаллизация мембранных белков — скорее искусство, чем ремесло. Во-первых, проблема с белками-неженками остается: нельзя просто взять и сделать пересыщенный раствор белка и подождать, пока вырастет кристалл. Этот подход ломается уже на моменте «сделать пересыщенный раствор». Вернее, на моменте «сделать раствор» — мембранные белки, повторимся, нельзя доставать из мембраны, иначе нарушится их структура и вообще они слипнутся в непонятные комки.
Для решения проблемы приходится придумывать сложные методы доставки белка из мембраномоделирующей среды прямиком в кристалл. В далеком (для автора текста) 1996 году был предложен метод кристаллизации in meso [15] (а через год в Science была опубликована первая структура белка, полученная таким методом [16]). Этот метод получил название «кристаллизация при помощи липидных кубических фаз» (огромный вклад в развитие этого метода внесли Вадим Черезов и Валентин Горделий).
Суть метода в следующем. При определенных условиях липиды (моноолеин уж точно; его и используют обычно) образуют в пространстве упорядоченную структуру из мембран (рис. 9), причем такую, что до любой точки пространства можно добраться, не выходя из мембраны. Получается разлинованное двумерными слоями пространство, похожее на губку (одну из разновидностей таких структур даже по аналогии называют sponge phase). При росте кристалла белки в растворе не диффундируют свободно к нему (как было бы в случае с водорастворимыми белками), но передвигаются внутри мембраны к растущему кристаллу, не теряя нативной конформации.
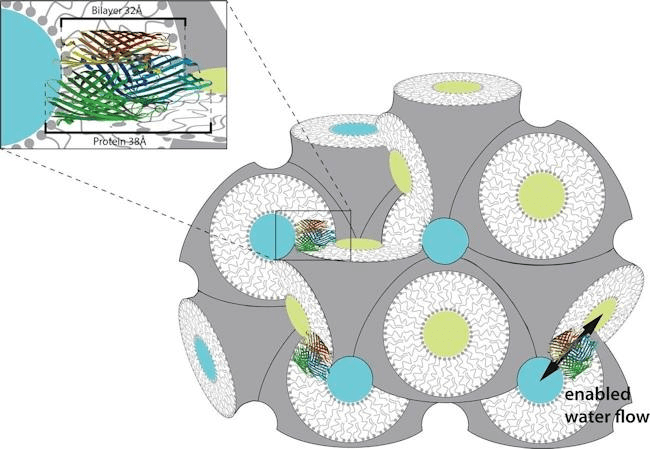
Рисунок 9. Художественное изображение липидной кубической фазы. Показана липидная кубическая фаза в разрезе. Белым показан липидный бислой, желтым и синим — несвязанные части, на которые фаза разделяет пространство. На увеличенной вставке — мембранный белок, встроенный в кубическую фазу так, что он может свободно «дрейфовать» по мембране к любой точке пространства.
сайт fsm.ethz.ch
Липидная фаза, однако, лишь малая часть успеха в кристаллизации. Нужно еще «запустить» рост кристалла в такой фазе, чтобы молекулам было куда стремиться по слоям губчатой фазы. Проблема обычно в следующем: кристаллы либо не растут в принципе, либо растут, но очень мелкие и/или плохо упорядоченные. Для «запуска» кристаллизации обычно перебирают огромное количество внешних условий: концентрации вспомогательных солей-осадителей, соотношение липид-вода, концентрация белка... Все это делается в кристаллизационных машинах (рис. 10) с ячейками объемом до нескольких десятков нанолитров, что позволяет перебирать бóльшее число условий на том же количестве белка. Далее машины размером с пару холодильников автоматически следят за ростом кристаллов в каждой отдельной ячейке.

Рисунок 10. People at work. С Сашей (вторая слева) вы уже знакомы — мы ходили за ней по пятам по разным комнатам, фотографируя что ни попадя. Когда пришли в кристаллизационную комнату, очень хотелось сфотографировать огромный кристаллизационный аппарат Formulatrix (здоровенный шкаф на заднем плане), но он оказался нефотогеничным. Зато удалось поймать интереснейший сюжет — настольный кристаллизационный аппарат при включении внезапно начал издавать не по инструкции громкий шум. Все сбежались и принялись дружно думать, что же с ним может быть не так. Технических подробностей мы не поняли, но сейчас вроде все в порядке.
фотография Евгения Пелевина (пресс-служба МФТИ)
Допустим, что условия подобраны правильно, и в кристаллизационном роботе вырос кристалл достаточного размера (рис. 11). Затем его со всеми предосторожностями отвозят на рентгеновскую установку (или несут, если она есть прямо в институте — МФТИ здесь сильно повезло, хотя для некоторых экспериментов мы все равно ездим на синхротрон), чтобы посмотреть рассеяние рентгеновского излучения на этом кристалле. Излучение крайне монохроматичное и жесткое, с длиной волны около одного ангстрема. Такое излучение рассеивается на электронах (точнее, на электронной плотности — сами электроны «размазаны» по молекуле в соответствии с принципом неопределенности), а упорядоченный кристалл дает четкую картину дифракции, по которой затем при помощи компьютерных методов рассчитывают структуру молекулы.

Рисунок 11. Кристаллы мембранных белков. а — Транспортер витамина B12. б — Адгезин Opca внешней мембраны бактерий. в — Холестерин. Последний — вообще не белок, но очень уж симпатичный.
фотографии Вадима Черезова (The Bridge Institute @ University of Southern California)
Коллеги по цеху
Справедливости ради скажем, что существуют и другие методы получения структуры биологических молекул: ЯМР-спектроскопия [17], особенно популярная в ХХ веке, и набирающая популярность криоэлектронная микроскопия — количество структур, решенных с ее помощью, удвоилось за последние пару лет. Оба они имеют свои преимущества — например, криоэлектронная микроскопия позволяет смотреть на структуры огромных белковых комплексов с разрешением до трех ангстрем (то есть увидеть вторичную структуру белка), а ЯМР умеет «смотреть» на динамику белка прямо в растворе [18], а не в неестественном для белка кристалле (правда, в случае мембранных белков окружение белка для ЯМР-исследований как минимум такое же неестественное, как и в кристалле). Однако они все еще уступают кристаллографии в разрешающей способности.
Принципы работы прекрасно объяснены авторами обзора [19], а проблемы и перспективы рассматриваются в колонке автора из Беркли [20].
У традиционной кристаллографии есть два принципиальных врага. Во-первых, очень сложно получить кристаллы приличного (скажем, десятки микрон) размера — просто для того, чтобы зарегистрировать достаточный сигнал рассеяния. Во-вторых, каждый кристалл под пучком рентгеновского излучения сильно повреждается (портится как структура всей решетки, так и отдельные молекулы), что немедленно портит картину дифракции. Чтобы с этим бороться, можно растить кристаллы больше или сильно увеличивать время эксперимента и уменьшать интенсивность, что не всегда хорошо сказывается на качестве данных. Однако опять-таки большие кристаллы растить проблематично (особенно для мембранных белков).
Обе эти проблемы в той или иной мере могут решить лазеры на свободных электронах (табл.) [21], [22], самый мощный из которых, к слову, начнет работу в январе 2017 года (рис. 12).
Во-первых, они генерируют очень короткие пучки (длиной от десяти фемтосекунд) — что позволяет снять картину дифракции до того, как будет нанесен какой-либо заметный урон кристаллу. Во-вторых, их светимость примерно в миллиард (!) раз больше, чем у традиционных синхротронных источников, что дает возможность снимать картину с кристаллов сильно меньшего размера [22].
| LCLS | SACLA | euXFEL | |
|---|---|---|---|
| Аббревиатура от... | Linac Coherent Light Source | The SPring-8 Angstrom Compact Free-Electron Laser | European X-Ray Free-Electron Laser |
| Местонахождение | Калифорния, США | Япония | Германия |
| Ввод в эксплуатацию | 2009 | 2011 | 2017 |
| Технология ускорителя | Нормальная проводимость | Нормальная проводимость | Суперпроводимость |
| Частота РЛСЭ, Гц | 120 | 60 | 27 000 |
| Минимальная длина волны, нм | 0,15 | 0,08 | 0,05 |
| Максимальная энергия электрона, млрд эВ (ГэВ) | 14,3 | 6–8 | 17,5 |
| Длина ускорителя, км | 3 | 0,75 | 3,4 |
| Число ондуляторов | 1 | 3 | 3 (возможно увеличение до 5) |
| Число экспериментальных станций | 3–5 | 4 | 6 (возможно увеличение до 10) |
| Пиковая светимость [фотоны / с / мм2 / мрад2/ 0,1% частоты] | 2 × 1033 | 1 × 1033 | 5 × 1033 |
| Средняя светимость [фотоны / сек / мм2 / мрад2/ 0,1% частоты] | 2,4 × 1022 | 1,5 × 1023 | 1,6 × 1025 |
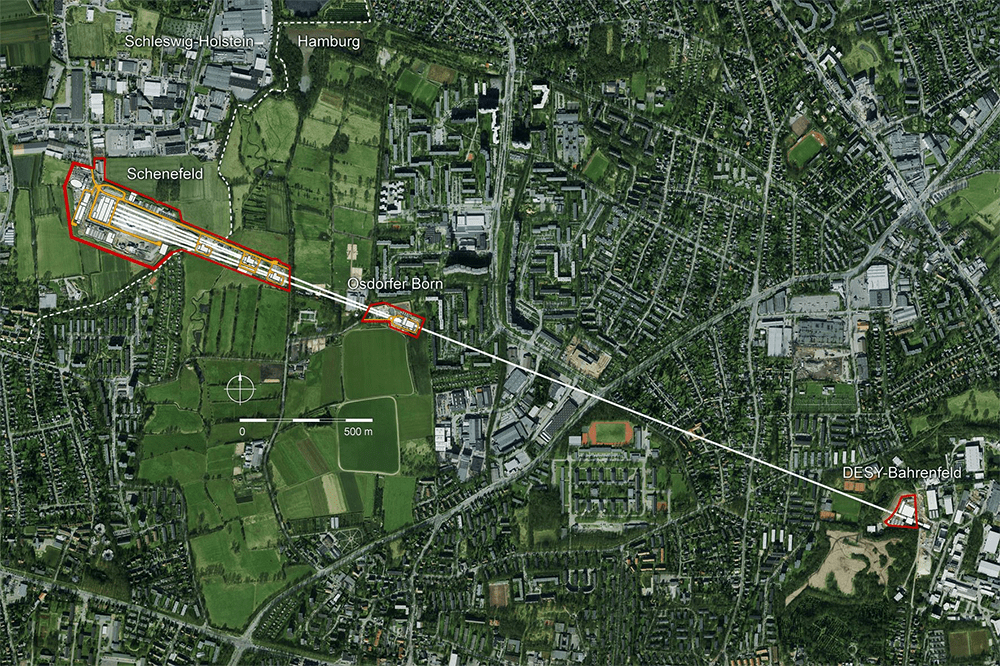
Рисунок 12. Планировка европейского лазера на свободных электронах euXFEL на базе синхротрона DESY в Гамбурге (Германия).
сайт desy.de
Стройное дерево исследований
Перечисленная последовательность (от гена до данных с синхротрона) — основа всех структурных исследований. Однако получение структуры — слишком идеальное окончание этого конвейера, и до нее получается довести не всегда. Часто не получается даже выделить белок из клетки (чего уж там говорить о кристаллизации). Когда получается, но до кристалла дело не доходит, приходится смотреть на белок другими способами. Кроме того, в кристалле белок может находиться не совсем в нативном состоянии, что, как правило, стараются исследовать другими методами. Кроме того, часто хочется посмотреть на то, как белок меняется при изменении внешних условий или как он ведет себя в растворе (или кубической фазе) — тогда можно будет понять, почему он не кристаллизуется, и получить-таки кристалл.
Японская двухплечевая
Рентгеновская установка Rigaku была собрана в лаборатории в 2011 году, причем на заказ — геометрия одной из частей (для малоуглового рассеяния) была модифицирована по просьбе и указаниям Александра Куклина из лаборатории нейтронной физики в Дубне, специалиста по малоугловому рассеянию нейтронов и сотрудника нашей лаборатории. После внесения модификаций по регламенту Rigaku должны были прислать своего инженера, чтобы проинструктировать ключевых сотрудников о том, как с установкой работать. В нашем случае, правда, получилось строго наоборот: специалист из Японии оказалась бывшей студенткой Куклина, и кроме экспресс-курса в малоугловое рассеяние получила еще немного ворчания по поводу ее познаний о принципах работы установки.
По центру находится источник рентгеновского излучения, который одновременно может использоваться двумя разными установками (рис. 13). Первая половина установки позволяет получать картину рассеяния для решения структур с разрешением порядка двух ангстрем (при хорошем кристалле). Эту половину используют для того, чтобы оценить, какие из выращенных кристаллов стоит везти на синхротронный эксперимент (время на эксперимент там жестко ограничено, поэтому нужно везти туда лучшие кристаллы), или для оптимизации кристаллизационных условий.

Рисунок 13. Алексей Власов, молодой специалист по малоугловому рассеянию. Работает в масштабах нанометров, а не ангстремов — изучает структуру белковых комплексов (каких, не говорит). Перед Алексеем открытая камера для малоуглового рассеяния — туда ставится образец, а рассеянное им излучение идет практически параллельно оптической оси в детектор (на заднем плане).
фотография Евгения Пелевина (пресс-служба МФТИ)
Интереснее возможности второй половины установки — они позволяют оценивать размеры и форму молекул (например, шарик, цилиндр или диск) прямо в растворах, запаянных в стеклянные капилляры, без получения кристаллов. Кроме того, установка активно используется при исследовании липидных кристаллизационных матриксов — она позволяет оценивать их параметры (геометрию, размер ячейки) для улучшения методов кристаллизации.
Побольше, пожалуйста, мне не видно!
Совершенно уникальная установка в лаборатории — наноскоп Carl Zeiss, собранный для Физтеха фактически под заказ по техническому заданию (рис. 14, 15). Наноскоп — потому что типичные рассматриваемые размеры не микрометры (как в микроскопе), а нанометры. Лаборатория получила возможность по частям собрать действительно уникальную установку, заточенную под микроскопию сверхвысокого разрешения и одномолекулярную микроскопию [23], [24]. Уникальную просто потому, что второй такой нет в мире. Честно. А еще потому, что список возможностей установки и дополнительного оборудования (FRAP-микроскопия, флуоресцентная микроскопия [24], SHG-установка, FLIM-микроскопия, PALM и 3D-PALM, FCS и FCSS) получился весьма впечатляющий. Совершенно великолепная машина.

Рисунок 14. Совершенно великолепная машина — наноскоп Carl Zeiss.
фотография Евгения Пелевина (пресс-служба МФТИ)

Рисунок 15. Валентин Борщевский, руководитель группы микроскопии сверхвысокого разрешения. Кроме интереса к кристаллографии, несколько лет назад заинтересовался микроскопией: «Машина появилась из-за давнишнего интереса лаборатории к микроксопии и была запланирована с первых дней работы. После ее появления интерес и возможности идут рука об руку».
фотография Евгения Пелевина (пресс-служба МФТИ)
Наноскоп получился настолько сложным, что первый раз его собрали в Carl Zeiss, разобрали и по частям перевезли в Россию. И потихоньку начали собирать здесь, силами приглашенных и местных инженеров. Работа с установкой до сих пор идет — ставятся как запланированные части, так и новые. Однако большинство фишек уже доступно для работы, и даже есть первые исследования, проведенные с его помощью (ниже в тексте).
История лаборатории: впору получать паспорт
У лаборатории довольно сложная история, и тут без поллитра завлаба не разберешься. Сначала одинокая, лаборатория с некоторого момента породила коллаборацию родственных лабораторий на Физтехе, проповедующих схожие методы исследований с разными целями. Не без труда автору этого текста удалось выяснить, во что это вылилось и как сделать из одной лаборатории примерно шесть.
История, пожалуй, началась в конце 90-х, когда на Физтехе был создан Центр биофизики и физикохимии надмолекулярных структур под руководством Валентина Ивановича Горделия (рис. 16).

Рисунок 16. Валентин Иванович Горделий, зам. заведующего лабораторией перспективных исследований мембранных белков, на встрече в исследовательском центре г. Юлиха (Германия) в январе 2016 года. Скоро будет заключен новый договор о сотрудничестве центра и нашей лаборатории, и он очень рад происходящему. Но тщательно скрывает это.
фотография Евгения Пелевина (пресс-служба МФТИ)
Создание Центра было активно поддержано не только руководством МФТИ, но и Исследовательским центром г. Юлиха (Forschungszentrum Jülich или просто FZJ). Лучше всего об этом прочитать в интервью 2007 года с Валентином Горделием для «Русского Журнала» — он подробно рассказывает о том, сколько весило оборудование, фактически подаренное FZJ Физтеху, и с какими проблемами пришлось столкнуться при открытии Центра:
Р.Ж.: Что больше всего угнетает?
В.Г.: То, с каким трудом приходится объяснять иностранцам наши проблемы, которые, конечно, не всегда зависят от ученых.
В 2011 году МФТИ получил финансирование на создание новой лаборатории, заделом для которой послужил центр биофизики. Новая лаборатория — это лаборатория перспективных исследований мембранных белков, заведующий — профессор Георг Бюльдт (Georg Büldt), на тот момент директор Института молекулярной биофизики (Institute of Complex Systems-5) в FZJ (рис. 17).
Здесь наступил еще один важный этап нашей истории.

Рисунок 17. Георг Бюльдт, давний коллега Валентина Горделия (начало их дружбы теряется в неизвестных автору текста восьмидесятых). Бессменный заведующий лабораторией перспективных исследований мембранных белков, директор Института молекулярной биофизики Исследовательского центра г. Юлиха.
фотография Евгения Пелевина (пресс-служба МФТИ)
Нужно больше лабораторий
В 2014 году были созданы еще две лаборатории, связанные с исследованиями мембранных белков.

Рисунок 18. Вадим Геннадьевич Черезов , заведующий лабораторией структурной биологии рецепторов, сопряженных с G-белком, и ужасно харизматичный человек. Один из первых аспирантов Валентина Горделия, уехавший в Америку в конце девяностых, теперь заведует лабораторией в МФТИ.
фотография Евгения Пелевина (пресс-служба МФТИ)
Первая — лаборатория структурной биологии рецепторов, сопряженных с G-белком под руководством Вадима Черезова (рис. 18). Вадим — физтех, один из первых аспирантов Валентина Горделия, заведующий лабораторией и заместитель директора института Бридж Университета Южной Калифорнии. Вадим участвовал в решении структур GPCR-белков вместе с Брайаном Кобилкой, нобелевским лауреатом на пару с Реем Стивенсом (про взаимосвязь исследований Кобилки и Черезова последний рассказывает в кратком интервью «Науке и технологиям России», а обзор Нобелевской премии-2012 есть в материале «биомолекулы» «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [25]).

Рисунок 19. Владимир Викторович Чупин, заведующий кафедрой биофизики на Физтехе и заведующий лабораторией физики и химии липидов там же. Прекрасный ученый и добрый заведующий кафедрой, с легкостью решающий проблемы нерадивых студентов (и радивых тоже — прим. автора).
фотография Евгения Пелевина (пресс-служба МФТИ)
Направление исследований, пожалуй, понятно из названия (отличительная черта коллаборации лабораторий). Группы Горделия и Черезова во многом схожи в методах исследований, хотя с тех пор, как Черезов уехал в Америку в начале девяностых, оба они развили достаточно самобытные методики работы с белками. Общие направления исследований тоже немного разные — Горделий идет в сторону светочувствительных белков и оптогенетики, а Черезова занимают GPCR-рецепторы (если вам интересны подробности об этих сверхважных мембранных белках, советуем ознакомиться со статьями по этой теме на «биомолекуле» [26], [27]).
Кроме того, в 2014 году к коллаборации присоединился Владимир Чупин (рис. 19), работавший до этого в лаборатории биомолекулярной ЯМР-спектроскопии [17] в Институте биоорганической химии РАН. Специализирующийся на химии липидов, Чупин в 2014 году стал заведующим лаборатории физики и химии липидов, изучающей мембраномоделирующие среды — необходимый инструмент для кристаллизации и других исследований мембранных белков, ибо их вплоть до получения кристаллов желательно все время держать в билипидном слое, иначе они быстро превратятся в неинтересный набор аминокислот с совершенно другой структурой (или вообще без нее). Липидные фазы, кристаллизация in meso, синтез липидов для модификации фаз — все здесь.
Наконец, в 2014 году на факультете общей и прикладной физики (ФОПФ МФТИ) открыли кафедру биофизики, отделившуюся от кафедры технологии наноструктур. Заведующим кафедрой стал Владимир Чупин, а основной задачей — обеспечить студентов знаниями, необходимыми для научной деятельности в области биофизики. Кроме учебы, студенты кафедры довольно рано начинают заниматься научной работой не только в наших лабораториях, но и в ведущих исследовательских институтах Москвы — ИБХ РАН, Институт электрохимии, НИИ «Генетика». Студенты во время учебы (или летом) проходят стажировки в Forschungszentrum Jülich (Германия), институте Бридж Университета Южной Калифорнии(США), EPFL (Швейцария), научно-исследовательском институте IBS (Франция), проводят измерения на синхротронах ESRF (Франция) или DESY (Германия). На правах рекламы: кафедра ведет набор студентов в бакалавриат, магистратуру и аспирантуру. По всем вопросам можно писать на адрес vvchupin@gmail.com.
Промежуточные итоги
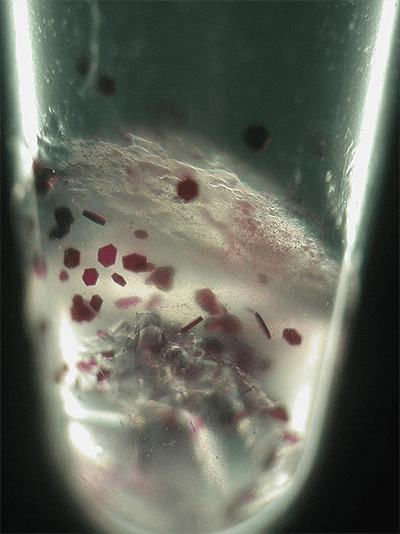
Рисунок 20. Кристаллы бактериородопсина в пробирке. На мембране бактерий бактериородопсин иногда собирается в целые домены (называемые пурпурными мембранами), часто окрашивая бактерию в необычный фиолетовый цвет.
фотография Валентина Борщевского (лаборатория перспективных исследований мембранных белков)
За несколько лет было завершено много достойных проектов, но подробнее нам хочется рассказать про один из них — исследование молекулярного механизма переноса протона в бактериородопсине.
Бактериородопсин (мембранный белок аж из архей, очень древний, перекачивающий протон с одной стороны клеточной мембраны на другую), известен человечеству вот уже более 40 лет [28]. За это время его удалось хорошо изучить: в частности, удалось посмотреть на то, через сколько промежуточных состояний он проходит при передаче протона. Выяснилось, что их там шесть [29]. Были получены структуры каждого из этих шести состояний, различающиеся, однако, у разных исследовательских групп принципиально. Причина была не ясна.
Если быть точным, бактериородопсины — семейство белков, похожих на человеческий родопсин [30], но бактериальных. И те, и другие белки содержат светочувствительный кофактор ретиналь, но выполняют разную функцию — у человека под действием света родопсины принимают сигнал и помогают нам видеть, а у бактерий просто передают протон через мембрану.
Перво-наперво нам удалось выяснить, почему большинство опубликованных на тот момент структур переходных состояний совершенно неинформативны (в смысле понимания того, как устроен активный центр в этом состоянии). Не вдаваясь в подробности, дело оказалось в том, что кристаллы, получающиеся у многих групп, имели характерный дефект роста кристаллов, делающий адекватный анализ состояний невозможным [31]. Группе во главе с Валентином Горделием и при участии тогда еще молодого Валентина Борщевского удалось получить кристалл без дефекта (рис. 20) и проанализировать механизм работы белка.
Однако было понятно, что дефектные кристаллы — не единственная помеха на пути к пониманию всех состояний бактериородопсина. Проблема (общая, впрочем, для кристаллографии) в том, что мощный пучок рентгеновского излучения сильно вредит кристаллу и искажает структуру белка, даже если импульс излучения довольно короткий и кристалл заморожен до криотемпературы. Это не мешает решить структуру, но вредит таким тонким вещам, как состояние активных центров — они гораздо чувствительнее к излучению и начинают рушиться при небольших [32] и очень небольших [33] интенсивностях. Довольно нескоро, но нам удалось справиться с этим достаточно пакостным эффектом и получить структуры всех состояний бактериородопсина от того момента, как он ловит фотон, до выброса протона.
Молодежные лаборатории по изучению старения
Новый виток развития коллаборации произошел в конце 2015 года. Объявили о создании Центра исследований молекулярных механизмов старения и возрастных заболеваний на основе существующих лабораторий (GPCR-ы, физика липидов, мембранные белки) плюс запланировали создать еще три лаборатории под руководством зарубежных ученых (рис. 21) (подробнее можно прочитать в пресс-релизе МФТИ [34] об открытии Центра). Направления исследований вытекают прямо из интереса к мембранным белкам: болезнь Альцгеймера (она плотно связана с пептидом, отщепляющимся от мембранного белка [35]) и оптогенетика (которая позволяет активировать отдельные нейроны, а это уже путь к исследованию нейродегенеративных заболеваний). Планы, признаться, грандиозные.

Рисунок 21. Иностранные ученые, активно участвующие в жизни Центра старения. а — Профессор Института биофизики Макса Планка Эрнст Бамберг. Активно участвует в оптогенетической деятельности Центра. б — Профессор Норберт Денчер из Института биофизики Технического университета в Дармштадте. Участвует в формулировке и решении задач по исследованию старения. в — Профессор Рей Стивенс, директор-основатель института Бридж Университета Южной Калифорнии, директор-основатель института iHuman в Шанхае. Консультирует и поддерживает исследования рецепторов, сопряженных с G-белком.
фотографии Евгения Пелевина (пресс-служба МФТИ)
Кроме лабораторий запланировали создание несколько групп — не настолько масштабных, но тоже значительных. Во-первых, работающие с наноскопом ученые объединились в группу спектроскопии сверхвысокого разрешения под руководством Валентина Борщевского. Во-вторых, выделилась группа талантливых молекулярных биологов под руководством молодого Виталия Шевченко. В третьих, талантливый Иван Гущин получил грант на открытие молодежной (по возрасту заведующего) лаборатории и решил заняться структурным анализом и дизайном белковых структур — немного о том, что можно делать с белками после того, как мы узнаем их структуру. Направление исследований комплементарно кристаллографии и вовсю использует ее методы, однако несколько шире идеологически и мощно задействует компьютерные методы моделирования [36].
Новейшая история
К тому моменту, как стало известно о создании Центра по изучению старения и всего такого, вышли две интереснейшие работы сразу по двум направлениям. Одно из них близко к оптогенетике, другое вовсю использует навороченный наноскоп Carl Zeiss.
Во-первых, у нас получилось решить структуру белка KR2 светочувствительного натриевого насоса из морской бактерии Krokinobacter eikastus (рис. 22) [37], [38]. Интерес в том, что под воздействием света этот белок, сидящий на мембране клетки, начинает выкачивать из нее ионы натрия (после определенных манипуляций с белком). До появления KR2 для нужд оптогенетики использовали протонные помпы, галородопсин и канальный родопсин. Мы же надеемся, что KR2 станет новым инструментом для оптогенетики.
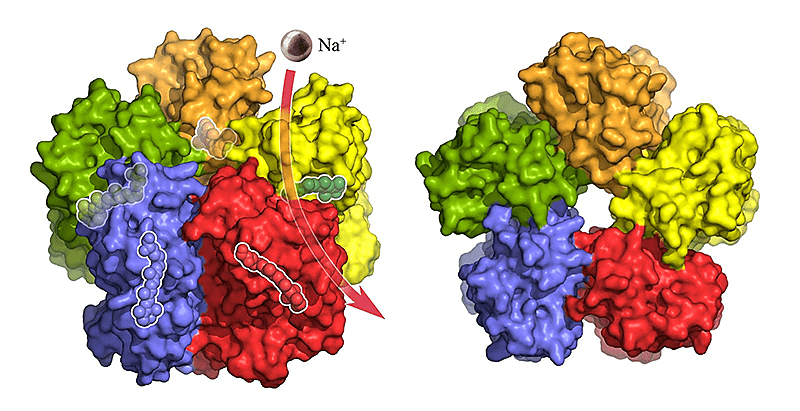
Рисунок 22. Мембранный белок KR2 умеет выкачивать натрий из клетки под действием света.
Forschungszentrum Jülich/IBS Grenoble
Вместе с коллегами из Юлиха, Гренобля и Франкфурта нам удалось не только получить структуру белка, но и, используя ее, модифицировать белок так, чтобы он пропускал через себя не натрий, а калий, делая физиологические изменения в клетке еще мягче и позволяя изменять мембранный потенциал незаметно для нейрона. Рациональный подход (решим структуру, посмотрим на нее и немного подумаем), примененный для получения мутантного KR2, выглядит весьма перспективным для дизайна инструментов для оптогенетики.
Во-вторых, у группы под руководством Валентина Борщевского получилось с помощью наноскопа посмотреть за ростом кристаллов уже упомянутого бактериородопсина при кристаллизации в липидной фазе. Оказалось, что они растут по механизму переконденсации — вещество для роста больших кристаллов поступает не из раствора, а из кристаллов поменьше, расположенных неподалеку (рис. 23). Получается, что большие кристаллы как бы «поедают» те, что поменьше, занимаясь каннибализмом под наблюдением наноскопа (подробно об этом можно прочитать в пресс-релизе на сайте МФТИ [39] или прямо в оригинальном исследовании [40]).

Рисунок 23. Вокруг большого кристалла в центре хорошо видна «обедненная зона» — в ней нет больших ярких кристаллов, только совсем маленькие. Кадр, сделанный при помощи наноскопа, хорошо подтверждает механизм кристаллизации.
фотография Валентина Борщевского (лаборатория перспективных исследований мембранных белков)
Заключение
Несмотря на то, что за недолгое время существования лаборатории у нас получилось завершить несколько значимых проектов, есть ощущение, что вся история только начинается. Открытие новых лабораторий (о которых вы еще прочитаете в рубрике «Места»), освоение новых направлений — удивительная, захватывающая пора. Нужно будет устанавливать новое оборудование, обустраивать рабочие места и развешивать имеющиеcя постеры по стенам. Рассказывать новым студентам о том, чем же конкретно мы собираемся заниматься и почему именно на нас стоит обратить внимание при выборе лаборатории. Рассказывать об этом широкой публике, не обходя стороной и научное сообщество. Обсуждать новые проекты и обрабатывать накопленные данные. И конечно, получать колоссальное удовольствие от происходящего.
Если вы считаете, что именно ваших знаний и навыков не хватает нашей лаборатории, и хотите присоединиться к нам — отправляйте резюме на borshchevskiy.vi@mipt.ru с темой «Биомолекула».
Литература
- Watson J.D. and Crick F.H. (1953). A structure for deoxyribose nucleic acid. Nature. 171, 737–738;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Yildirim M.A., Goh K.I., Cusick M.E., Barabási A.L., Vidal M. (2007). Drug-target network. Nat. Biotechnol. 25, 1119–1126;
- Tiefenauer L. and Demarche S. (2012). Challenges in the development of functional assays of membrane proteins. Materials. 5, 2205–2242;
- Hughes J.P., Rees S., Kalindjian S.B., Philpott K.L. (2011). Principles of early drug discovery. Br. J. Pharmacol. 162, 1239–1249;
- Светлая голова;
- Busskamp V., Picaud S., Sahel J.A., Roska B. (2012). Optogenetic therapy for retinitis pigmentosa. Gene Ther. 19, 169–175;
- Оптогенетика + голография = прозрение?;
- В полку генов убыло;
- Биофизики МФТИ вместе со своими зарубежными коллегами научились быстро синтезировать ценные белки с помощью химер. (2015). «Импульс»;
- Bratanov D., Balandin T., Round E., Shevchenko V., Gushchin I., Polovinkin V. et al. (2015). An approach to heterologous expression of membrane proteins. The case of bacteriorhodopsin. PLoS One. 10, e0128390;
- Физическая водобоязнь;
- Липидный фундамент жизни;
- Роль слабых взаимодействий в биополимерах;
- Landau E.M. and Rosenbusch J.P. (1996). Lipidic cubic phases: a novel concept for the crystallization of membrane proteins. Proc. Natl. Acad. Sci. USA. 93, 14532–14535;
- Pebay-Peyroula E., Rummel G., Rosenbusch J.P., Landau E.M. (1997). X-ray structure of bacteriorhodopsin at 2.5 angstroms from microcrystals grown in lipidic cubic phases. Science. 277, 1676–1681;
- Сверхпроводящие магниты и рецепторы биомембран: Лаборатория биомолекулярной ЯМР-спектроскопии ИБХ РАН;
- Mineev K.S., Goncharuk S.A., Kuzmichev P.K., Vilar M., Arseniev A.S. (2015). NMR dynamics of transmembrane and intracellular domains of p75NTR in lipid-protein nanodiscs. Biophys. J. 109, 772–782;
- Cheng Y. (2015). Single-particle cryo-EM at crystallographic resolution. Cell. 161, 450–457;
- Glaeser R.M. (2016). How good can cryo-EM become? Nat. Methods. 13, 28–32;
- Фемтосекундные рентгеновские лазеры — кристаллография будущего;
- McNeil B.W. and Thompson N.R. (2010). X-ray free-electron lasers. Nat. Photonics. 4, 814–821;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Рецептор медиатора настроения;
- Структуры рецепторов GPCR «в копилку»;
- Oesterhelt D. and Stoeckenius W. (1971). Rhodopsin-like protein from the purple membrane of Halobacterium halobium. Nat. New Biol. 233, 149–152;
- Garczarek F. and Gerwert K. (2006). Functional waters in intraprotein proton transfer monitored by FTIR difference spectroscopy. Nature. 439, 109–112;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Borshchevskiy V., Efremov R., Moiseeva E., Büldt G., Gordeliy V. (2010). Overcoming merohedral twinning in crystals of bacteriorhodopsin grown in lipidic mesophase. Acta Crystallogr. D. Biol. Crystallogr. 66, 26–32;
- Borshchevskiy V.I., Round E.S., Popov A.N., Büldt G., Gordeliy V.I. (2011). X-ray-radiation-induced changes in bacteriorhodopsin structure. J. Mol. Biol. 409, 813–825;
- Borshchevskiy V., Round E., Erofeev I., Weik M., Ishchenko A., Gushchin I. et al. (2014). Low-dose X-ray radiation induces structural alterations in proteins. Acta Crystallogr. D. Biol. Crystallogr. 70, 2675–2685;
- Центр исследований молекулярных механизмов старения и возрастных заболеваний создается на базе шести лабораторий МФТИ. (2015). «Импульс»;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- В МФТИ научились моделировать поведение клеточных мембран для предсказания влияния лекарств и ядов. (2016). «Импульс»;
- Универсальный «переключатель» для светочувствительных клеток. (2015). «Импульс»;
- Gushchin I., Shevchenko V., Polovinkin V., Kovalev K., Alekseev A., Round E. et al. (2015). Crystal structure of a light-driven sodium pump. Nat. Struct. Mol. Biol. 22, 390–395;
- Кристаллы бактериородопсина поедают мелких собратьев. (2015). «Импульс»;
- Bogorodskiy A., Frolov F., Mishin A., Round E., Polovinkin V., Cherezov V. et al. (2015). Nucleation and growth of membrane protein crystals in meso — a fluorescence microscopy study. Cryst. Growth Des. 15, 5656–5660;
- Sorensen T.L., McAuley K.E., Flaig R., Duke E.M. (2006). New light for science: synchrotron radiation in structural medicine. Trends Biotechnol. 24, 500–508.






