
Светящиеся таблетки: предложен новый способ хранить и идентифицировать бактериофаги, а также делиться ими
19 августа 2024
Светящиеся таблетки: предложен новый способ хранить и идентифицировать бактериофаги, а также делиться ими
- 457
- 0
- 4
-
Автор
-
Редакторы
Бактериофагам давно прочат роль главной альтернативы антибиотикам. Но с их применением в медицине есть немало сложностей. Например, фаготерапию нужно подбирать индивидуально для каждого пациента, но не существует простого и быстрого способа проверить чувствительность бактерий к вирусам. К тому же коллекции фагов разбросаны по разным организациям и нет единой централизованной системы. Поэтому учёным сложно быстро обмениваться образцами тех или иных фагов. Решение этих проблем предложили канадские исследователи из Макмастерского университета и университета Лаваля. Они «упаковали» фаги вместе с некоторыми реагентами в таблетки и поместили в планшеты размером с книгу. Эти «карманные хранилища» не сильно требовательны к условиям хранения и транспортировки и позволяют проанализировать чувствительность патогенных бактерий к фагам за 30–120 минут. О своей разработке ученые рассказали в июльском выпуске Nature Communications.
Последнее время слово «бактериофаг» всё чаще звучит в научных, врачебных кругах и врывается в общественное пространство. «Биомолекула» тоже не осталась в стороне: на сайте появился целый спецпроект, посвященный вирусам бактерий [1-3]. Это неудивительно: ведь проблема антибиотикорезистентности никуда не делась, а лишь продолжает нарастать. Альтернативы антибиотикам по-прежнему нужны, и фаготерапия выглядит весьма привлекательным кандидатом.
Фаги хороши во многих отношениях: они довольно эффективно уничтожают патогенные бактерии (в том числе устойчивые к антибактериальной терапии), действуют избирательно, не нарушая нормальную микрофлору. Максимально безопасны для организма человека. Подробнее о прелестях их медицинского применения можно почитать в материале «Бактериофаги в медицине» [3].
Но есть и немалые сложности [4]. Например, узкая специфичность фагов, хотя и является в целом их преимуществом, часто становится помехой. Многие из этих вирусов атакуют бактерии не просто одного вида, а отдельных штаммов [5]. Как следствие, фаготерапия должна быть персонализированной, то есть для каждого пациента нужно подбирать свою комбинацию бактериофагов.
Фаговый коктейль — это готовый лекарственный препарат. Каждое новое лекарство нужно проверять в клинических исследованиях и регистрировать. Обычно на это уходят годы, и требуются немалые финансовые вложения (подробно о клинических исследованиях — в материале «Путь к тысячам аптек начинается с одной молекулы» [6]). Понятное дело, для каждого пациента так делать никто не станет, да и сам пациент при таком подходе может не дождаться лечения. О том, как пытаются решать эту проблему, мы рассказывали в статье «Бактериофаги для отделения интенсивной терапии: российские исследователи проверили новый подход» [7].
Но даже если бы не было бюрократических сложностей, подбор фагов для персонализированной терапии — всё равно довольно сложная задача в техническом плане. Во-первых, неплохо было бы иметь какие-то большие централизованные библиотеки, где хранилось бы много разных видов фагов. Пока таких нет. Точнее, библиотеки-то в разных странах есть, но разрозненные. Между ними зачастую не налажено сотрудничество и из-за этого общая коллекция вирусов довольно «разношерстная». Например, в России свои коллекции фагов представлены в НПЦ «Микромир», НПО «Микроген», ИБХ РАН, ФИЦ Биотехнологии РАН, ИХБФМ СО РАН, ФНКЦ ФХМ.
Во-вторых, не так-то просто выбрать подходящие фаги среди сотен образцов, хранящихся в библиотеках. Современные методики довольно долгие и трудоемкие. Например, золотым стандартом считается спот-тест. Суть его в том, что на агаровую чашку с газоном чувствительной культуры бактерий наносят капли из соответствующего разведения образца бактериофага и оценивают активность вирусов по степени лизиса бактериального штамма [8]. Проблема в том, что спот-тест требует довольно длительной инкубации — от 6 часов до нескольких суток [9]. Другие тесты тоже не идеальны, и их результаты не всегда отражают то, насколько хорошо фаги будут работать в организме человека. Наконец, при хранении и транспортировке фагов нужно соблюдать определенные условия, что создаёт отдельные сложности.
Для преодоления вышеупомянутых проблем персонализированной фаготерапии требуется эффективное решение, а именно надежная и быстрая высокопроизводительная технология с долговечными и портативными реагентами для анализа, которые можно легко отправлять по всему миру для использования в месте оказания помощи с минимальной инфраструктурой или обучением персонала.
Вирусы + бактерии + светлячки
Ученые решили обратить внимание на биохимические методы исследования. Ведь когда бактерии разрушаются во время фаговой инфекции, выделяются определенные вещества. И по ним можно косвенно не только обнаружить лизис, но и судить о его активности.
В качестве такой молекулы-маркера был выбран аденозинтрифосфат (АТФ, рис. 1). Его легко обнаружить с помощью биолюминесцентного соединения люциферина и фермента светлячков люциферазы.
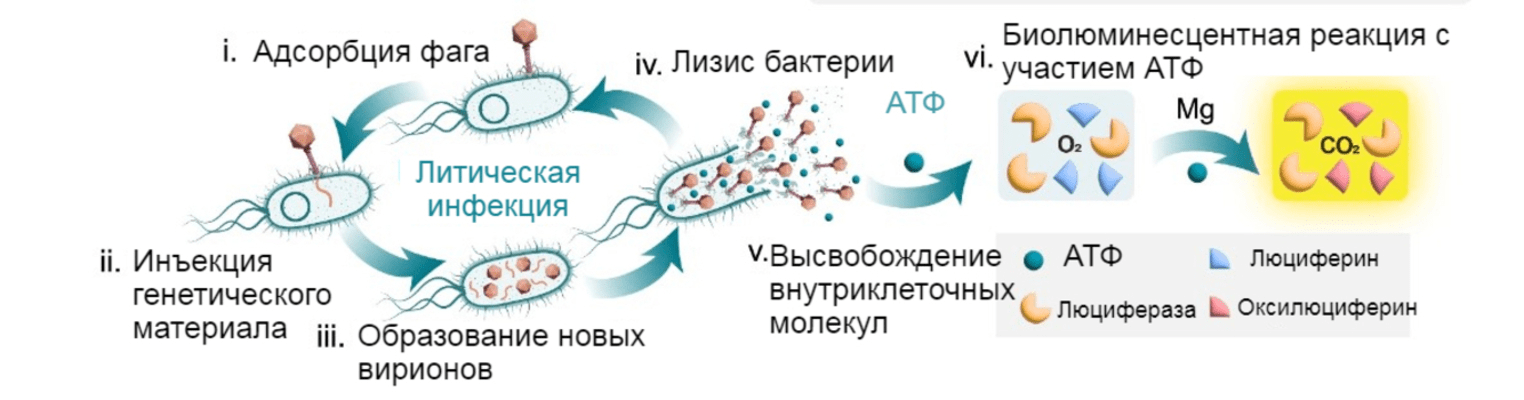
Рисунок 1. Обнаружения лизиса бактерий бактериофагами по выходу из клеток АТФ.
Бактериофаг сталкивается с клеткой-хозяином, прикрепляется к определенным рецепторам (i) и вводит внутрь свой генетический материал (ii). Далее происходит цепочка событий, в результате которой вирус превращает жертву в «фабрику» по производству новых фаговых частиц (iii), что в конечном счете приводит к лизису клетки-хозяина (iv), высвобождению потомства фага и выбросу молекул АТФ (v). АТФ реагирует с люциферином, образуя аденилат люциферина, который окисляется ферментом люциферазой в присутствии магния с образованием оксилюциферина, CO2 и аденозинмонофосфата (АМФ). В итоге возникает свечение (vi).
Люциферин начинает светиться, когда окисляется — таков принцип биолюминесценции [10]. Но сам он реагирует с кислородом очень медленно. Чтобы ускорить этот процесс и «пришить» к реакции АТФ, выделяющуюся при лизисе бактерий, как раз и нужна люцифераза. Она катализирует реакцию, проходящую в две стадии:
- Сначала люциферин реагирует с АТФ, и получаются люцифериладенилат и неорганический пирофосфат (PPi).
- Затем люцифериладенилат реагирует с кислородом, в итоге образуются оксилюциферин, аденозинмонофосфат и выделяется свет. Если бактериальная культура светится, значит, там вовсю орудуют фаги, и их стоит применять у человека с инфекцией, вызванной такими же микроорганизмами (рис. 2).
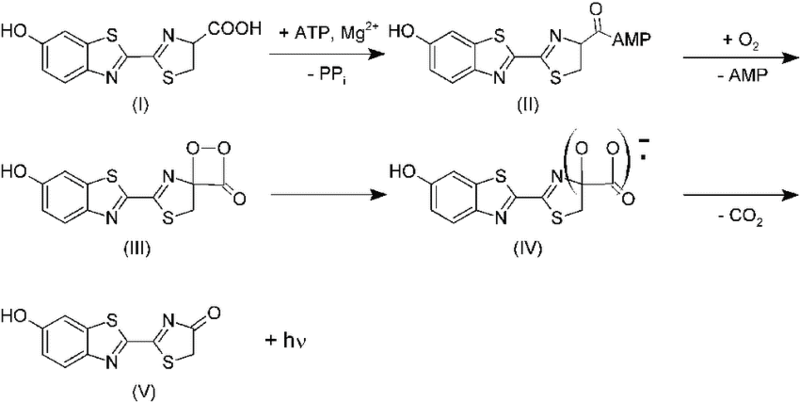
Рисунок 2. Вот что на самом деле вызывает ночное сияние светлячков.
Люциферин (I) реагирует с АТФ: в итоге высвобождается неорганический пирофосфат (PPi) и образуется люцифериладенилат (II). Последний реагирует с кислородом: высвобождается АМФ и образуется промежуточный продукт — диоксетанон (III). Он декарбоксилируется с образованием оксилюциферина (V) в синглетном возбужденном состоянии. В финале оксилюциферин испускает фотон света.).
Но с этой реакцией не всё так просто. Люцифераза — фермент термолабильный. При температурах выше 30 °C она очень быстро теряет активность. А в теле человека такой низкой температуры не бывает — наоборот, во время инфекций она повышается. Если проводить анализ при более низких температурах, то по реакции «в пробирке» нельзя судить о том, что будет происходить в организме.
Да и для бактериальных патогенов оптимальная температура обычно составляет 37 °C. В таких условиях у них активно протекают метаболизм и размножение. Соответственно, и литическая активность фагов будет высока.
Вторая большая сложность в том, что все современные анализы для обнаружения АТФ требуют поэтапного добавления компонентов. Из-за этого проверка фагов усложняется, снижается пропускная способность.
Оптимизация технологии
Для начала авторы работы решили проверить, можно ли не добавлять компоненты поэтапно, а сделать всё «в одной чашке», сразу смешав бактерии и с фагами, и со всеми реагентами.
Оказалось, что это вполне реально. Несмотря на то, что люцифераза постепенно инактивировалась, анализ помог не только отличить инфицированные культуры от неинфицированных, но и различить эффекты фагов с высокой, умеренной и низкой литической активностью. Для этого, соответственно, использовали вирусы P32, JG004 и PP7, инфицирующие синегнойные палочки. Такого результата получалось добиваться даже при изначально низком титре бактериофагов.
Дальше предстояло решить проблему быстрой инактивации фермента люциферазы при высоких температурах. Исследователи вспомнили, что есть полисахарид пуллулан, способный защищать биомолекулы от высоких температур. И дисахарид трегалоза, защищающий бактериофаги от высыхания.
Авторы взяли суспензию фагов, лиофилизированные реагенты для обнаружения АТФ, пуллулан и трегалозу; всё смешали и добавили к культурам бактерий. Там, где вирусы успешно инфицировали и разрушали своих жертв, свечение было таким же сильным и появлялось так же быстро, как без сахаров, но при этом люцифераза при температуре 37 °C разрушалась намного меньше, и потери сигнала оказались незначительными.
На последнем шаге эту смесь высушили и сделали из нее таблетки. Все компоненты оказались внутри «сахарной матрицы». Эксперименты показали, что в таком виде они остаются стабильны, если их хранить четыре недели в вакууме при комнатной температуре. А без сахаров высушенные фаги с реагентами утрачивали активность уже через неделю.
Чтобы «оживить» таблетку, достаточно добавить к ней воду. После этого можно вносить бактерии и по биолюминесценции смотреть, действуют ли вирусы на данного возбудителя (рис. 3). При таком подходе снижается скорость увеличения биолюминесцентного сигнала, но это некритично и на самом деле является хорошим компромиссом в пользу простоты и скорости анализа.
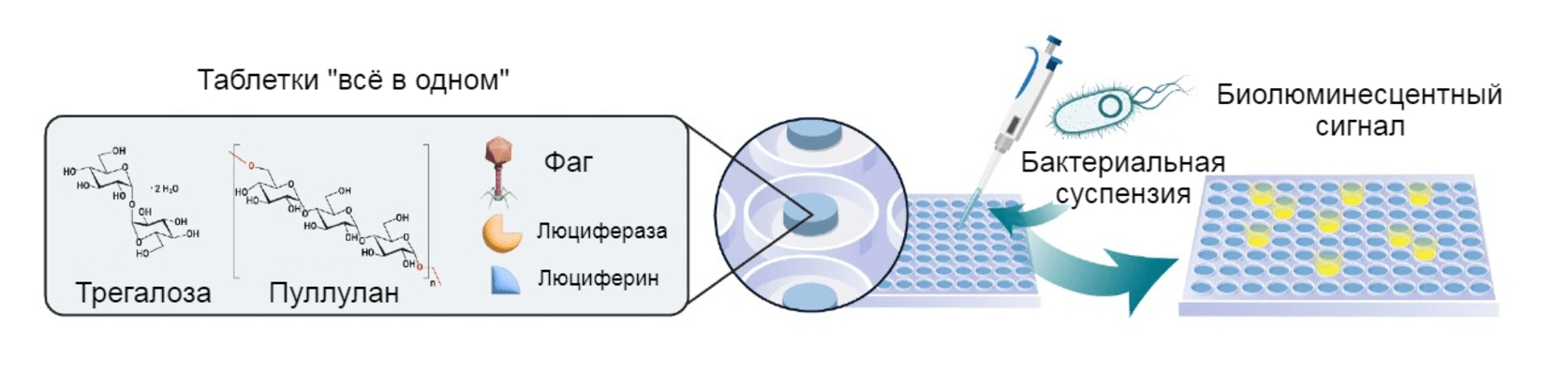
Рисунок 3. Суть технологии: всё просто!
Чтобы проверить чувствительность бактерий к фагам из библиотеки, достаточно добавить их к восстановленным таблеткам.
Когда исследователи попробовали идентифицировать подходящие фаги для Salmonella enterica, Escherichia coli и Staphylococcus aureus, они пришли к выводу, что метод вполне рабочий. На подбор бактериофагов таким способом уходит лишь от 30 до 120 минут. Это намного быстрее, чем при использовании классических методик (рис. 4).
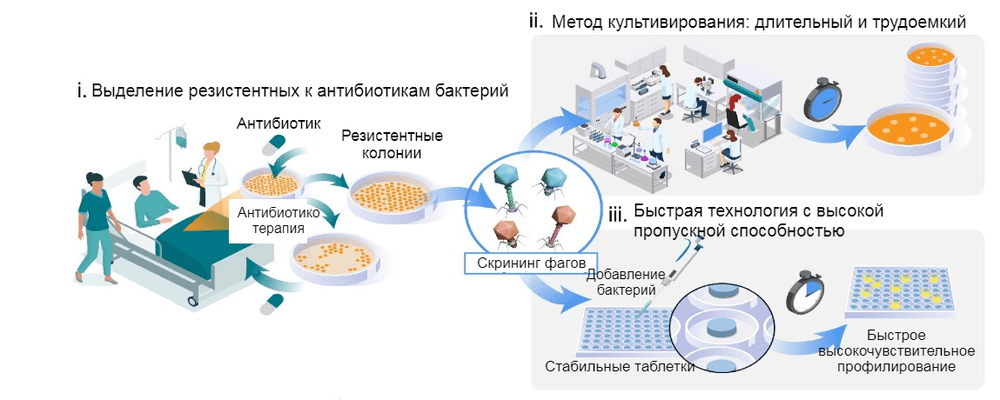
Рисунок 4. Схемы и подходы к персонализированной фаговой терапии.
В первую очередь необходимо выделить у пациента резистентный к антибактериальным препаратам штамм возбудителя (i). Далее нужно провести скрининг и отобрать подходящие бактериофаги. С применением классических методик это относительно сложно и долго (ii); ну а технология канадских ученых куда быстрее (iii)!.
Подводя итог, авторы, помимо высокой скорости определения чувствительности бактерий к фагам, отметили следующие преимущества своей разработки:
- отпадает необходимость использовать холодильные цепи и специальные упаковки для хранения и транспортировки образцов;
- для проведения исследования не нужно сложное оборудование и не нужно обучать персонал. Это особенно важно для регионов, где есть проблемы с доступом к лабораториям, а также в зонах катастроф;
- есть возможность полуколичественно определять способность фагов к биологическому контролю.
В конечном счете новая методика способна ускорить скрининг и упростить обмен материалом для отдельных библиотек фагов между собой и с клиниками.
При этом авторы отметили, что новый метод также имеет определенные ограничения: например, на результат анализа может повлиять лизис извне или абортивная инфекция. Система «всё в одном» не заменит методы точного контроля, но поможет быстро проводить скрининг фагов и формировать шорт-лист для отдельно взятого пациента. Медицинское применение фагов ограничено многими факторами, но в последнее время ученые из разных стран весьма активно работают над тем, чтобы преодолеть эти сложности. Разработка канадских исследований стала очередным шагом, который поможет упростить внедрение фаготерапии в клиническую практику и найти ей наиболее рациональное применение.
Литература
- Огромный и загадочный мир бактериофагов;
- Бактериофаги в действии: аспекты их практического применения в ветеринарии, сельском хозяйстве и экологии;
- Бактериофаги в медицине;
- Fereshteh B. et al. (2024) High throughput platform technology for rapid target identification in personalized phage therapy. Nature Communications. 15, 5626;
- Chung K.M., Liau X.L. and Tang S.S. (2023) Bacteriophages and Their Host Range in Multidrug-Resistant Bacterial Disease Treatment. Pharmaceuticals (Basel). 16 (10), 1467;
- Путь к тысячам аптек начинается с одной молекулы;
- Бактериофаги для отделения интенсивной терапии: российские исследователи проверили новый подход;
- Давыдов Д.С., Мовсесянц А.А., Парфенюк Р.Л. и Дурманова З.В. Методические рекомендации «Оценка качества лечебно-профилактических бактериофагов по показателям «Подлинность» и «Специфическая активность». Москва: Министерство здравоохранения Российской Федерации ФГБУ «НЦЭСМП» Минздрава России, 2021. - 694 с.;
- Hans R. (2023) Phage Spot Lysis Test: Phage detection technique. The Phage;
- Биолюминесценция: возрождение;
- Milne B.F., Marquesab M.A.L. and Nogueiraa F. (2010) Fragment molecular orbital investigation of the role of AMP protonation in firefly luciferase pH-sensitivity. Physical Chemistry Chemical Physics. 42, 14285-14293.





