Бактериофаги в медицине
19 августа 2022
Бактериофаги в медицине
- 6662
- 0
- 14
В условиях глобальной антибиотикорезистентности бактериофаги могут стать эффективным средством лечения и профилактики бактериальных инфекций. Возможности фаготерапии продемонстрированы при персонализированном применении, что в новой парадигме современной медицины, основанной на индивидуальном подходе к пациенту, особенно актуально. Иллюстрация в высоком разрешении.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редактор
-
Рецензент
-
Иллюстратор
Растущая антибиотикорезистентность бактерий — серьезная угроза для здравоохранения. В этих условиях актуален поиск альтернативных антимикробных препаратов, и бактериофаги — одни из них. В одноименном спецпроекте мы уже рассказывали об истории открытия этих уникальных биологических агентов и их применении в ветеринарии. А сейчас пришло время поговорить об их возможностях в современной медицине.
Бактериофаги

Партнер спецпроекта — НПЦ «Микромир» — производитель препаратов с бактериофагами для применения в медицине и ветеринарии.
Бактериофаги — это вирусы, заражающие бактериальные клетки. Они составляют наиболее многочисленную и эволюционно древнюю группу вирусов в биосфере Земли. Бактериофаги играют важную роль в контроле численности микробных популяций и в горизонтальном переносе бактериальных генов, выступая в качестве векторных систем.
В спецпроекте мы дадим общую информацию о бактериофагах, истории их изучения, использовании в лаборатории, попытках применения в медицине и ветеринарии и возможных будущих применениях.
Резистентность к антибиотикам — актуальная проблема медицины
Обнаружение антибиотиков более 80 лет назад открыло новые горизонты в лечении множества заболеваний и вместе с тем положило начало современному феномену развития резистентности к патогенам. Впрочем, по всей вероятности, устойчивость микробной флоры к антибактериальным средствам имеет гораздо более глубокие корни .
Все интригующие подробности «противостояния» бактерий и антибиотиков читайте в статьях: «Антибиотики и антибиотикорезистентность: от древности до наших дней» [1] и «Антибиотикорезистентность: How to make antibiotics great again*?» [2]. — Ред.
Так, несколько исследований выявили гены антибиотикорезистентности в древних и современных образцах микроорганизмов, изолированных из природной среды, в частности, из почвы. Например, отдельные линии метициллинрезистентного золотистого стафилококка появились у европейских ежей ещё до открытия и начала активного использования антибиотиков. Джеспер Ларсен с соавторами описал экологические и эволюционные механизмы возникновения такой устойчивости к метициллину как возможную коэволюционную адаптацию S. aureus при колонизации ежей, инфицированных грибами дерматофитами [3].
И все же основной причиной антибиотикорезистентности является воздействие на микроорганизмы антибиотиков, чаще из-за их чрезмерного использования в сельском хозяйстве и здравоохранении [4], [5]. В дополнение к хорошо известным факторам, влияющим на устойчивость к антибиотикам, ускорению распространения этого феномена в последние годы способствовало и неправильное применение противомикробных препаратов при COVID-19 (рис. 1).
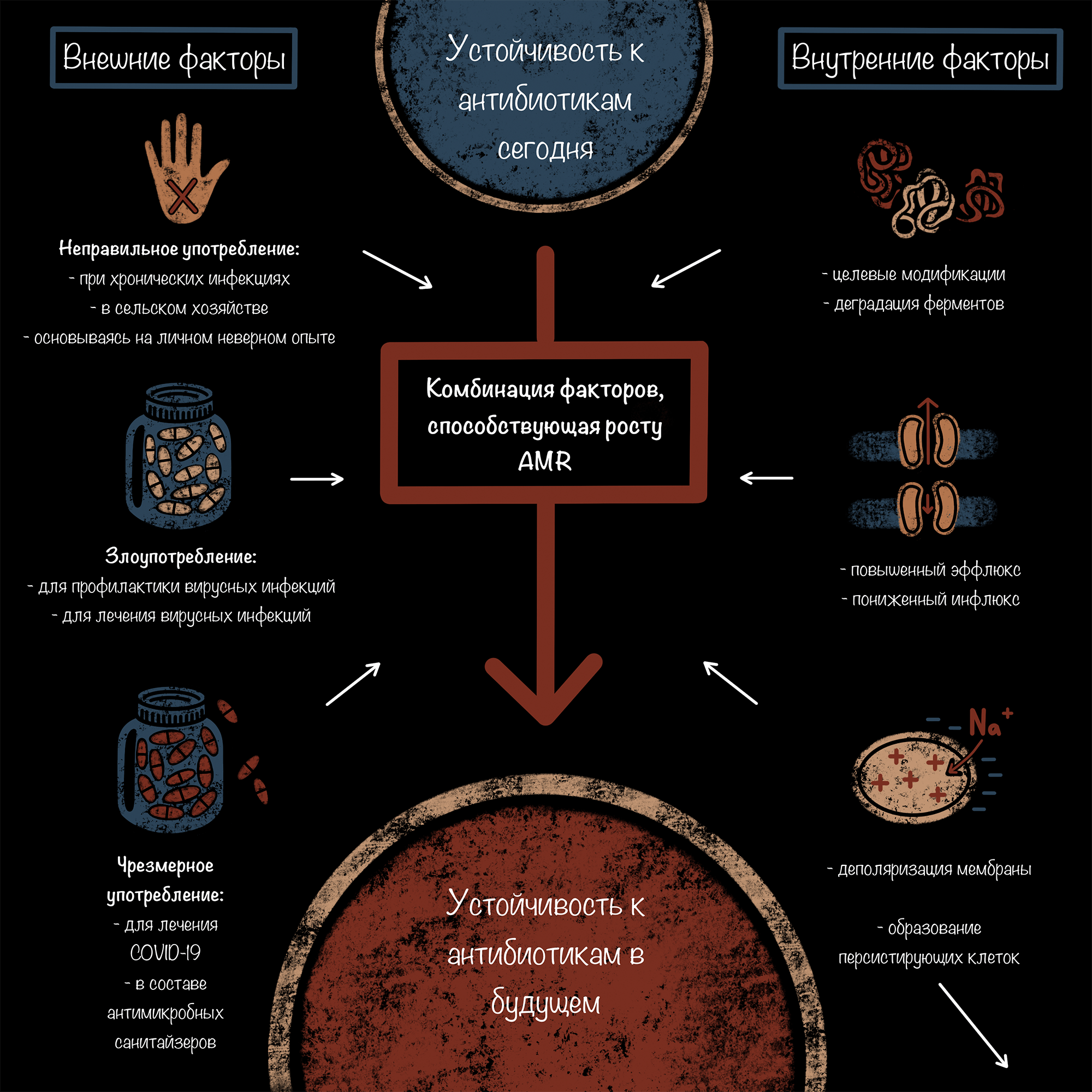
Рисунок 1. Факторы, способствующие росту антибиотикорезистентности (AMR). Это и внешние воздействия на бактерий, и собственная изменчивость их клеток. При этом такая адаптация к внешним воздействиям, как переход бактерий в персистентное состояние [6], на возрастание AMR не влияет (на рисунке стрелка направлена в другую сторону).
иллюстрация Анастасии Самоукиной по [4]
К сожалению, на сегодняшний день резистентность обнаружена практически ко всем разработанным антибиотикам. Яркий пример — ванкомицин, введенный в клиническую практику в 1972 году для лечения метициллинрезистентных штаммов S. aureus и коагулазонегативных стафилококков [7]. Считалось, что появление устойчивых штаммов к этому антибиотику крайне маловероятно. Но уже в 1979 и 1983 годах зарегистрировали случаи устойчивости к ванкомицину у коагулазонегативных стафилококков.
Однако надежда всё же есть: в последние годы исследователи обнаружили несколько нерибосомносинтезируемых циклических пептидных антибиотиков (например, лугдунин [8], [9] и тейксобактин [10]), резистентных форм бактерий к которым пока выделить не удалось. Омрачает ситуацию только то, что выход на рынок нового антибиотика занимает в среднем не менее 10 лет. И это если какая-то компания захочет взвалить на себя такой «груз» забот.
К сожалению, стратегия разработки новых формул для эффективной борьбы с резистентными бактериями и доведение их до производства, видимо, терпит фактическое поражение: 14 из 18 крупнейших фармкомпаний отказались от исследований в области антибиотикотерапии [5]. Слияния, которые происходили между крупнейшими игроками фармрынка, существенно сократили количество исследовательских групп. Свою роль сыграл и экономический кризис, который привел к сокращению финансирования исследований в этом направлении. Сегодня разработка антибиотиков не считается экономически выгодным вложением средств для фармацевтической промышленности.
В то же время в 2017 году Всемирная организация здравоохранения опубликовала отчет об устойчивых к антимикробным препаратам бактериальных патогенах, заслуживающих приоритетного внимания. Большинство бактерий из перечня вырабатывали фермент металло-ß-лактамазу 1 из Нью-Дели (NDM-1), придающий устойчивость к широкому спектру бета-лактамных антибиотиков, используемых для борьбы с антибиотикорезистентными бактериями [4].
По данным систематического обзора, опубликованного в январе нынешнего года в The Lancet, 4,95 млн смертей во всем мире в 2019 году были связаны с антибиотикорезистентностью [11].
Пандемия ухудшила ситуацию: одной из основных стратегий по преодолению заболеваемости стало использование антисептиков, то есть постоянное воздействие на микробную популяцию фармацевтических агентов с различной концентрацией. Предполагается, что широкое использование антисептиков может способствовать возникновению и распространению антибиотикорезистентности за счет мутагенных механизмов, дестабилизирующих микробный геном. В таких условиях резко возрастает актуальность применения альтернативных противомикробных средств, в частности, уже хорошо известных агентов — бактериофагов.
Фаготерапия в медицине: от начала до наших дней
Об истории открытия бактериофагов мы подробно писали в первой статье цикла [12], а вот на исследованиях их свойств мы остановимся подробно сейчас. За последние 100 лет эти исследования можно разбить на три этапа.
Первый последовал за публикацией Феликса д’Эрелля 1922 года, разработавшего медицинское применение бактериофагов и создавшего новую дисциплину — фаготерапию [13]. Этот метод лечения стал известен во всем мире, но, поскольку в дальнейшем сообщалось как о его успехах, так и о неудачах, не смог противостоять натиску антибиотиков, получивших широкое распространение в 40-х годах прошлого века.
Феликс д’Эрелль активно продвигал идею о том, что бактериофаги — это не ферменты, а «живые» вирусы, что впоследствии и было принято научным сообществом, а антимикробный эффект бактериофагов получил название «феномен Феликса д’Эрелля». Величайшая заслуга д’Эрелля заключается в том, что именно он выдвинул идею использовать бактериофаги для лечения бактериальных инфекций у человека и животных, за которую десять раз номинировался на Нобелевскую премию, начиная с 1925 года [14]. И тот факт, что лауреатом премии ученый так и не стал, не умаляет его заслуг.
Второй этап истории фаготерапии начался в 40-х годах XX века с использованием бактериофагов как модельных организмов [15], что вело к крупным фундаментальным открытиям и прокладывало путь к развитию научной дисциплины — молекулярной биологии [14]. Так, способность бактериофагов встраивать свой геном в геном хозяина легла в основу разработки ряда генно-инженерных инструментов в микробиологии. До 90-х годов прошлого века бактериофаги в основном изучались в качестве модельных систем для понимания многих аспектов биологии — от детальной регуляции экспрессии генов до трехмерных структур белков.
Третий этап начался около 20 лет назад. В этот период появились исследования бактериофагов с упором на их роль в биосфере и использование для борьбы с нежелательными бактериальными популяциями. Долгое время терапевтические фаги воспринимали как средство, которое стабильно должно уничтожать бактериальные популяции. Сегодня произошел отход от классической парадигмы, в основе которой лежали представления о бактериофагах как вирусах, элиминирующих все бактерии. Стало очевидно, что бактериофаги — своеобразные регуляторы, поддерживающие баланс бактериальных популяций в биосфере [16].
История применения бактериофагов
Продукты с бактериофагами
Коммерческая лаборатория под руководством Ф. д’Эрелля в Париже в начале 20-х годов прошлого века произвела пять фаговых препаратов против различных инфекций [17]. Их продавцом выступила компания, впоследствии ставшая крупным производителем косметических продуктов, — L’Oreal.
Институт Oswaldo Cruz Institute в Рио-де-Жанейро в 1924 году начал производство бактериофагов для борьбы с дизентерией в странах Латинской Америки [17]. В течение года была выпущено 10 000 ампул фагов, которые отправляли в госпитали по всей Бразилии.
В 40-х годах прошлого века американская компания Eli Lilly выпустила семь фаговых продуктов [17] (в том числе препараты против стафилококков, стрептококков, кишечных палочек и других патогенов), предназначавшихся для лечения абсцессов, гнойных ран, вагинитов, острых и хронических инфекций верхних дыхательных путей и других.
Одной из главных фигур в истории фагов стал советский бактериолог Георгий Элиава, работавший в 1919–1921, 1925–1927 и 1931 годах в Пастеровском институте в Париже вместе с известными бактериологами, в том числе д’Эреллем [17]. Созданный Элиавой Институт бактериофагов, микробиологии и вирусологии в Тбилиси производил фаговые препараты против десятка бактериальных возбудителей, включая стафилококков, синегнойную палочку, протея и многих кишечных патогенов. Бóльшая часть продукции института отправлялась советским военным для лечения диареи и раневых инфекций [18]. Сегодня в Грузии и России используется «Интестифаг» — коктейль, нацеленный на около 20 различных патогенных бактерий, ассоциированных с инфекцией ЖКТ. Второй препарат — «Пиофаг» — используется при лечении гнойных кожных и раневых инфекций.
Фаги для лечения дизентерии
Первым успешным опытом применения бактериофагов можно считать лечение дизентерии [17]. В испытаниях на базе Hôpital des Enfants-Malades в Париже в 1919 году принял участие Ф. д’Эрелль наряду с другими специалистами. Все они, чтобы подтвердить безопасность бактериофагов, сначала приняли препарат сами, а на следующий день ввели его 12-летнему мальчику с тяжелой формой дизентерии. Симптомы прекратились после однократного введения, а через несколько дней врачи зарегистрировали полное выздоровление. Впоследствии препарат ввели еще трем пациентам с дизентерией — результат был сопоставим, что подтвердило эффективность бактериофагов.
В 1940 году Липкин Я.О. и Никольская П.В. применили фаготерапию к 100 пациентам с дизентерией [17]. Результаты показали значительное влияние фагов на течение заболевания, в том числе в случаях, когда лечение было начато довольно поздно. 25% пациентов не отмечали симптомов заболевания уже ко второму дню лечения, 79% — к четвертому и 100% к шестому, в то время как в группе стандартной терапии показатели составили лишь 2%, 14% и 46% соответственно.
Фаги для лечения холеры
В труде «Бактериофаги и феномен выздоровления» Ф. д’Эрелль описал успешный опыт применения бактериофагов во время эпидемии холеры в Индии 1932 года, позволивший снизить смертность от этой инфекции. Пациентам вводили перорально 2 мл холерных фагов в 20 мл воды.
Фаги в военной хирургии
Применение фагов в хирургии и лечении ран началось во время финской кампании 1933–1940 годов, когда было проведено первое исследование Г.А. Кокина [17]. Он описал использование произведенной в Грузии смеси фагов, нацеленных на анаэробов, стафилококков и стрептококков, для лечения газовой гангрены. Коктейль вводили 767 инфицированным солдатам, летальный исход инфекции наблюдали в 18,8% случаев по сравнению с 42,22% в контрольной группе, получавшей другую терапию. Сопоставимые результаты получили и другие советские исследователи (Львов и Пастернак) [17]. Этот же фаговый препарат использовался в качестве неотложной помощи при ранениях для профилактики газовой гангрены. Только у 1,4% солдат из 2500, которые получили фаги, выявили симптомы газовой гангрены, в то время как в контрольной группе были инфицированы 4,3% солдат. Эта и две другие масштабные исследовательские работы позволили сделать вывод о том, что профилактическое применение фагов снижает в среднем на 30% количество случаев газовой гангрены [17].
В 1938 году знаменитый советский хирург Николай Бурденко рекомендовал использовать фаги против гнойных инфекций. В книге Александра Цулукидзе «Опыт применения бактериофагов в условиях военной травмы» обобщаются результаты финской кампании, особенно актуальные для военных хирургов. Автор описал 20 госпитальных случаев применения бактериофагов против аэробных бактерий. 17 из 20 раненых, получивших препарат на поле боя, и три человека, которым ввели фаги по прибытии в больницу, находились в тяжелом состоянии, все были инфицированы Clostridium perfringens. Врачи зафиксировали, что солдаты, получившие препарат раньше, быстрее выздоравливали, чем те, кому ввели фаги позже. В первой группе не было зафиксировано осложнений, в то время как во второй у двух пациентов развился генерализованный сепсис, приведший к смерти.
Фаги при брюшном тифе
Описаны случаи лечения с помощью фагов пациентов с брюшным тифом в 40-х годах прошлого века. Первый случай (35 больных): результаты показали незначительное улучшение состояния, в частности, укорочение периода лихорадки. Второй случай (57 больных): наилучший результат был достигнут при комбинированном внутримышечно-пероральном приеме фагов. Третий случай (100 пациентов) показал положительный эффект у 32% больных. Авторы пришли к выводу, что раннее лечение фагами приводит к более высокой эффективности терапии [17].
Нина Чанишвили и Ричард Шарп в своем материале, выпущенном в 2008 году, подробно описывают опыт лечения фагами ряда заболеваний, причем во многих проведенных исследованиях ученые используют группу плацебо [19].
К числу успешных примеров применения бактериофагов можно отнести использование грузинского пиофага в американском Southwest Regional Wound Care Center [18], что побудило Рэнди Волькотта в 2008 году провести исследование I фазы использования фагов, нацеленных на золотистого стафилококка, синегнойную и кишечную палочки при язвах на ногах [20]. Результаты исследования продемонстрировали отсутствие нежелательных явлений при использовании коктейля фагов. В то же время заметной разницы между испытуемой и контрольной группами по скорости заживления и частоте выздоровления найдено не было. Изучение активности фагов планировали провести в исследовании II фазы, однако оно пока не состоялось.
Применение генномодифицированных фагов
В 2019 году описан случай использования коктейля из трех генно-инженерных фагов у пациента 15 лет с муковисцидозом после двусторонней трансплантации легких и хронически инфицированного Pseudomonas aeruginosa и Mycobacterium abscessus subspecies massiliense [21]. Для выявления потенциально терапевтических фагов ученые выделили из биоматериала пациента штамм M. abscessus subsp. massiliense GD01. И далее работали с коллекцией из более чем 10 000 фагов, выделенных с использованием клеток Mycobacterium smegmatis.
При скрининге коллекции удалось определить фаг Muddy, эффективно уничтожающий M. abscessus subsp. massiliense GD01, фаг ZoeJ с меньшей эффективностью и малоэффективный фаг BPs. Чтобы разработать вариант ZoeJ, эффективно заражающий и убивающий GD01, исследователи использовали метод Bacteriophage Recombineering of Electroporated DNA (BRED) — направленный мутагенез фаговых геномов путем их рекомбинации с нужной ДНК внутри клеток Mycobacterium smegmatis, отличающихся повышенной частотой рекомбинации [22].
Поработав с третьим фагом (BPs), ученые смогли получить мутантов HRM1 и HRM10, эффективно заражающих GD01.
Три этих фага эффективно заражали и уничтожали штамм GD01, выделенный у пациента, но, к сожалению, не другие штаммы. При этом терапия хорошо переносилась и ассоциировалась с объективным клиническим улучшением, в том числе заживлением ран, улучшением состояния печени, значительным разрешением инфицированных кожных узелков [21].
Фаги при рецидивирующих пневмониях
Коллективы Федерального научно-клинического центра реаниматологии и реабилитологии и НПЦ «Микромир» совместно разработали комплексный препарат бактериофагов для ингаляционного введения и в 2021 году предложили технологию адаптивной фаготерапии пациентов с рецидивирующими пневмониями в отделении нейрореаниматологии [23].
Препарат против 14 госпитальных полирезистеных видов бактерий назначили 43 пациентам в критическом состоянии с тяжелым повреждением головного мозга. Части из них (29 чел.) давали бактериофаги вместе с антибиотиками, а оставшимся (14 чел.) — без антибиотиков. Группу сравнения составили 40 пациентов, получавших только антибиотики. Результаты показали хорошую переносимость препарата и отсутствие клинически значимых побочных эффектов. К 21 дню в группе «фаги+антибиотики» снизилась степень повреждения легких, а в группе «фаги» уменьшилась потребность в искусственной вентиляции легких. Результаты в группе «фаги» не уступали таковым в контрольной группе, а ряд клинико-лабораторных показателей, в частности, уровни АЛТ и АСТ, имел тенденцию к улучшению.
Это говорит о том, что использование бактериофагов вместо антибиотиков особенно актуально для длительно болеющих людей. Ведь организму человека при приеме антибиотиков необходимо их метаболизировать и выводить, что требует энергетических затрат и создает дополнительную нагрузку на организм пациентов с хроническими заболеваниями. Результат же фаготерапии достигается «пассивно», без активного участия макроорганизма.
Отдельные клинические случаи современной фаготерапии
В 2016 году Пол Тернер с коллегами сообщил о выделении фага, при применении которого восстанавливается чувствительность к антибиотикам полирезистентной Pseudomonas aeruginosa. Позднее этот фаг был использован для лечения пациента c инфекцией аортального протеза, которая не отвечала на агрессивную антибиотикотерапию. Эта же команда в 2020 году сообщила о лечении фагами пациентов с кистозным фиброзом и инфекциями, устойчивыми к антибиотикам.
О заметной успешной клинической попытке фаготерапии в 2017 году рассказали ученые и врачи Медицинской школы Калифорнийского университета в Сан-Диего, использовавшие внутривенную терапию для лечения пациента с тяжелой системной инфекцией, вызванной полирезистентными микроорганизмами [24]. Введение бактериофагов обеспечило элиминацию резистентного Acinetobacter baumannii и выздоровление пациента. Этот случай приобрел широкую огласку, что стало толчком к первому клиническому испытанию эффективности внутривенной фаговой терапии в Северной Америке. Команда ученых из той же Медицинской школы в сотрудничестве с биотехнологической компанией AmpliPhi Biosciences Corporation в 2019 году начала клиническое исследование эффективности внутривенной терапии экспериментальным бактериофагом пациентов с резистентной инфекцией Staphylococcus aureus. Его результаты пока не опубликованы.
Зарегистрирован случай клинического применения фаготерапии при обширной некротизирующей легочной инфекции P. аeruginosa [49]. Пациентке — женщине 77 лет, — в комбинации с антибактериальными препаратами назначили фаговый коктейль из четырех литических бактериофагов. Препарат применяли как ингаляционно, через небулайзер, так и внутривенно 2 раза в день на протяжении 7 дней.
Терапия хорошо переносилась, не сопровождалась развитием побочных эффектов — ни во время лечения, ни после него, — и привела к разрешению инфекции и уничтожению Pseudomonas аeruginosa. При этом, учитывая степень тяжести заболевания и последовательное развитие устойчивости к антимикробным препаратам, наблюдавшееся на протяжении лечения, маловероятно, что успешной деколонизации Pseudomonas аeruginosa удалось бы достичь без введения в схему терапии фагового коктейля. Таким образом, данный случай подтверждает, что дополнительная терапия фагами может рассматриваться в случаях осложненной инфекции, когда стандартная противомикробная терапия не позволяет достичь терапевтического ответа вследствие развивающейся антибиотикорезистентности или лекарственной аллергии.
Современные представления о механизме действия бактериофагов
Бактериофаги — вирусы, которые встречаются в биосфере всюду, где живут бактерии. В каждом грамме почвы и воды насчитывается от десяти до сотен миллионов фагов [25], а на коже и в организме человека — миллиарды.
Литические фаги связываются со специфическими рецепторами на поверхности клетки-хозяина, вводят свой геном в клетку и начинают размножение, что приводит к лизису (разрушению) клетки и дальнейшему высвобождению фагов-потомков в окружающую среду (литический цикл) (рис. 2).
Умеренные фаги не сразу «убивают» клетку-хозяина: они интегрируют геном в хромосому хозяина, размножаясь вместе с бактерией (лизогенный цикл) (рис. 2). Однако смена условий может запустить литический цикл, и профаг «проснется». Показано, что большинство факторов, которые вызывают стресс или повреждение ДНК клетки-хозяина, активируют у умеренных фагов литический цикл.
Существуют некоторые опасения, связанные с терапевтическим использованием умеренных фагов, однако подтверждено, что они обладают интересными потенциально полезными свойствами [26]. Прежде всего, умеренные фаги очень распространены в природе, что облегчает их поиск и изоляцию. Особенно перспективны достижения в технологиях секвенирования: большое число геномных последовательностей, хранящееся в базах данных, упрощает доступ, анализ и идентификацию умеренных фагов по маркерным генам, таким как интегразы.
Литические фаги, по всей вероятности, всё-таки останутся основным выбором для фаготерапии, однако терапевтическое использование умеренных фагов также может позволять достигать определенных целей. Интеграцию умеренных фагов в бактериальные геномы можно исследовать, например, для доставки синтетических генных сетей, нарушающих важные бактериальные внутриклеточные процессы и приводящих к гибели клетки или ресенсибилизации бактерий к антибиотикам. Поскольку этот подход не предполагает лизиса клеток, он снижает риск высвобождения эндотоксинов, существующий при применении литических фагов. Также возможно адаптировать геном умеренных фагов, удалив гены, участвующие в поддержании лизогенного жизненного цикла или в вирулентности бактерий. Таким образом умеренные фаги становятся литическими.
Хронические фаги не лизируют клетку и не интегрируют свой геном в геном хозяина. Они используют его как «фабрику» по производству фагов (например, нитчатые фаги М13). Инфицированные клетки не разрушаются, но практически прекращают делиться. Высвобождение новых частиц происходит через поры в клеточной стенке, образованные специальными белками фага.
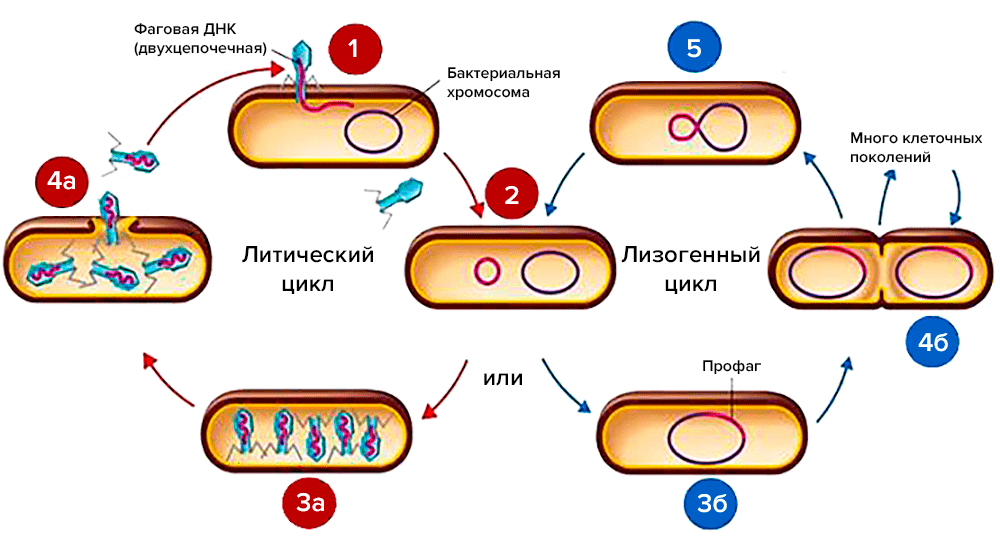
Рисунок 2. Литический и лизогенный циклы. 1. Прикрепление фагового хвоста к определенному рецепторному участку на стенке бактериальной клетки, инвазия в клетку. 2. ДНК фага входит в литический или лизогенный цикл. Литический цикл: 3а. Синтез новых вирусных белков внутри клетки-хозяина, сборка новых фаговых частиц. 4а. Вирионы высвобождаются в виде зрелых фагов при лизисе клетки. Лизогенный цикл: 3б. ДНК фага интегрируется в бактериальную хромосому путем рекомбинации и превращается в профаг. 4б. Бактерия нормально размножается. 5. Репликация хромосомы, при которой под действием внешних триггеров возможно отделение фаговой двухцепочечной ДНК (дцДНК), что может приводить либо к запуску литического цикла, либо к возврату в состояние профага.
При использовании фагов могут наблюдаться четыре исхода, которые являются этапами усиливающегося воздействия фагов в течение терапии: нулевой, бактерицидный, бактериолитический и вирионпродуцирующий [27].
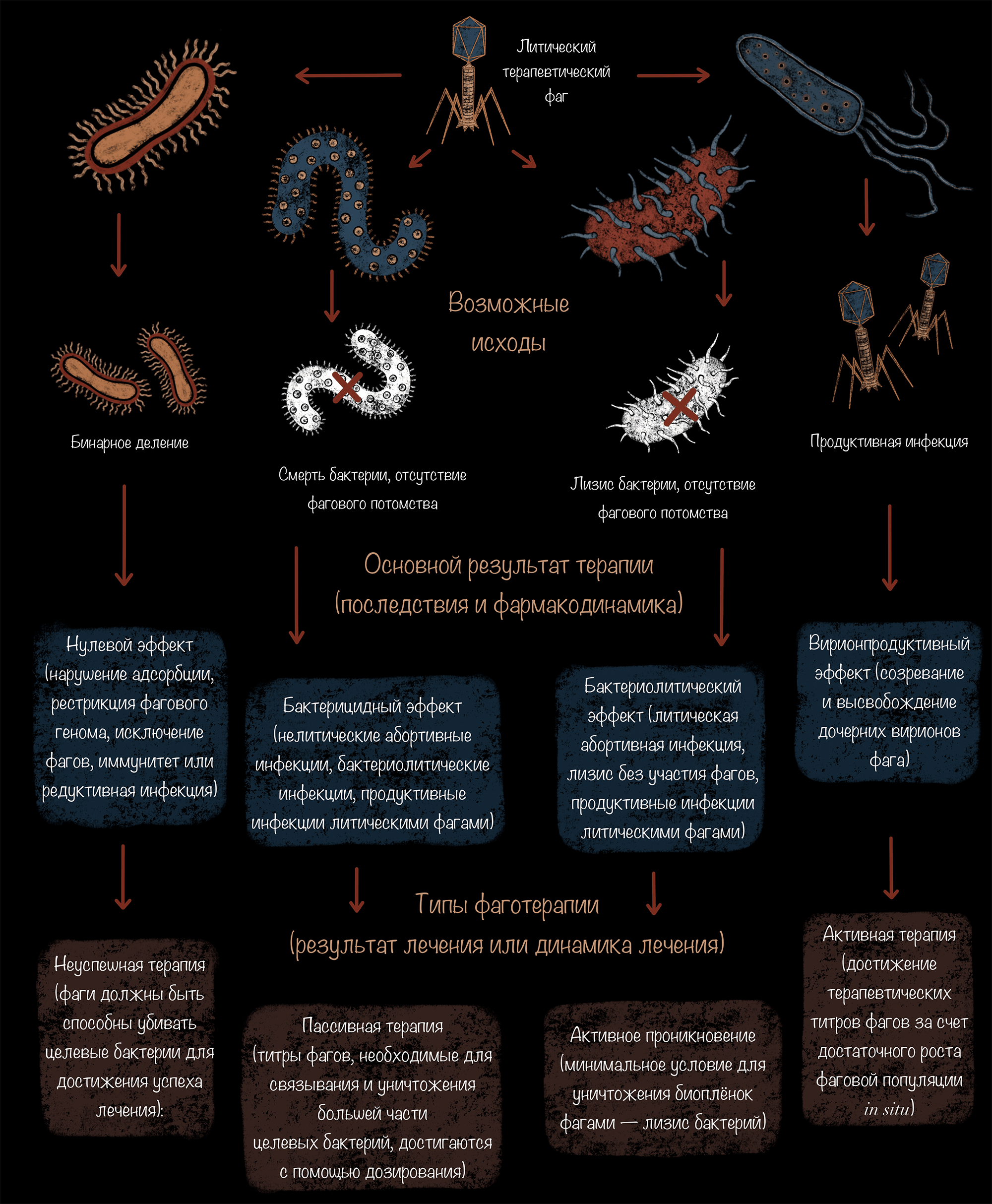
Рисунок 3. Основные результаты и типы фаготерапии. Воздействие фаговых препаратов может приводить к четырем исходам: нулевому (бактерии продолжают размножаться), бактерицидному (бактерии умирают, но не обязательно в результате лизиса, а, например, при абортивной инфекции), бактериолитическому без продукции фагов (бактерии лизируются, но фаговые частицы не образуются) и продуктивному (бактерии лизируются с выходом полноценных фаговых частиц). В соответствии с этими четырьмя исходами выделяют и четыре типа фаготерапии.
иллюстрация Анастасии Самоукиной по [27]
Благодаря возможностям генной инженерии в Корее создали экспериментальные синтетические фаги с новыми свойствами. Основные мишени модификации сосредоточили в трех зонах [28]:
- сайт распознавания целей — расширение или изменение спектра целевых клеток-хозяев;
- капсид — уменьшение иммунного ответа хозяина-млекопитающего за счет модификации;
- геном — уменьшение иммунного ответа хозяина-млекопитающего за счет инсерционной инактивации гена эндолизина (фермента, расщепляющего пептидогликан в клеточных стенках бактерий во время лизиса), введение гетерологичных эффекторных генов для повышения антибактериальной эффективности фагов.
Рекомбинантный фаг P945 с инсерционно инактивированным геном эндолизина демонстрировал пониженный лизис Staphylococcus aureus, однако продолжал оказывать бактерицидное действие.
Генетически модифицированные фаги могут обойти некоторые ограничения фагов дикого типа (например, узкий спектр активности — «нацеленность» на определенные микроорганизмы), однако необходимы более глубокие исследования, чтобы оценить возможность восстановления дикого типа.
Доказательная база фаготерапии
К сегодняшнему дню накопилось не так много сообщений о клиническом применении фагов и тем более о контролируемых клинических испытаниях. При этом, по всей вероятности, существенно больше опыта по использованию фагов в качестве антибактериальных агентов накоплено в клинической практике, чем в клинических исследованиях.
В 2009 году в Великобритании прошло рандомизированное клиническое исследование, изучающее безопасность и предварительную эффективность фаготерапии при хроническом отите [29]. В работе исследовали коктейль из шести фагов с литической активностью в отношении P. aeruginosa. У трех пациентов из 12, получавших фаговую терапию (общее число участников — 24; контрольная группа — 12), не обнаружили P. aeruginosa к 42 дню терапии. И в целом к концу эксперимента только в этой группе значительно снизилось количество P. aeruginosa. О нежелательных явлениях, связанных с терапией, не сообщалось, что подтверждает безопасность бактериофагов.
В 2016 году были опубликованы результаты рандомизированного исследования, проведенного в Бангладеш и изучавшего безопасность и эффективность двух разных фаговых коктейлей, нацеленных на патогенные E. coli при диарее [30]. Исследование не показало существенных различий между группой пероральной фаготерапии и группой плацебо, однако подтвердило отсутствие неблагоприятных побочных эффектов. Поскольку не было предпринято никаких действий для нейтрализации желудочного содержимого до введения фагов, не исключено, что большое количество фаговых частиц не смогли выжить в солянокислой среде желудка. Кроме того, неясно, был ли фаг литическим по отношению к конкретным штаммам E. coli, вызывавшим инфекцию.
Первым клиническим испытанием фаготерапии, проведенным с использованием стандартов GMP (Good Manufacturing Practice), стало французское рандомизированное контролируемое исследование PhagoBurn, опубликованное в 2018 году [31]. Исследуемый фаговый коктейль из 12 фагов использовался в качестве средства против Escherichia coli и Pseudomonas aeruginosa при ожоговых раневых инфекциях. Результаты исследования показали, что среднее время до стерилизации ран в группе фаготерапии составило 144 часа, в то время как в группе плацебо — всего 47 часов. Эти неожиданно пессимистичные результаты могут быть объяснены введением более низкой дозы фагов, чем необходимо: концентрация фагового коктейля в эксперименте оказалась сниженной на 4–5 порядков по сравнению с концентрацией на момент изготовления препарата.
Некоторые исследователи классифицируют бактериофаги как пробиотики (например, такой или такой), способные при введении в адекватном количестве давать благоприятные эффекты на здоровье. Так, в исследовании Алешкина А.В. и соавторов показано, что фаговый коктейль, содержащий бактериофаги, нацеленные на Escherichia, Staphylococci, Listeria и Salmonella, обеспечил снижение риска пищевой инфекции наряду с хорошей переносимостью [32].
Рандомизированное двойное слепое плацебоконтролируемое исследование PHAGE, проведенное американскими учеными в 2018 году, продемонстрировало хорошую переносимость и высокий профиль безопасности коктейля из четырех фагов (LH01-Myoviridae, LL5-Siphoviridae, T4D-Myoviridae и LL12-Myoviridae) при желудочно-кишечных расстройствах легкой и средней степени тяжести [33].
Относительная неуспешность доклинических и клинических исследований при оптимистичных результатах отдельных случаев практического применения фагов вызывает закономерные вопросы. Объяснение может лежать в плоскости сложной природы фагов и их действия в реальных условиях, которые не могут в полной мере отразить «упрощенные» модели в рамках клинических исследований. Так, многие исследования на животных основывались на использовании только одной дозы фага, в большинстве случаев — местной аппликации в легких, реже — внутрибрюшинно [39].
И сейчас уже возникает понимание, что действие фаговых препаратов зависит от физиологического состояния бактериальных клеток [40–42]. В лабораторных опытах фаги обычно испытывают на культурах клеток, растущих экспоненциально, то есть очень быстро, поскольку им всегда хватает питательных веществ. Но в природе, в том числе и в организмах животных и человека, бактерии из-за высокой плотности популяции чаще всего находятся в стационарной фазе роста — им уже не хватает питательных веществ для бурного размножения, а потому численность клеток почти не увеличивается.
В стационарной фазе бактериальные клетки «затягивают пояса» — включают специальные антистрессовые механизмы: меньше синтезируют белки-транспортеры, более плотно упаковывают хромосомы, снижают количество рибосом и т.п. [43].
И вот в таких условиях многие фаги (например, T4 — вирус бактерии Escherichia coli) способны входить в так называемый режим гибернации — «замораживать активы». В этом состоянии процесс производства фага приостанавливается в какой-то момент после начала синтеза его ДНК (но до завершения формирования капсида) — до тех пор, пока клетке-хозяину не станут доступны новые питательные вещества. Получив питание, фаг «просыпается» и производит значительное количество вирусных частиц в короткие сроки [43].
Для самих фагов режим гибернации — способ выжить в изменившихся условиях, в условиях стресса. Фаг как бы «консервирует» бактерию в ожидании лучших времен, чтобы тут же инициировать всплеск размножения.
Но в этом-то и заключается одна из проблем доклинических исследований на многих животных моделях и клинических исследований на людях. Эффект фаговых препаратов часто оказывается слабым или смазанным. И довольно сложно бывает понять настоящую причину этого: то ли доза низкая, то ли препарат не работает, то ли фаг в режиме гибернации, то ли инопланетяне помешали.
Поэтому уже сейчас многие фармпроизводства начинают приходить к тому, чтобы выращивать фаговые препараты не в периодических культурах, где основная фаза роста бактерий — экспоненциальная, а в непрерывных, где бóльшую часть времени клетки проводят в стационарной фазе [40]. Таким образом можно в какой-то мере понять, как будет себя вести препарат в реальных условиях.
Впрочем, есть аспект, который отмечен и в клинических исследованиях, и на практике: это — высокий профиль безопасности фагов. За период их использования и изучения не зарегистрировано случаев негативных эффектов, что можно считать одним из существенных преимуществ этих препаратов по сравнению с другими антимикробными средствами.
Фаги vs антибиотики
Рациональный подход к фаготерапии имеет много потенциальных преимуществ по сравнению с антибиотиками. Рассмотрим основные.
- Бактериостатические антибиотики вызывают антибиотикорезистентность, а также появление клеток-персистеров [44], генотипически эквивалентных бактериям дикого типа и физиологически устойчивых к антибиотикам [6]. Литические фаги же всегда (в идеале) бактерицидны: лизис клеток в подходящих условиях (вспомним режим гибернации) происходит по завершении цикла репликации. Более того, фаги, в отличие от антибиотиков, при заражении влияют на многие важные клеточные процессы, включая репликацию ДНК, транскрипцию и трансляцию [45], и в некоторой степени являются более сложными мишенями для эволюции бактериальной резистентности.
Развитие устойчивости к противомикробным препаратом неизбежно [45]. Фаги же, в отличие от антибиотиков, подбирают нацеленно на определенный вид или штамм. К тому же они могут эволюционировать вместе с бактериями с течением времени, преодолевая устойчивость. - Популярные антибиотики широкого спектра могут нарушать нормальный баланс микрофлоры, обеспечивающей защитный эффект и занимающей нишевые участки, предотвращая или ограничивая проникновение бактериальных патогенов [45]. Фаг специфичен для видов и даже отдельных штаммов бактерий, что делает его идеальным терапевтическим средством для избирательного действия и уничтожения конкретных патогенов.
- Антибиотики необходимо вводить постоянно [45], чтобы обеспечить бактерицидный или бактериостатический эффект, что может приводить к различным побочным эффектам. В то время как фаги (которых для достижения наилучшего эффекта в большинстве схем лечения тоже предлагается вводить многократно) воздействуют только на бактерий в месте заражения и выводятся из организма, когда восприимчивые бактерии погибают.
- Пока продолжается регресс в открытии новых антибиотиков, поиск новых бактериофагов не представляет особых сложностей из-за огромного разнообразия фагов в природе [45]
Нельзя не упомянуть и некоторые ограничения фаготерапии по сравнению с антибиотикотерапией. Скорее всего, фаги не станут оптимальным лечебным средством «от всех инфекций», поскольку не имеют надежного механизма проникновения в эукариотические клетки. Впрочем, в последнее время появляются работы, описывающие такие процессы.
Кроме того, фаговая популяция способна к быстрому экспоненциальному росту, и при лизисе бактерий могут высвобождаться потенциально опасные бактериальные антигены, особенно, если фаги вводятся перорально, хотя на практике ни одного подобного негативного эффекта не было зарегистрировано. И, конечно, нормативные преграды для реализации фаготерапии в современной медицине серьезно осложняют внедрение ее в схему лечения: ни FDA, ни EMA, например, не допускают клинического применения фаговых препаратов. Лишь иногда отдельные врачи рискуют назначать их как препараты последнего выбора — когда другие лекарства уже не помогают.
Фаготерапия не способна стать альтернативой антибиотикотерапии. А вот снизить количество потребляемых антибиотиков при применении фагов возможно. Показано, что совместное применение фагов и антимикробных препаратов помогает восстановить чувствительность бактерий к антибиотикам [46], поскольку при мутагенезе и отборе в сторону фагорезистетных форм бактерий нередко утрачиваются механизмы антибиотикорезистентности. В то же время использование комплексного фагового коктейля против одного бактериального штамма позволяет расширить литический спектр и значительно снизить вероятность образования фагорезистетных форм возбудителей [47]. Понятно, что не все фаги и антибиотики синергичны [48], и механизмы их синергизма еще изучаются, однако перспективы фагов как средств, обеспечивающих персонализированный подход совместно с антибиотикотерапией, остаются довольно оптимистичными.
При этом в качестве безусловно сильной стороны фаготерапии можно выделить ее высокую безопасность. Тот факт, что за более чем вековой период применения бактериофагов как на практике, так и в клинических исследованиях не было зафиксировано случаев неблагоприятных реакций, можно рассматривать как существенное преимущество фаговых препаратов по сравнению с другими противомикробными средствами.
И хотя пока фаготерапия не одобрена мировыми регуляторами (впрочем, в Австралии есть подвижки в этом направлении — там был утвержден стандартизированный протокол лечения и мониторинга фаготерапии для взрослых и детей), немалое количество отдельных случаев успешного применения бактериофагов дает надежду на то, что в недалеком будущем удастся разработать для фаговых препаратов протоколы проведения клинических исследований, которые сделают их верифицируемыми и повторяемыми. И тогда фагам, наконец, будет открыт легальный путь в клиническую практику.
Литература
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Jesper Larsen, Claire L. Raisen, Xiaoliang Ba, Nicholas J. Sadgrove, Guillermo F. Padilla-González, et. al.. (2022). Emergence of methicillin resistance predates the clinical use of antibiotics. Nature. 602, 135-141;
- Tekle Airgecho Lobie, Aklilu Abrham Roba, James Alexander Booth, Knut Ivan Kristiansen, Abraham Aseffa, et. al.. (2021). Antimicrobial resistance: A challenge awaiting the post-COVID-19 era. International Journal of Infectious Diseases. 111, 322-325;
- Laura JV Piddock. (2012). The crisis of no new antibiotics—what is the way forward?. The Lancet Infectious Diseases. 12, 249-253;
- Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью;
- Ventola C. L. (2015). The antibiotic resistance crisis: part 1: causes and threats. P & T: a peer-reviewed journal for formulary management. 40 (4), 277–283;
- Антибиотики прямо под нашим носом;
- Katharina Bier, Birgit Schittek. (2021). Beneficial effects of coagulase‐negative Staphylococci on Staphylococcus aureu s skin colonization. Exp Dermatol. 30, 1442-1452;
- Yun‐Kun Qi, Xiaowen Tang, Ning‐Ning Wei, Cheng‐Jian Pang, Shan‐Shan Du, KeWei Wang. (2022). Discovery, synthesis, and optimization of teixobactin, a novel antibiotic without detectable bacterial resistance. Journal of Peptide Science;
- Christopher JL Murray, Kevin Shunji Ikuta, Fablina Sharara, Lucien Swetschinski, Gisela Robles Aguilar, et. al.. (2022). Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet. 399, 629-655;
- Огромный и загадочный мир бактериофагов;
- Alexander Sulakvelidze, Zemphira Alavidze, J. Glenn Morris. (2001). Bacteriophage Therapy. Antimicrob Agents Chemother. 45, 649-659;
- William C. Summers. (2014). History of Phage Research and Phage Therapy. Phages. 1-17;
- Модельные организмы: фаг лямбда;
- Damien Maura, Laurent Debarbieux. (2011). Bacteriophages as twenty-first century antibacterial tools for food and medicine. Appl Microbiol Biotechnol. 90, 851-859;
- Nina Chanishvili. (2012). Phage Therapy—History from Twort and d'Herelle Through Soviet Experience to Current Approaches. Advances in Virus Research. 3-40;
- Stephen T. Abedon, Sarah J. Kuhl, Bob G. Blasdel, Elizabeth Martin Kutter. (2011). Phage treatment of human infections. Bacteriophage. 1, 66-85;
- Nina Chanishvili, Richard Sharp. (2008). Bacteriophage therapy: experience from the Eliava Institute, Georgia. Microbiol. Aust.. 29, 96;
- D.D. Rhoads, R.D. Wolcott, M.A. Kuskowski, B.M. Wolcott, L.S. Ward, A. Sulakvelidze. (2009). Bacteriophage therapy of venous leg ulcers in humans: results of a phase I safety trial. J Wound Care. 18, 237-243;
- Rebekah M. Dedrick, Carlos A. Guerrero-Bustamante, Rebecca A. Garlena, Daniel A. Russell, Katrina Ford, et. al.. (2019). Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. Nat Med. 25, 730-733;
- Laura J. Marinelli, Mariana Piuri, Zuzana Swigoňová, Amrita Balachandran, Lauren M. Oldfield, et. al.. (2008). BRED: A Simple and Powerful Tool for Constructing Mutant and Recombinant Bacteriophage Genomes. PLoS ONE. 3, e3957;
- N. V. Beloborodova, A. V. Grechko, M. M. Gurkova, A. Yu. Zurabov, F. M. Zurabov, et. al.. (2021). Adaptive Phage Therapy in the Treatment of Patients with Recurrent Pneumonia (Pilot Study). Obŝaâ reanimatologiâ. 17, 4-14;
- Robert T. Schooley, Biswajit Biswas, Jason J. Gill, Adriana Hernandez-Morales, Jacob Lancaster, et. al.. (2017). Development and Use of Personalized Bacteriophage-Based Therapeutic Cocktails To Treat a Patient with a Disseminated Resistant Acinetobacter baumannii Infection. Antimicrob Agents Chemother. 61;
- Ganeshan, Hosseinidoust. (2019). Phage Therapy with a focus on the Human Microbiota. Antibiotics. 8, 131;
- Rodrigo Monteiro, Diana Priscila Pires, Ana Rita Costa, Joana Azeredo. (2019). Phage Therapy: Going Temperate?. Trends in Microbiology. 27, 368-378;
- Katarzyna Danis-Wlodarczyk, Krystyna Dąbrowska, Stephen T. Abedon. (2021). Phage Therapy: The Pharmacology of Antibacterial Viruses. Current Issues in Molecular Biology. 81-164;
- Bi-o Kim, Eun Kim, Yeon-Ji Yoo, Hee-Won Bae, In-Young Chung, You-Hee Cho. (2019). Phage-Derived Antibacterials: Harnessing the Simplicity, Plasticity, and Diversity of Phages. Viruses. 11, 268;
- A. Wright, C.H. Hawkins, E.E. Änggård, D.R. Harper. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistantPseudomonas aeruginosa; a preliminary report of efficacy. Clinical Otolaryngology. 34, 349-357;
- Shafiqul Alam Sarker, Bernard Berger, Ying Deng, Silas Kieser, Francis Foata, et. al.. (2017). Oral application of
E scherichia coli bacteriophage: safety tests in healthy and diarrheal children fromB angladesh. Environ Microbiol. 19, 237-250; - Patrick Jault, Thomas Leclerc, Serge Jennes, Jean Paul Pirnay, Yok-Ai Que, et. al.. (2019). Efficacy and tolerability of a cocktail of bacteriophages to treat burn wounds infected by Pseudomonas aeruginosa (PhagoBurn): a randomised, controlled, double-blind phase 1/2 trial. The Lancet Infectious Diseases. 19, 35-45;
- A.V. Aleshkin, Gabrichevsky Moscow Research Institute of Epidemiology and Microbiology, Moscow, Russian Federation, N.V. Volozhantsev, E.A. Svetoch, I.A. Kiseleva, et. al.. (2016). Bacteriophages as probiotics: phage-based probiotic dietary supplement in prophylaxis against foodborne infections. Infekc. bolezni. 14, 31-40;
- Melinda Gindin, Hallie P. Febvre, Sangeeta Rao, Taylor C. Wallace, Tiffany L. Weir. (2019). Bacteriophage for Gastrointestinal Health (PHAGE) Study: Evaluating the Safety and Tolerability of Supplemental Bacteriophage Consumption. Journal of the American College of Nutrition. 38, 68-75;
- Lucía Fernández, Diana Gutiérrez, Ana Rodríguez, Pilar García. (2018). Application of Bacteriophages in the Agro-Food Sector: A Long Way Toward Approval. Front. Cell. Infect. Microbiol.. 8;
- Christine Rohde, Johannes Wittmann, Elizabeth Kutter. (2018). Bacteriophages: A Therapy Concept against Multi-Drug–Resistant Bacteria. Surgical Infections. 19, 737-744;
- Gilbert Verbeken, Isabelle Huys, Jean-Paul Pirnay, Serge Jennes, Nina Chanishvili, et. al.. (2014). Taking Bacteriophage Therapy Seriously: A Moral Argument. BioMed Research International. 2014, 1-8;
- Elizabeth Martin Kutter, Sarah J Kuhl, Stephen T Abedon. (2015). Re-establishing a place for phage therapy in western medicine. Future Microbiology. 10, 685-688;
- Alan Fauconnier. (2017). Regulating phage therapy. EMBO Rep. 18, 198-200;
- Stephen T Abedon. (2015). Phage therapy of pulmonary infections. Bacteriophage. 5, e1020260;
- Dominik Nabergoj, Petra Modic, Aleš Podgornik. (2018). Effect of bacterial growth rate on bacteriophage population growth rate. MicrobiologyOpen. 7, e00558;
- Hilla Hadas, Monica Einav, Itzhak Fishov, Arieh Zaritsky. (1997). Bacteriophage T4 Development Depends on the Physiology of its Host Escherichia Coli. Microbiology. 143, 179-185;
- Stephen T. Abedon, Troy D. Herschler, David Stopar. (2001). Bacteriophage Latent-Period Evolution as a Response to Resource Availability. Appl Environ Microbiol. 67, 4233-4241;
- Daniel Bryan, Ayman El-Shibiny, Zack Hobbs, Jillian Porter, Elizabeth M. Kutter. (2016). Bacteriophage T4 Infection of Stationary Phase E. coli: Life after Log from a Phage Perspective. Front. Microbiol.. 7;
- Stephanie M. Amato, Mehmet A. Orman, Mark P. Brynildsen. (2013). Metabolic Control of Persister Formation in Escherichia coli. Molecular Cell. 50, 475-487;
- Catherine Loc-Carrillo, Stephen T. Abedon. (2011). Pros and cons of phage therapy. Bacteriophage. 1, 111-114;
- Benjamin K. Chan, Mark Sistrom, John E. Wertz, Kaitlyn E. Kortright, Deepak Narayan, Paul E. Turner. (2016). Phage selection restores antibiotic sensitivity in MDR Pseudomonas aeruginosa. Sci Rep. 6;
- Fedor Zurabov, Evgeniy Zhilenkov. (2021). Characterization of four virulent Klebsiella pneumoniae bacteriophages, and evaluation of their potential use in complex phage preparation. Virol J. 18;
- Thaysa Leite Tagliaferri, Mathias Jansen, Hans-Peter Horz. (2019). Fighting Pathogenic Bacteria on Two Fronts: Phages and Antibiotics as Combined Strategy. Front. Cell. Infect. Microbiol.. 9;
- Susan Maddocks, Aleksandra Petrovic Fabijan, Josephine Ho, Ruby C. Y. Lin, Nouri L. Ben Zakour, et. al.. (2019). Bacteriophage Therapy of Ventilator-associated Pneumonia and Empyema Caused by Pseudomonas aeruginosa. Am J Respir Crit Care Med. 200, 1179-1181.