Бактериофаги для отделения интенсивной терапии: российские исследователи проверили новый подход
26 февраля 2024
Бактериофаги для отделения интенсивной терапии: российские исследователи проверили новый подход
- 749
- 0
- 2
В больницах часто циркулируют устойчивые к антибиотикам бактерии, способные вызвать тяжелые инфекции. Российские исследователи предложили применять для профилактики и лечения бактериофаги и подбирать «фаговые коктейли» сразу для всех пациентов в одном отделении.
-
Автор
-
Редакторы
Интерес врачей и ученых к применению бактериофагов в лечении бактериальных инфекций продолжает расти во всем мире. Во многом это продиктовано нарастающей проблемой антибиотикорезистентности. У фагопрепаратов есть преимущества, но с их внедрением в клиническую практику возникает немало сложностей. Например, трудно совместить современные требования к клиническим исследованиям и регистрации лекарственных препаратов с необходимостью создавать для пациентов с инфекциями, вызванными разными видами и штаммами микроорганизмов, персонализированные коктейли из фагов. Эксперты ищут пути решения этой проблемы. Перспективный подход продемонстрировали исследователи из Федерального научно-клинического центра реаниматологии и реабилитологии (ФНКЦ РР) и НПЦ «Микромир». В своей работе, опубликованной 14 декабря 2023 года в журнале Antibiotics, они подбирали комбинации бактериофагов не индивидуально для каждого пациента, а с учетом бактерий, циркулирующих в отделении интенсивной терапии.
Бактериофаги

Партнер спецпроекта — НПЦ «Микромир» — производитель препаратов с бактериофагами для применения в медицине и ветеринарии.
Бактериофаги — это вирусы, заражающие бактериальные клетки. Они составляют наиболее многочисленную и эволюционно древнюю группу вирусов в биосфере Земли. Бактериофаги играют важную роль в контроле численности микробных популяций и в горизонтальном переносе бактериальных генов, выступая в качестве векторных систем.
В спецпроекте мы дадим общую информацию о бактериофагах, истории их изучения, использовании в лаборатории, попытках применения в медицине и ветеринарии и возможных будущих применениях.
Чем острее встает проблема антибиотикорезистентности [1], тем громче звучат разговоры о том, что нужно искать эффективную альтернативу антибиотикам. Обычно в первую очередь упоминают препараты на основе бактериофагов — вирусов, атакующих бактерии. Фанатов фаготерапии особенно много среди врачей постсоветского пространства. И это объяснимо: много десятилетий назад в странах Запада о «пожирателях бактерий» как терапевтических агентах практически забыли, сделав ставку на антибиотики, а в СССР это направление активно развивалось.
О том, как проходит «гонка вооружений» между учеными и бактериями, можно почитать в статье «Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?» [2]. А если вам интересно узнать подробнее о бактериофагах и их применении в медицине, то на эту тему у нас есть несколько материалов: «Огромный и загадочный мир бактериофагов» [3], «Бактериофаги в медицине» [4], «Пожиратели бактерий: убийцы в роли спасителей» [5].
Сейчас интерес к фагопрепаратам растет во всем мире. По сравнению с антибиотиками, у них есть яркие преимущества: фаги атакуют только определенные бактерии и не нарушают микрофлору; они эффективны против микроорганизмов, устойчивых к антибактериальной терапии; практически не вызывают побочных реакций; сами размножаются и обеспечивают оптимальную «дозу» в очаге инфекции [6].
Если бы были только плюсы, то фаги уже давно заменили бы антибиотики. Однако они по-прежнему не находят широкого применения в клинической практике из-за серьезных ограничений. Ахиллесовой пятой фаготерапии является в том числе и одно из ее главных преимуществ — слишком высокая избирательность атаки. Даже если взять коктейль из бактериофагов широкого спектра действия, они всё равно будут более селективны, чем антибиотики узкого спектра [6]. С одной стороны, это хорошо: антибиотики зачастую «выжигают» микрофлору и из-за этого могут вызывать неприятные симптомы, а бактериофаги филигранно уничтожают только тех, кого нужно.
Но у медали есть и обратная сторона. Благодаря широкому спектру действия, врач может назначить антибиотик эмпирически, даже не зная, какая бактерия вызвала инфекцию, и есть неплохая вероятность, что лекарство поможет. Фаги же всегда нужно тщательно подбирать: они эффективны только против определенных видов бактерий или даже против определенных их штаммов внутри одного вида.
Даже если фаг называют «поливалентным», то есть имеющим широкий спектр хозяев, это еще не означает, что он будет уничтожать всех возбудителей. Вирус может поражать разные виды бактерий, но при этом «выбирать» в каждом из них только определенные штаммы. Например, стафилококковый фаг φ812 инфицирует 95% из 782 штаммов золотистого стафилококка (Staphylococcus aureus) и только 43% штаммов других видов стафилококков из тех, что были проверены [7]. А фаг P-27/HP способен вызывать инфекцию у 60% из 28 изолятов (чистых культур, полученных из определенного источника) золотистого стафилококка [8]. И оба этих вируса в научной литературе называют поливалентными [9].
В клинической практике всё зачастую еще сложнее. Многие бактериальные инфекции вызваны не одним, а сразу несколькими возбудителями [10]. Получается, чтобы успешно применять фаготерапию, для каждого пациента нужно готовить индивидуальный «коктейль» из вирусов, а потом постоянно контролировать его эффективность и вносить коррективы. Ведь и фаги, и бактерии довольно быстро эволюционируют. Есть вероятность, что со временем возбудители станут устойчивыми к вирусам, и инфекция останется недолеченной.
Из-за этих и ряда других особенностей фагов как уникальных и сложных биологических объектов возникают огромные сложности с лицензированием фагопрепаратов.
Вирусы и бюрократия
В статье «Путь к тысячам аптек начинается с одной молекулы» [11] мы рассказывали, насколько это сложно, долго и дорого — провести все необходимые клинические испытания и зарегистрировать новый лекарственный препарат. В большинстве случаев фармпроизводителям достаточно пройти эти семь кругов ада всего раз (это если считать и клинические, и доклинические исследования). После этого можно начинать производство лекарства по одному утвержденному рецепту и отправлять его в клиники и аптеки.
А как же быть с бактериофагами, ведь их часто нужно подбирать индивидуально и периодически корректировать состав препаратов, чтобы бактерии не стали к ним устойчивыми?
Если формально считать фагопрепараты такими же лекарственными средствами, как и все остальные, то тут статья 13 российского Федерального закона от 12.04.2010 №61-ФЗ (ред. от 19.10.2023 г.) «Об обращении лекарственных средств» дает однозначные указания. Государственной регистрации подлежат не только новые препараты, но и «лекарственные препараты, зарегистрированные ранее, но произведенные в других лекарственных формах», а также «новые комбинации зарегистрированных ранее лекарственных препаратов». Получается, если смешать «старые» фаги в другом составе и пропорциях, то это уже новое лекарство, и его надо опять регистрировать. С таким подходом не может идти и речи о том, чтобы активно развивать фаготерапию и быстро обеспечивать каждого пациента именно тем препаратом, который нужен в его случае.
Аналогичная проблема есть и в других странах. В США фагопрепараты классифицируют как лекарства (drugs), в Европейском союзе — как лекарственные средства (medicinal product). Специальных правил, которые регулировали бы разработку новых бактериофагов и их применение в клинической практике, до сих пор нет. При этом многие эксперты отмечают, что для фагов нужны отдельные нормативные акты, с учетом уникальных особенностей фаготерапии [12].
Сторонники лечения бактериофагами среди врачей предпочитают не дожидаться, когда для них создадут идеальные условия, а используют доступные лазейки:
При лечении конкретного пациента, если проверенных вмешательств не существует или существующие не оказывают должного эффекта, врач, после консультации с экспертами и получения информированного согласия пациента или его законного представителя, может использовать непроверенное вмешательство, если, по мнению врача, его применение дает надежду спасти жизнь пациента, восстановить его здоровье или облегчить страдания. Такое вмешательство должно впоследствии стать объектом исследования, организованного с целью оценки его эффективности и безопасности. В любом случае, вся новая информация должна документироваться и, в соответствующих случаях, становиться публично доступной,
В частных беседах некоторые российские врачи рассказывали автору этой публикации о том, что зачастую они не могут «официально» назначить бактериофаги, но могут порекомендовать их пациенту, рассказать, что такие препараты есть, они способны помочь, но применять их придется, что называется, на свой страх и риск. Такая осторожность со стороны докторов тоже связана с пробелами в регулировании.
В поисках решений, которые устроят всех
Организации в разных странах, регулирующие процесс регистрации лекарственных препаратов, придерживаются весьма консервативной политики. Там работают люди, которые настороженно относятся к масштабным нововведениям, и у них на то есть веские причины. Нынешние подходы и правила выкристаллизовались ценой череды трагических ошибок и недосмотров .
О самых громких случаях мы рассказывали в материале «Доверяй, но проверяй: как контролируют эффективность и безопасность лекарств и других продуктов после регистрации?» [13]. А о том, как врачи и ученые постепенно пришли к современной концепции клинических исследований, можно почитать в статье «С миру по нитке: как соединились компоненты клинического исследования» [14].
Но у регуляторов совсем нет задачи ставить палки в колеса хорошим инициативам и лишать пациентов потенциально полезных лекарственных препаратов. Эксперты ищут способы окончательно вывести фаготерапию из тени и предлагают подходы к лицензированию, которые устраивали бы всех.
Самого большого прогресса на данный момент удалось добиться в Бельгии. В 2016 году на заседании Палаты представителей министр социальных дел и здравоохранения признал, что в Европе не предусмотрено специального регулирования для фаготерапии, и это проблема. После обсуждения вопроса с учеными из военного госпиталя королевы Астрид в Брюсселе, в 2017 году бактериофаги было решено классифицировать как магистральные препараты. Так в Бельгии и других странах Европы называют «любой лекарственный препарат, приготовленный в аптеке в соответствии с медицинским рецептом для отдельного пациента» [15]. То есть производители поставляют в аптеку только ингредиенты — в данном случае отдельные бактериофаги. А уже фармацевт готовит подходящий коктейль для отдельно взятого пациента. На рисунке 1 показано, как работает эта схема.
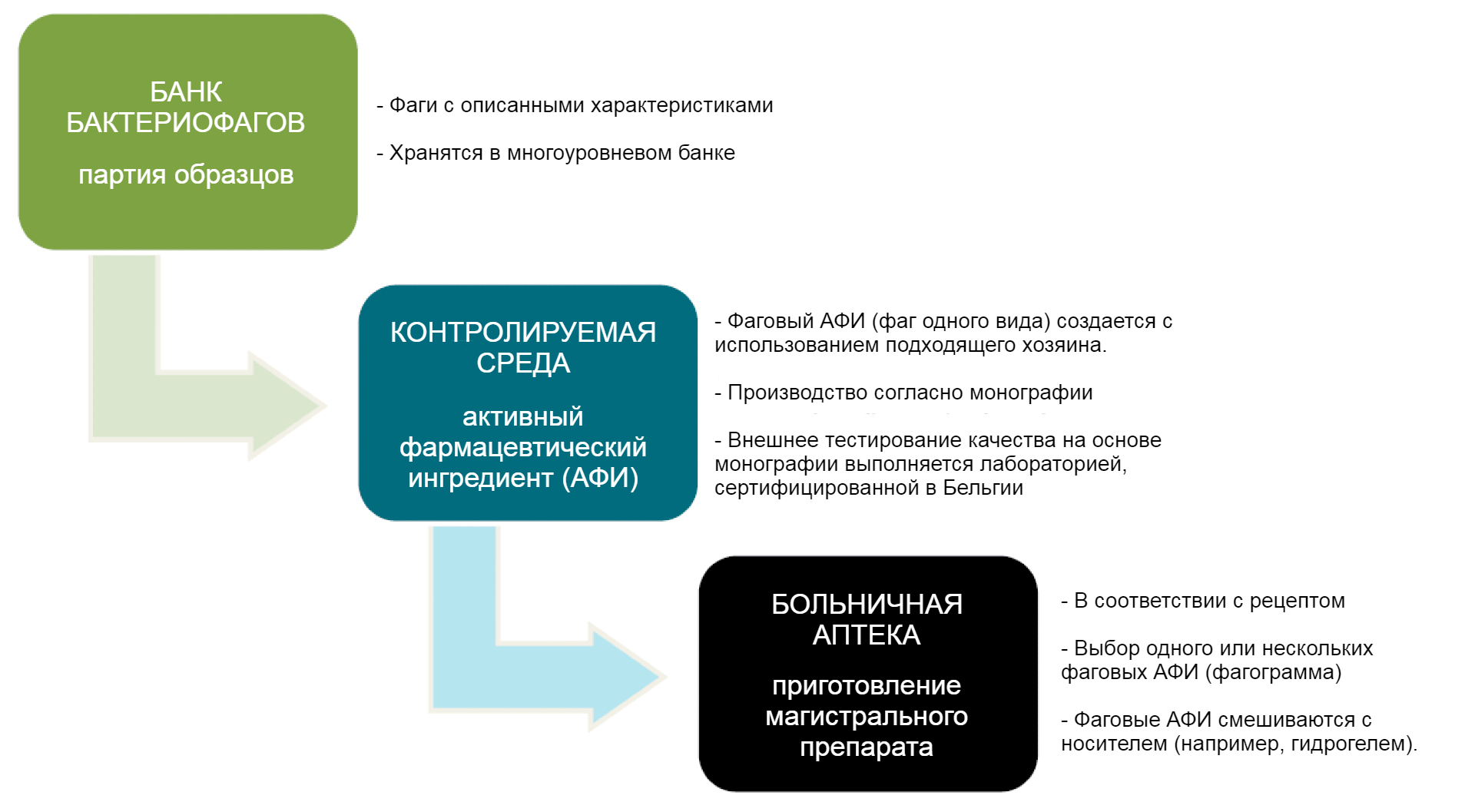
Рисунок 1. Схема применения бактериофагов в качестве магистральных препаратов. Всё начинается с того, что в банке фагов отбирают одну партию «фаговых семян» с описанными характеристиками. Из этой партии получают фаговый активный фармацевтический ингредиент (АФИ). Его свойства и качество проверяют во внешней лаборатории. Фаговые АФИ имеют право производить как государственные, так и частые компании; к каждой партии прилагается запись с подробным описанием процесса ее производства. Затем АФИ вместе с протоколом регистрации партии и результатами проверки во внешней лаборатории передают в больничную аптеку. Там из нужных АФИ уже делают магистральные препараты. Состав таких лекарств подбирают в соответствии с чувствительностью возбудителей у того или иного пациента к тем или иным фагам — так называемой фагограммой (по аналогии с антибиотикограммой).
Этот подход — неплохой компромисс. Он позволяет и строгие требования со стороны регулирующих организаций соблюсти, и быстро вводить в клиническую практику препараты на основе бактериофагов, готовить для каждого пациента персонализированное лекарство.
Российское законодательство тоже дает возможность реализовать такую схему. Существует приказ Министерства здравоохранения РФ от 22 мая 2023 г. №249н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, имеющими лицензию на фармацевтическую деятельность». Он разрешает производство препаратов «аптечными организациями, имеющими лицензию на фармацевтическую деятельность, в том числе по рецептам на лекарственные препараты и по требованиям медицинских организаций». При этом допустимо использовать «лекарственные препараты и (или) фармацевтические субстанции, включенные в государственный реестр лекарственных средств для медицинского применения, единый реестр зарегистрированных лекарственных средств Евразийского экономического союза».
Тут стоит немного пояснить термины. Они прописаны в статье 4 Федерального закона от 12.04.2010 №61-ФЗ (ред. от 30.01.2024 г.) «Об обращении лекарственных средств»:
- Лекарственные препараты
- лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности.
То есть в данном случае речь идет об уже готовых таблетках и микстурах, произведенных на заводе. Аптеки могут использовать их, чтобы готовить индивидуально для пациентов свои препараты. К слову, такую практику в России решили вернуть совсем недавно.
- Фармацевтическая субстанция
- лекарственное средство в виде одного или нескольких обладающих фармакологической активностью действующих веществ вне зависимости от природы происхождения, которое предназначено для производства, изготовления лекарственных препаратов и определяет их эффективность.
По сути это то же сырье, которое используют на заводах фармкомпаний.
Что примечательно, уже упомянутая выше статья 13 закона «Об обращении лекарственных средств» прямо говорит, что лекарственные препараты, изготовленные в аптеках, и фармацевтические субстанции не подлежат государственной регистрации. Это позволяет избежать некоторых бюрократических процедур. Очень похоже на бельгийскую схему, которая отлично подошла для фагопрепаратов.
Теперь, после такого долгого вступления, пришло время поговорить о том, что сделали российские исследователи, какие результаты получили, и как это поможет в развитии фаготерапии.
Лекарство для всего отделения
Российские ученые и врачи решили подойти к решению проблемы персонализированной фаготерапии с неочевидной стороны: готовить препараты не для отдельно взятых пациентов, а сразу для всей клиники или отделения, с учетом циркулирующих там болезнетворных бактерий. Такой подход был назван адаптивной фаготерапией [12], и она должна помочь в профилактике и лечении внутрибольничных (нозокомиальных) инфекций.
Внутрибольничные инфекции в настоящее время являются серьезной проблемой. Несмотря на все мероприятия по соблюдению асептики и антисептики, в клиниках зачастую обитают микроорганизмы, которые уже давно вынуждены противостоять антибиотикам и приобрели лекарственную устойчивость. Эти «бывалые» бактерии стали для врачей большой головной болью. Внутрибольничные инфекции уносят множество жизней [16]. Причем в пределах одного отделения пациентов зачастую заставляют тяжело болеть и убивают одни и те же виды и штаммы микроорганизмов. Это и навело ученых на мысль использовать фагопрепараты, подобранные сразу для всего отделения. По задумке авторов исследования, такой подход помог бы сэкономить время, быстрее подбирать эффективные препараты и оперативно начинать лечение.

Основное отличие предложенного подхода от классической «индивидуальной фаготерапии» заключается в том, что подбор бактериофагов осуществляется не к штаммам бактерий, выделенным у одного человека, а ко всему спектру патогенов, циркулирующих в отделении реанимации и интенсивной терапии. Это сокращает время принятия решения и позволяет немедленно начать применение фагов при поступлении пациента в учреждение, тем самым дает возможность предупреждать возникновение и развитие бактериальных инфекций. Применение описанного протокола позволит снизить количество используемых антибиотиков и сохранить их эффективность. Наша главная цель с коллегами из ФНКЦ РР — улучшить качество лечения и ухода за пациентами в критическом состоянии, способствовать их скорейшей реабилитации и возвращению к качественной жизни в социуме.
Идею проверили в отделении интенсивной терапии Федерального научно-клинического центра реаниматологии и реабилитологии» (ФНКЦ РР). Фаги решили использовать для профилактики и лечения внутрибольничной пневмонии. В качестве производителя препаратов выступил НПЦ «Микромир». Исследователи составили протокол адаптивной фаготерапии — его схема представлена на рисунке 2.
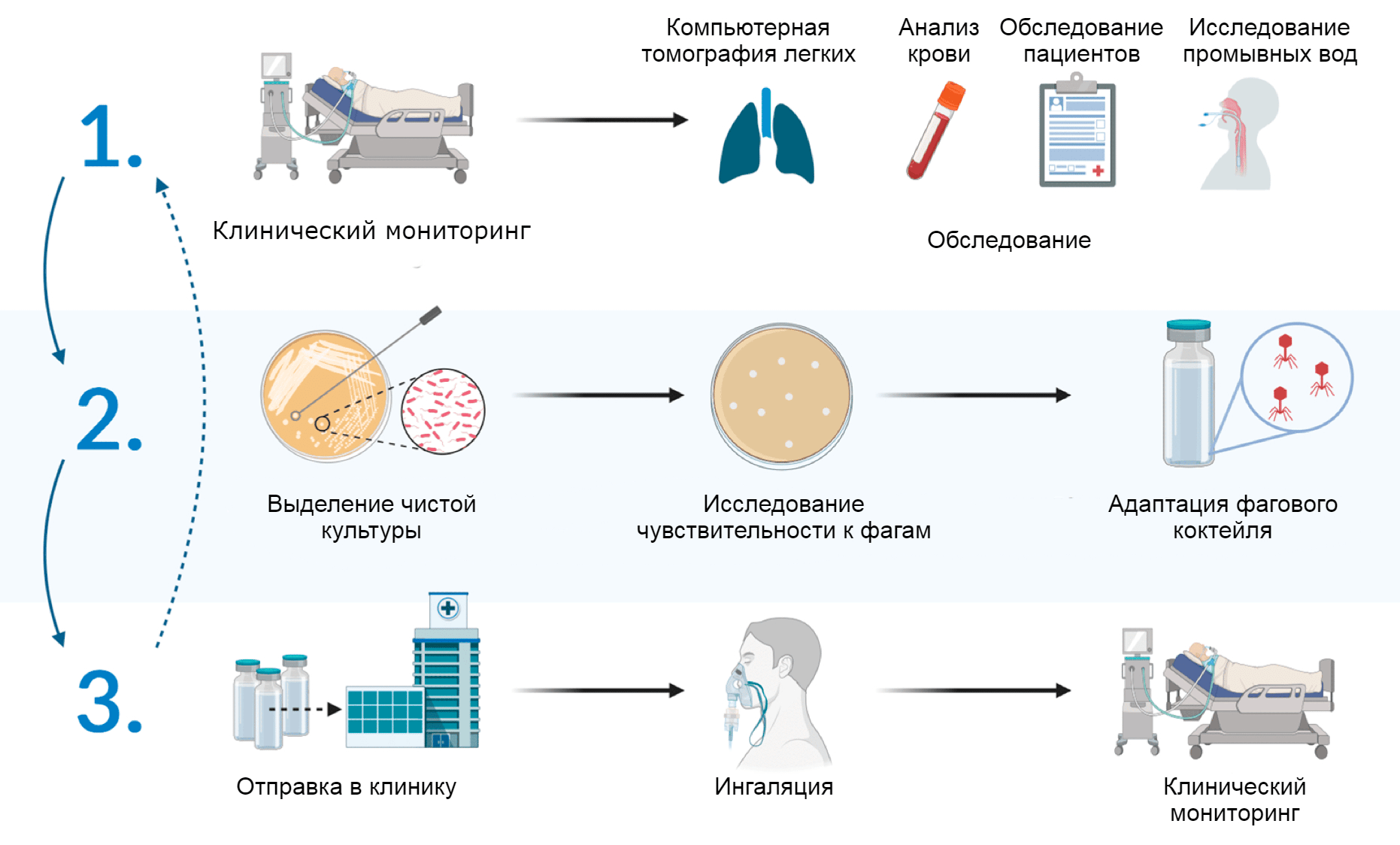
Рисунок 2. Протокол адаптивной фаготерапии для пациентов отделения интенсивной терапии. На первом этапе в клинике проводят обследование и получают у пациентов материал для микробиологического контроля. На втором этапе сотрудники лаборатории выделяют чистые культуры возбудителей и проверяют, к каким бактериофагам они чувствительны. На третьем этапе специально подобранный коктейль из фагов отправляют в клинику. В процессе его применения проводят контрольные обследования и оценивают эффективность.
Исследование было небольшим, но результаты получились весьма обнадеживающими. Авторы описали клинические случаи с тремя пациентами: женщиной 42 лет и двумя мужчинами 59 и 73 лет. Изначально все они поступили в клинику с кровоизлияниями в головном мозге.
Против каждой выделенной болезнетворной бактерии подобрали 3–4 вирулентных фага и включили их в коктейль. Лечение проводили в течение 28 дней в виде ингаляций (аэрозоль из небулайзера) дважды в день. При этом ни один пациент не получал антибиотиков. Результаты лечения показали, что подобранные фаги справились со своими задачами весьма успешно:
- У всех пациентов перестали выделяться бактерии с множественной лекарственной устойчивостью: клебсиеллы (K. pneumoniae), золотистые стафилококки (S. aureus) и ацинетобактеры (A. baumannii).
- У всех улучшилось состояние ткани легких по результатам компьютерной томографии.
- У всех пациентов в крови снизился уровень вещества, сигнализирующего о воспалении — C-реактивного белка.
- У некоторых пациентов из-за инфекции в крови повысился уровень белка прокальцитонина — после фаготерапии он тоже снизился, и это свидетельствовало о стихании инфекционного процесса.
- Состояние всех трёх больных в целом улучшилось.
Конечно, всего трое пациентов — это мало, поэтому авторы научной работы отметили, что результаты нужно перепроверить в более крупных исследованиях. Но первый шаг сделан, и он показал, что в этом направлении стоит работать дальше. Адаптивная фаговая терапия продемонстрировала эффективность. Потенциально она может помочь в борьбе с опасными бактериями, снизить потребность пациентов в антибиотиках и тем самым притормозить появление новых устойчивых возбудителей. А подход, когда препараты подбирают сразу для всего отделения, позволяет начинать лечение в тот же день, когда пациент поступает в палату. Не нужно ждать, пока именно у него возьмут анализы, выделят болезнетворные бактерии и проверят их на чувствительность к фагам [12].
Чтобы широко внедрить адаптивную фаготерапию в клиническую практику, по мнению авторов исследования, нужна сеть фаговых центров и авторизованных лабораторий, которые будут работать в сотрудничестве с клиниками. А чтобы не было бюрократической волокиты, необходимо создать запас зарегистрированных фармацевтических субстанций на основе разных фагов. К слову, в России такой процесс регистрации уже идет.
Литература
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Огромный и загадочный мир бактериофагов;
- Бактериофаги в медицине;
- Пожиратели бактерий: убийцы в роли спасителей;
- Catherine Loc-Carrillo, Stephen T. Abedon. (2011). Pros and cons of phage therapy. Bacteriophage. 1, 111-114;
- Roman Pantůček, Alena Rosypalová, Jiřı́ Doškař, Jana Kailerová, Vladislava Růžičková, et. al.. (1998). The Polyvalent Staphylococcal Phage φ812:Its Host-Range Mutants and Related Phages. Virology. 246, 241-252;
- Ragini Gupta, Yogendra Prasad. (2011). Efficacy of Polyvalent Bacteriophage P-27/HP to Control Multidrug Resistant Staphylococcus aureus Associated with Human Infections. Curr Microbiol. 62, 255-260;
- Alexa Ross, Samantha Ward, Paul Hyman. (2016). More Is Better: Selecting for Broad Host Range Bacteriophages. Front. Microbiol.. 7;
- Jiaxi Lin, Fangyuan Du, Miao Long, Peng Li. (2022). Limitations of Phage Therapy and Corresponding Optimization Strategies: A Review. Molecules. 27, 1857;
- Путь к тысячам аптек начинается с одной молекулы;
- Fedor Zurabov, Marina Petrova, Alexander Zurabov, Marina Gurkova, Petr Polyakov, et. al.. (2023). Adaptive Phage Therapy for the Prevention of Recurrent Nosocomial Pneumonia: Novel Protocol Description and Case Series. Antibiotics. 12, 1734;
- Доверяй, но проверяй: как контролируют эффективность и безопасность лекарств и других продуктов после регистрации?;
- С миру по нитке: как соединились компоненты клинического исследования;
- Jean-Paul Pirnay, Gilbert Verbeken, Pieter-Jan Ceyssens, Isabelle Huys, Daniel De Vos, et. al.. (2018). The Magistral Phage. Viruses. 10, 64;
- Sikora F. and Zahra F. Nosocomial Infections. Treasure Island (FL): StatPearls Publishing, 2024.