
Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021)
05 октября 2021
Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021)
- 2778
- 0
- 6
Нобелевские лауреаты этого года Дэвид Джулиус и Ардем Патапутян
-
Автор
-
Редакторы
Американские нейробиологи Дэвид Джулиус и Ардем Патапутян стали лауреатами Нобелевской премии по физиологии или медицине в 2021 году. Премией отмечено открытие рецепторов температуры и прикосновения, благодаря которым мы чувствуем также обжигающий вкус острой еды или мягкость пуховой перины. Премия этого года продолжает славную традицию поощрять исследования сенсорных систем — до того в 2012 году награду по химии присудили за изучение GPCR-рецепторов, дающих нам еще три чувства.
Важно понимать, что происходит
Возможность в полной мере воспринимать окружающую среду всегда являлась важным эволюционным преимуществом. Чем лучше организм понимает, в каком положении находится, в каком состоянии его системы органов и где он может найти прибежище, тем для него лучше. Вся полученная через различные рецепторы информация определяет дальнейшее поведение организма, именно поэтому преобразование внешних воздействий в биологические сигналы играет решающую роль в физиологии. «Биомолекула» уже немало писала про рецепторы, и для начала — если ты терпелив, читатель, — мы приглашаем ознакомиться с рецепторами, за которые дали «Нобеля» в прошлый раз (в 2012 году, и по химии [1]), в частности — со зрительным рецептором родопсином [2].
У млекопитающих многие реакции регулируются с помощью механотрансдукции — преобразования механических стимулов в понятный клеткам электрохимический потенциал действия. Эмбриональное развитие, осязание, боль, проприоцепция (ощущение относительного положения частей тела и их движения), слух, регулировка кровотока, рост и повреждение легких, гомеостаз костей и мышц — всё это управляется механотрансдукцией [3], [4]. У растений механическая сила влияет на морфогенез, например, при формировании боковых корней [5]. Одноклеточные организмы, такие как инфузории, чувствуют прикосновение и изменяют направление движения в ответ на тактильный стимул [6]. Механотрансдукция в волосковых клетках внутреннего уха позвоночных происходит чрезвычайно быстро, задействуя ионный канал, непосредственно активируемый внешней силой [7].
Также не стоит забывать о терморецепции. Любому организму важно верно оценивать температуру окружающей среды, чтобы выбирать подходящие для себя тепловые условия, а также чтобы избежать повреждений экстремальными температурами. Основа терморецепции — преобразование тепловой энергии в биологические сигналы: это и делают белковые терморецепторы. У животных развилось огромное разнообразие термосенсорных механизмов, позволяющих им чувствовать изменения температуры и реагировать на них. У людей этот процесс имеет решающее значение для гомеостатического поддержания температуры тела, а также для поведенческих реакций на температуру окружающей среды, таких как ношение пальто на улице, когда идет снег; или использование ухватки, чтобы вытащить горячий противень из духовки.
Каждый день наш организм обрабатывает информацию от сотен и тысяч объектов, которых мы касаемся, переносим, употребляем в пищу. Мозг постоянно получает сигналы от внешней среды и внутренних органов и реагирует соответственно. Однако до открытий Дэвида Джулиуса и Ардема Патапутиана в нейрофизиологической картине мира всё еще зиял заметный пробел: как именно температура и механические стимулы превращаются в электрические импульсы в нервной системе?
Горячо — холодно
Первым за изучение терморецепции взялся Дэвид Джулиус. В 1997 году он с коллегами изучал реакцию клеток на капсаицин — алкалоид, содержащийся в различных видах стручкового перца. Все мы знаем, что если съесть много перца, во рту будут чувствоваться жжение и боль . Необходимо было выявить рецептор, ответственный за эти ощущения. Джулиус и его сотрудники создали библиотеку генов, работающих в сенсорных нейронах: по их расчетам, там должен был оказаться и белок, реагирующий на капсаицин. Они экспрессировали отдельные гены из этой коллекции в культивируемых клетках, которые на капсаицин реагировать не должны, и после кропотливых поисков был найден тот самый ген, придающий клеткам чувствительность к капсаицину.
Однако, диалектическим образом, где боль — там и обезболивание. При определенных условиях капсаицин и его аналоги могут послужить и для избавления от страданий: «Жгучий перец облегчит боль» [8], «Молекулярная биология боли» [9].
Дальнейшие эксперименты показали, что этот ген кодирует новый ионный канал, позже названный TRPV1. Его функция — определение и регуляция температуры тела, а также восприятие жгучей боли, связанной с воспалением в периферических тканях [10]. Исследовали его способность реагировать на тепло, и выяснили, что этот канал начинает пропускать ионы при температуре выше 43 °C: именно в этот момент мы начинаем чувствовать боль [11]. Проверить это несложно: сидя в ванной, включите горячую воду; а когда будет уже невтерпеж, измерьте температуру.
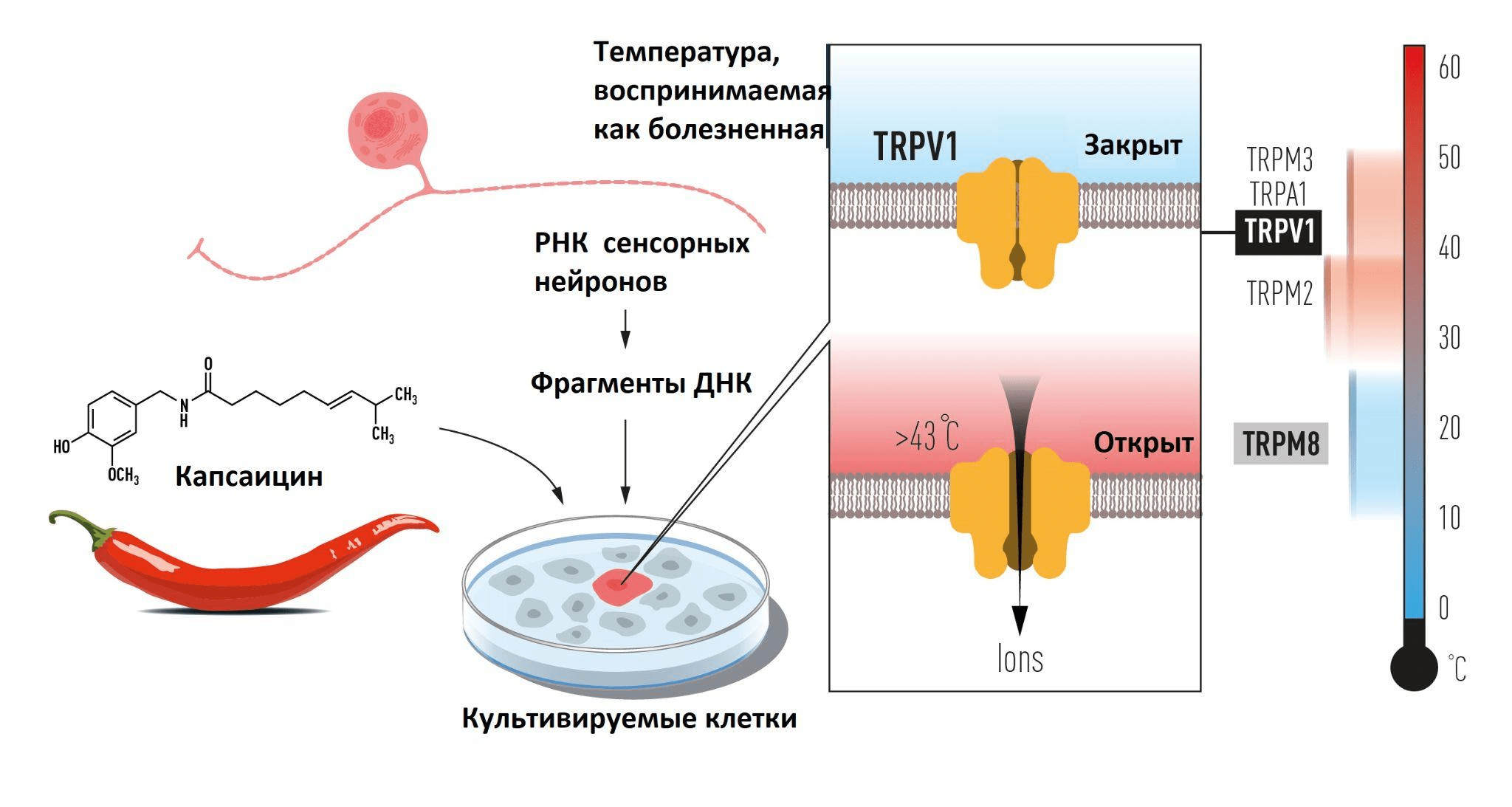
Рисунок 1. Схема эксперимента, в котором капсаицин был использован для идентификации TRPV1 — ионного канала, активируемого теплом. Справа показаны другие ионные каналы, активирующиеся при различных температурах.
Press release: The Nobel Prize in Physiology or Medicine 2021, рисунок адаптирован
В лаборатории Джулиуса проводят не только биохимические исследования: трехмерные структуры канала TRPV1 (причем сразу в двух состояниях: открытом [12] и закрытом [13]), а потом и родственных белков, также были получены здесь. Кстати, сделано это было при помощи совсем «свежего» на тот момент метода криоэлектронной микроскопии, вскоре после того удостоенного своей «Нобелевки» [14].
Параллельные открытия
Основываясь на своей работе по терморецепторам, в 2002 году Дэвид Джулиус обнаружил «холодовой» рецептор и назвал его CMR1 [15]. Однако в это же время Ардем Патапутян также обнаружив этот рецептор, назвал его TRPM8 и показал, что он дополнительно активируется ментолом [16], [17]. Забавно, что оба эти открытия произошли одновременно, однако полностью независимо друг от друга.
В итоге научным сообществом было принято обозначение рецептора TRPM8. В дальнейшем открыли и другие ионные каналы семейства TRP, и обнаружили, что они активируются в широком диапазоне физиологических температур. С помощью генетически модифицированных мышей, у которых «выключали» эти гены [18], изучили механизмы терморецепции. Впоследствии эти открытия помогли в разработке анальгетических и противовоспалительных препаратов, регулирующих активность подобных каналов. К примеру, препараты, воздействующие на канал TRPM8, препятствуют холодовой гиперчувствительности, в том числе вызванной хроническими состояниями, такими как диабет или рак [19].
На меня оказывают давление!
Пока шло активное изучение и идентификация новых терморецепторов на мембране клеток, оставалось непонятным, как механические стимулы преобразуются в ощущения прикосновений. Однако продолжалось это недолго: уже в 2010 году Ардем Патапутян с коллегами написал статью, в которой описал этот механизм [20]. Исследователи брали клетки, которые испускали электрический сигнал, когда на них оказывали давление (в ходе экспериментов их протыкали микропипеткой). Была собрана библиотека из 72 генов-кандидатов, кодирующих возможные рецепторы. Эти гены «выключали» один за другим, чтобы обнаружить ген, ответственный за механочувствительность. Так удалось определить единственный белок, без которого клетки теряли чувствительность к прикосновениям: им оказался механочувствительный ионный канал Piezo1; впоследствии открыли и похожий на него Piezo2.
Но как он работает? Для ответа на этот вопрос достаточно взглянуть на его структуру. Термочувствительные каналы меняют конформацию и начинают пропускать ионы под влиянием температуры, ну а их механочувствительные собратья изменяются буквально под давлением обстоятельств!
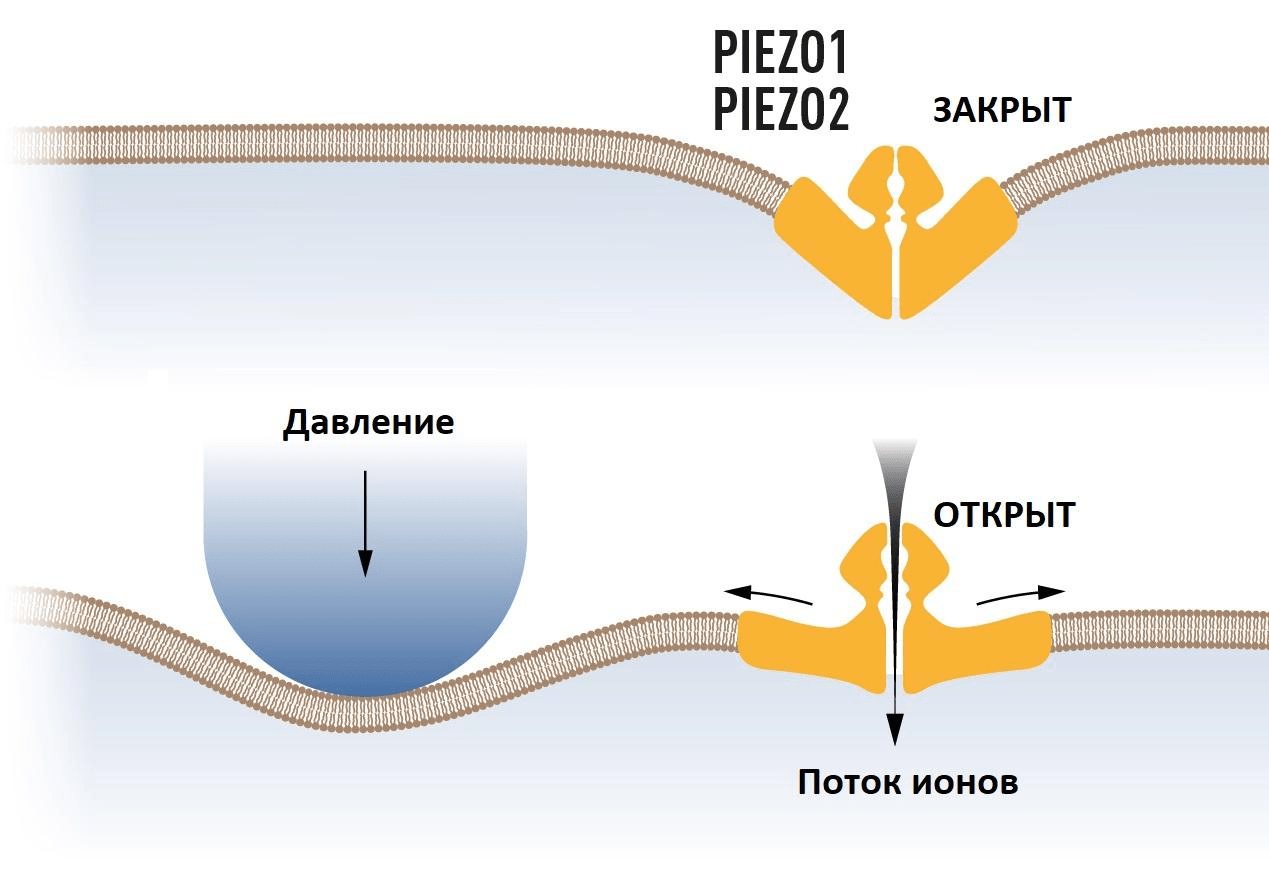
Рисунок 2. Схема работы каналов Piezo1 и Piezo2. При внешнем воздействии мембрана клетки изменяется, каналы открываются и начинают пропускать ионы.
Press release: The Nobel Prize in Physiology or Medicine 2021, рисунок адаптирован
Было также показано, что Piezo2 отвечает за восприятие положения и движения тела в пространстве — проприоцепцию. Оба этих канала регулируют важные физиологические процессы, например артериальное давление [21] и растяжение мочевого пузыря [22].
Что же в итоге?
Эти открытия позволили понять процесс преобразования внешних воздействий в нервный импульс, а выявленные ионные каналы оказались важны для понимания многих физиологических процессов и лечения болезней. Уже много лет эти знания используются для разработки и производства новых лекарств. Исследователи, помимо Нобелевской премии, уже получали престижные награды: в 2020-м они на двоих получили премию Квали в области нейронаук, а в этом году Ардем Патапутян был удостоен премии Frontiers of Knowledge Award.
Выбор Нобелевского комитета был неочевиден, учитывая множество интригующих работ на конкурсе в этом году. В списке фаворитов (традиционно формируемом агентством научной информации Clarivate) были исследования известного ученого Жана-Пьера Шанжё, открывшего ацетилхолиновый рецептор никотинового типа ; открытие японскими учеными Тосио Хирано и Тадамицу Кисимото интерлейкина-6 — противовоспалительного вещества из группы цитокинов; а также разработка метода оптогенетики Карлом Дессейротом. По доброй традиции, никто из названных заранее фаворитов не получил премии. Однако ни у кого нет сомнений, что Нобелевская премия как символ высшего признания достижений научным сообществом была выдана абсолютно заслуженно, за прорыв в области механо- и терморецепции.
Стоит отметить, что работы Шанжё в некотором смысле предвосхитили многие современные исследования рецепторов, ибо он предложил концепции аллостерии и кооперативного действия мультимерных рецепторов, имеющие отношение сразу ко многим рецепторам и ионным каналам. Согласно идеям Шанжё, канал может пребывать не только в открытом и закрытом состояниях, но также в особой неактивной форме — десенситизированной, которая в течение некоторого времени нечувствительна к любым воздействиям. Такие состояния были обнаружены у многих рецепторов.
Литература
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Martin Chalfie. (2009). Neurosensory mechanotransduction. Nat Rev Mol Cell Biol. 10, 44-52;
- Owen P. Hamill, Boris Martinac. (2001). Molecular Basis of Mechanotransduction in Living Cells. Physiological Reviews. 81, 685-740;
- Gabriele B. Monshausen, Simon Gilroy. (2009). Feeling green: mechanosensing in plants. Trends in Cell Biology. 19, 228-235;
- Kenji Iwatsuki, Tadayoshi Hirano. (1995). Induction of the thigmotaxis in Paramecium caudatum. Comparative Biochemistry and Physiology Part A: Physiology. 110, 167-170;
- D.P. Corey, A.J. Hudspeth. (1979). Response latency of vertebrate hair cells. Biophysical Journal. 26, 499-506;
- Жгучий перец облегчит боль;
- Молекулярная биология боли;
- John P.M. White, Laszlo Urban, Istvan Nagy. (2011). TRPV1 Function in Health and Disease. CPB. 12, 130-144;
- Michael J. Caterina, Mark A. Schumacher, Makoto Tominaga, Tobias A. Rosen, Jon D. Levine, David Julius. (1997). The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature. 389, 816-824;
- Erhu Cao, Maofu Liao, Yifan Cheng, David Julius. (2013). TRPV1 structures in distinct conformations reveal activation mechanisms. Nature. 504, 113-118;
- Maofu Liao, Erhu Cao, David Julius, Yifan Cheng. (2013). Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504, 107-112;
- Крупные подробности микроскопического мира: Нобелевская премия по химии 2017;
- David D. McKemy, Werner M. Neuhausser, David Julius. (2002). Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature. 416, 52-58;
- Andrea M. Peier, Aziz Moqrich, Anne C. Hergarden, Alison J. Reeve, David A. Andersson, et. al.. (2002). A TRP Channel that Senses Cold Stimuli and Menthol. Cell. 108, 705-715;
- «Мятный холодок»: почему ментол создаёт ощущение прохлады во рту;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Mustafa Nazıroğlu, Nady Braidy. (2017). Thermo-Sensitive TRP Channels: Novel Targets for Treating Chemotherapy-Induced Peripheral Pain. Front. Physiol.. 8;
- B. Coste, J. Mathur, M. Schmidt, T. J. Earley, S. Ranade, et. al.. (2010). Piezo1 and Piezo2 Are Essential Components of Distinct Mechanically Activated Cation Channels. Science. 330, 55-60;
- Wei-Zheng Zeng, Kara L. Marshall, Soohong Min, Ihab Daou, Mark W. Chapleau, et. al.. (2018). PIEZOs mediate neuronal sensing of blood pressure and the baroreceptor reflex. Science. 362, 464-467;
- Marianela G. Dalghi, Dennis R. Clayton, Wily G. Ruiz, Mohammad M. Al-bataineh, Lisa M. Satlin, et. al.. (2019). Expression and distribution of PIEZO1 in the mouse urinary tract. American Journal of Physiology-Renal Physiology. 317, F303-F321.






