
Власть колец: всемогущие кольцевые РНК
13 февраля 2018
Власть колец: всемогущие кольцевые РНК
- 2503
- 0
- 15
Почти не изученный мир кольцевых РНК полон тайн и загадок
-
Автор
-
Редакторы
Темы
В клетках эукариот гены, как правило, экспрессируются с образованием линейных молекул РНК. Однако по матрице многих генов синтезируются и ковалентно замкнутые кольцевые РНК. Эти молекулы почти 40 лет были обделены вниманием молекулярных биологов, и, как оказалось, совершенно незаслуженно. Недавние успехи в секвенировании РНК показали, что кольцевые РНК считываются с тысяч разных генов, и постепенно накапливаются сведения о многообразии и важности функций этих «темных лошадок». Выяснилось, например, что синтез некоторых кольцевых РНК связан с развитием ряда заболеваний, в том числе онкологических и болезни Альцгеймера. А это значит, что у нас появился прекрасный повод поговорить о биологии кольцевых РНК и их связи со здоровьем человека.
Мир рибонуклеиновых кислот удивительно богат: есть в нём и крупные молекулы, несущие информацию о структуре белков, и малые, регулирующие синтез этих самых белков, и те, что входят в состав рибосом и ферментов или даже сами, без белковой помощи выполняют ферментативные функции [1]. Удивительно разнообразны не только функции, но и пространственные структуры этих молекул — причудливые сочетания петель, шпилек, псевдоузлов и т.п. [2]. В этом молекулярном калейдоскопе затерялся особый, слабо изученный класс РНК — молекулы, ковалентно замкнутые в кольцо. Впервые кольцевые РНК обнаружили еще в 1979 году, однако тогда они не привлекли к себе должного внимания и были приняты всего-навсего за побочные продукты сплайсинга, не наделенные какими-то особыми клеточными ролями. Однако недавно выяснилось, что не так уж и просты эти колечки: многие из них выполняют регуляторные функции и даже причастны к серьезным проблемам со здоровьем. Откуда же берутся эти загадочные молекулы и как они работают?
Как транскрипт может превратиться в кольцо?
Теоретически кольцевую РНК (англ. circular RNA, circRNA) можно получить тремя разными способами.
Во-первых, в ходе сплайсинга [3] интроны удаляются из созревающего транскрипта не в виде линейного фрагмента, а в виде лассо. Если от этого лассо отрезать «хвост», то получится кольцевая РНК. Такие интронные кольцевые молекулы накапливаются преимущественно в ядре и обозначаются ciRNA (circular intronic long non-coding RNAs) [4].
Во-вторых, в созревающем транскрипте отдельные экзоны могут выпетливаться, и такие петли могут вырезаться сплайсосомой и ковалентно замыкаться в кольцо. Так образуются кольцевые РНК, состоящие только из одного экзона. Кольцевые РНК, которые состоят исключительно из экзонов — одного или нескольких, — объединяют в группу ecircRNA (exonic circRNAs) и обычно находят в цитоплазме [4].
В-третьих, выпетливаться может участок, содержащий несколько интронов и экзонов. При вырезании и замыкании сплайсосомой такой петли формируются кольцевые РНК, содержащие и экзоны, и интроны. Они локализуются преимущественно в ядре и обозначаются EIciRNA (exon-intron circRNAs). Эти молекулы могут продолжить сплайсироваться, и после удаления интронов из них получатся кольцевые РНК, состоящие из нескольких экзонов (рис. 1) [4].
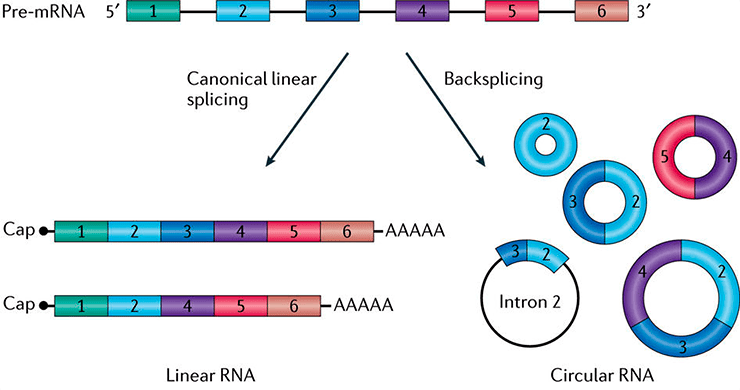
Рисунок 1. Схема, иллюстрирующая разнообразие кольцевых РНК.
Процесс вырезания сплайсосомой выпетливающихся участков транскрипта называется бэксплайсингом (англ. backsplicing). За счет чего происходит такое выпетливание?
- Зачастую интроны, окружающие один экзон, содержат комплементарные друг другу инвертированные повторы, которые, образуя водородные связи, формируют «стебелек» петли (рис. 2).
- Выпетливание может происходить при участии специальных белков: два мономера такого белка связываются с двумя концами будущей петли, димеризуются и сближают концы так, что сплайсосома может ковалентно сшить их. Пока известны три белка, регулирующих образование некоторых кольцевых РНК: Quaking (QKI), Muscleblind (Mbl/MBNL1—3) и Fusedinsarcoma (FUS). Так, Muscleblind регулирует образование circRNA своего же гена, связываясь с особыми участками в интронах незрелого транскрипта (рис. 3).
Кроме того, образование кольцевых РНК зависит от белков, которые связываются с незрелой мРНК в сайтах вырезания кольцевых РНК, делая их недоступными для сплайсосомы.
Обобщая, можно сказать, что биогенез кольцевых РНК — это сложный процесс, регулируемый комбинацией многих факторов, в том числе расположением инвертированных повторов и взаимодействием с белками, которые опосредуют выпетливание или, напротив, делают бэксплайсинг невозможным [4].
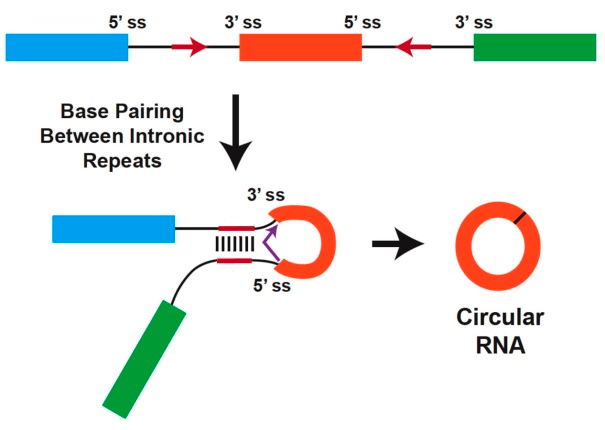
Рисунок 2. Участие инвертированных повторов в образовании кольцевых РНК. Чтобы одноцепочечная РНК образовала петлю, она должна содержать комплементарные последовательности нуклеотидов: например, ...AAACGC.....GCGUUU... Это возможно, если в ДНК, с которой такая РНК считалась, есть инвертированные повторы — например, ретроэлементы SINE [13]. Комплементарное взаимодействие повторов, находящихся в интронах, сближает сайты сплайсинга на 5′- и 3′-концах «внутреннего» экзона (или нескольких экзонов), чем и провоцирует образование кольцевой РНК.
Интересно, что у некоторых архей образование рибосомных РНК (рРНК) протекает через стадию кольцевой молекулы-предшественницы, которая далее нарезается на отдельные рРНК [5].
Кругооборот кольцевых РНК
Лишенные свободных концов, кольцевые РНК не по зубам ферментам-экзонуклеазам, которые разрушают многие транскрипты упорным отщеплением концевых нуклеотидов. В связи с этим средняя кольцевая РНК более стабильна, чем линейная мРНК: circRNA живет 19–24 часа (иногда до 48 часов), что в 2–5 (а то и в 10) раз превышает возможности линейных молекул. Однако как же всё-таки разрушаются кольцевые РНК?
Существует несколько гипотез на этот счет.
- Кольцевые РНК могут расщеплять эндонуклеазы, которые разрушают нуклеиновые кислоты не с концов, а «вгрызаются» во внутренние части молекулы. Вероятно, в этом случае за разрушение отвечает комплекс, содержащий микроРНК, «наводящие» эндонуклеазы группы Argonauteна молекулы-мишени [1], [6].
- В circRNA, подлежащих разрушению, некоторые аденозины могут специфически метилироваться. Такие метилированные РНК распознаются особыми белками, переносящими их в места деградации рибонуклеиновых кислот — так называемые Р-тельца.
- В разрушении circRNA могут быть задействованы особые органеллы — аутофагосомы, среди прочего содержащие эндонуклеазы [7].
- Клетки могут выбрасывать излишние circRNA в кровь в составе мембранных пузырьков — внеклеточных везикул.
Если для первого гипотетического пути разрушения кольцевых РНК есть некоторые экспериментальные подтверждения, то остальные модели еще ожидают своей проверки опытом [4].
Функции кольцевых РНК
Описаны биологические эффекты как самих кольцевых РНК, так и процесса их образования. Кроме того, кольцевые РНК могут кодировать пептиды, которые тоже выполняют определенные клеточные функции.
Хотя бэксплайсинг, приводящий к образованию circRNA, — событие в 100 раз более редкое, чем обычный линейный сплайсинг, вполне вероятно, что эти два процесса конкурируют друг с другом и взаимоподавляются. Возможно, именно подавление линейного сплайсинга в ходе формирования кольцевых РНК — основная клеточная функция этих удивительных молекул. Выпетливание участка незрелого транскрипта за счет комплементарного связывания инвертированных повторов в интронах само по себе может эффективно подавлять линейный сплайсинг. Кроме того, для протекания как бэксплайсинга, так и линейного сплайсинга необходимы одни и те же участки транскрипта; обычно они задействованы именно в линейном процессе, что в большинстве случаев подавляет бэксплайсинг. Действительно, показано, что с одного и того же гена кольцевые РНК и обычные линейные мРНК не синтезируются одновременно. Однако экспериментальные данные свидетельствуют о более сложной, чем обычное конкурентное подавление, связи между линейным и бэксплайсингом. Как бы то ни было, какие-то факторы должны определять, что будет считываться с гена в данный момент — кольцевая РНК или мРНК? Возможно, важную роль в этом решении играет скорость транскрипции. Так, альтернативный сплайсинг часто приводит к образованию лассо, содержащих интроны (то есть возможных предшественников кольцевых РНК), а это нередко происходит при ускорении транскрипции [4].
Выбор между бэксплайсингом и линейным сплайсингом может быть основан и на более сложных механизмах. Предполагают, например, что кольцевая РНК, которая считывается с гена mbl, забирает на себя весь белковый продукт этого гена — Muscleblind. Известно, что этот белок необходим для образования линейных mbl-мРНК, поэтому, связываясь с ним и не давая ему функционировать, кольцевые mbl-РНК (circMbl) подавляют синтез своих линейных «собратьев» (рис. 3).
Не исключена и возможность комплементарного связывания кольцевых РНК с участками породивших их генов, то есть с ДНК [4].
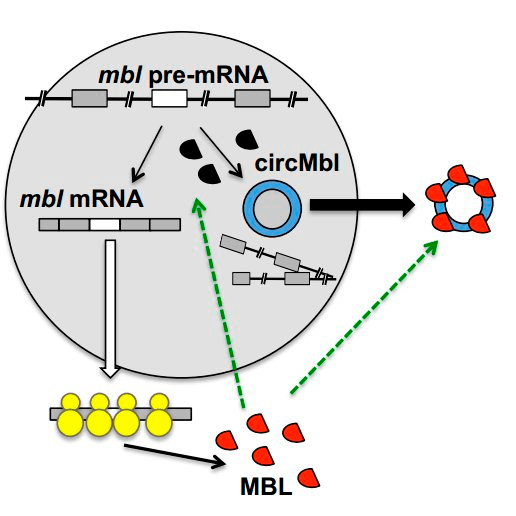
Рисунок 3. Регуляция синтеза Muscleblind (MBL) при помощи кольцевой РНК.
Ряд экспериментов свидетельствует в пользу того, что EIciRNA (экзон-интронные) и ciRNA (интронные) влияют на транскрипцию своих собственных генов, стимулируя РНК-полимеразу II. Исследователям удалось осадить с помощью антител комплекс EIciRNA с РНК-полимеразой II, причем выяснилось, что для стимуляции полимеразы необходим еще один компонент — малая ядерная РНК U1. Возможно, при взаимодействии с EIciRNA U1 располагается таким образом, что стимулирует работу полимеразы. А вот ciRNA, похоже, могут связываться непосредственно с хроматином в области «родительских» генов и повышать скорость их транскрипции. Удалось осадить, например, ciRNA под названием ci-ankrd52 в комплексе с активно работающей РНК-полимеразой II (активная форма фермента отличается особым фосфорилированием С-концевого домена). Поскольку ciRNA способны связываться и с «чужими» последовательностями ДНК, их роль в контроле экспрессии генов может быть значительной [4].
Для двух ecircRNA (экзонных, локализованных в цитоплазме) экспериментально показана способность влиять на синтез белка. Кольцевая РНК circANRIL нарушает работу комплекса белков, процессирующих рРНК, уменьшая тем самым количество функциональных рибосом и выход белка. А circPABPN1 подавляет работу белка HuR, необходимого для трансляции ряда мРНК [4].
Кольцевые РНК могут служить структурной основой для сборки белковых комплексов и тем самым обеспечивать межбелковые взаимодействия. Например, благодаря circ-Foxo3 циклинзависимая киназа 2 (Cdk2) взаимодействует со своим ингибитором, p21, что приводит к остановке клеточного цикла. А еще кольцевые РНК могут секвестрировать белки — ограничивать их перемещение к рабочим местам. Так, вышеупомянутая circ-Foxo3 может «запирать» в цитоплазме транскрипционный фактор E2F1 и некоторые другие белки [5].
Но секвестрированием белков дело не ограничивается. Некоторые экзонные кольцевые РНК содержат сайты связывания негативных регуляторов экспрессии генов — микроРНК. В англоязычной литературе такие circRNA часто называют microRNA sponges — «губки, впитывающие микроРНК». Связываясь с ними, микроРНК уже не могут взаимодействовать с комплементарными мРНК-мишенями и мешать их трансляции. Например, кольцевая РНК CDR1as содержит 74 сайта связывания с микроРНК miR-7, а мышиная кольцевая РНК, считанная с гена Sry (важен для определения пола), — 16 сайтов связывания с miR-138. Стоит, однако, отметить, что лишь для немногих кольцевых РНК показана способность связываться с микроРНК, то есть это скорее исключение, чем правило. Интересно, что circRNA найдены у некоторых одноклеточных эукариот, у которых вообще нет микроРНК, а именно — у дрожжей Saccharomyces cerevisiae и малярийного плазмодия Plasmodium falciparum. Таким образом, связывание с микроРНК не может быть основной функцией кольцевых РНК, хотя во многих статьях его так позиционируют [4].
Ряд кольцевых РНК играет важную роль в противовирусном иммунитете. Например, у кур, устойчивых к вирусу птичьего лейкоза, 12 circRNA образуются в бόльших количествах, чем у обычных кур. Многие из этих молекул связываются с микроРНК, регулирующими экспрессию генов, которые связаны с такими иммунными процессами, как активация В-лимфоцитов и презентация антигена. Любопытно, что иммунная система тоже влияет на синтез кольцевых РНК. Например, иммунные факторы NF90 и NF110 (сплайс-варианты гена ILF3) стимулируют образование circRNA из созревающего транскрипта в ядре. В условиях же вирусной инфекции эти белки уходят в цитоплазму, где связываются с вирусными мРНК и тормозят жизненный цикл вируса; количество ядерной circRNA при этом снижается, что может модулировать экспрессию генов. Кольцевые РНК могут участвовать в подавлении инфекции и путем связывания вирусных или клеточных микроРНК, мешающих иммунному ответу [5].
Известно, что большинство событий бэксплайсинга затрагивает экзоны и происходит в РНК генов, кодирующих белки. В связи с этим возникает вопрос: а могут ли кольцевые РНК сами кодировать белки или хотя бы более короткие пептиды? Трансляция большинства мРНК начинается с распознавания рибосомой видоизмененного нуклеотида на 5′-конце мРНК, так называемого кэпа. У кольцевых РНК нет свободного 5′-конца, поэтому у них не может быть и кэпа. Однако некоторые клеточные и вирусные РНК могут транслироваться в отсутствие кэпа при участии особой последовательности — IRES (от англ. Internal Ribosome Entry Site, внутренний сайт посадки рибосомы) [8]. С кольцевыми РНК могло бы происходить то же самое.
И действительно, искусственные circRNA, содержащие IRES и кодирующие какой-нибудь пептид, удавалось транслировать. Однако показано, что большинство кольцевых РНК в живых клетках не связаны с рибосомами, поэтому вряд ли их трансляция носит массовый характер. Пока известны две кольцевые РНК, по которым, вероятно, синтезируются белки in vivo — это circMbl и circZNF609. Стоит отметить, что эти молекулы образуются несколько нестандартно: в первом случае бэксплайсинг затрагивает первый экзон, который, как мы помним, обычно в состав кольцевых РНК не включается, а во втором в circRNA попадает фрагмент 5′-нетранслируемой области исходного транскрипта, который обладает свойствами IRES. Возможно, синтез белков по circRNA возможен только в особых условиях, например, при стрессе — тепловом шоке или голодании [4].
Если предположить, что какая-то кольцевая РНК содержит открытую рамку считывания с числом нуклеотидов, кратным трем, то теоретически трансляция такой РНК может протекать по механизму катящегося кольца. Результатом такой трансляции была бы теоретически бесконечная цепочка повторяющихся блоков аминокислот, и рост ее ограничивался бы процессивностью рибосом. Подобные случаи пока не известны для клеточных кольцевых РНК, однако нечто похожее происходит с вироидной кольцевой РНК, ассоциированной с вирусом желтой пятнистости риса [4].
Методы обнаружения и базы данных кольцевых РНК
Последние успехи в обнаружении кольцевых РНК связаны с усовершенствованиями технологии секвенирования РНК, такими как увеличение длины одиночных прочтений, улучшение алгоритмов сопоставления РНК с известными генами и расширение библиотек РНК. Кольцевые РНК можно отличить от линейных с помощью биоинформатического подхода (по результатам секвенирования) или «мокрым» способом — с помощью экзонуклеаз. Как упоминалось выше, эти ферменты быстро расщепляют линейные РНК, но не трогают кольцевые. С помощью экзонуклеаз идентифицировали тысячи кольцевых РНК, но всё же большинство circRNA описали благодаря высокопроизводительному секвенированию с использованием специальных алгоритмов [9], [10].
В настоящее время функционирует несколько баз данных, посвященных кольцевым РНК, и онлайн-инструментов для работы с ними. В их числе:
- Circ2Traits— содержит информацию о кольцевых РНК, связанных с заболеваниями человека;
- CircInteractome — онлайн-инструмент для определения сайтов связывания с микроРНК и белками в кольцевых РНК;
- CircRNADb— содержит детальную информацию о хорошо изученных кольцевых РНК;
- HumanViCe — хранилище последовательностей кольцевых РНК, которые могут связываться с клеточными или вирусными микроРНК в зараженных клетках.
Медицинское значение кольцевых РНК
Кольцевые РНК в разном количестве выявляются в плазме крови, причем в периферической крови их даже больше, чем в клетках органов. Причины этого неясны, особенно если учесть тот факт, что в 25-процентной сыворотке circRNA распадаются всего через 30 секунд (в клетке средняя кольцевая РНК существует 1–2 дня). Как бы то ни было, наличие и количество некоторых кольцевых РНК в плазме крови может служить важным показателем здоровья организма. Иными словами, кольцевые РНК можно использовать в качестве биомаркеров для диагностики и определения стадии таких патологий, как коронарные заболевания сердца, различные виды рака (в том числе лейкемия), диабет и рассеянный склероз [4].
Некоторые кольцевые РНК связаны с клеточным старением. Так, circPVT1 действует как ингибитор старения пролиферирующих фибробластов [9]. Ряд кольцевых РНК ассоциирован с возрастными изменениями организма: например, идентифицированы молекулы, связанные со старением мышц у мартышек [11].
К настоящему моменту известны 10 кольцевых РНК, вовлеченных в развитие сердечно-сосудистых и метаболических заболеваний (например, сахарного диабета). Уже упоминавшаяся circANRIL может защищать от атеросклероза, подавляя созревание рРНК и сдерживая этим деление клеток, избыточная пролиферация которых ведет к формированию атеросклеротических бляшек. Кольцевая РНК под названием MICRA может сигнализировать о нарушениях работы левого желудочка, возникших вследствие инфаркта миокарда. При гипертрофии сердца и сердечной недостаточности наблюдается снижение синтеза ряда кольцевых РНК [4].
Для некоторых клеточных РНК показана связь с сахарным диабетом. Известно, что гиперпродукция микроРНК miR-7 в β-клетках поджелудочной железы способствует развитию диабета, а гиперпродукция ciRS-7 — кольцевой РНК, связывающей miR-7, — в этих клетках, напротив, улучшает секрецию инсулина [9].
В нервных тканях различных организмов (от плодовой мушки до человека) находят особенно много кольцевых РНК. Возможно, это связано с большей распространенностью альтернативного сплайсинга в нейронах. Кроме того, кольцевые РНК в них могут выполнять особые функции, связанные с проведением нервных импульсов. Белок Qki, задействованный в образовании circRNA, участвует в развитии олигодендроцитов и регулирует миелинизацию, а также подавляет образование дендритов в центральной нервной системе. Мутации гена этого белка связывают с атаксией (расстройством координации движений) и шизофренией [4]. Есть свидетельства и о связи кольцевых РНК с болезнью Альцгеймера [9], [11].
Более 20 кольцевых РНК связаны с развитием разных видов рака, таких как колоректальный рак, рак яичника, мочевого пузыря, молочной железы, печени, желудка, почек и предстательной железы. Онкологические процессы часто сопровождаются транслокациями, которые приводят к появлению специфичных для определенных опухолей видов circRNA. Чаще всего кольцевые РНК, ассоциированные с развитием рака, функционируют как «губки» для микроРНК [4].
Поскольку кольцевые РНК, по всей вероятности, вовлечены в патогенез ряда заболеваний или способны модулировать их течение, их также рассматривают как потенциальные мишени терапии и терапевтические агенты.
Литература
- Обо всех РНК на свете, больших и малых;
- Биоинформатика в мире РНК-структур;
- Белки против РНК — кто первым придумал сплайсинг?;
- Lesca M. Holdt, Alexander Kohlmaier, Daniel Teupser. (2017). Molecular roles and function of circular RNAs in eukaryotic cells. Cell. Mol. Life Sci.;
- Man Wang, Fei Yu, Wei Wu, Yuan Zhang, Wenguang Chang, et. al.. (2017). Circular RNAs: A novel type of non-coding RNA and their potential implications in antiviral immunity. Int. J. Biol. Sci.. 13, 1497-1506;
- Эпигенетика псориаза: молекулярные отметины судьбы;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Бактерии тоже могут начинать синтез белка на IRES;
- John Greene, Anne-Marie Baird, Lauren Brady, Marvin Lim, Steven G. Gray, et. al.. (2017). Circular RNAs: Biogenesis, Function and Role in Human Diseases. Front. Mol. Biosci.. 4;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Amaresh C. Panda, Ioannis Grammatikakis, Rachel Munk, Myriam Gorospe, Kotb Abdelmohsen. (2017). Emerging roles and context of circular RNAs. WIREs RNA. 8, e1386;
- Linda Szabo, Julia Salzman. (2016). Detecting circular RNAs: bioinformatic and experimental challenges. Nat Rev Genet. 17, 679-692;
- Alu: история одной последовательности.






